Questions
Chapitre 1 – La stœchiométrie
Sujets inclus dans le chapitre :
- La mole
- # de moles, d’atomes…
- Trouver la masse et la masse molaire
- Détermination des formules chimiques
- formule moléculaire/empirique
- Composition en
- Équilibrer les équations / faire des équations
- La stœchiométrie des réactions
- Réactifs limitants
- Le reste est similaire aux 2 sujets ci-dessus
- La stœchiométrie des solutions
- Molarité et molalité
- % en masse, en volume…
- Réactions d’oxydoréduction
- États d’oxydation
- Demi-réaction – conditions basiques et acides
Questions:
- La composition en pourcentage d’un gaz inconnu est de 41,95% C, 22,35% O, 29,36% N, et 6,34% H. Quelle est la formule empirique du gaz inconnu ?
- Équilibrer l’équation chimique suivante, en utilisant des demi-réactions, dans des conditions de base :
MnO4 (aq) + C6H12O4 (aq) → Mn2+ (aq) + HCO3 (aq)
- Une solution aqueuse avec un pourcentage en masse de 20,0% pour le C2H5OH (le C2H5OH est le seul soluté). La densité de la solution est de 0,945 g/mL. Calculer la molarité, la molalité et la fraction molaire de C2H5OH dans la solution.
- Parmi Na (s), Na+ (aq), NaCl (s), Cl2 (g) et Cl- (aq), lequel des éléments suivants est un oxydant ?
- Quel est l’état d’oxydation de C dans HCN (notez que le carbone est l’atome central, H est le moins électronégatif des trois et N est le plus électronégatif des trois) ?
- 205,0 g de H2O, 225,0 g de O2 et 240,0 g de P4 réagissent ensemble selon l’équation suivante :
6 H2O + 5 O2 + P4 → 4 H3PO4
- Quelle est la masse (en grammes) de H3PO4 produite ? Quelle est la masse (en grammes) totale des réactifs excédentaires qui n’ont pas réagi ?
- Walmart vend de l’antigel, une solution aqueuse qui contient 28,6 % d’éthylène glycol (C2H6O2) en masse. Si la densité de cette solution est de 1,03 g/cm3, calculez sa molalité.
- Un vendeur vient à votre porte et vous dit que l’eau du robinet de votre quartier a récemment été testée et que des niveaux élevés de plomb (Pb) ont été trouvés. Il peut vous vendre un appareil de purification pour 7 500 dollars qui peut se fixer à votre robinet et éliminer les ions de plomb de l’eau. Il veut tester votre eau pour voir si elle est nécessaire ; tout ce dont il a besoin de votre part est un petit échantillon d’eau du robinet (100,0 ml).
- Son kit de test utilise les demi-réactions suivantes pour tester les ions plomb. Trouvez la réaction d’oxydoréduction globale équilibrée, dans des conditions de base (y compris les phases).
- Pb2+(aq) → Pb (s)
- CN–(aq) → CNO– (aq)
- Identifiez l’agent oxydant et l’agent réducteur dans votre réaction ci-dessus.
- Son kit de test utilise les demi-réactions suivantes pour tester les ions plomb. Trouvez la réaction d’oxydoréduction globale équilibrée, dans des conditions de base (y compris les phases).
- Quel composé présente le degré d’oxydation le plus élevé de l’azote :
- NO+
- N2
- NO3–
- NO2
- N2O
- NH3
- La combustion complète d’un échantillon de 1,119 g d’un composé gazeux inconnu (composé de C, H et S) donne 2,020 g de CO2, 0,689 g de H2O et un peu de SO2.
- Trouvez le nombre de moles de chaque élément de l’échantillon.
- Quelle est la formule empirique du composé ?
Chapitre 2 – Les gaz
Concepts inclus dans le chapitre 2 :
- Forces intermoléculaires
- Identifier les forces et expliquer leur force/comportement relatif dans une molécule
- Gaz et tableau périodique
- Tendances
- Variable de mesure des gaz
- Introduction à PV=nRT
- Passer du bar au distributeur automatique …
- Lois sur le gaz *expérience 1
- Utilisation et application de différentes lois
- PV=nRT et utiliser n pour calculer la masse…
- Mélanges de gaz et pressions partielles
- Trouver la masse molaire à partir de PV=nRT et de la masse
- Détermination des formules moléculaires
- Pressions partielles
- Théorie cinétique et moléculaire des gaz (comportement idéal des gaz)
- Comportements expliqués
- Racine moyenne au carré
- Énergie cinétique moyenne
- Diffusion et effusion
- Explication et application de ces 2 concepts
- Comportements réels/non idéaux en matière de gaz
- Expliquer/appliquer les concepts aux questions et aux graphiques
Questions:
- Si nous faisons réagir 88,8 g de C2H5OH (l) et 88,8 g de O2 (g) dans une réaction de combustion produisant du CO2 (g) et du H2O (l). La combustion se fait dans un récipient en acier de 10,0 litres et la température est fixée à 25,00°C. Quelle est la masse de CO2 (g) produite ? En ignorant les pressions de vapeur de C2H5OH (l) et de H2O (l), quelle est la pression totale (en atm) avant et après la réaction ? (indice : ces deux valeurs ne sont pas nécessairement les mêmes) Enfin, quelle est la vitesse moyenne des molécules de CO2 (g) à la fin de la réaction ?
- La composition en pourcentage d’un gaz inconnu est de 40,84% C, 20,40% O, 29,77% N et 9,00% H. Quelle est la formule empirique ? Si le gaz inconnu a une densité de 11,07 g/L, une température de 777 K et une pression de 1,00 atm, quelle est la formule moléculaire ?
- Dans un récipient en acier de 33,3 litres, on trouve 88,8 g de CO2 (g), 77,7 g de N2 (g) et un peu de O2 (g). La température est de 25°C et la pression est de 5,555 atm. Quelle est la masse molaire de O2 (g).
- La masse volumique d’un échantillon ne contenant que du CO2 (g) est de 1,55 g/L. La pression est de 2,22 atm. Quelle est la vitesse moyenne des molécules de CO2 (g) ?
- Dans un conteneur en acier de 10,0 L, nous avons 19,9 g de N2 (g). La pression est de 2,50 atm. Quelle est la vitesse moyenne des molécules de N2 (g) ? Supposons que nous ajoutions 19,9 g d’O2 (g) dans le récipient. La température est réglée sur 25°C et le volume est fixé à 10,0 L. Quelle est la pression totale ?
- Un ballon d’un litre est rempli de gaz néon. Un trou est fait dans le ballon et le gaz s’échappe à un taux de 0,0280 mol/hr. Si le même ballon est rempli d’argon à la même pression et à la même température, son taux d’effusion sera de ____________.
- La loi du gaz idéale fonctionne mieux à basse température et à haute pression. Encerclez la bonne réponse.
- Vrai
- Faux
- Lorsque le Dr Fox fait de la plongée sous-marine, elle utilise du NITROX, un mélange spécial d’air enrichi qui permet des plongées plus répétitives en réduisant l’accumulation d’azote dans le sang (de cette façon, elle n’aura pas “les courbes” !). Le magasin de plongée local prépare des bouteilles de 7,20 litres de NITROX en mélangeant 25,0 g d’O2 à 42,0 g de N2 à une température de 25,0°C.
- Quelle est la fraction molaire de chaque gaz dans le mélange ?
- Quelle est la pression partielle de chaque gaz, en bar ?
- La réaction suivante, qui se produit dans une cuve scellée, a un rendement de 94,9 %: 2 NaN3 (s)→2 Na (l) +3N2 (g)
- Quel volume de N2, mesuré à 735 mmHg et 26,0°C, est produit lorsque 75,0 g d’azide de sodium se décompose ?
Chapitre 3 – La thermochimie
Sujets inclus dans le chapitre 3 :
- Introduction à la thermochimie
- Économie d’énergie
- Système, environnement, univers
- Types d’énergie
- exothermique / endothermique
- Énergie interne
- -q = q
- Première loi de la thermodynamique
- Énergie interne suite
- Introduction du travail et de l’enthalpie
- Enthalpie
- Enthalpie, q= mc∆T
- Recherche de différentes variables à l’aide de variations de l’équation d’enthalpie
- Calorimétrie
- Calculs isolés (dans un calorimètre)
- La loi de Hess
Questions:
- Dans un calorimètre à bombe à volume constant, nous avons brûlé 1,22 g de C6H10O (l) (indice : la combustion est une réaction avec une substance réagissant avec O2(g) pour produire du CO2 (g) et de l’H2O (l)). Le calorimètre de la bombe a une capacité thermique de 3,50 kJ K-1 et contient 2,725 kg d’eau. La capacité calorifique spécifique de l’eau est de 4,184 J K-1 g-1. La température du calorimètre et de l’eau passe de 20,50°C à 23,25°C. Avec ces informations données, calculer Q, W, ∆H et ∆U si on faisait la combustion avec une mole de C6H10O (l) sous une pression constante de 1,00 bar à 25.00°C.
-
- Nous plaçons 100,0 g de métal 100.00०C dans 222,2 g d’eau, ce qui correspond à 10.00°C. L’eau se trouve dans une tasse qui est à la même température que l’eau. La capacité thermique de la tasse est de 500 J K-1. La température finale du métal, de l’eau et du gobelet est de 13,33°C. Quelle est la capacité thermique spécifique du métal ?
- La combustion d’une mole de méthane (CH4 (g)) libère 891 kJ de chaleur. Nous voulons chauffer 6,66 kg d’eau de 20.00°C à 30.00°C. Si le méthane se trouve à 25.0°C et a une pression de 1,00 atm, quel volume de CH4 (g) devrions-nous avoir ?
- Nous avons 437 g d’eau dans un récipient. La température de l’eau et du conteneur est de 23.0°C. Nous avons un morceau de fer de 122g à une température de 57.0°C et nous le plaçons dans l’eau du conteneur. Les capacités thermiques spécifiques de l’eau et du fer sont respectivement de 4,184 J K-1 g-1 et de 0,44 J/ (g ०C). La capacité thermique du conteneur est de 217 J/°C. Quelle est la température finale de l’eau, du fer et du récipient ?
- Avec les informations données :
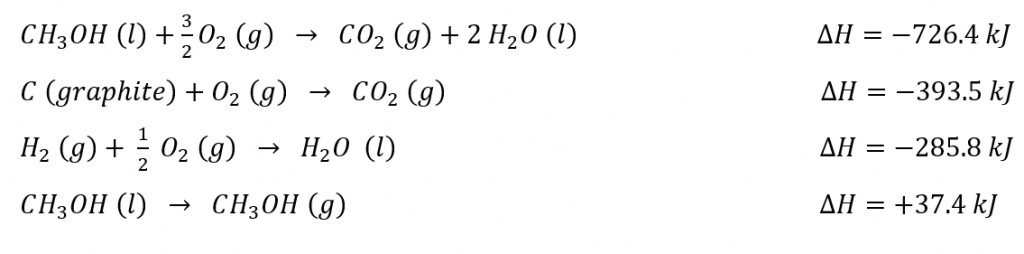
- Calculer les valeurs pour ∆U et ∆H pour la formation d’une mole de CH3OH (g) :
- Lorsque le courant a été coupé à un chauffe-eau de 125 litres, la température de l’eau est passée de 75,0°C à 22,5°C. La quantité de chaleur, en kilojoules, transférée aux alentours était de : _______________.
- L’été dernier, le Dr Fox a fait de la plongée sous-marine à False Bay, en Afrique du Sud, où la température de l’eau était de 13,5°C. Malgré le port de deux combinaisons de plongée en néoprène de 5 mm d’épaisseur, le Dr Fox a quand même perdu de la chaleur corporelle à un rythme de 38,0 J par seconde. Quelle quantité de chaleur corporelle, en kJ, a été perdue au cours d’une plongée de 45 minutes ?
- Pour la réaction suivante : 2 C2H6 (g) +7 O2 (g) → 4 CO2 (g) + 6 H2O (l) ∆H=-3119kJ
- Quelle quantité de chaleur, en kJ, est associée à la combustion de 10,0 g d’éthane ?
- Quelle est la quantité de travail, en kJ, issue de la combustion de 10,0 g d’éthane à 25,00°C ? (Supposons qu’une quantité stœchiométrique exacte d’oxygène soit présente).
Chapitre 4 – Équilibre chimique
Parmi les sujets abordés, on peut citer
- Introduction à l’équilibre chimique
- Réponses écrites aux questions – sur la réversibilité, les constantes de taux…
- La constante d’équilibre et le quotient de réaction
- Introduction à K (quand il est plus grand ou plus petit que 1 et ce que cela signifie) et Q (ce que cela représente)
- Q et K ensemble en questions – comment l’équilibre va-t-il se modifier
- Résoudre les problèmes d’équilibre
- Questions K et Kp
- Trouver la concentration et les pressions partielles
- Le principe de Le Chatelier
- Les effets sur l’équilibre sont basés sur ce qui est changé et est expliqué par le principe.
Questions :
-
- Pour la réaction 2 A (aq) → 2 B (aq) + C (aq), la constante d’équilibre est de 2,22 à 25.0०C. Si les concentrations de B (aq) et C (aq) sont respectivement de 0,277 M et 0,444 M, quelle est la concentration de A (aq) nécessaire pour avoir une énergie libre, G, de -5,00 kJ ? Notez que la température est toujours de 25,0°C.
- Pour la réaction 2 A (g) → 2 B (g) + C (g), nous commençons seulement par A (g) et B (g), et la pression partielle de A est le double de celle de B. Il n’y a pas de C (g). La pression totale est à l’origine de 6,00 atm. Nous atteignons l’équilibre. La pression finale est maintenant de 6,80 atm. Quelle est la valeur de G०for cette réaction. Notez que la température est toujours de 25,0°C.
- Pour la réaction A (aq) + B (aq) → 2 C (aq), la valeur de G०is +4,77 kJ (ou kJ/mol) à 25.0°C. Les concentrations initiales pour A (aq), B (aq) et C (aq) sont respectivement de 0,322 M, 0,244 M et 0,455 M. Quelle est la concentration de C (aq) une fois que nous avons atteint l’équilibre à 25.0°C ?
- La constante de formation, Kf, de Ag(CN)2- est de 3,0 x 1020. Nous mettons 6,66 g de AgNO3 dans une solution de 1 000 L d’une solution de 0,800 M avec CN-. Nous supposons que le volume reste fixé à 1 000 L. Quelles sont les concentrations de Ag+ (aq), CN- (aq) et Ag(CN)2- à l’équilibre ? Réaction: Ag+ (aq) + 2 CN– (aq) → Ag(CN)2– (aq)
- Considérez la réaction suivante : A (g) + 2 B (g) ⇌ 2 C (g), Dans un ballon de 2,50 litres, A et B sont ajoutés à des pressions initiales de 0,500 bar chacun. On laisse le mélange s’équilibrer à 1000 K et on constate que le ballon contient 0,0147 mol de C.
- Quelle quantité de chaleur, en kJ, est associée à la combustion de 8,50 g d’éthane ?
- Quelle est la quantité de travail, en kJ, issue de la combustion de 8,50 g d’éthane à 25,00°C ? (Supposons qu’une quantité stoechiométrique exacte d’oxygène soit présente).
- Considérons la réaction gazeuse suivante :
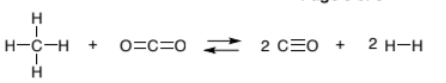
- Un mélange équimolaire de CH4 et de CO2, à une pression totale de 20,0 bars, est placé dans un ballon de 1,00 L et laissé à l’équilibre à 1200 K. À l’équilibre, le ballon contient 19,6 bars d’hydrogène. Quelle est la valeur de K de la réaction?
- Compte tenu des informations ci-dessous, la valeur de la constante d’équilibre pour la réaction :
- A (g) + 2 B (g) ⇌ 2 C (g) est:
- 2 A (g) ⇌ 2 X (g) Kp = 35.5
- 2 C (g) ⇌ X (g) + B (g) Kp = 7.2
Chapitre 5 – Équilibres acide/base
Parmi les sujets abordés, on peut citer
- Définitions acide-base et paires acide-base conjuguées
- Identification du conjugué et étiquetage d’une équation avec appariement acide-base
- Autoionisation de l’eau et pH/pOH
- Espèces amphiprotiques
- Calculs du pH et du pOH
- Calculs de la concentration d’ions
- Force acide/base
- Identification de la force des espèces sur la base de leur comportement/structure et comparaison de leur force à celle d’autres composés
- Calculs Ka/Kb
- Calculs de la concentration d’équilibre
- Acides polyprotiques
- Calcul des concentrations avec les valeurs multiples de Ka et Kb
- Acidité des hydrures et des oxoacides
- Hydrolyse des solutions salines
- Classification des sels comme neutres, acides ou basiques
- Acide de Lewis et bases
- Dessiner les structures lewis
Questions :
- Le NH3 (aq) est une base faible avec une constante de dissociation, Kb, de 1,8 x 10-5. Quel est le pH d’une solution aqueuse à 0,333 M dans NH4Cl ?
- Sur le site 25.0°C, nous plaçons 2,33 g d’acide, HA, dans suffisamment d’eau pour produire 25,0 ml de solution. Le pH initial est de 1,44. Nous titrons cette solution avec une solution de NaOH à 0,222 M et il nous faut 22,2 ml pour atteindre le point d’équivalence.
- Quelle est la masse molaire de l’AH ?
- Quelle est la constante d’ionisation, Ka, de l’HA ?
- Quel serait le pH d’une solution de 2 000 M dans le NaA ?
-
- Pour la réaction suivante 2 A (aq) ⇌ B (aq) + C (aq), la constante d’équilibre est de 5,55 à 25.0°C. Les concentrations initiales pour A (aq), B (aq) et C (aq) sont respectivement de 0,444 M, 0,555 M et 0,666 M. Quelle est la concentration de A (aq) à l‘équilibre à 25.0°C ?
- Nous avons une solution aqueuse de NaOH de 666 ml. Nous ajoutons un excès de Al(NO3)3 pour produire le précipité Al(OH)3 (s). Nous produisons 0,0888 g de Al(OH)3 (s). Quel était le pH initial de la solution ?
- Après des vacances de plongée, le Dr Fox doit nettoyer et rincer tout son matériel de plongée avant de le remettre en stock. Elle veut utiliser le “Diver’s Buddy Scuba Shampoo“, une solution aqueuse de triméthylamine (N(CH3)3, Kb = 6,31 x 10-6) disponible dans le commerce. Le Dr Fox mesure le pH de la solution et constate qu’il est de 10,55. Quelle est la concentration de triméthylamine dans le shampoing, en mol/L ?
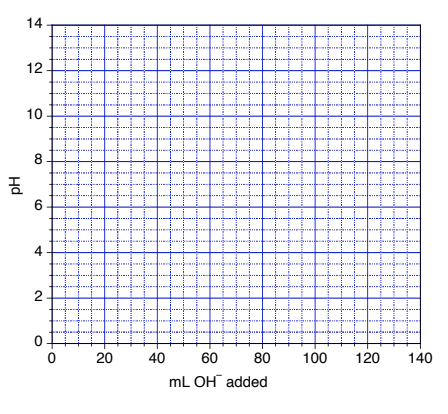
- Vous effectuez un titrage de 80,0mL de 0,0900 M HCN avec 0,0900 M NaOH. Déterminez le pH de la solution :
- Initialement
- Au point de demi-équivalence
- Au point d’équivalence
- Utilisez ces valeurs pour tracer une courbe de titrage sur le graphique fourni.
Chapitre 6 – Équilibres ioniques dans les systèmes aqueux
Parmi les sujets abordés, on peut citer
- Effet d’ion commun
- Les questions de Ksp et l’utilisation de Ksp pour trouver des concentrations
- Solutions tampons *expérience 3
- Réactions acide-base et titrages *expérience 4*
- Équilibres des composés ioniques légèrement solubles
- Ksp et prévision des précipitations
Questions :
- La constante de solubilité pour Mg(PO4)2 est de 1,0 x 10-24. Calculer la solubilité (en g/L) de Mg(PO4)2 dans
- L’eau pure
- Une solution de 0,30 M de Mg(NO3)2
- Nous préparons une solution tampon en faisant réagir 12,1 g de NH3 et 6,2 g de HCl dans suffisamment d’eau pour produire 1 000 litres de solution. La constante d’ionisation pour la base faible (NH3) est de 1,8×10-5.
- Quel est le pH de la solution ?
- Quel serait le pH de la solution si nous ajoutions 1,00 g de NaOH (en supposant que le volume reste le même) ?
- Quel serait le pH de la solution si nous ajoutions 1,00 g de HCl (en supposant que le volume reste le même) ?
- Quel volume d’une solution 0,277 M faut-il ajouter à l’acide acétique, CH3COOH, pour neutraliser 28,0 ml d’une solution 0,348 M de Ba(OH)2 ? Le Ba(OH)2 est une base forte et l’acide acétique est un acide faible avec un pKa de 4,74. Quel est le pH de la solution au point d’équivalence ?
- La constante d’ionisation de l’acide acétique, CH3COOH, est de 1,8 x 10-5. Quel est le pH d’une solution si l’on ajoute 0,847 g d’acétate de sodium, CH3COONa, à de l’eau pure et que le volume final est de 100,0 ml.
- Vous souhaitez préparer une solution tampon avec un pH = 9,45.
- Combien de grammes de (NH4)2SO4 ajouteriez-vous à 425 ml de NH3 0,258 M pour ce faire ? Vous pouvez supposer que le volume de la solution reste constant. Kb de NH3 = 1,8×10-5
- Vous avez accès à 0,258 M de NH3 et à du (NH4)2SO4 plus solide. Quel composant du tampon, et quelle quantité (en g ou en ml) ajouteriez-vous à 0,100 L du tampon de la partie (a) pour modifier son pH à 9,30 ? Vous pouvez supposer que le volume de la solution reste constant.
- Un étudiant mélange 31,0 ml de 2,74 M Pb(NO3)2 (aq) avec 20,0 ml de 0,00163 M NaI (aq).
- Identifier le précipité attendu
- Quelles sont les valeurs de [Pb2+], [Na+], [NO3–] et [I–] après que la solution ait atteint l’équilibre à 25°C ? Vous pouvez supposer que les volumes sont additifs.
- Dans la liste ci-dessous, encerclez les sels basiques et soulignez les sels neutres
- KCl
- FeCl3
- NH4Br
- Ca(CN)2
- LiF
- CuNO3

