3.2 – Types d’énergie
La thermochimie est une branche de la thermodynamique chimique, la science qui traite des relations entre la chaleur, le travail et les autres formes d’énergie dans le contexte des processus chimiques et physiques. En nous concentrant sur la thermochimie dans ce chapitre, nous devons considérer certains concepts largement utilisés de la thermodynamique.
Les substances agissent comme des réservoirs d’énergie, ce qui signifie qu’on peut leur ajouter ou leur retirer de l’énergie. L’énergie est stockée dans une substance lorsque l’énergie cinétique de ses atomes ou molécules est augmentée. L’énergie cinétique plus importante peut prendre la forme de translations accrues (déplacements ou mouvements linéaires), de vibrations ou de rotations des atomes ou des molécules. Lorsque l’énergie thermique est perdue, l’intensité de ces mouvements diminue et l’énergie cinétique baisse. Le total de toutes les sortes d’énergie possibles présentes dans une substance est appelé l’énergie interne (U), parfois symbolisée par E.
Énergie interne
L’énergie interne d’un système est identifiée par le mouvement aléatoire et désordonné des molécules ; l’énergie totale (interne) d’un système comprend l’énergie potentielle et cinétique. L’énergie interne d’un système est identifiée par le mouvement aléatoire et désordonné des molécules ; l’énergie totale (interne) d’un système comprend l’énergie potentielle et l’énergie cinétique, contrairement à l’énergie externe qui est fonction de l’échantillon par rapport à l’environnement extérieur (par exemple l’énergie cinétique si l’échantillon est en mouvement ou l’énergie potentielle si l’échantillon est à une certaine hauteur du sol, etc.
). Le symbole du changement d’énergie interne est ΔU et peut être calculé à l’aide de l’équation suivante où U1 est l’énergie interne initiale du système et U2 est l’énergie interne finale du système:
ΔU = U2 – U1
Chaleur
L’énergie thermique est l’énergie cinétique associée au mouvement aléatoire des atomes et des molécules. La température est une mesure quantitative du “chaud” ou du “froid”. Lorsque les atomes et les molécules d’un objet se déplacent ou vibrent plus rapidement, ils ont une énergie cinétique moyenne (Ek) plus élevée, et on dit que l’objet est “chaud”. Lorsque les atomes et les molécules se déplacent plus lentement, ils ont une énergie cinétique moyenne (Ek) plus faible, et nous disons que l’objet est “froid” (figure 3.2.1.). En supposant qu’aucune réaction chimique ou changement de phase (comme la fusion ou la vaporisation) ne se produise, l’augmentation de la quantité d’énergie thermique dans un échantillon de matière entraînera une augmentation de sa température. Et, en supposant qu’aucune réaction chimique ou changement de phase (comme la condensation ou la congélation) ne se produise, une diminution de la quantité d’énergie thermique dans un échantillon de matière entraînera une baisse de sa température.
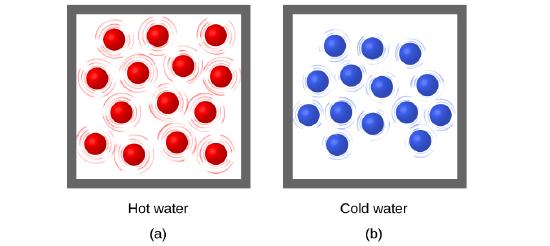
Figure 3.2.1. (a) Les molécules d’un échantillon d’eau chaude se déplacent plus rapidement que (b) celles d’un échantillon d’eau froide.
La chaleur (q) est le transfert d’énergie thermique entre deux corps à des températures différentes. Le flux de chaleur (un terme redondant, mais couramment utilisé) augmente l’énergie thermique d’un corps et diminue l’énergie thermique de l’autre. Supposons que nous ayons initialement une substance (H) à haute température (et à haute énergie thermique) et une substance (L) à basse température (et à faible énergie thermique). Les atomes et les molécules de H ont un Ek moyen plus élevé que ceux de L. Si nous mettons la substance H en contact avec la substance L, l’énergie thermique passera spontanément de la substance H à la substance L. La température de la substance H diminuera, tout comme le Ek moyen de ses molécules ; la température de la substance L augmentera, tout comme le Ek moyen de ses molécules. Le flux de chaleur se poursuivra jusqu’à ce que les deux substances soient à la même température (figure 3.2.2.).
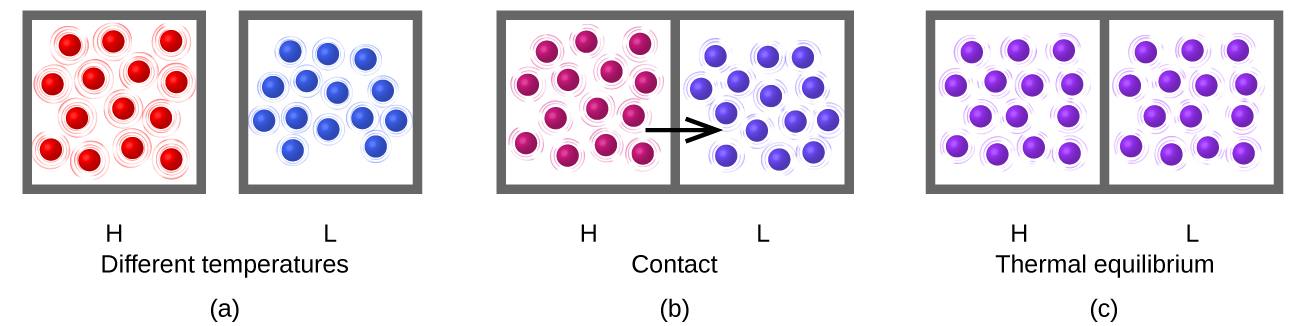
Figure 3.2.2. (a) Les substances H et L sont initialement à des températures différentes, et leurs atomes ont des énergies cinétiques moyennes différentes. (b) Lorsqu’elles sont mises en contact l’une avec l’autre, les collisions entre les molécules entraînent un transfert d’énergie cinétique (thermique) de la matière la plus chaude vers la plus froide. (c) Les deux objets atteignent un “équilibre thermique” lorsque les deux substances sont à la même température et que leurs molécules ont la même énergie cinétique moyenne.
La matière qui subit des réactions chimiques et des changements physiques peut libérer ou absorber de la chaleur. Un changement qui libère de la chaleur est appelé un processus exothermique. Par exemple, la réaction de combustion qui se produit lors de l’utilisation d’une torche à oxyacétylène est un processus exothermique – ce processus libère également de l’énergie sous forme de lumière, comme le montre la flamme de la torche (figure 3.2.3. a). Une réaction ou un changement qui absorbe de la chaleur est un processus endothermique. Une poche froide utilisée pour traiter les entorses musculaires est un exemple de processus endothermique. Lorsque les substances contenues dans la poche froide (eau et nitrate d’ammonium) sont réunies, le processus qui en résulte absorbe de la chaleur, ce qui entraîne une sensation de froid.

Figure 3.2.3. (a) Un chalumeau oxyacétylénique produit de la chaleur par la combustion d’acétylène dans l’oxygène. L’énergie libérée par cette réaction exothermique chauffe puis fait fondre le métal coupé. Les étincelles sont de minuscules morceaux du métal fondu qui s’envolent. (b) Une poche de froid utilise un processus endothermique pour créer la sensation de froid. (crédit a : modification du travail par “Skatebiker“/Wikimedia commons).
La chaleur peut faire plus qu’augmenter la température
La plupart des substances se dilatent lorsque leur température augmente et se contractent lorsque leur température diminue. Cette propriété peut être utilisée pour mesurer les changements de température, comme le montre la figure 3.2.4. Le fonctionnement de nombreux thermomètres dépend de la dilatation et de la contraction des substances en réponse aux changements de température.


Figure 3.2.4. (a) Dans un thermomètre à alcool ou à mercure, le liquide (teinté en rouge pour la visibilité) se dilate lorsqu’il est chauffé et se contracte lorsqu’il est refroidi, beaucoup plus que le tube de verre qui contient le liquide. (b) Dans un thermomètre bimétallique, deux métaux différents (tels que le laiton et l’acier) forment une bande à deux couches. Lorsqu’il est chauffé ou refroidi, l’un des métaux (le laiton) se dilate ou se contracte plus que l’autre (l’acier), ce qui provoque l’enroulement ou le déroulement de la bande. Les deux types de thermomètres ont une échelle calibrée qui indique la température. (crédit a : modification du travail par “dwstucke“/Flickr). (c) La démonstration permet d’observer les effets du chauffage et du refroidissement d’une bande bimétallique enroulée. Une bobine bimétallique provenant d’un thermomètre réagit à la chaleur d’un briquet, en se déroulant puis en s’enroulant à nouveau lorsque le briquet est retiré. Animation utilisée avec la permission de Hustvedt (via Wikipedia)
Direction du flux de chaleur : procédés endothermiques et exothermiques
La réaction de l’aluminium en poudre avec l’oxyde de fer(III), connue sous le nom de réaction thermite, génère une énorme quantité de chaleur – suffisamment, en fait, pour faire fondre l’acier. L’équation chimique équilibrée de la réaction est la suivante :
2 Al (s) + Fe2O3 (s) → 2 Fe (s) + Al2O3 (s)
On peut aussi écrire cette équation chimique comme :
2 Al (s) + Fe2O3 (s) → 2 Fe (s) + Al2O3 (s) + chaleur
pour indiquer que la chaleur est l’un des produits. Les équations chimiques dans lesquelles la chaleur est indiquée comme un réactif ou un produit sont appelées équations thermochimiques. Dans cette réaction, le système est constitué d’atomes d’aluminium, de fer et d’oxygène ; tout le reste, y compris le récipient, constitue l’environnement. Au cours de la réaction, il se produit une telle quantité de chaleur que le fer se liquéfie. Finalement, le système se refroidit ; le fer se solidifie à mesure que la chaleur est transférée à l’environnement. Un processus dans lequel la chaleur (q) est transférée d’un système à son environnement est décrit comme exothermique. Par convention, q < 0 pour une réaction exothermique. Regardez cette vidéo pour voir la réaction ci-dessus en action.
Lorsque vous tenez un glaçon dans votre main, la chaleur de l’environnement (y compris votre main) est transférée au système (la glace), ce qui fait fondre la glace et refroidit votre main. Nous pouvons décrire ce processus par l’équation thermochimique suivante :
chaleur + H2O (s) → H2O (l)
Lorsque la chaleur est transférée à un système à partir de son environnement, le processus est endothermique. Par convention, q > 0 pour une réaction endothermique.
En résumé, par convention, q < 0 pour une réaction exothermique et q > 0 pour une réaction endothermique.
Exemple 3.2.1 – Réactions exothermiques vs. endothermiques
Décider si les procédés suivants sont endothermiques ou exothermiques
a. L’eau s’évapore d’une porte de douche
b. Un comprimé d’acide est ajouté à une piscine et l’eau environnante se réchauffe
c. Le NH4Cl est dissous dans l’eau et la solution refroidit
d.La combustion d’une bûche dans un feu de camp
Solution
a. Endothermique
b. Exothermique
c. Endothermique
d. Exothermique
Techniquement, il n’est pas acceptable d’avoir de la chaleur dans la réaction chimique comme dans les équations décrites ci-dessus, car ce n’est pas une véritable espèce dans la réaction. Cependant, il s’agit d’une approche pratique pour représenter le comportement exothermique et endothermique et elle est couramment utilisée par les chimistes.
Travail
En chimie, le travail est souvent défini en termes de changement de volume contre la pression. (La pression est la force divisée par la surface, alors convainquez-vous que P x V a les mêmes unités que F x d.) Par exemple, la pression atmosphérique est constante à 1 bar. Si vous avez un échantillon de gaz à une pression plus élevée, et que vous le laissez s’équilibrer mécaniquement avec l’atmosphère, il se dilatera jusqu’à atteindre un nouveau volume. Le travail effectué en se dilatant contre la pression atmosphérique est (1 bar)(ΔV), où ΔV est (volume final – volume initial). En général, le travail effectué par l’expansion des gaz est appelé travail PV, et est exprimé :
w = – PΔV
où P est la pression constante et ΔV est le changement de volume du système. Le signe négatif associé au travail PV effectué indique que le système perd de l’énergie lorsque le volume augmente. Si le volume augmente à pression constante (ΔV > 0), le travail effectué par le système est négatif, ce qui indique qu’un système a perdu de l’énergie en effectuant des travaux sur son environnement. À l’inverse, si le volume diminue (ΔV < 0), le travail effectué par le système est positif, ce qui signifie que l’environnement a effectué un travail sur le système, augmentant ainsi son énergie.
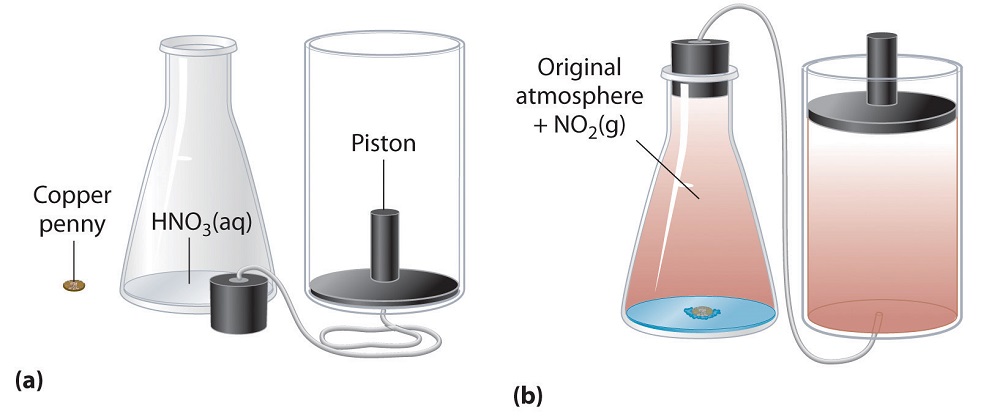
Figure 3.2.5. Exemple de travail réalisé par une réaction effectuée à pression constante. (a) Au départ, le système (un sou de cuivre et de l’acide nitrique concentré) est à la pression atmosphérique. (b) Lorsque le sou est ajouté à l’acide nitrique, le volume de NO2 gazeux qui se forme provoque le déplacement du piston vers le haut pour maintenir le système à la pression atmosphérique. Ce faisant, le système effectue un travail sur son environnement.
Les réactions chimiques peuvent effectuer un travail par électrochimie (cela implique des réactions d’oxydoréduction et sera couvert l’année prochaine), et le travail pression-volume des gaz.
Exemple 3.2.2 – Calculs de travail avec les gaz
Quel est le travail effectué par un gaz s’il se dilate de 3,44 L à 6,19 L contre une pression extérieure constante de 1,26 atm ? Exprimez la réponse finale en joules.
Solution
Il faut d’abord déterminer le changement de volume, ΔV. Un changement est toujours la valeur finale moins la valeur initiale :
ΔV = Vfinal – Vinitial
ΔV = 6.19 L – 3.44 L
ΔV = 2.75 L
Nous pouvons maintenant utiliser la définition du travail pour déterminer le travail effectué :
w = – Pexterne × ΔV
w = – (1.26 atm) × (2.75 L)
w = – 3.47 L⋅atm
Nous construisons maintenant un facteur de conversion à partir de la relation entre le litre-atmosphère et le joule :
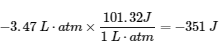
Vérifiez votre apprentissage 3.2.1 – Calculs de travail avec les gaz
Quel est le travail effectué lorsqu’un gaz se dilate de 0,66 L à 1,33 L contre une pression extérieure de 0,775 atm ?
Réponse
-53 J
La chaleur et le travail sont les moyens par lesquels l’énergie peut se déplacer entre les objets. Quand on pense aux molécules, la différence entre le travail et la chaleur est très simple. Le travail implique un mouvement ordonné des molécules, comme toutes les molécules d’un objet se déplaçant dans la même direction. La chaleur implique un mouvement désordonné ou aléatoire des molécules.
Questions
★ Questions
- Un système de molécules a une énergie interne originale de 8 700 000 J. Vous avez refroidi ce système de 99 K et son énergie interne est maintenant de 4 501 kJ. Calculez la variation de l’énergie interne (ΔU).
2. Vous laissez deux cubes de fer entrer en contact. Un cube est à 800 K et l’autre à 323,15°C. Prévoyez la température de ces deux cubes une fois qu’ils ont atteint l’équilibre thermique. Indiquez votre réponse en Kelvin.
3. Calculez combien de calories se trouvent dans 71 kJ.
4. Classifier chaque réaction comme exothermique ou endothermique :
a. C6H12O6 (s) + 6 O2 (g) → 6 CO2 (g) + 6 H2O (l) + chaleur
b. La glace fond dans l’eau
c. TNT explose
d. La fission nucléaire décompose les atomes d’uranium en atomes à noyau plus petit
★★ Questions
5. Vous disposez d’un ballon initialement rempli de 400 ml d’air. Quel est le volume final du ballon si vous faites -885,13 J de travail pour l’agrandir ? La pression atmosphérique est de 1,12 atm.
Réponses
- – 4199 kJ
- 698.15 K
- 16,96 kilocalories
- (a) Exothermique, (b) Endothermique, (c) Exothermique, (d) Exothermique
- 1190,29 ml
Domaine scientifique qui traite des relations entre la chaleur, le travail et toutes les formes d'énergie associées aux processus chimiques et physiques
Total de tous les types d'énergie possibles présents dans une ou plusieurs substances
Propriété intensive de la matière qui est une mesure quantitative de la "chaleur" et de la "froideur" ; mesure de la quantité moyenne d'énergie cinétique que contient un système
Transfert d'énergie thermique entre deux organismes
Réaction chimique ou changement physique qui libère de la chaleur
Réaction chimique ou changement physique qui absorbe la chaleur

