7.6 – Théorie de L’état de Transition
La théorie de l’état de transition (TET) offre une alternative plus précise à l’équation d’Arrhenius et à la théorie des collisions précédemment utilisées. La théorie de l’état de transition tente de fournir une meilleure compréhension de l’énergie d’activation, Ea, et des propriétés thermodynamiques impliquant l’état de transition. La théorie des collisions de la vitesse de réaction, bien qu’intuitive, ne dispose pas d’une méthode précise pour prédire le facteur de probabilité de la réaction. La théorie suppose que les réactifs sont des sphères dures plutôt que des molécules avec des structures spécifiques. En 1935, Henry Eyring a contribué à l’élaboration d’une nouvelle théorie appelée théorie de l'état de transition afin de fournir une alternative plus précise à l’équation d’Arrhenius et à la théorie de la collision précédemment utilisées. L’équation d’Eyring fait intervenir la fabrique de fréquences statistiques, v, qui est fondamentale pour la théorie.
Selon la TET, entre l’état où les molécules sont des réactifs et l’état où les molécules sont des produits, il y a l’état de transition. Dans l’état de transition, les réactifs sont combinés en une espèce appelée complexe activé. La théorie suggère qu’il y a trois facteurs principaux qui déterminent si une réaction va se produire:
La concentration du complexe activé
La vitesse à laquelle le complexe activé se brise
La manière dont le complexe activé se brise: s’il se brise pour reformer les réactifs ou s’il se brise pour former un nouveau complexe, les produits.
La théorie des collisions propose que tous les réactifs qui se combinent ne subissent pas une réaction. Toutefois, si les conditions de la théorie de la collision sont remplies et qu’une collision réussie se produit entre les molécules, la théorie de l’état de transition permet l’un des deux résultats suivants: un retour aux réactifs ou un réarrangement des liaisons pour former les produits.
Considérons une réaction bimoléculaire:
où K est la constante d’équilibre. Dans le modèle de l’état de transition, le complexe activé AB est formé:
A + B ⇌ AB‡ → C
Il existe une barrière énergétique, qui est l’énergie d’activation, dans la voie de la réaction. Une certaine quantité d’énergie est nécessaire pour que la réaction se produise. L’état de transition, AB‡, est formé à une énergie maximale. Ce complexe à haute énergie représente un intermédiaire instable. Une fois que la barrière énergétique est surmontée, la réaction peut se dérouler et la formation du produit a lieu.
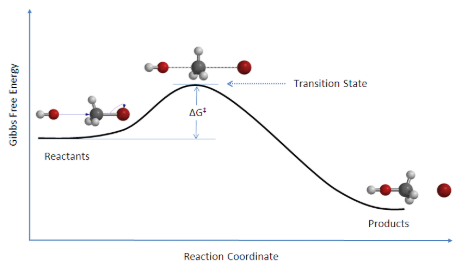
Réaction: HO– + CH3Br → [HO—CH3—Br]‡ → CH3OH + Br
Figure 7.6.1. Diagramme des coordonnées de réaction pour la réaction de substitution nucléophile bimoléculaire (SN2) entre le bromométhane et l’anion hydroxyde. Image utilisée avec la permission de Wikipedia.
La variation de l’énergie libre, ΔG, est égale à la somme de l’enthalpie plus le produit de la température et de l’entropie du système et sera enseignée plus tard en chimie physique. De plus, une réaction SN2 dénote l’addition du nucléophile et le départ du groupe partant, ce qui sera abordé en chimie organique II.
La vitesse d’une réaction est égale au nombre de complexes activés qui se décomposent pour former des produits. Elle est donc la concentration du complexe à haute énergie multipliée par la fréquence à laquelle il franchit la barrière.
vitesse = v[AB]‡ = v[A][B]K‡
La vitesse peut être réécrit:
vitesse = k[A][B]]
En combinant les équations ci-dessus, on obtient:
k[A][B] = v[A][B]K‡
k = vK‡
Équation 7.6.1 Constante d’équilibre thermodynamique
où
v est la fréquence de la vibration,
k est la constante de vitesse et
K‡ est la constante d’équilibre thermodynamique.
La mécanique statistique (pas montrée) prévoit que la fréquence, v, est équivalente à l’énergie thermique, kBT, divisée par la constante de Planck, h.
v = kBTh
où
kB est la constante de Boltzmann (1,381 x 10-23 J/K),
T est la température absolue en Kelvin (K) et
h est la constante de Planck (6,626 x 10-34 Js).
En substituant l’équation pour v dans l’équation pour k:
k = kBThK‡
L’équation pour k est souvent étiquetée avec un autre terme (M1-m) qui rend les unités égales avec M est la molarité et m est la molécularité de la réaction.
Il est important de noter ici que la constante d’équilibre K‡ peut être calculée par des propriétés absolues, fondamentales, telles que la longueur de liaison, la masse atomique et la fréquence de vibration. Cela donne à la théorie de vitesse de transition le nom alternatif de théorie de vitesse absolue, car la constante de vitesse, k, peut être calculée à partir de propriétés fondamentales.
L’équation équilibrée d’une réaction chimique indique ce qui réagit et ce qui est produit, mais elle ne révèle rien sur la manière dont la réaction mécanisme de réactionse déroule réellement. Le mécanisme de réaction (ou chemin de réaction) est le processus, ou chemin, par lequel une réaction se produit.
Une réaction chimique se déroule généralement par étapes, même si cela n’est pas toujours évident pour un observateur. La décomposition de l’ozone, par exemple, semble suivre un mécanisme en deux étapes:
Nous appelons chaque étape d’un mécanisme de réaction une réaction élémentaire[/pb_glossary]. Les réactions élémentaires se produisent exactement comme elles sont écrites et ne peuvent pas être décomposées en étapes plus simples. Les réactions élémentaires s'additionnent pour former la réaction globale, qui, pour la décomposition, est la suivante:
2O3 (g) → 3O2 (g)
Remarquez que l'atome d'oxygène produit dans la première étape de ce mécanisme est consommé dans la deuxième étape et n'apparaît donc pas comme produit dans la réaction globale. Les espèces qui sont produites dans une étape et consommées dans une étape ultérieure sont appelées [pb_glossary id="1936"]intermédiaires.
Bien que l'équation de réaction globale pour la décomposition de l'ozone indique que deux molécules d'ozone réagissent pour donner trois molécules d'oxygène, le mécanisme de la réaction n'implique pas la collision et la réaction de deux molécules d'ozone. Il s'agit plutôt d'une molécule d'ozone qui se décompose en une molécule d'oxygène et un atome d'oxygène intermédiaire; l'atome d'oxygène réagit ensuite avec une deuxième molécule d'ozone pour donner deux molécules d'oxygène. Ces deux réactions élémentaires se produisent exactement comme elles sont représentées dans le mécanisme de réaction.
Théorie selon laquelle entre l'état où les molécules sont des réactifs et l'état où les molécules sont des produits, il existe un état de transition où les réactifs sont combinés en une espèce appelée le complexe activé
Utilisé en cinétique chimique pour illustrer la progression et les diverses propriétés d'une réaction
Réaction élémentaire impliquant trois espèces réactives
Théorie selon laquelle entre l'état où les molécules sont des réactifs et l'état où les molécules sont des produits, il existe un état de transition où les réactifs sont combinés en une espèce appelée le complexe activé
Séquence par étapes des réactions élémentaires par lesquelles un changement chimique a lieu
Réaction qui se déroule en une seule étape, exactement comme le décrit son équation chimique

