5.1 – Définitions acide-base et paires acide-base conjugées
Les acides et les bases sont connus depuis longtemps. Lorsque Robert Boyle les a caractérisés en 1680, il a constaté que les acides dissolvaient de nombreuses substances, changeaient la couleur de certains colorants naturels (par exemple, ils font passer le bleu au rouge), et perdaient ces propriétés caractéristiques au contact des alcalis (bases). Au XVIIIe siècle, il a été reconnu que les acides ont un goût aigre, réagissent avec le calcaire pour libérer une substance gazeuse (aujourd’hui connue sous le nom de CO2), et interagissent avec les alcalis pour former des substances neutres. En 1815, Humphry Davy a largement contribué au développement du concept moderne d’acide-base en démontrant que l’hydrogène est le constituant essentiel des acides. Vers la même époque, Joseph Louis Gay-Lussac a conclu que les acides sont des substances qui peuvent neutraliser les bases et que ces deux classes de substances ne peuvent être définies que l’une par rapport à l’autre. L’importance de l’hydrogène a été réaffirmée en 1884 lorsque Svante Arrhenius a défini un acide comme un composé qui se dissout dans l’eau pour donner des cations d’hydrogène (aujourd’hui reconnus comme des ions hydronium) et une base comme un composé qui se dissout dans l’eau pour donner des anions d’hydroxyde.
Les acides et les bases sont des solutions communes qui existent partout. Ils ont des propriétés chimiques opposées et sont capables de se neutraliser mutuellement pour former H2O, ce qui sera abordé plus loin dans une sous-section. Les acides et les bases peuvent être définis par leurs observations physiques et chimiques dans le tableau ci-dessous.
Tableau 5.1.1 Propriétés générales des acides et des bases
|
Propriétés générales des acides et des bases |
|
|
Acides |
Bases |
|
Produire une douleur perçante dans une plaie |
Donner une impression de glissement |
|
Goût aigre |
Goût amer |
|
Sont incolores lorsqu’ils sont placés dans la phénolphtaléine (un indicateur) |
Sont roses lorsqu’elles sont placées dans de la phénolphtaléine (un indicateur) |
|
Sont rouges sur du papier de tournesol bleu (un indicateur de pH) |
Sont bleus sur du papier de tournesol rouge (un indicateur de pH) |
|
ont un pH < 7 |
Avoir un pH > 7 |
|
Produisent de l’hydrogène gazeux lorsqu’ils réagissent avec des métaux |
|
|
Produisent du dioxyde de carbone lorsqu’ils réagissent avec les carbonates |
|
|
Exemples courants : citrons, oranges, vinaigre, urine, acide sulfurique, acide chlorhydrique |
Exemples courants : savon, dentifrice, eau de javel, produits de nettoyage, eau de chaux, eau ammoniacale, hydroxyde de sodium |
Les acides et les bases dans les solutions aqueuses conduisent l’électricité parce qu’ils contiennent des ions dissous. Par conséquent, les acides et les bases sont des électrolytes, les acides et les bases forts se comportant comme des électrolytes forts par rapport aux acides et aux bases faibles se comportant comme des électrolytes faibles.
En chimie, les acides et les bases ont été définis différemment par trois séries de théories : La première est la définition d’Arrhenius, qui repose sur l’idée que les acides sont des substances qui se dissocient (se détachent) dans une solution aqueuse pour produire des ions hydrogène (H+) tandis que les bases produisent des ions hydroxyde (OH-) en solution. Les deux autres définitions, discutées en détail dans ce chapitre, comprennent la définition de Brønsted-Lowry, qui définit les acides comme donneurs de protons (H+) et les bases comme accepteurs de protons, et la théorie de Lewis des acides et des bases, qui affirme que les acides sont des accepteurs de paires d’électrons tandis que les bases sont des donneurs de paires d’électrons. Comme le montre la figure 5.1.1, plus le niveau de théorie s’élargit pour inclure plus de substances couvertes par chaque définition, plus la théorie se rapproche de la description précise de la chimie acide-base réelle.
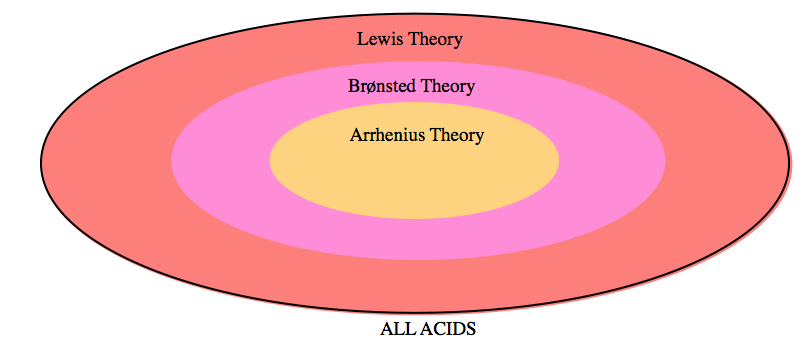
Figure 5.1.1. Un diagramme de Venn représentant les trois niveaux de la théorie de la classification des acides. La théorie d’Arrhenius est la moins précise, et ne couvre qu’un petit sous-ensemble de substances. Brønsted-Lowry développe les définitions d’Arrhenius et est donc légèrement plus large. La théorie de Lewis, l’explication la plus complète, décrit avec le plus de précision tout le comportement acido-basique.
Définition d’Arrhenius des acides et des bases
En 1884, le chimiste suédois Svante Arrhenius a proposé deux classifications spécifiques des composés, appelées acides et bases. Lorsqu’ils sont dissous dans une solution aqueuse, certains ions sont libérés dans la solution. La définition d’Arrhenius des réactions acide-base est un développement de la “théorie de l’hydrogène des acides”. Elle a été utilisée pour fournir une définition moderne des acides et des bases, et a suivi les travaux d’Arrhenius avec Friedrich Wilhelm Ostwald pour établir la présence d’ions dans une solution aqueuse en 1884. C’est ainsi qu’Arrhenius a reçu le prix Nobel de chimie en 1903.
Selon cette théorie, un acide d'Arrhenius est un composé qui augmente la concentration des ions H+ lorsqu’il est ajouté à l’eau. Ce processus est représenté dans ce que l’on appelle une réaction de dissociation dans une équation chimique. Par exemple :
HCl (aq) → H+ (aq) + Cl- (aq)
Dans cette réaction, l’acide chlorhydrique (HCl) se dissocie (se sépare) en ions hydrogène (H+) et chlore (Cl–) lorsqu’il est dissous dans l’eau, libérant ainsi des ions H+ en solution.
Une base d'Arrhenius est un composé qui augmente la concentration des ions hydroxyde, OH–, lorsqu’il est ajouté à l’eau. Par exemple, la base d’Arrhenius est un composé qui augmente la concentration des ions hydroxyde, OH–, lorsqu’il est ajouté à l’eau :
NaOH (aq) → Na+ (aq) + OH- (aq)
Dans cette réaction, une solution aqueuse d’hydroxyde de sodium (NaOH) se dissocie en ions sodium (Na+) et en ions hydroxyde (OH-) lorsqu’elle est dissoute dans l’eau.
Comme vous pouvez l’imaginer, ce niveau de théorie d’Arrhenius est assez limité. Les définitions d’Arrhenius de l’acidité et de l’alcalinité sont limitées aux solutions aqueuses et se réfèrent à la concentration des ions solvatés. Selon cette définition, une solution de H2SO4 ou de HCl pur dissous dans du toluène ne serait pas considérée comme acide, malgré le fait que ces deux acides donneront un proton au toluène. En outre, selon la définition d’Arrhenius, une solution d’amine de sodium (NaNH2) dans de l’ammoniac liquide n’est pas alcaline, bien que l’ion amine (NH2-) déprotonera facilement l’ammoniac. Ainsi, la définition d’Arrhenius ne peut décrire que les acides et les bases dans un environnement aqueux, et la théorie d’Arrhenius exclut de nombreuses substances connues pour présenter un caractère acido-basique.
Une autre faille de la théorie d’Arrhenius est sa dépendance au concept de dissociation des acides, c’est-à-dire un acide “HX” se séparant dans l’eau pour former des ions H+ et X-. Nous savons maintenant que le cation H+ n’existe pas réellement sous cette forme en solution aqueuse ; il est plus précisément représenté comme l’ion hydronium, H3O+.
Par conséquent, étant donné que la théorie du niveau d’Arrhenius ne peut décrire que les acides et les bases dans un environnement aqueux, qu’elle repose sur le concept erroné de la dissociation des acides et qu’elle exclut de nombreuses substances en raison de ses définitions restrictives, cette théorie peut généralement être ignorée à mesure que nous avançons dans notre discussion.
Définition des acides et des bases selon Brønsted-Lowry
En 1923, le chimiste danois Johannes Brønsted et le chimiste anglais Thomas Lowry ont développé les idées d’Arrhenius en élargissant les définitions des acides et des bases. La théorie de Brønsted-Lowry est centrée sur le proton, H+. Un proton est ce qui reste lorsque l’isotope le plus courant de l’hydrogène, 1H, perd un électron. Un composé qui donne un proton à un autre composé est appelé un acide de Brønsted-Lowry, et un composé qui accepte un proton est appelé une base de Brønsted-Lowry. Une réaction acide-base est donc définie comme le transfert d’un proton d’un donneur de proton (acide) à un accepteur de proton (base).
En utilisant ces définitions très simples, le niveau de théorie de Brønsted-Lowry couvre la grande majorité du comportement acido-basique connu, et cette théorie peut donc être appliquée avec succès pour la plus grande partie de ce chapitre (et de ce cours). Cependant, pour être inclus à tous les acides et bases, une théorie encore plus générale est nécessaire. Dans la section 5.6 de ce texte, nous présenterons le modèle final et le plus général du comportement acide-base introduit par le chimiste américain G. N. Lewis.
Les acides peuvent être des substances inorganiques ou organiques (par exemple HCl contre acide acétique, CH3COOH), des substances neutres ou des ions (par exemple H2O contre HSO4-). Chacune de ces espèces contient au moins un atome d’hydrogène ; pour être définie comme un acide de Brønsted-Lowry, la substance doit pouvoir donner cet atome à une autre substance sous la forme d’un proton, H+. Les bases peuvent également être des substances inorganiques ou organiques (par exemple NaOH contre méthylamine, CH3NH2), des substances ou des ions neutres (par exemple NH3 contre [Al(H2O)5OH]2+). Chacun de ces exemples est capable d’accepter un proton et peut donc être classé comme base de Brønsted-Lowry. Les bases les plus connues et les plus reconnaissables sont généralement des composés ioniques inorganiques qui contiennent l’ion hydroxyde, comme NaOH et Ca(OH)2.
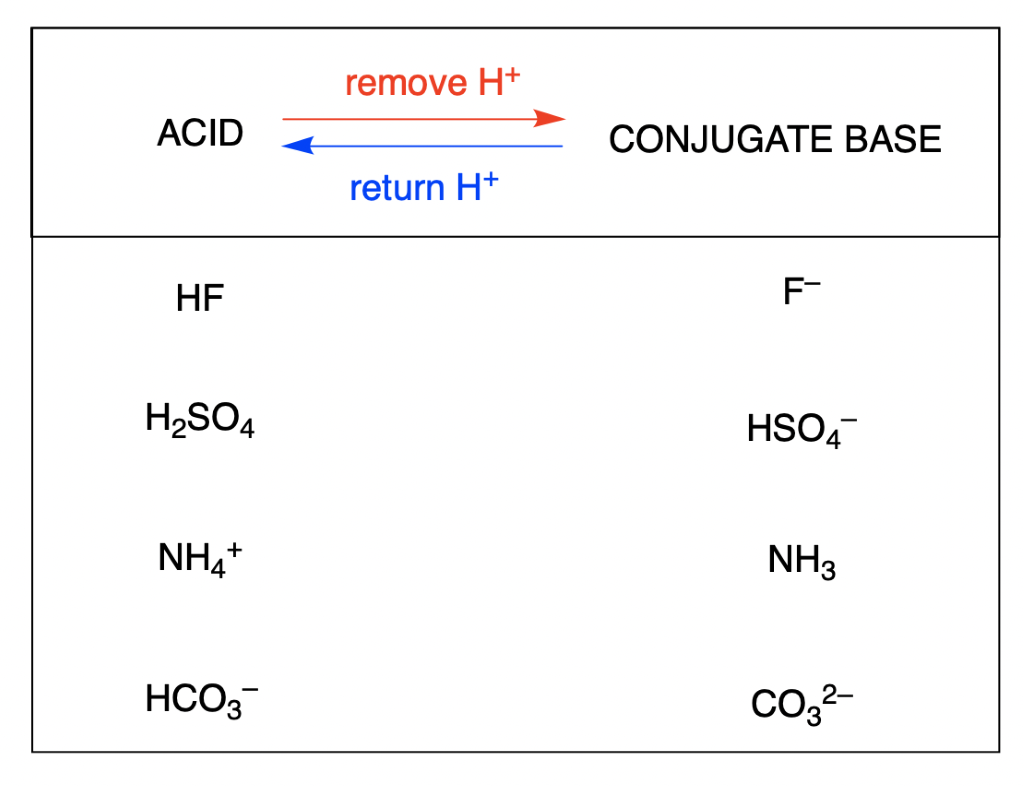
La base conjuguée d’un acide est ce qui reste après que l’acide a donné un proton. Cette espèce est une base parce qu’elle peut accepter un proton pour reformer l’acide original :
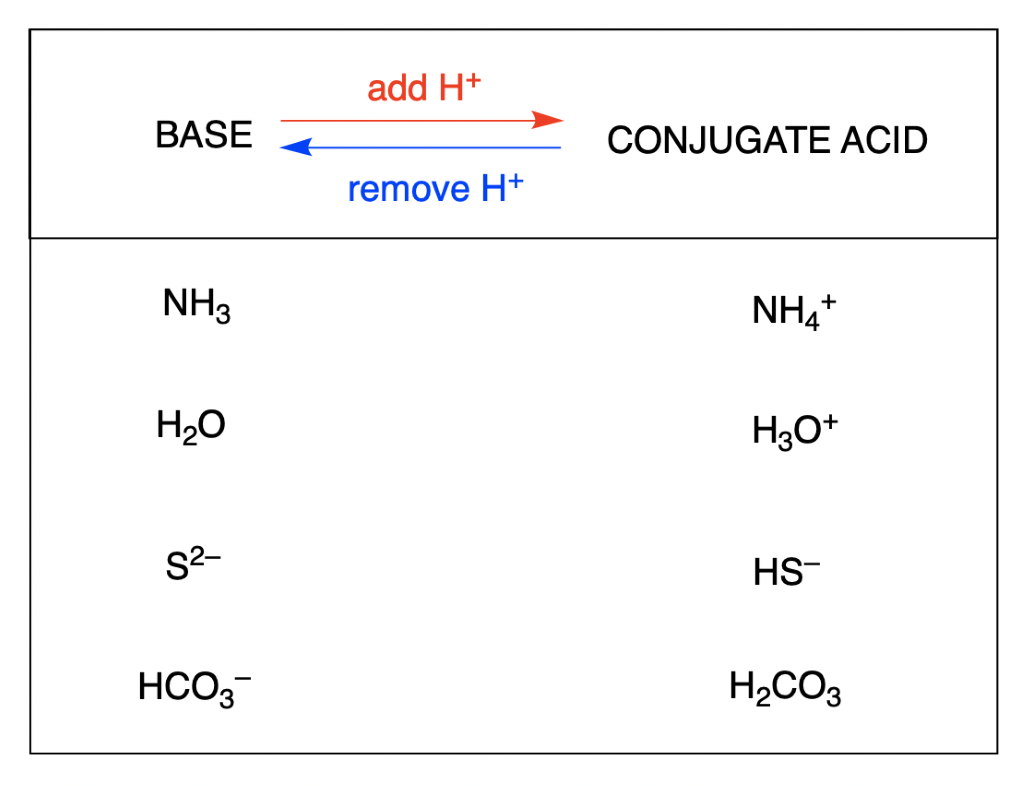
L'acide conjugué d’une base est ce qui se produit après que la base a accepté un proton. Cette espèce est un acide parce qu’elle peut abandonner un proton pour reformer la base d’origine :
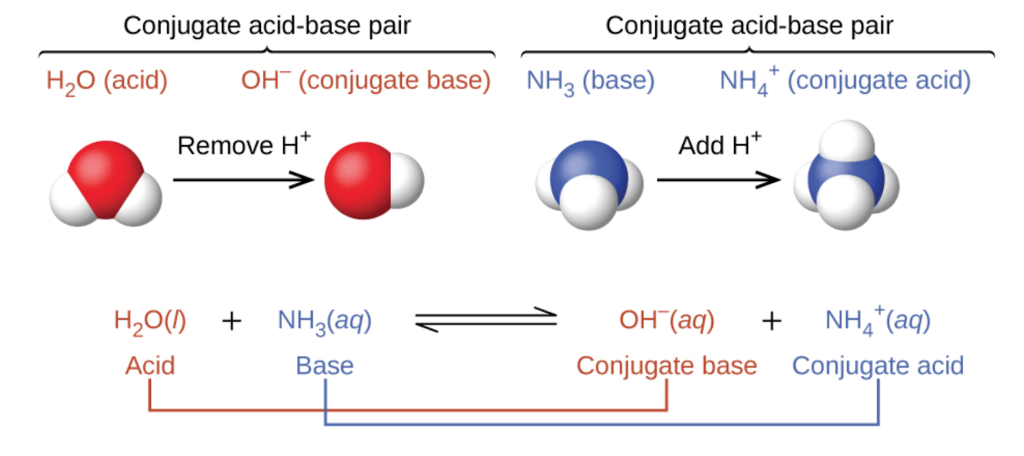
Dans les deux schémas ci-dessus, le comportement des acides en tant que donneurs de protons et celui des bases en tant qu’accepteurs de protons sont représentés de manière isolée. En réalité, toutes les réactions acide-base impliquent le transfert de protons entre les acides et les bases. Ceci est très utile lorsqu’on vous demande de classer les réactions, comme dans la section 1.4 – Stœchiométrie en solution, où nous avons discuté des trois types de réactions chimiques couverts par le CHM 1311 : réactions acide-base, redox et précipitation. Si vous pouvez identifier les quatre termes d’une réaction de transfert de protons (un acide, une base, un acide conjugué et une base conjuguée), vous pouvez être certain qu’il s’agit d’une réaction acide-base de Brønsted-Lowry. Prenons par exemple la réaction acide-base qui se produit lorsque de l’ammoniac est dissous dans l’eau. Une molécule d’eau (fonctionnant comme un acide) transfère un proton à une molécule d’ammoniac (fonctionnant comme une base), ce qui donne la base conjuguée de l’eau, OH-, et l’acide conjugué de l’ammoniac, NH4+ :
La réaction entre un acide de Brønsted-Lowry et une base est appelée ionisation (notez que cela diffère légèrement du terme de dissociation défini précédemment). Plus précisément, lorsque nous ajoutons un acide à l’eau, il se produit une ionisation de l'acide, dans laquelle les protons sont transférés des molécules d’acide aux molécules d’eau. Par exemple, lorsque le fluorure d’hydrogène se dissout dans l’eau et s‘ionise, les protons sont transférés des molécules de fluorure d’hydrogène aux molécules d’eau, ce qui donne des ions hydroniums et des ions fluorure :
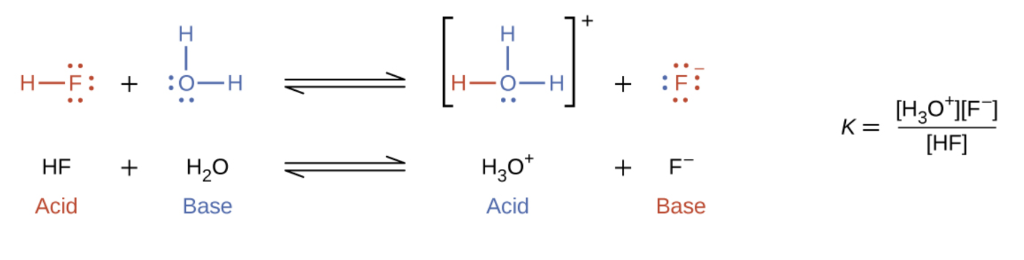
Lorsque nous ajoutons une base à l’eau, il se produit une réaction d’ionisation des bases dans laquelle les protons sont transférés des molécules d’eau aux molécules de base. Par exemple, l’ajout de pyridine à l’eau produit des ions hydroxyde et des ions pyridinium :
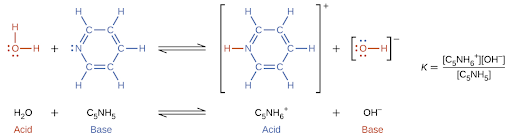
Remarquez que ces deux réactions d’ionisation sont représentées comme des processus d’équilibre. L’étendue relative de ces réactions d’ionisation acide et basique est un sujet important traité dans une section ultérieure de ce chapitre.
|
Comme une réaction acide-base commence avec deux espèces et finit avec deux espèces, nous ne devrions pas utiliser le terme “dissociation” dans le contexte des acides et des bases (par exemple la dissociation d’un acide en solution). La raison en est que le terme implique qu’une espèce se dissocie en deux, alors qu’en réalité la réaction acide-base implique un transfert de protons entre deux espèces. |
Souvent, pour décrire une réaction acide-base, on peut désigner la partie de l’acide ou de la base qui n’est pas ionisée en solution (c’est-à-dire qui reste sous sa forme neutre) comme étant non ionisée ou ionisée. Dans ce texte, nous utiliserons ce dernier terme, mais soyez prêts à reconnaître les deux adjectifs lorsque vous étudiez la chimie.
Comment reconnaître la différence entre un chimiste et un plombier ? Demandez-leur de prononcer le mot UNIONISÉ!
Questions
★ Questions
- Écrivez des équations qui montrent que le NH3 est à la fois un acide conjugué et une base conjuguée.
2. Écrivez des équations qui montrent que H2PO4− agit à la fois comme un acide et comme une base.
3. Démontrer par des équations ioniques nettes appropriées que chacune des espèces suivantes peut agir comme un acide de Brønsted-Lowry :
(a) H3O+
(b) HCl
(c) NH3
(d) CH3CO2H
(e) NH4+
(f) HSO4–
4. Démontrer par des équations ioniques nettes appropriées que chacune des espèces suivantes peut agir comme un acide de Brønsted-Lowry :
(a) HNO3
(b) PH4+
(c) H2S
(d) CH3CH2COOH
(e) H2PO4–
(f) HS–
5. Démontrer par des équations ioniques nettes appropriées que chacune des espèces suivantes peut agir comme base de Brønsted-Lowry :
(a) HS–
(b) PO43-
(c) NH2–
(d) C2H5OH
(e) O2-
(f) H2PO4–
6. Quel est l’acide conjugué de chacun des éléments suivants ? Quelle est la base conjuguée de chacun d’entre eux ?
(a) H2S
(b) H2PO4–
(c) PH3
(d) HS–
(e) HSO3–
(f) H3O2+
(g) H4N2
(h) CH3OH
7. Identifier et étiqueter l’acide de Brønsted-Lowry, sa base conjuguée, la base de Brønsted-Lowry et son acide conjugué dans chacune des équations suivantes :
(a) HNO3 + H2O → H3O+ + NO3–
(b) CN– + H2O → HCN + OH–
(c) H2SO4 + Cl– → HCl + HSO4–
(d) HSO4– + OH– → SO42- + H2O
(e) O2– + H2O → 2 OH–
(f) [Cu(H2O)3(OH)]+ + [Al(H2O)6]3+ → [Cu(H2O)4]2+ + [Al(H2O)5(OH)]2+
(g) H2S + NH2– → HS– + NH3
Réponses
- Un exemple pour le NH3 en tant qu’acide conjugué :NH2– + H+ → NH3; en tant que base conjuguée: NH4+ (aq) + OH– (aq) → NH3 (aq) + H2O (l)
2. Sous forme d’acide :H2PO4– + H+ → H3PO4 ; sous forme de base : H2PO4– + OH– → HPO42- + H2
3. (a) H3O+ (aq) → H+ (aq) + H2O (l)
(b) HCl (l) → H+ (aq) + Cl– (aq)
(c) NH3 → NH2– + H+
(d) CH3CO2H (aq) → H+ (aq) + CH3CO2– (aq)
(e) NH4+ (aq) → NH3 (aq) + H+ (aq)
(f) HSO4– (aq) → H+ (aq) + SO42- (aq)
4. (a) HNO3 → H+ + NO3–
(b) PH4+ → H+ + PH3
(c) H2S → H+ + HS–
(d) CH3CH2COOH → H+ + CH3CH2COO–
(e) H2PO4– → H+ + HPO42-
(f) HS– → H+ + S2-
5. (a) H2O (l) + H+ (aq) → H3O+ (aq)
(b) OH– (aq) + H+ (aq) → H2O (l)
(c) NH3 (aq) + H+ (aq) → NH4+ (aq)
(d) CN– (aq) + H+ (aq) → HCN (aq)
(e) S2- (aq) + H+ (aq) → HS– (aq)
(f) H2PO4– (aq) + H+ (aq) → H3PO4 (aq)
6. (a) Acide conjugué : H3S+ ; Base conjuguée : HS–
(b) Acide conjugué : H3PO4 ; Base conjuguée : HPO42-
(c) Acide conjugué : PH4+ ; Base conjuguée : PH2–
(d) Acide conjugué : H2S ; Base conjuguée : S2-
(e) Acide conjugué :H2SO3 ; Base conjuguée :SO32-
(f) Acide conjugué : H4O22+ ; Base conjuguée : H2O2
(g) Acide conjugué : H5N2+ ; Base conjuguée : H3N2–
(h) Acide conjugué : CH3OH2+ ; Base conjuguée :CH3O–
7. Les étiquettes sont les suivantes : acide de Bronsted-Lowry = BA ; sa base conjuguée = CB ; base de Bronsted-Lowry = BB ; son acide conjugué = CA.
(a) HNO3 (BA), H2O (BB), H3O+ (CA), NO3– (CB)
(b) CN– (BB), H2O (BA), HCN (CA), OH– (CB)
(c) H2SO4 (BA), Cl– (BB), HCl (CA), HSO4– (CB)
(d) HSO4– (BA), OH– (BB), SO42- (CB), H2O (CA)
(e) O2- (BB), H2O (BA), OH– (CA and CB)
(f) [Cu(H2O)3(OH)]+ (BB), [Al(H2O)6]3+ (BA), [Cu(H2O)4]2+ (CA), [Al(H2O)5(OH)]2+ (CB)
(g) NH2– (BB), HS– (CB), NH3 (CA)
Composé qui augmente la concentration d'ions hydrogène en solution aqueuse
Composé qui augmente la concentration en ions hydroxyde dans une solution aqueuse
Espèce chimique réelle qui représente un ion hydrogène se combinant avec une molécule d'eau en solution aqueuse
Toute espèce qui peut donner un proton à une autre molécule
Toute espèce qui peut accepter un proton d'une autre molécule
Substance formée lorsqu'un acide perd un proton
Substance formée lorsqu'une base gagne un proton
Constante d'équilibre pour une réaction d'ionisation acide
Constante d'équilibre pour une réaction d'ionisation des bases

 Toutes les
Toutes les