6.2 – Solutions tampons
Un mélange d’un acide faible et de sa base conjuguée (ou un mélange d’une base faible et de son acide conjugué) est appelé une solution tampon, ou simplement un tampon. Les solutions tampons résistent à un changement de pH lorsque de petites quantités d’un acide fort ou d’une base forte sont ajoutées (figure 6.2.1.). Une solution d’acide acétique et d’acétate de sodium (CH3COOH + CH3COONa) est un exemple de tampon constitué d’un acide faible et de sa base conjuguée, tandis qu’une solution d’ammoniac et de chlorure d’ammonium (NH3 + NH4Cl) est un exemple de tampon constitué d’une base faible et de son acide conjugué.

Figure 6.2.1. (a) La solution non tamponnée à gauche et la solution tamponnée à droite ont le même pH (pH 8) ; elles sont basiques, ce qui montre la couleur jaune de l’indicateur methyl orange à ce pH. (b) Après l’addition de 1 ml d’une solution de HCl 0,01 M, la solution tampon n’a pas changé de pH de façon détectable, mais la solution non tamponnée est devenue acide, comme l’indique le changement de couleur de l’orange méthylique, qui devient rouge à un pH d’environ 4 (crédit : modification des travaux de Mark Ott).
Comment fonctionnent les tampons
Les tampons sont fabriqués en mélangeant un acide faible avec sa base conjuguée ou une base faible avec son acide conjugué. Il est essentiel que l’acide et la base forment une paire conjuguée; de cette façon, les deux espèces ne peuvent pas se neutraliser l’une l’autre. Par exemple, si un tampon est formé à partir d’un acide faible HA et de sa base conjuguée A–, tout transfert de protons qui se produit donne des produits identiques aux réactifs, un processus connu sous le nom de réaction d’identité :
HA + A– → A– + HA
Au lieu de cela, la paire conjuguée d’acide et de base fonctionne pour neutraliser les sources externes de base et d’acide, respectivement, dans les réactions suivantes :
HA + OH– → A– + H2O
A– + H3O+ → HA + H2O
Nous reviendrons plus tard sur ces réactions de neutralisation, mais examinons d’abord les différences entre les tampons acides et basiques.
Tampons acides : mélanges aqueux de HA + A-
Si l’on mélange de l’acide acétique et de l’acétate de sodium dans de l’eau, la solution aqueuse obtenue a un pH < 7. Elle est acide parce que le Ka de l’acide acétique (1,8 x 10-5) est supérieur au Kb de l’acétate de la base conjuguée (5,6 x 10-10) :
CH3COOH + H2O ⇌ CH3COO– + H3O+ Ka = 1.8×10–5
CH3COO– + H2O ⇌ CH3COOH + OH– Kb = 5.6×10–10
Si l’on compare les valeurs K, le premier équilibre est plus proche des produits que le second, il y a donc plus d’ion hydronium que d’ion hydroxyde dans le mélange, ce qui produit un pH global acide pour le mélange.
Cette solution est un tampon car elle contient la paire conjuguée d’un acide faible et de sa base conjuguée, HA et A–, et les deux espèces sont présentes en concentrations importantes. Cela permet de maintenir la concentration en ions hydronium (le pH) presque constante même après l’ajout d’un acide fort ou d’une base forte. La paire d’acides/bases conjuguées est capable de neutraliser l’acide fort ou la base forte ajoutée à la solution.
Par exemple, si une source externe d’acide augmente la quantité de H3O+, le tampon contrebalance cette addition :
CH3COO– (aq) + H3O+ (aq) → CH3COOH (aq) + H2O (l)
Dans cette réaction, la base conjuguée, CH3COO–, va neutraliser l’acide ajouté, H3O+. Cette réaction s’achève, car la réaction de CH3COO– avec H3O+ a une constante d’équilibre qui est l’inverse du Ka pour CH3COOH : 1/Ka = 1/(1,8×10-5) = 5,5×104, ce qui indique une réaction fortement favorisée par le produit. Tant qu’il y a significativement plus de CH3COO– que de H3O+, le H3O+ ajouté à l’extérieur sera consommé, augmentant la concentration de CH3COOH et diminuant la concentration de CH3COO–. Mais, comme ces deux espèces sont toutes deux présentes en grandes concentrations, le rapport acide/base conjuguée est presque constant et la quantité de H3O+ présente ne changera pratiquement pas une fois l’équilibre rétabli.
Si une base forte était ajoutée, comme l’hydroxyde de sodium (NaOH) :
CH3CO2H (aq) + H2O (l) ⇌ H3O+ (aq) + CH3CO2– (aq)
Dans cette réaction, l’acide conjugué, CH3COOH, va neutraliser les quantités ajoutées de base, OH-, augmentant légèrement la concentration de CH3COO– dans la solution et diminuant la quantité de CH3COOH. Là encore, comme la majeure partie de l’OH- est neutralisée, le pH ne changera que très peu.
Tampons de base : mélanges aqueux de B + HB+
Un mélange d’ammoniac et de chlorure d’ammonium est basique car le Kb de l’ammoniac est supérieur au Ka de l’ion ammonium. C’est un tampon parce qu’il contient également l’acide conjugué de la base faible. Si l’on ajoute une base (ions hydroxyde), les ions ammonium du tampon réagissent avec les ions hydroxyde pour former de l’ammoniac et de l’eau et ramener la concentration d’ions hydroxyde presque à sa valeur initiale :
NH4+ (aq) + OH- (aq) → NH3 (aq) + H2O (l)
Si nous ajoutons un acide (ions hydronium), les molécules d’ammoniac dans le mélange tampon réagissent avec les ions hydroniums pour former des ions ammonium et réduire la concentration d’ions hydronium presque à sa valeur initiale :
H3O+ (aq) + NH3 (aq) → NH4+ (aq) + H2O (l)
Les trois parties de l’exemple suivant illustrent le changement de pH qui accompagne l’ajout de base à une solution tamponnée d’un acide faible et à une solution non tamponnée d’un acide fort.
Exemple 6.2.1 – Changements de pH dans les solutions tamponnées et non tamponnées
Les tampons d’acétate sont utilisés dans les études biochimiques des enzymes et d’autres composants chimiques des cellules pour empêcher les changements de pH qui pourraient modifier l’activité biochimique de ces composés.
(a) Calculer le pH d’un tampon d’acétate qui est un mélange d’acide acétique 0,10 M et d’acétate de sodium 0,10 M.
b) Calculer le pH après avoir ajouté 1,0 ml de NaOH 0,10 M à 100 ml de ce tampon, ce qui donne une solution d’un volume total de 101 ml.
c) Calculer le pH après avoir ajouté 1,0 ml de NaOH 0,10 M à 100 ml d’une solution non tamponnée de HCl 1,8 × 10-5.
Solution
(a) Pour déterminer le pH de la solution tampon, nous utilisons un calcul d’équilibre typique (comme illustré dans les exemples précédents) :
Déterminer la direction du changement. L’équilibre dans un mélange de H3O+, CH3CO2−, et CH3CO2H est :
CH3CO2H (aq) + H2O (l) ⇌ H3O+ (aq) + CH3CO2– (aq)
La constante d’équilibre pour le CH3CO2H n’est pas donnée, nous la recherchons donc dans l’annexe H : Ka = 1,8 × 10-5. Avec [CH3CO2H] = [CH3CO2–] = 0,10 M et [H3O+] = ~0 M, la réaction se déplace vers la droite pour former H3O+.
Déterminer les concentrations x et d’équilibre. Un tableau des changements et des concentrations suit :
CH3CO2H + H2O ⇌ H3O+ + CH3CO2–
|
Concentration initiale (M) |
0.10 |
|
~0 |
0.10 |
|
Changement (M) |
-x |
|
x |
x |
|
Concentration à l’équilibre (M) |
0.10 – x |
|
x |
0.10 + x |
Résoudre x et les concentrations d’équilibre. Nous trouvons :
x=1.8×10-5 M
et
[H3O+]=0+x=1.8×10-5 M
Ainsi :
Vérifiez votre travail. Si nous calculons toutes les concentrations d’équilibre calculées, nous constatons que la valeur d’équilibre du coefficient de réaction, Q = Ka.
Note : Remarquez que lorsque [HA] = [A–], pH = pKa. Qualitativement, on s’attendrait à une diminution du pH à mesure que le [HA] augmente, puisque cela augmente le [H3O+]. Inversement, on s’attendrait à une augmentation du pH lorsque le [A–] augmente. Comme A- est la base conjuguée de l’HA (voir l’équation ci-dessous), en augmentant la concentration de A–, l’équilibre favorisera l’HA (selon le principe de Le Chatelier), diminuant ainsi le [H3O+] en solution et augmentant donc le pH. Plus loin dans ce chapitre, l’équation de Henderson-Hasselbach sera introduite et démontrera mathématiquement pourquoi pH = pKa quand [HA] = [A–].
(b) Comme nous ajoutons une base, elle sera neutralisée par l’acide du tampon, l’acide acétique. Nous calculons d’abord les concentrations d’un mélange intermédiaire résultant de la réaction complète entre l’acide du tampon et la base ajoutée. Ensuite, nous déterminons les concentrations du mélange au nouvel équilibre :
Déterminez les moles de NaOH. Un millilitre (0,0010 L) de 0,10 M de NaOH en contient :
0.0010 L×(0.10 mol NaOH/1 L)= 1.0×10-4 mol NaOH
Déterminez les moles de CH2CO2H. Avant la réaction, 0,100 L de la solution tampon contient :
0.100 L ×(0.100 mol CH3CO2H/1L)=1.00×10-2 mol CH3CO2H
Résolvez la quantité de NaCH3CO2 produite. Le 1,0 × 10-4 mol de NaOH neutralise 1,0 × 10-4 mol de CH3CO2H, ce qui laisse :
(1.0×10-2)-(0.01×10-2)=0.99×10-2 mol CH3CO2H
et produisant 1,0 × 10-4 mol de NaCH3CO2. Cela donne un total de :
(1.0×10-2)+(0.01×10-2)=1.01×10-2 mol NaCH3CO2
Trouvez la molarité des produits. Après réaction, le CH3CO2H et le NaCH3CO2 sont contenus dans 101 ml de la solution intermédiaire, donc :
[NaCH3CO2]= (1.01×10-2 mol/0.101 L) = 0.100M
Nous calculons maintenant le pH après que la solution intermédiaire, qui est de 0,098 M dans le CH3CO2Het de 0,100 M dans le NaCH3CO2, soit arrivée à l’équilibre. Le calcul est très similaire à celui de la partie (a) de cet exemple :
Cette série de calculs donne un pH = 4,75. Ainsi, l’ajout de la base n’a que légèrement augmenté le pH de la solution de 4,74 à 4,75.
c) La solution 1,8 × 10-5 M de HCl a la même concentration en ions hydronium que la solution 0,10 M de tampon acide acétique-sodium acétate décrite dans la partie (a) de cet exemple. La solution contient :
0.100L= (1.8×10-5 mol HCl/1L) = 1.8×10-6 mol HCl
Comme indiqué dans la partie (b), 1 ml de NaOH 0,10 M contient 1,0 × 10-4 mol de NaOH. Lorsque les solutions de NaOH et de HCl sont mélangées, le HCl est le réactif limitant la réaction. Tout le HCl réagit, et la quantité de NaOH qui reste l’est :
(1.0×10-4)-(1.8×10-6)=9.8×10-5M
La concentration de NaOH est de
9.8×10-5 M NaOH/0.101L= 9.7×10-4 M
Le pOH de cette solution est :
pOH=-log[OH–]=-log(9.7×10-4) = 3.01
Le pH est :
pH=14.00-pOH=10.99
Le pH passe de 4,74 à 10,99 dans cette solution non tamponnée. En comparaison, le changement de 4,74 à 4,75 s’est produit lorsque la même quantité de NaOH a été ajoutée à la solution tampon décrite dans la partie (b).
Vérifiez votre apprentissage 6.2.1 – Changements de pH dans les solutions tamponnées et non tamponnées
Montrer que l’ajout de 1,0 ml de HCl 0,10 M fait passer le pH de 100 ml d’une solution de HCl 1,8 × 10-5 M de 4,74 à 3,00.
Solution
pH initial de 1,8 × 10-5 M HCl ; pH = -log [H3O+] = -log [1,8 × 10-5] = 4,74
Moles de H3O+ dans 100 ml de HCl 1,8 × 10-5 M ; 1,8 × 10-5 moles/L × 0,100 L = 1,8 × 10-6
Moles de H3O+ ajoutées par addition de 1,0 ml de HCl 0,10 M : 0,10 moles/L × 0,0010 L = 1,0 × 10-4 moles ; pH final après addition de 1,0 ml de HCl 0,10 M :
pH= -log[H3O+] = -log(total moles H3O+/total volume) = -log(1.0×10-4 + 1.8×10-6 mol/0.101 L) = 3.00
Sélection des mélanges tampons appropriés
Il existe deux règles empiriques utiles pour sélectionner les mélanges de tampons :
1. Un bon mélange tampon doit avoir des concentrations à peu près égales de ses deux composants.
2. Une solution tampon a généralement perdu son utilité lorsque la quantité d’un composant de la paire de tampons est inférieure à environ 10 % de l’autre. La figure 6.2.2. montre l’effet sur le pH d’un tampon d’ions acide acétique – acétate lorsque la quantité de base forte est ajoutée. Au départ, le tampon contient des quantités égales d’acide acétique et d’acétate, et le pH initial est de 4,74. Une modification de 1 unité de pH se produit lorsque la concentration d’acide acétique est réduite à 11 % de la concentration d’ions acétate.
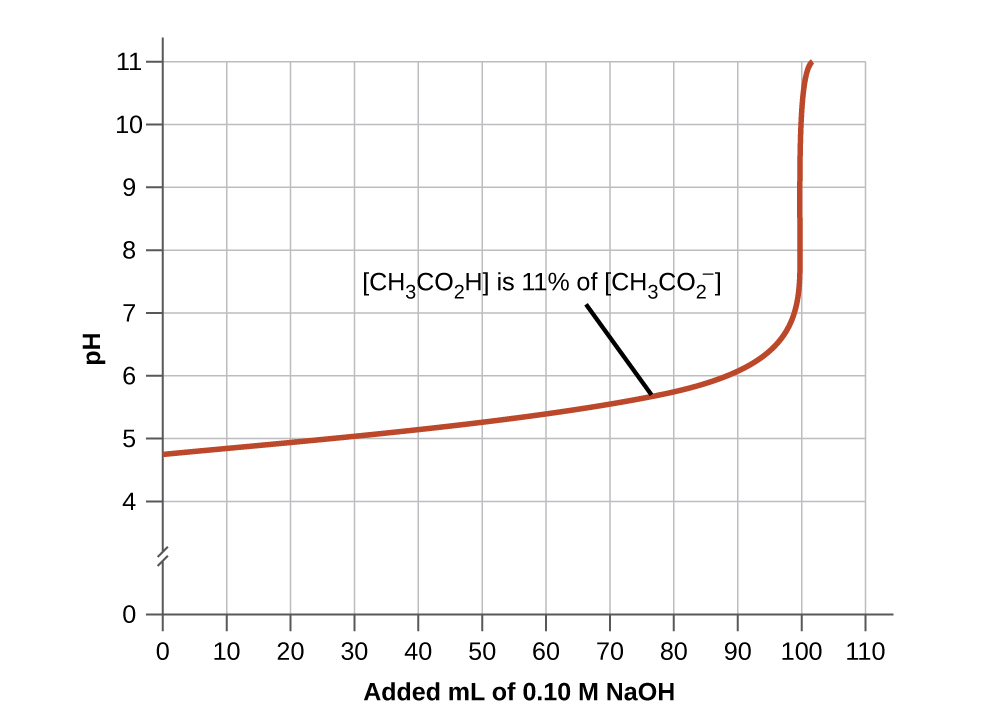
Figure 6.2.2. Le graphique, une illustration de l’action tampon, montre le changement de pH lorsqu’une quantité croissante d’une solution de NaOH 0,10 M est ajoutée à 100 ml d’une solution tampon dans laquelle, initialement, [CH3CO2H] = 0.10 M and [CH3CO2−] = 0.10 M.
3. Les acides faibles et leurs bases conjuguées sont meilleurs comme tampons pour les pH inférieurs à 7 ; les bases faibles et leurs acides conjugués sont meilleurs comme tampons pour les pH supérieurs à 7.
|
Courbes d’action tampon Pourquoi les courbes d’action des tampons ont-elles cette apparence ? L’essentiel est d’identifier ce qui se passe à chaque partie de la courbe. La figure 6.2.2. montre un tampon d’ions d’acide acétique et d’acétate qui commence à un pH de 4,74. Au fur et à mesure que le NaOH est lentement ajouté, le pH augmente très peu jusqu’à ce qu’environ 90 ml de NaOH soient introduits. Ceci est dû au fait que l’acide acétique réagit avec les anions OH- ionisés et que la paire conjuguée acide/base atteint l’équilibre. Cela épuise les OH- en solution et maintient le pH assez constant. Ensuite, le graphique nous montre que le pH augmente très rapidement avec une très petite addition de NaOH. Cela s’explique par le fait que le NaOH a épuisé tout l’acide acétique disponible pour la neutralisation de son anion OH-. Une fois qu’il n’y a plus de neutralisation possible, l’excès de OH- en solution rend rapidement la solution basique avec l’excès de OH-. Bien que le graphique se coupe, la fin de la courbe se stabilise en ligne droite. Cela se produit lorsque suffisamment de NaOH a été ajouté pour amener l’ensemble de la solution à un pH d’environ 13 (le pH du NaOH). |
L’équation Henderson-Hasselbalch
L’expression de la constante d’ionisation pour une solution d’un acide faible peut s’écrire comme :
Ka=([H3O+][A–])/[HA]
Réorganiser pour résoudre le [H3O+], nous obtenons :
[H3O+]=Ka×([HA]/[A–])
En prenant le logarithme négatif des deux côtés de cette équation, on arrive à
-log[H3O+] = -log(Ka)-log([HA]/[A–])
qui peut s’écrire
pH=pKa+log([A–]/[HA])
où pKa est le négatif du logarithme commun de la constante d’ionisation de l’acide faible (pKa = -log Ka). Cette équation relie le pH, la constante d’ionisation d’un acide faible, et les concentrations de l’acide faible et de sa base conjuguée dans une solution tamponnée. Les scientifiques utilisent souvent cette expression, appelée équation de Henderson-Hasselbalch, pour calculer le pH des solutions tampon. Il est important de noter que l’hypothèse “x est petit” doit être valable pour utiliser cette équation.
|
Lawrence Joseph Henderson et Karl Albert Hasselbalch Lawrence Joseph Henderson (1878-1942) était un médecin, biochimiste et physiologiste américain, pour ne citer que quelques-unes de ses nombreuses activités. Il a obtenu un diplôme de médecine à Harvard et a ensuite passé deux ans à Strasbourg, puis dans une partie de l’Allemagne, avant de revenir pour y occuper un poste de conférencier. Il est finalement devenu professeur à Harvard et y a travaillé toute sa vie. Il a découvert que l’équilibre acide-base dans le sang humain est régulé par un système tampon formé par le dioxyde de carbone dissous dans le sang. Il a écrit une équation en 1908 pour décrire le système tampon acide carbonique – carbonate dans le sang. Henderson avait de vastes connaissances ; en plus de ses importantes recherches sur la physiologie du sang, il a également écrit sur les adaptations des organismes et leur adaptation à leur environnement, sur la sociologie et sur l’enseignement universitaire. Il a également fondé le Laboratoire de la Fatigue, au Harvard Business School, qui a examiné la physiologie humaine en mettant l’accent sur le travail dans l’industrie, l’exercice et la nutrition. En 1916, Karl Albert Hasselbalch (1874-1962), un médecin et chimiste danois, a partagé la paternité d’un article avec Christian Bohr en 1904 qui décrivait l’effet Bohr, lequel montrait que la capacité de l’hémoglobine dans le sang à se lier à l’oxygène était inversement liée à l’acidité du sang et à la concentration de dioxyde de carbone. L’échelle de pH a été introduite en 1909 par un autre Danois, Sørensen, et en 1912, Hasselbalch a publié des mesures du pH du sang. En 1916, Hasselbalch a exprimé l’équation de Henderson en termes logarithmiques, en accord avec l’échelle logarithmique du pH, et c’est ainsi qu’est née l’équation de Henderson-Hasselbalch. |
Médecine : le système tampon dans le sang
Le sang est un exemple important de solution tamponnée, l’acide et l’ion principaux responsables de l’action tampon étant l’acide carbonique, H2CO3, et l’ion bicarbonate, HCO3–. Lorsqu’un excès d’ion hydrogène pénètre dans la circulation sanguine, il est éliminé principalement par la réaction :
H3O+ (aq) + HCO3– (aq) → H2CO3 (aq) + H2O (l)
Lorsqu’un excès de l’ion hydroxyde est présent, il est éliminé par la réaction :
OH– (aq) + H2CO3 (aq) → HCO3– (aq) + H2O (l)
La concentration d’acide carbonique, H2CO3, est d’environ 0,0012 M, et la concentration de l’ion hydrogénocarbonate, HCO3-, est d’environ 0,024 M. En utilisant l’équation de Henderson-Hasselbalch et le pKa de l’acide carbonique à la température du corps, nous pouvons calculer le pH du sang :
pH=pKa+log([base]/[acid])=6.4+log(0.024/0.0012)=7.7
Le fait que la concentration en H2CO3 soit nettement inférieure à celle de l’ion HCO3- peut sembler inhabituel, mais ce déséquilibre est dû au fait que la plupart des sous-produits de notre métabolisme qui entrent dans notre circulation sanguine sont acides. Par conséquent, il doit y avoir une proportion plus importante de base que d’acide, afin que la capacité du tampon ne soit pas dépassée.
L’acide lactique est produit dans nos muscles lorsque nous faisons de l’exercice. Lorsque l’acide lactique pénètre dans la circulation sanguine, il est neutralisé par l’ion HCO3-, produisant ainsi du H2CO3. Une enzyme accélère alors la décomposition de l’acide carbonique excédentaire en dioxyde de carbone et en eau, qui peuvent être éliminés par la respiration. En fait, en plus des effets régulateurs du système tampon carbonate sur le pH du sang, l’organisme utilise la respiration pour réguler le pH du sang. Si le pH du sang diminue trop, une augmentation de la respiration élimine le CO2 du sang par les poumons, ce qui entraîne une réaction d’équilibre qui fait baisser le [H3O+]. Si le sang est trop alcalin, un taux de respiration plus faible augmente la concentration de CO2 dans le sang, entraînant la réaction d’équilibre dans l’autre sens, augmentant le [H+] et rétablissant un pH approprié.
Pouvoir et Intervalle des Tampons
Les tampons sont caractérisés par deux paramètres, l’intervalle et le pouvoir des tampons. L’intervalle tampon est l’intervalle des valeurs de pH sur lequel un tampon peut neutraliser de manière fiable les acides/bases externes ajoutés. Il est égal à pKa ± 1, et est donc fonction de l’identité de l’acide dans la paire conjuguée acide/base utilisée pour construire le tampon. Par exemple, le pKa de l’acide acétique est de 4,74 ; par conséquent, les tampons fabriqués en mélangeant de l’acide acétique et de l’acétate peuvent avoir des pH allant de 3,74 à 5,74. C’est une conséquence de la deuxième exigence relative aux tampons mentionnée ci-dessus : un composant ne peut pas être présent en quantité inférieure à 10 % de l’autre, ou :
1/10 < [base]/[acide] < 10/1
En d’autres termes, le rapport entre la base et l’acide dans le tampon doit être supérieur à 0,1 mais inférieur à 10. Dès que ce rapport devient trop déséquilibré (c’est-à-dire en dehors de l’intervalle ci-dessus), alors la plage du tampon a été dépassée, et nous ne nous attendons plus à ce que le mélange neutralise efficacement les acides/bases externes.
Les solutions tampons n’ont pas une capacité illimitée à maintenir le pH relativement constant (figure 6.2.3.). Si nous ajoutons tellement de base à un tampon que l’acide faible est épuisé, aucune autre action tampon vers la base n’est possible. En revanche, si nous ajoutons un excès d’acide, la base faible est épuisée, et aucune action tampon supplémentaire n’est possible. En fait, nous n’avons même pas besoin d’épuiser tout l’acide ou la base dans un tampon pour le surcharger ; son action tampon diminuera rapidement à mesure qu’un composant donné s’approche de l’épuisement.

Figure 6.2.3. La couleur de l’indicateur (orange méthyle) montre qu’une petite quantité d’acide ajoutée à une solution tamponnée de pH 8 (bécher de gauche) a peu d’effet sur le système tamponné (bécher du milieu). Cependant, une grande quantité d’acide épuise le pouvoir tampon de la solution et le pH change de façon spectaculaire (bécher de droite). (crédit : modification du travail de Mark Ott)
Le pouvoir tampon est donc la quantité d’acide ou de base qui peut être ajoutée à un volume donné d’une solution tampon avant que le pH ne change de manière significative, généralement d’une unité. Le pouvoir tampon dépend des quantités d’acide faible et de sa base conjuguée qui se trouvent dans un mélange de tampons.
Plus la solution tampon est concentrée, plus son pouvoir tampon est important. Comme l’illustre la figure 6.2.4, lorsque du NaOH est ajouté à des solutions qui contiennent différentes concentrations d’un tampon acide acétique/acétate de sodium, la variation observée du pH du tampon est inversement proportionnelle à la concentration du tampon. Si la capacité du tampon est 10 fois supérieure, la solution tampon peut alors absorber 10 fois plus d’acide ou de base forte avant de subir une modification significative du pH.
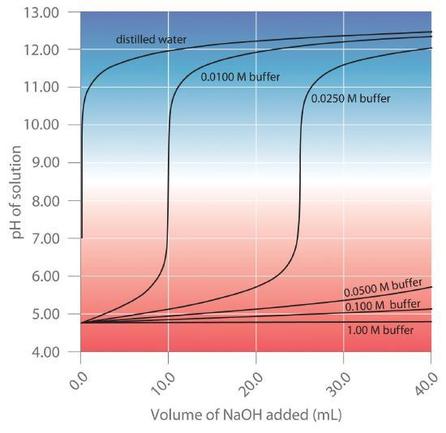
Figure 6.2.4. Effet de la concentration du tampon sur la capacité d’un tampon
|
Laboratoire CHM1311 | Expérience n°3 : Équilibres |
||||||||||||||||||||
|
Objectif Dans cette expérience, vous devrez vous rafraîchir la mémoire de plusieurs concepts dans différents chapitres (dont celui-ci) : les principes fondamentaux des équilibres et le principe de Le Châtelier (chapitre 4), les acides et bases forts/faibles, les constantes de dissociation, le pH et les indicateurs (chapitre 5), et l’objectif et la fonction des tampons que nous abordons dans cette section (chapitre 6). Cette expérience est divisée en trois parties principales. Premièrement, vous examinerez l’effet de l’ajout et de la consommation de réactifs sur un système [Cu(H2O)4]2+ / [Cu(NH3)4]2+ à l’équilibre dans le contexte du principe de Le Châtelier. Ensuite, vous établirez des équilibres multiples en utilisant l’ion Ag+ et en notant les observations lorsque vous ajoutez divers réactifs. Enfin, vous préparerez un système tampon qui simule le système tampon de bicarbonate métabolique que l’on trouve dans le sang de la plupart des animaux, et vous déterminerez quels effets sur le corps sont imités lorsque vous ajoutez des acides et des bases. Principes Equilibres pH Systèmes tampons Effet d’ion commun Effet de la température Précautions de sécurité Portez un équipement de protection individuelle (EPI) approprié à tout moment dans le cadre du laboratoire – cela inclut votre blouse de laboratoire et vos lunettes de protection. Veillez à consulter la fiche de données de sécurité des composés suivants pour obtenir des informations pertinentes sur la santé et la sécurité, les premiers soins, la manipulation et l’élimination des déchets :
Vous travaillerez avec des acides et des bases en laboratoire. Notez que même dilués, ils sont toujours corrosifs et doivent être manipulés avec précaution. En cas de contact avec la peau ou les vêtements, prévenez votre assistant technique et assurez-vous de bien rincer à l’eau pendant au moins 15 minutes. Si vous renversez un acide ou une base, veillez à le nettoyer immédiatement car il peut facilement être confondu avec de l’eau (étant donné que les deux sont incolores). Manipulez le nitrate d’argent avec précaution car il se tache facilement. Évitez d’inhaler profondément l’ammoniac et le sulfure de sodium ; ces deux substances ont une odeur très forte. Dans cette expérience, vous travaillerez avec de nombreux produits chimiques, dont beaucoup sont d’apparence similaire (par exemple, de nombreux acides et bases semblent incolores et non visqueux). Veillez à ne pas confondre les réactifs – vérifiez l’étiquette de chaque réactif que vous ajoutez lors de la préparation du mélange réactionnel. Éléments à prendre en considération Comme nous l’avons déjà souligné dans la théorie et les instructions de l’expérience, toutes les observations que vous ferez sont de nature qualitative, alors assurez-vous de noter autant d’observations que possible ! Il s’agit notamment des propriétés physiques (par exemple, la phase de la matière, la couleur, la viscosité, la solubilité) et des propriétés chimiques (par exemple, le pH, la réactivité avec d’autres substances). Si nécessaire, révisez vos connaissances sur les équilibres acide/base, les changements dans les systèmes d’équilibre et les systèmes tampons. Pour pratiquement toutes les étapes de cette expérience, vous ajoutez un réactif à un mélange/système réactionnel et vous devrez expliquer la chimie derrière chaque étape. Pour ce faire, vous devrez 1) utiliser l’équation de réaction fournie dans les instructions, et 2) intégrer vos connaissances des équilibres acide/base, du système d’équilibre et des systèmes tampons Référence Venkateswaran, R. Chimie générale – Manuel de laboratoire – CHM 1301/1311. |
||||||||||||||||||||
Mélange de quantités appréciables d'une paire acide-base faible ; le tampon résiste à des changements spectaculaires du pH lorsque de petites quantités d'acide ou de base sont ajoutées
Version logarithmique de l'expression de la constante d'ionisation de l'acide, formatée de façon pratique pour calculer le pH des solutions tampon
Quantité d'un acide ou d'une base qui peut être ajoutée à un volume d'une solution tampon avant que son pH ne change de manière significative (généralement d'une unité de pH) ; en d'autres termes, la quantité d'acide ou de base qu'un tampon peut contrecarrer


