2.1 – Forces intermoléculaires
Les États de la Matière
Les différences dans les propriétés d’un solide, d’un liquide ou d’un gaz reflètent l’amplitude des forces d’attraction entre les atomes, les molécules ou les ions qui composent chaque phase. L’état dans lequel une substance existe dépend de l’importance relative de ses forces intermoléculaires (FIM) et des énergies cinétiques (Ek) de ses molécules. Les FIM sont les différentes forces d’attraction qui peuvent exister entre les atomes et les molécules d’une substance en raison de phénomènes électrostatiques, comme nous le verrons en détail dans ce module. Ces forces servent à maintenir les particules proches les unes des autres, tandis que l’Ek des particules fournit l’énergie nécessaire pour surmonter les forces d’attraction et ainsi augmenter la distance entre les particules. La figure 2.1.1. illustre comment des changements d’état physique peuvent être induits en modifiant la température, donc l’Ek moyen, d’une substance donnée.
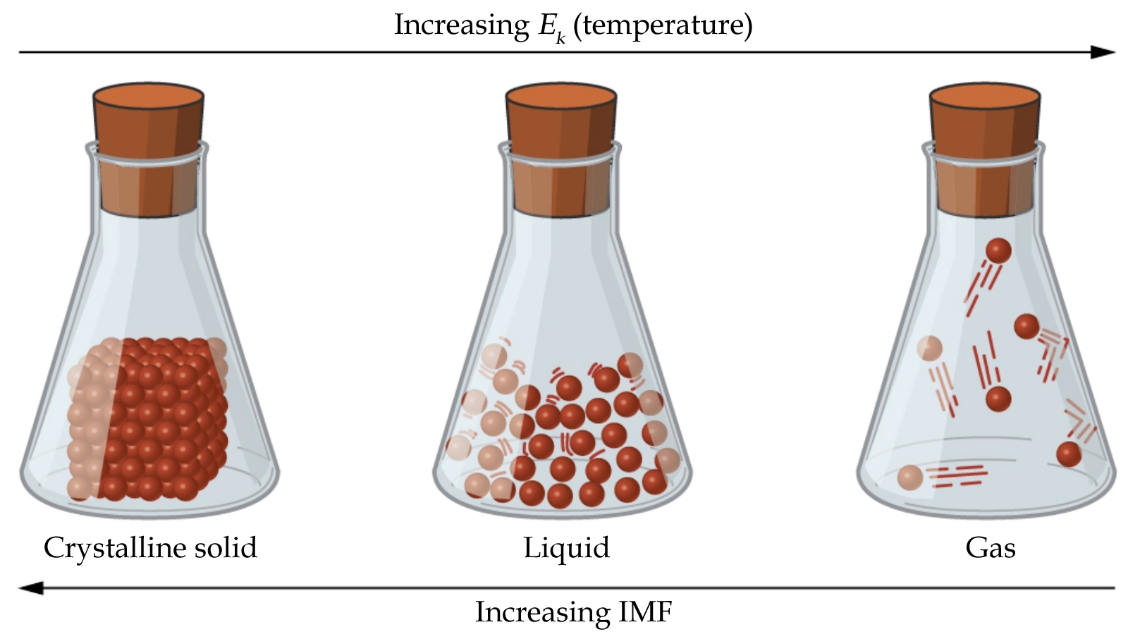
Figure 2.1.1. Les transitions entre les états solide, liquide et gaz d’une substance se produisent lorsque les conditions de température ou de pression favorisent les changements associés des forces intermoléculaires. (Note : l’espace entre les particules dans la phase gazeuse est beaucoup plus grand que celui indiqué).
À titre d’exemple des processus décrits dans la figure 2.1.1, prenons un échantillon d’eau. Lorsque l’eau gazeuse est suffisamment refroidie, les attractions entre les molécules d’H2O seront capables de les maintenir ensemble lorsqu’elles entrent en contact les unes avec les autres ; le gaz se condense, formant de l’H2O liquide. Par exemple, de l’eau liquide se forme à l’extérieur d’un verre froid lorsque la vapeur d’eau présente dans l’air est refroidie ce verre, comme le montre la figure 2.1.2.

Figure 2.1.2. La condensation se forme lorsque la vapeur d’eau dans l’air est suffisamment refroidie pour former de l’eau liquide, comme (a) à l’extérieur d’un verre de boisson froide ou (b) sous forme de brouillard (crédit a : modification du travail de Jenny Downing ; crédit b : modification du travail de Cory Zanker)
Nous pouvons également liquéfier de nombreux gaz en les comprimant, si la température n’est pas trop élevée. L’augmentation de la pression rapproche les molécules d’un gaz, de sorte que les attractions entre les molécules deviennent fortes par rapport à leur Ek. Par conséquent, elles forment des liquides. Le butane, C4H10, est le combustible utilisé dans les briquets jetables et est un gaz à température et pression standard.
Nous définissons la température et la pression standard (STP) pour les gaz comme étant 0°C et 1,00 bar (1 bar = 100 000 Pa = 0,987 atm) afin d’établir des conditions pratiques pour comparer les volumes molaires des gaz. À l’intérieur du compartiment à combustible du briquet, le butane est comprimé à une pression qui entraîne sa condensation à l’état liquide, comme le montre la figure 2.1.3.

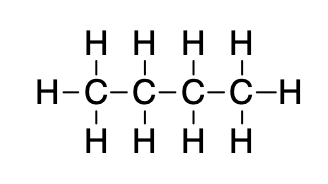
Figure 2.1.3. Le butane gazeux est comprimé dans le compartiment de stockage d’un briquet jetable, ce qui entraîne sa condensation à l’état liquide. (crédit : modification du travail par “Sam-Cat”/Flickr)
Enfin, si la température d’un liquide devient suffisamment basse, ou si la pression sur le liquide devient suffisamment élevée, les molécules du liquide n’ont plus assez d’Ek pour surmonter la FIM attractive entre elles, et un solide se forme. Une discussion plus approfondie de ces changements et d’autres changements d’état, ou transitions de phase, est fournie dans une section ultérieure de ce chapitre.
Forces entre les molécules
Dans des conditions appropriées, les attractions entre toutes les molécules de gaz les amèneront à former des liquides ou des solides. Cela est dû à des forces intermoléculaires, et non à des forces intramoléculaires. Les forces intramoléculaires sont celles qui, au sein de la molécule, maintiennent la molécule ensemble, par exemple les liaisons entre les atomes. Les forces intermoléculaires sont les attractions entre les molécules, qui déterminent un grand nombre des propriétés physiques d’une substance. La figure 2.1.4. illustre ces différentes forces moléculaires. La force de ces forces d’attraction varie considérablement, bien que les FIM entre les petites molécules soient généralement faibles par rapport aux forces intramoléculaires qui lient les atomes entre eux au sein d’une molécule. Par exemple, pour surmonter les FIM dans une molécule de HCl liquide et la convertir en HCl gazeux, il ne faut qu’environ 17 kilojoules d’énergie. Cependant, pour rompre les liaisons covalentes entre les atomes d’hydrogène et de chlore dans une mole de HCl, il faut environ 25 fois plus d’énergie : 430 kilojoules.
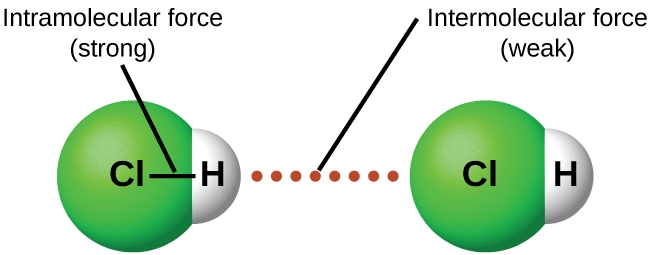
Figure 2.1.4. Les forces intramoléculaires maintiennent une molécule intacte. Les forces intermoléculaires maintiennent de multiples molécules ensemble et déterminent de nombreuses propriétés d’une substance.
Toutes les forces d’attraction entre les atomes et les molécules neutres sont connues sous le nom de forces de van der Waals, bien qu’elles soient généralement désignées de manière plus informelle par le terme d’attraction intermoléculaire. Nous examinerons les différents types de FIM dans les trois prochaines sections de ce module.
Forces de dispersion
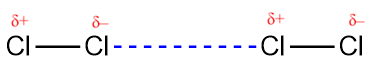
L’une des trois forces de van der Waals est présente dans toutes les phases condensées, quelle que soit la nature des atomes ou des molécules qui composent la substance. Cette force attractive est appelée la force de dispersion de London en l’honneur du physicien américain d’origine allemande Fritz London qui, en 1928, l’a expliquée pour la première fois. Cette force est souvent appelée simplement la force de dispersion. Parce que les électrons d’un atome ou d’une molécule sont en mouvement constant (ou bien parce que la localisation de l’électron est soumise à une variabilité mécanique quantique), à tout moment, un atome ou une molécule peut développer un dipôle temporaire et instantané si ses électrons sont répartis de manière asymétrique. Les dipôles sont présents dans les molécules où il y a une dispersion inégale de la charge. Si la densité d’électrons augmente à une extrémité de la molécule, on appelle cette zone un delta négatif (δ–). Cela signifie alors que l’autre extrémité de la molécule a une densité d’électrons diminuée, c’est pourquoi elle est marquée d’un delta positif (δ+). Ces étiquettes sont illustrées dans la figure suivante. La présence de ce dipôle peut, à son tour, déformer les électrons d’un atome ou d’une molécule voisine, produisant un dipôle induit. Ces deux dipôles temporaires, qui fluctuent rapidement, entraînent donc une attraction électrostatique relativement faible entre les espèces – une force dite de « dispersion » comme celle illustrée dans la figure 2.1.5.
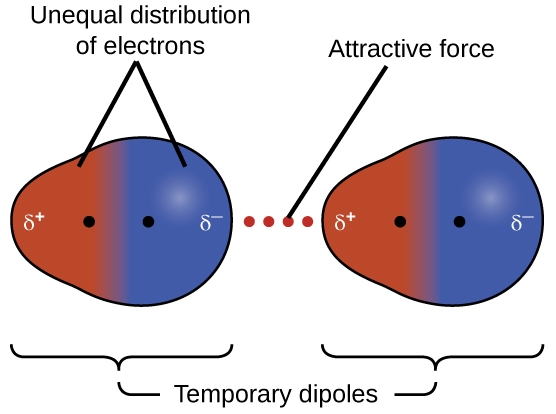
Figure 2.1.5. Les forces de dispersion résultent de la formation de dipôles temporaires, comme illustré ici pour deux molécules diatomiques non polaires.
Les forces de dispersion qui se développent entre les atomes de différentes molécules peuvent attirer les deux molécules l’une vers l’autre. Ces forces sont cependant relativement faibles et ne deviennent significatives que lorsque les molécules sont très proches. Les atomes et molécules plus grands et plus lourds présentent des forces de dispersion plus importantes que les atomes et molécules plus petits et plus légers. F2 et Cl2 sont des gaz à température ambiante (démontrant des forces d’attraction plus faibles) ; Br2 est un liquide, et I2 est un solide (démontrant des forces d’attraction plus fortes). Les tendances des points de fusion et d’ébullition observés pour les halogènes démontrent clairement cet effet, comme le montre le tableau suivant.
Tableau 2.1.1 Points de fusion et d’ébullition des halogènes
|
Points de fusion et d’ébullition des halogènes |
||||
|
Halogène |
Masse molaire |
Rayon atomique |
Point de fusion |
Point d’ébullition |
|
fluor, F2 |
38 g/mol |
72 pm |
53 K |
85 K |
|
chlore, Cl2 |
71 g/mol |
99 pm |
172 K |
238 K |
|
brome, Br2 |
160 g/mol |
114 pm |
266 K |
332 K |
|
iode, I2 |
254 g/mol |
133 pm |
387 K |
457 K |
|
astate, At2 |
420 g/mol |
150 pm |
575 K |
610 K |
L’augmentation des points de fusion et d’ébullition avec l’augmentation de la taille atomique/moléculaire peut être rationalisée en considérant comment l’ampleur des forces de dispersion est affectée par la structure électronique des atomes ou des molécules dans la substance. Dans un grand atome, les électrons de valence sont, en moyenne, plus éloignés des noyaux que dans un petit atome. Ainsi, ils sont moins étroitement maintenus et peuvent plus facilement former les dipôles temporaires qui produisent l’attraction. La mesure de la facilité ou de la difficulté qu’a une autre charge électrostatique (par exemple, un ion ou une molécule polaire proche) à déformer la distribution de la charge d’une molécule (son nuage d’électrons) est connue sous le nom de polarisabilité. Une molécule dont le nuage de charges est facilement déformé est dite très polarisable et aura de grandes forces de dispersion ; une molécule dont le nuage de charges est difficile à déformer n’est pas très polarisable et aura de petites forces de dispersion.
Exemple 2.1.1 – Les forces de London et leurs effets
Ordonnez les composés suivants d’un élément du groupe 14 et de l’hydrogène du point d’ébullition le plus bas au plus haut : CH4, SiH4, GeH4 et SnH4. Expliquez votre raisonnement.
Solution
Vous vous souvenez peut-être des liaisons chimiques et de la géométrie moléculaire de la chimie au secondaire. Tous ces composés sont non polaires, donc ils peuvent seulement subir des forces de dispersion: plus la molécule est petite, moins elle est polarisable et plus les forces de dispersion sont faibles ; plus la molécule est grande, plus les forces de dispersion sont fortes. Les masses molaires de CH4, SiH4, GeH4 et SnH4 sont d’environ 16 g/mol, 32 g/mol, 77 g/mol et 123 g/mol, respectivement. Par conséquent, le CH4 devrait avoir le point d’ébullition le plus bas et le SnH4 le point d’ébullition le plus élevé. Le classement du point d’ébullition le plus bas au point d’ébullition le plus élevé devrait être CH4 < SiH4 < GeH4 < SnH4.
Un graphique des points d’ébullition réels de ces composés par rapport à la période de l’élément du groupe 14 montre que cette prédiction est correcte :
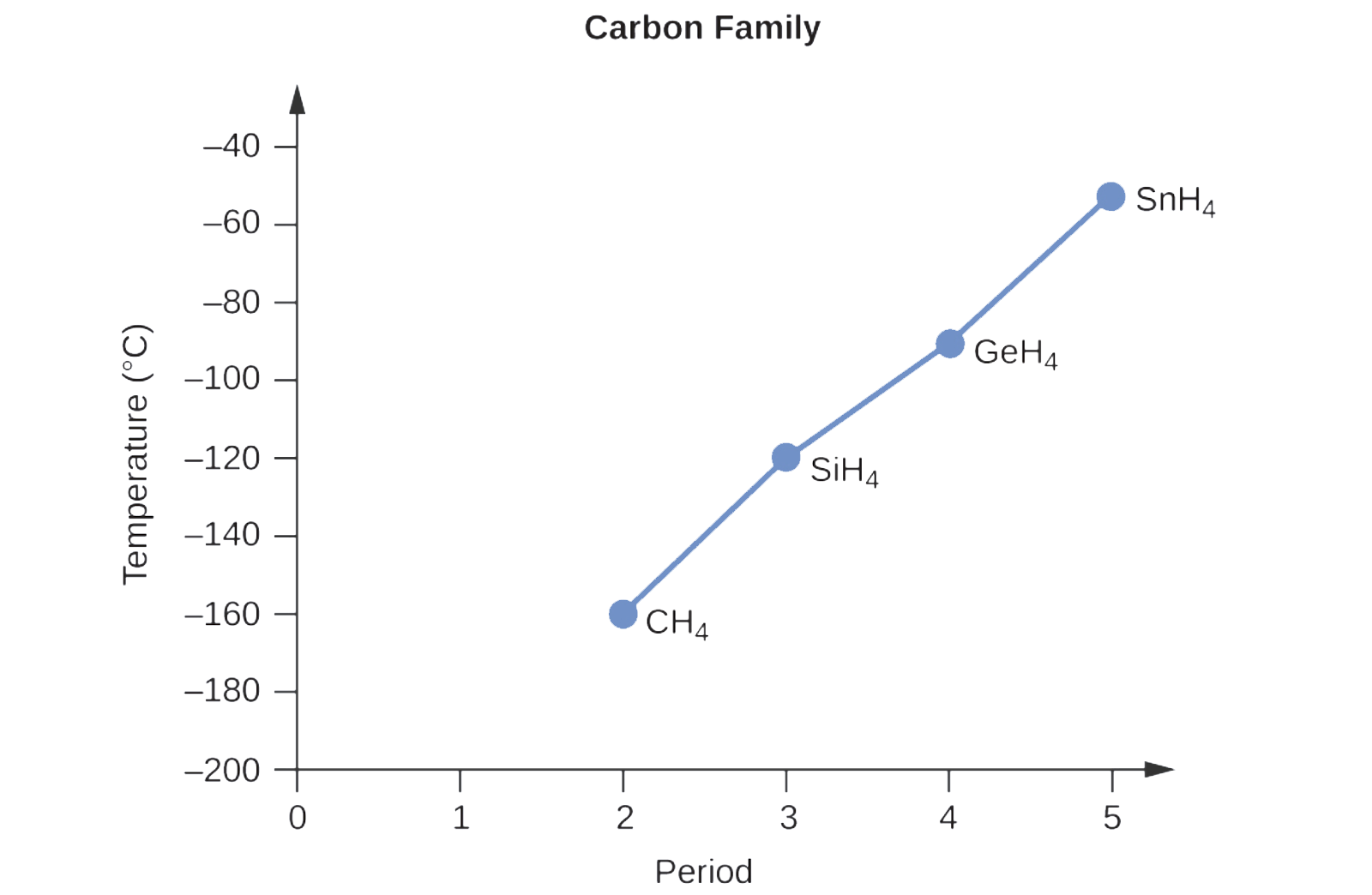
Vérifiez votre apprentissage 2.1.1 – Les forces de London et leurs effets
Classer les hydrocarbures suivants du point d’ébullition le plus bas au plus haut : C2H6, C3H8 et C4H10.
Réponse
C2H6 < C3H8 < C4H10. Tous ces composés sont non polaires et n’ont que des forces de dispersion de London : plus la molécule est grosse, plus les forces de dispersion sont importantes et plus le point d’ébullition est élevé. L’ordre du point d’ébullition le plus bas au plus élevé est donc C2H6 < C3H8 < C4H10.
La forme des molécules affecte également l’ampleur des forces de dispersion entre elles. Par exemple, les points d’ébullition des isomères n-pentane, isopentane et néopentane (illustrés dans la figure 2.1.6.) sont respectivement de 36 °C, 27 °C et 9,5 °C. Même si ces composés sont composés de molécules ayant la même formule chimique, C5H12, la différence des points d’ébullition suggère que les forces de dispersion dans la phase liquide sont différentes, étant les plus élevées pour le n-pentane et les moins élevées pour le néopentane. La forme allongée du n-pentane offre une plus grande surface disponible pour le contact entre les molécules, ce qui se traduit par des forces de dispersion plus importantes. La forme plus compacte de l’isopentane offre une plus petite surface disponible pour le contact intermoléculaire et, par conséquent, des forces de dispersion plus faibles. Les molécules de néopentane sont les plus compactes des trois, offrant la plus petite surface disponible pour le contact intermoléculaire et, par conséquent, les forces de dispersion les plus faibles. Ce comportement est analogue aux connexions qui peuvent être formées entre les bandes de fixations de la marque VELCRO : plus la surface de contact de la bande est grande, plus la connexion est forte.
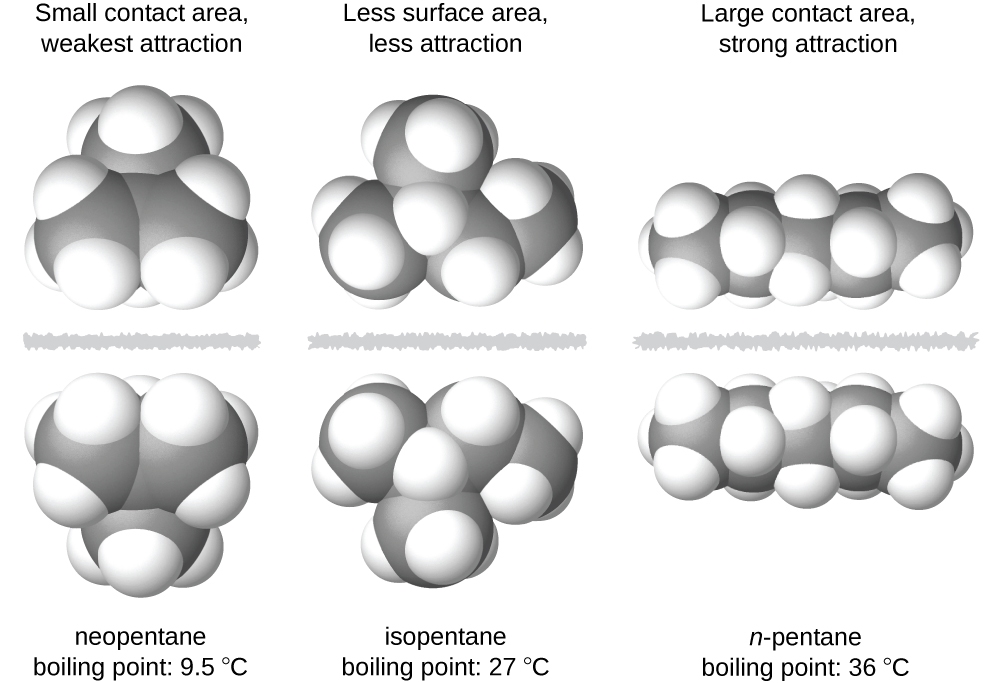
Figure 2.1.6. La force des forces de dispersion augmente avec la surface de contact entre les molécules, comme le montrent les points d’ébullition de ces isomères du pentane.
Geckos et les forces intermoléculaires
Les geckos ont une étonnante capacité à adhérer à la plupart des surfaces. Ils peuvent rapidement traverser des murs lisses et des plafonds qui n’ont pas de prise pour les orteils, et ils le font sans avoir de ventouses ou de substance collante sur les orteils. Et si un gecko peut facilement soulever ses pattes lorsqu’il marche sur une surface, si vous essayez de le ramasser, il reste collé à la surface. Comment les geckos (ainsi que les araignées et certains autres insectes) sont-ils capables de faire cela ? Bien que ce phénomène ait été étudié depuis des centaines d’années, les scientifiques n’ont découvert que récemment les détails du processus qui permet aux pattes des geckos de se comporter de cette façon.
Les orteils des geckos sont couverts de centaines de milliers de minuscules poils appelés sétules, chaque sétule se ramifiant à son tour en centaines de minuscules pointes plates et triangulaires appelées spatules. Le nombre énorme de spatules sur ses sétules fournit un gecko, comme le montre la figure 2.1.7, avec une grande surface totale pour s’accrocher à une surface. En 2000, Kellar Autumn, qui dirige une équipe de recherche multi-institutionnelle sur les geckos, a constaté que les geckos adhéraient aussi bien au dioxyde de silicium polaire qu’à l’arséniure de gallium non polaire. Cela a prouvé que les geckos adhèrent aux surfaces en raison des forces de dispersion – des faibles attractions intermoléculaires résultant de distributions de charges temporaires et synchronisées entre molécules adjacentes. Bien que les forces de dispersion soient très faibles, l’attraction totale sur des millions de spatules est suffisamment importante pour supporter plusieurs fois le poids du gecko.
En 2014, deux scientifiques ont développé un modèle pour expliquer comment les geckos peuvent rapidement passer de “collant” à “non collant”. Alex Greaney et Congcong Hu, de l’Université de l’État de l’Oregon, ont décrit comment les geckos peuvent y parvenir en modifiant l’angle entre leurs spatules et la surface. Les pieds des geckos, qui sont normalement non collants, deviennent collants lorsqu’une petite force de cisaillement est appliquée. En bouclant et en déroulant leurs orteils, les geckos peuvent alterner entre le collage et le décollage d’une surface, et donc se déplacer facilement sur celle-ci. Des recherches plus approfondies pourraient éventuellement conduire à la mise au point de meilleurs adhésifs et d’autres applications.
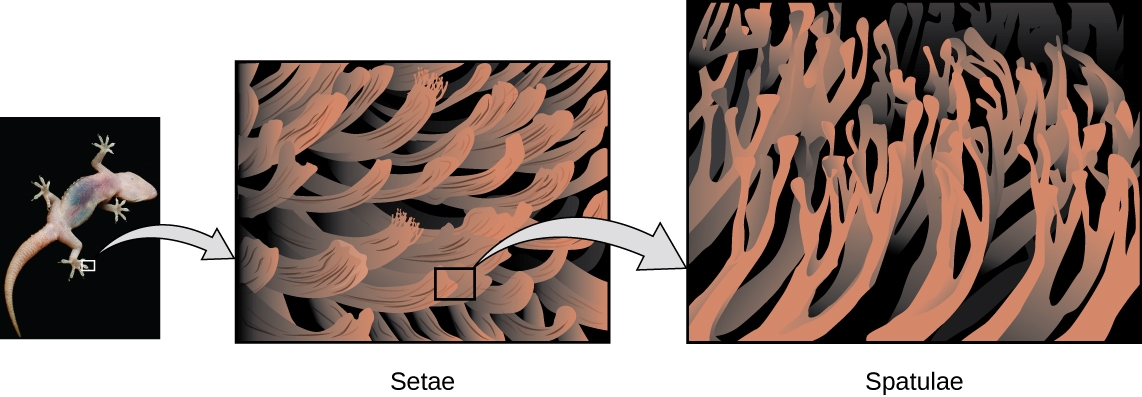
Figure 2.1.7. Les orteils des geckos contiennent un grand nombre de minuscules poils (sétules), qui se ramifient en de nombreuses pointes triangulaires (spatules). Les geckos adhèrent aux surfaces en raison des attractions de van der Waals entre la surface et les millions de spatules d’un gecko. En modifiant la façon dont les spatules entrent en contact avec la surface, les geckos peuvent activer et désactiver leur adhérence. (crédit photo : modification du travail par “JC*+A !”/Flickr)
Attractions dipôle-dipôle
Vous vous souvenez peut-être de votre cours de chimie au secondaire sur les liaisons chimiques et la géométrie moléculaire, selon lequel les molécules polaires ont une charge partielle positive d’un côté et une charge partielle négative de l’autre côté de la molécule – une séparation de charge appelée dipôle. Prenons une molécule polaire telle que le chlorure d’hydrogène, HCl. Dans la molécule de HCl, l’atome de Cl, le plus électronégatif, porte la charge partielle négative, tandis que l’atome de H, le moins électronégatif, porte la charge partielle positive. Une force d’attraction entre les molécules de HCl résulte de l’attraction entre l’extrémité positive d’une molécule de HCl et l’extrémité négative d’une autre. Cette force d’attraction est appelée attraction dipôle-dipôle, c’est-à-dire la force électrostatique entre l’extrémité partiellement positive d’une molécule polaire et l’extrémité partiellement négative d’une autre, comme l’illustre la figure 2.1.8.
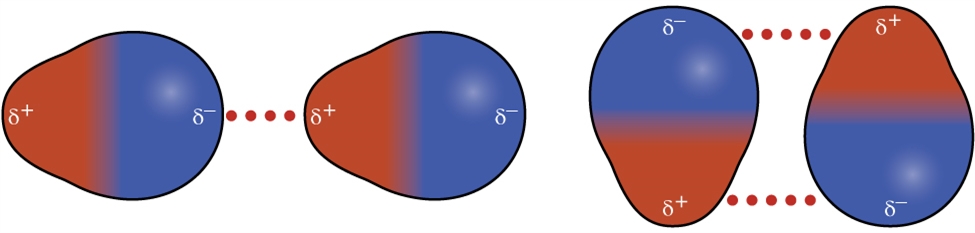
Figure 2.1.8. Cette image montre deux arrangements de molécules polaires, comme le HCl, qui permettent une attraction entre l’extrémité négative partielle d’une molécule et l’extrémité positive partielle d’une autre.
L’effet d’une attraction dipôle-dipôle est apparent lorsque l’on compare les propriétés des molécules de HCl à celles des molécules de F2 non polaires. Le HCl et le F2 sont tous deux constitués du même nombre d’atomes et ont approximativement la même masse moléculaire. À une température de 150 K, les molécules des deux substances auraient la même valeur moyenne d’Ek. Cependant, les attractions dipôle-dipôle entre les molécules de HCl sont suffisantes pour provoquer leur condensation pour former un liquide, alors que les forces de dispersion relativement plus faibles entre les molécules de F2 non polaires ne le sont pas, et donc cette substance est gazeuse à cette température. Le point d’ébullition plus élevé du HCl (188 K) par rapport au F2 (85 K) reflète la plus grande force des attractions dipolaires-dipolaires entre les molécules de HCl, par rapport aux attractions entre les molécules de F2 non polaires. Nous utiliserons souvent des valeurs telles que les points d’ébullition ou de congélation, ou les enthalpies de vaporisation ou de fusion, comme indicateurs des forces d’attraction relatives des FIM présents dans différentes substances.
Exemple 2.1.2 – Les forces dipolaires et leurs effets
Prédisez lequel aura le point d’ébullition le plus élevé entre le N2 ou le CO. Expliquez votre raisonnement.
Solution
Le CO et le N2 sont tous deux des molécules diatomiques ayant une masse d’environ 28 amu, ils subissent donc des forces de dispersion similaires à celles de London. Comme le CO est une molécule polaire, il subit des attractions dipolaires-dipolaires. Comme N2 est non polaire, ses molécules ne peuvent pas présenter d’attractions dipolaires-dipolaires. Les attractions dipôle-dipôle entre les molécules de CO sont comparativement plus fortes que les forces de dispersion entre les molécules de N2 non polaires, de sorte que le CO devrait avoir le point d’ébullition le plus élevé.
Vérifiez votre apprentissage 2.1.2 – Les forces dipolaires et leurs effets
Prévoyez lequel aura le point d’ébullition le plus élevé : ICl ou Br2. Expliquez votre raisonnement.
Réponse
ICl. ICl et Br2 ont des masses similaires (~160 amu) et possèdent donc des forces de dispersion londoniennes similaires. ICl est polaire et présente donc également des attractions dipolaires-dipolaires ; Br2 est non polaire et ne le fait pas. Les attractions dipôle-dipôle relativement plus fortes nécessitent plus d’énergie pour être surmontées, c’est pourquoi ICl aura le point d’ébullition le plus élevé.
Liaison hydrogène
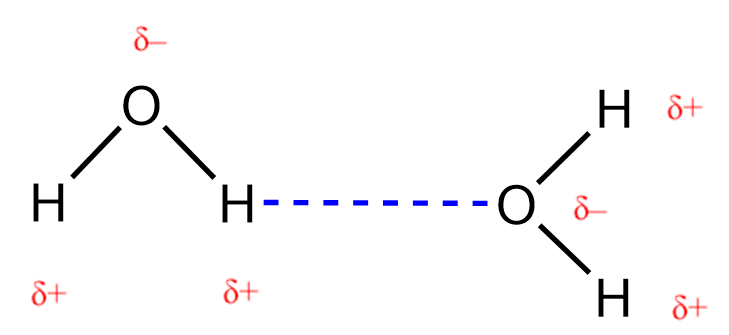
Le fluorure de nitrosyle (NOCl, masse moléculaire 49 amu) est un gaz à température ambiante. L’eau (H2O, masse moléculaire 18 amu) est un liquide, même si elle a une masse moléculaire plus faible. Il est évident que nous ne pouvons pas attribuer cette différence entre les deux composés aux forces de dispersion. Les deux molécules ont à peu près la même forme et l’NOCl est la molécule la plus lourde et la plus grosse. On s’attend donc à ce qu’elle subisse des forces de dispersion plus fortes. En outre, nous ne pouvons pas attribuer cette différence de points d’ébullition à des différences de moments dipolaires des molécules. Les deux molécules sont polaires et présentent des moments dipolaires comparables. La grande différence entre les points d’ébullition est due à une attraction dipôle-dipôle particulièrement forte qui peut se produire lorsqu’une molécule contient un atome d’hydrogène lié à un atome de fluor, d’oxygène ou d’azote. Ces trois éléments ont des valeurs très élevées d’électronégativité, la capacité d’un atome à attirer la densité d’électrons dans une liaison chimique vers son propre noyau (défini et discuté dans la section 9.3). La très grande différence d’électronégativité entre l’atome H (2.1) et l’atome auquel il est lié (4.0 pour un atome F, 3.5 pour un atome O, ou 3.0 pour un atome N), combinée à la très petite taille d’un atome H et aux tailles relativement petites des atomes F, O ou N, conduit à des charges partielles très concentrées avec ces atomes. Les molécules ayant des fragments F-H, O-H ou N-H sont très fortement attirées par les fragments similaires des molécules voisines, un type d’attraction dipôle-dipôle particulièrement fort appelé liaison hydrogène. Parmi les exemples de liaisons hydrogène, on peut citer HF⋯HF, H2O⋯HOH et H3N⋯HNH2, où les liaisons hydrogène sont indiquées par des points. La figure 2.1.9. illustre les liaisons hydrogène entre les molécules d’eau.
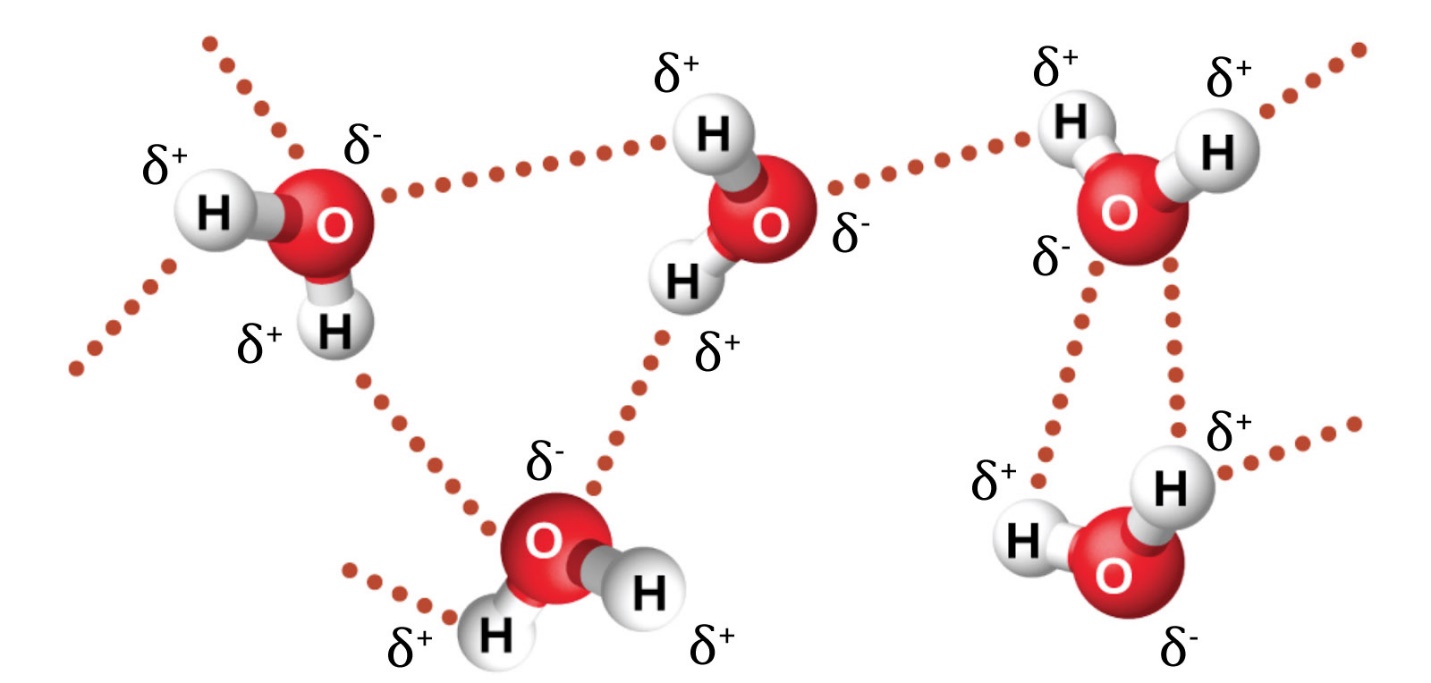
Figure 2.1.9. Les molécules d’eau participent à de multiples interactions de liaisons d’hydrogène avec les molécules d’eau voisines.
Malgré l’utilisation du mot “liaison”, gardez à l’esprit que les liaisons hydrogène sont des forces d’attraction intermoléculaires, et non des forces d’attraction intramoléculaires (liaisons covalentes). Les liaisons hydrogène sont beaucoup plus faibles que les liaisons covalentes, seulement 5 à 10% environ aussi fortes, mais sont généralement beaucoup plus fortes que les autres forces d’attraction et de dispersion dipolaires.
Les liaisons hydrogène ont un effet prononcé sur les propriétés des phases condensées (liquides et solides). Par exemple, examinez les tendances des points d’ébullition des hydrures du groupe 15 (NH3, PH3, AsH3 et SbH3), des hydrures du groupe 16 (H2O, H2S, H2Se et H2Te) et des hydrures du groupe 17 (HF, HCl, HBr et HI). Les points d’ébullition des trois hydrures les plus lourds pour chaque groupe sont indiqués sur la figure 2.1.10. Au fur et à mesure que l’on descend dans l’un de ces groupes, les polarités des molécules diminuent légèrement, alors que la taille des molécules augmente considérablement. L’effet des forces de dispersion de plus en plus fortes domine celui des attractions dipôle-dipôle de plus en plus faibles, et on observe que les points d’ébullition augmentent régulièrement.
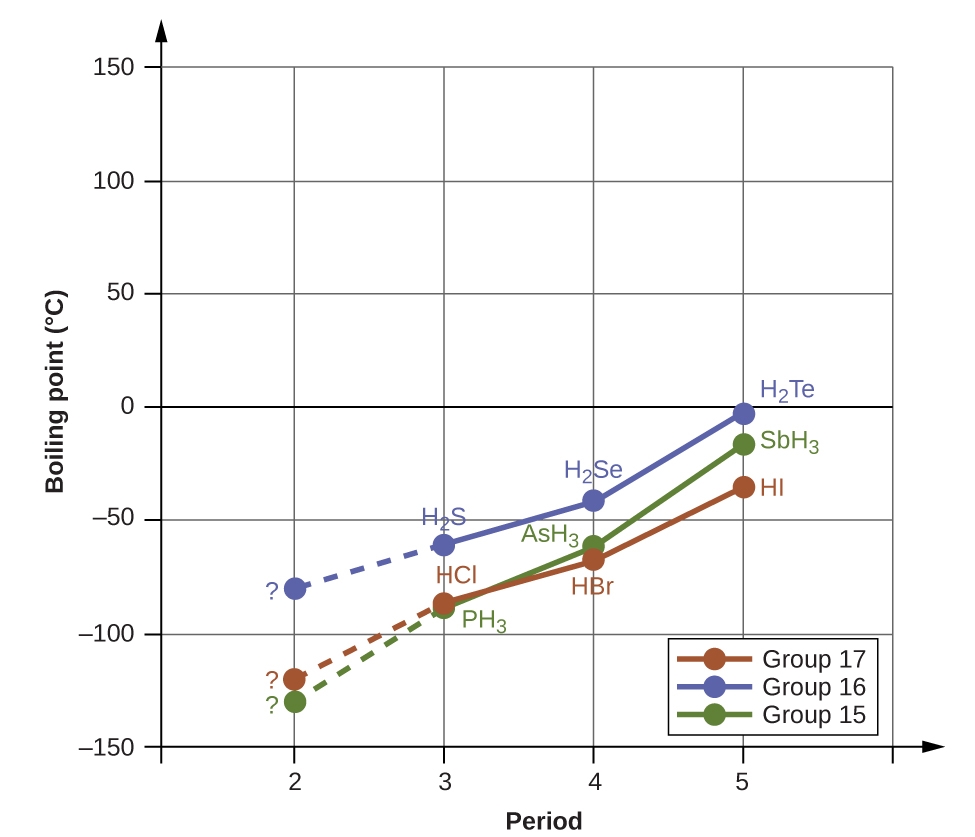
Figure 2.1.10. Pour les hydrures des groupes 15, 16 et 17, les points d’ébullition de chaque classe de composés augmentent avec l’augmentation de la masse moléculaire des éléments dans les périodes 3, 4 et 5.
Si nous utilisons cette tendance pour prévoir les points d’ébullition de l’hydrure le plus léger pour chaque groupe, nous nous attendons à ce que le NH3 bouille à environ -120 °C, le H2O à environ -80 °C et le HF à environ -110 °C. Toutefois, lorsque nous mesurons les points d’ébullition de ces composés, nous constatons qu’ils sont nettement plus élevés que les tendances prévues, comme le montre la figure 2.1.11. Le contraste saisissant entre nos prévisions naïves et la réalité fournit des preuves irréfutables de la solidité de la liaison hydrogène.
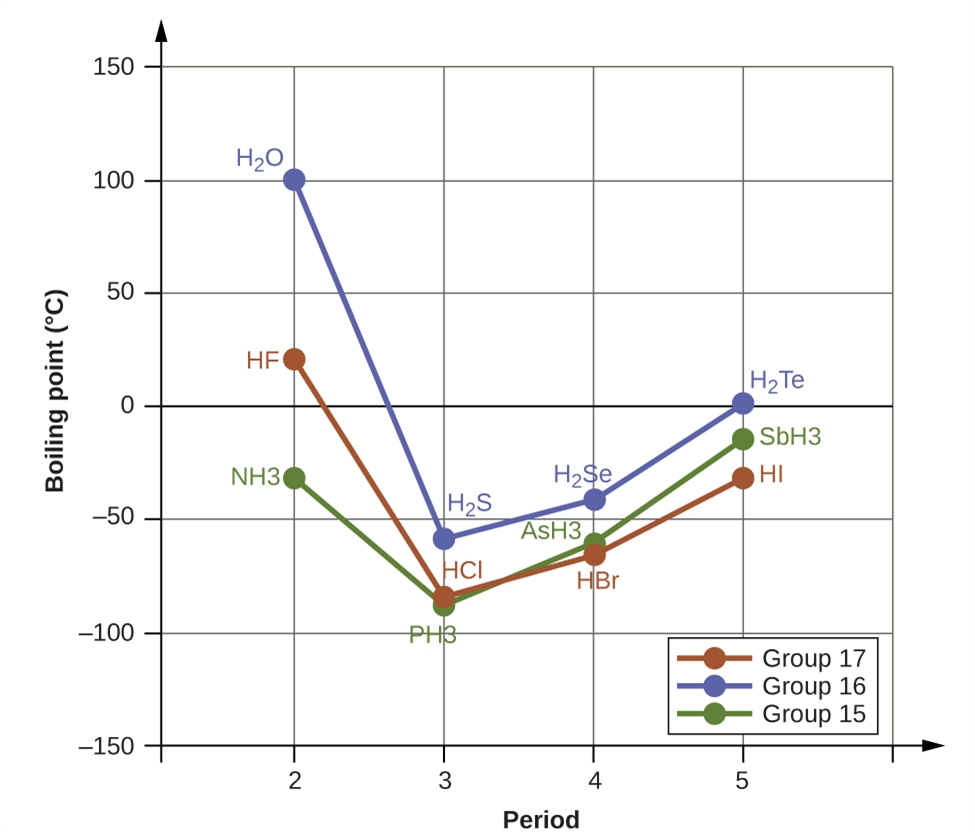
Figure 2.1.11. En comparaison avec les périodes 3-5, les hydrures binaires des éléments de la période 2 des groupes 17, 16 et 15 (F, O et N, respectivement) présentent des points d’ébullition anormalement élevés en raison des liaisons hydrogène.
Exemple 2.1.3 – Effet des liaisons d’hydrogène sur les points d’ébullition
Considérons les composés diméthyléther (CH3OCH3), éthanol (CH3CH2OH), et propane (CH3CH2CH3). Leurs points d’ébullition, en ordre aléatoire, sont de -42,1 °C, -24,8 °C et 78,4 °C. Associez chaque composé avec son point d’ébullition. Expliquez votre raisonnement.
Solution
Les formes prévues par VSEPR de CH3OCH3, CH3CH2OH et CH3CH2CH3 sont similaires, tout comme leurs masses molaires (46 g/mol, 46 g/mol et 44 g/mol, respectivement), de sorte qu’elles présenteront des forces de dispersion similaires. Comme le CH3CH2CH3 est non polaire, il ne peut présenter que des forces de dispersion. Comme CH3OCH3 est polaire, il subira également des attractions dipolaires-dipolaires. Enfin, CH3CH2OH possède un groupe -OH, et il subira donc l’attraction dipôle-dipôle unique en son genre, connue sous le nom de liaison hydrogène. Ainsi, l’ordre en termes de force des FIM, et donc de points d’ébullition, est CH3CH2CH3 < CH3OCH3 < CH3CH2OH. Le point d’ébullition du propane est de -42,1 °C, celui du diméthyléther est de -24,8 °C, et celui de l’éthanol est de 78,5 °C.
Vérifiez votre apprentissage 2.1.3 – Effet des liaisons d’hydrogène sur les points d’ébullition
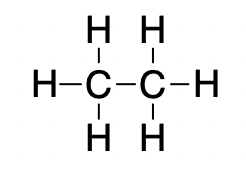
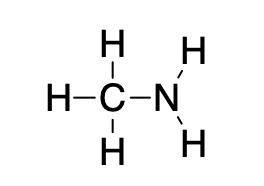
L’éthane (CH3CH3) a un point de fusion de -183 °C et un point d’ébullition de -89 °C. Prévoir les points de fusion et d’ébullition relatifs de la méthylamine (CH3NH2). Expliquez votre raisonnement.
Réponse
CH3CH3 et CH3NH2 sont similaires en taille et en masse, mais la méthylamine possède deux liaisons N-H et présente donc une liaison hydrogène. Cela augmente considérablement ses IMF, et donc ses points de fusion et d’ébullition. Par conséquent, on prévoit que le point de fusion et le point d’ébullition de la méthylamine seront nettement plus élevés que ceux de l’éthane. Notre prédiction est confirmée par les valeurs de la littérature : Le CH3NH2 a un point de fusion de -93 °C et un point d’ébullition de -6 °C.
Liaison de l’hydrogène et de l’ADN
L’acide désoxyribonucléique (ADN) se trouve dans tout organisme vivant et contient l’information génétique qui détermine les caractéristiques de l’organisme, fournit le schéma directeur pour la fabrication des protéines nécessaires à la vie, et sert de modèle pour transmettre cette information à la descendance de l’organisme. Une molécule d’ADN est constituée de deux chaînes (anti-)parallèles de nucléotides répétitifs, qui forment sa structure en double hélice bien connue, comme le montre la figure 2.1.12.
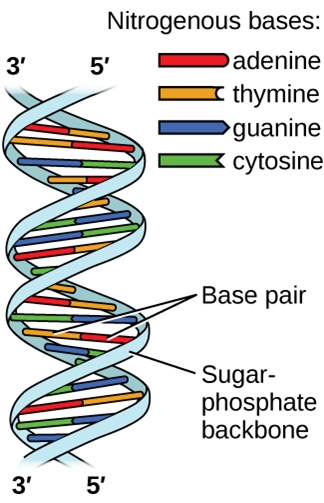
Figure 2.1.12. Deux molécules d’ADN séparées forment une hélice à double brin dans laquelle les molécules sont maintenues ensemble par une liaison hydrogène. (crédit : modification des travaux de Jerome Walker, Dennis Myts)
Chaque nucléotide contient un sucre (désoxyribose) lié à un groupe phosphate d’un côté, et une des quatre bases azotées de l’autre. Deux de ces bases, la cytosine (C) et la thymine (T), sont des structures à un seul anneau appelées pyrimidines. Les deux autres, l’adénine (A) et la guanine (G), sont des structures à double anneau appelées purines. Ces bases forment des paires de bases complémentaires composées d’une purine et d’une pyrimidine, l’adénine étant associée à la thymine, et la cytosine à la guanine. Chaque paire de bases est maintenue ensemble par une liaison hydrogène. A et T partagent deux liaisons hydrogène, C et G en partagent trois, et les deux paires ont une forme et une structure similaires Figure 2.1.13.
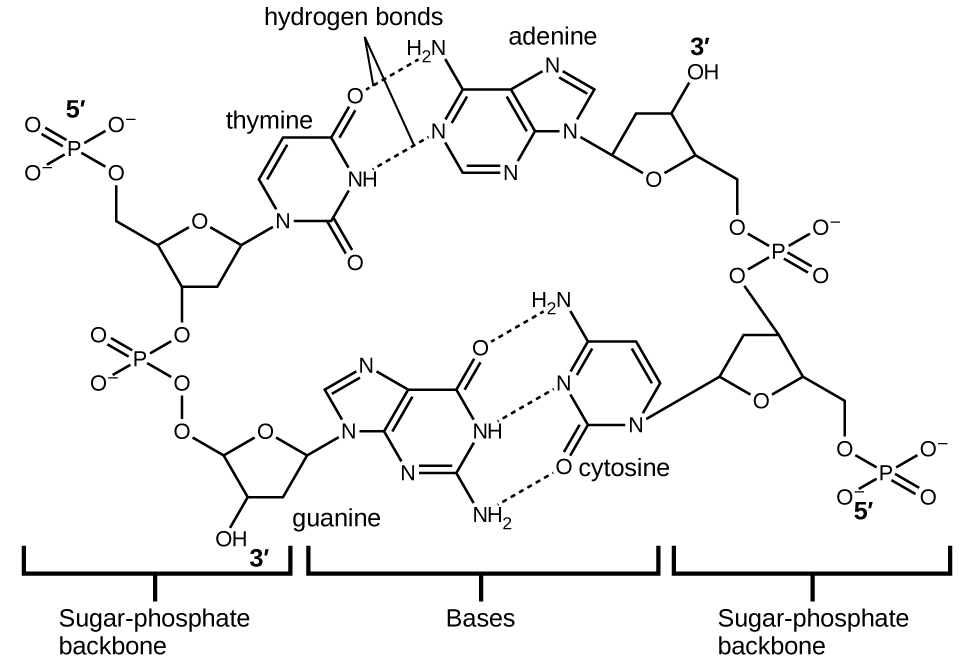
Figure 2.1.13. La géométrie des molécules de base entraîne une liaison hydrogène maximale entre l’adénine et la thymine (AT) et entre la guanine et la cytosine (GC), ce qu’on appelle des “paires de bases complémentaires”.
L’effet cumulatif de millions de liaisons hydrogène maintient effectivement les deux brins d’ADN ensemble. Il est important de noter que les deux brins d’ADN peuvent relativement facilement se “dézipper” au milieu, car les liaisons hydrogène sont relativement faibles par rapport aux liaisons covalentes qui maintiennent ensemble les atomes des différentes molécules d’ADN. Cela permet aux deux brins de fonctionner comme un modèle pour la réplication.
Résumé
Les transitions entre les phases solide et liquide ou liquide et gazeuse sont dues à des changements dans les interactions intermoléculaires mais n’affectent pas les interactions intramoléculaires. Les trois principaux types d’interactions intermoléculaires sont les interactions dipôle-dipôle, les forces de dispersion de London (ces deux dernières sont souvent appelées collectivement forces de van der Waals) et les liaisons hydrogène. Les interactions dipôle-dipôle proviennent des interactions électrostatiques des extrémités positives et négatives de molécules ayant des moments dipolaires permanents; leur force est proportionnelle à l’amplitude du moment dipolaire et à 1/r6, où r est la distance entre les dipôles. Les forces de dispersion de London sont dues à la formation de moments dipolaires instantanés dans les molécules polaires ou non polaires à la suite de fluctuations de courte durée de la distribution de la charge électronique, qui à leur tour provoquent la formation temporaire d’un dipôle induit dans les molécules adjacentes. Comme dans le cas des interactions dipôle-dipôle, leur énergie chute de 1/r6. Les grands atomes ont tendance à être plus polarisables que les petits car leurs électrons extérieurs sont moins étroitement liés et sont donc plus facilement perturbés. Les liaisons hydrogène sont des interactions dipôle-dipôle particulièrement fortes entre des molécules qui ont de l’hydrogène lié à un atome fortement électronégatif, comme O, N ou F. L’atome H partiellement chargé positivement qui en résulte sur une molécule (le donneur de liaison hydrogène) peut interagir fortement avec une paire d’électrons isolés d’un atome O, N ou F partiellement chargé négativement sur des molécules adjacentes (l’accepteur de liaison hydrogène). En raison de la forte liaison hydrogène entre les molécules d’eau O⋅H>, l’eau a un point d’ébullition exceptionnellement élevé, et la glace a une structure ouverte, en forme de cage, qui est moins dense que l’eau liquide. Le tableau suivant résume la situation :
Tableau 2.1.2 Énergies de liaison relatives des forces intermoléculaires
|
Énergies de liaison relatives des forces intermoléculaires |
||
|
Visuel |
Énergie (kJ/mol)† |
|
|
Dispersion de London |
|
Moins de 4 – 63 |
|
Dipole-dipôle |
|
2 – 8 |
|
Liaisons hydrogène |
|
4 – 50 |
| † Ege, Seyhan (2003) Chimie organique : Structure et réactivité. Houghton Mifflin College. ISBN 0618318097. pp. 30–33, 67. | ||
Questions
★ Questions
1. Ouvrez le PhET States of Matter Simulation pour répondre aux questions suivantes :
a. Sélectionnez l’onglet Solide, Liquide, Gaz. Explorez en sélectionnant différentes substances, en chauffant et en refroidissant les systèmes, et en changeant l’état. Quelles similitudes remarquez-vous entre les quatre substances pour chaque phase (solide, liquide, gaz) ? Quelles différences remarquez-vous ?
b. Pour chaque substance, sélectionnez chacun des états et enregistrez les températures données. Comment les températures données pour chaque état sont-elles en corrélation avec les forces de leurs attractions intermoléculaires? Expliquez.
c. Sélectionnez l’onglet Potentiel d’interaction, et utilisez les atomes de néon (Ne) par défaut. Déplacez l’atome de Ne sur la droite et observez comment l’énergie potentielle change. Sélectionnez le bouton Force totale, et déplacez l’atome de Ne comme précédemment. Quand est-ce que la force totale sur chaque atome est-elle attractive et suffisamment grande pour avoir de la matière? Ensuite, sélectionnez le bouton Forces des composants, et déplacez l’atome de Ne. Quand est-ce que les forces d’attraction (van der Waals) et de répulsion (chevauchement des électrons) s’équilibrent-elles? Quel est le rapport entre l’énergie potentielle et le graphique de la distance entre les atomes? Expliquez.
2. Définissez ce qui suit et donnez un exemple de chacun :
a. Force de dispersion
b. Attraction dipôle-dipôle
c. Liaison hydrogène
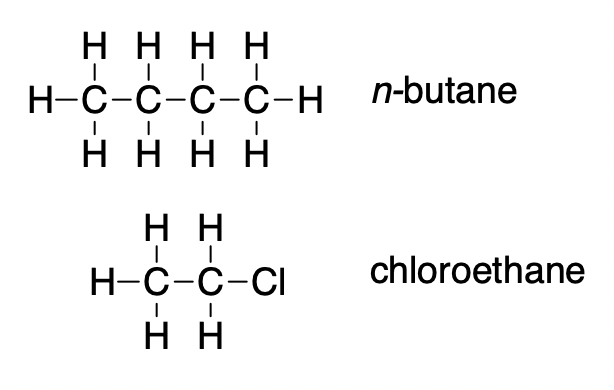
3. Sur la base des attractions intermoléculaires, expliquer les différences de points d’ébullition du n-butane (-1 °C) et du chloroéthane (12 °C), qui ont des masses molaires similaires.
4. Le point de fusion de H2O (s) est de 0 °C. Le point de fusion de H2S (s) devrait-il être de -85 °C, 0 °C ou 185 °C ? Expliquez votre réponse.
5. Le silane (SiH4), la phosphine (PH3) et le sulfure d’hydrogène (H2S) fondent à -185 °C, -133 °C et -85 °C, respectivement. Qu’est-ce que cela suggère sur le caractère polaire et les attractions intermoléculaires de ces trois composés ?
6. Les protéines sont des chaînes d’acides aminés qui peuvent se former selon divers arrangements, dont l’un est une hélice. Quel type d’IMF est responsable du maintien du brin de protéine dans cette forme ? Sur l’image de la protéine, montrez les emplacements des IMF qui maintiennent la protéine ensemble :
7. Identifier les forces intermoléculaires présentes dans les solides suivants :
a. CH3CH2OH
b. CH3CH2CH3
c. CH3CH2Cl
Réponses
1.
a. Des similitudes : Les solides et les liquides sont plus denses que les gaz. Plus la température du système est élevée, plus le mouvement moléculaire est rapide. Différences : Pour l’eau, l’état liquide est plus dense que l’état solide ; tandis que les autres solides sont plus denses que leur état liquide. Différentes substances ont des températures différentes.
|
Température Néon Argon Oxygène Eau |
|
Solide -260°C -230°C -242°C -116°C |
|
Liquide -247°C -187°C -204°C 55°C |
|
Gaz -218°C -84°C -79°C 536°C |
Plus la température est élevée, plus les substances sont résistantes au FIM.
b. L’énergie potentielle diminue d’abord dans la région négative, puis continue à augmenter. Lorsque la distance entre deux atomes est supérieure à ε, la force totale sur chaque atome est attractive et suffisamment grande pour que la matière s’y intéresse. Lorsque la distance entre deux atomes est égale à ε, les forces d’attraction (van der Waals) et de répulsion (chevauchement des électrons) s’équilibrent. À ce stade, l’ensemble du système a l’énergie potentielle la plus faible.
2. (a) Les forces de dispersion se produisent lorsqu’un atome développe un moment dipolaire temporaire résultant du fait que ses électrons sont répartis de manière asymétrique autour du noyau. Cette structure est plus fréquente dans de gros atomes comme l’argon ou le radon. Un deuxième atome peut alors être déformé par l’apparition du dipôle dans le premier atome. Les électrons du deuxième atome sont attirés vers l’extrémité positive du premier atome, ce qui crée un dipôle dans le deuxième atome. Le résultat net est un dipôle temporaire qui fluctue rapidement et qui s’attire mutuellement (exemple : Ar). (b) Une attraction dipôle-dipôle est une force qui résulte d’une attraction électrostatique de l’extrémité positive d’une molécule polaire pour l’extrémité négative d’une autre molécule polaire (exemple : les molécules ICI s’attirent mutuellement par interaction dipôle-dipôle). (c) Des liaisons hydrogène se forment chaque fois qu’un atome d’hydrogène est lié à un des atomes les plus électronégatifs, comme un atome de fluor, d’oxygène ou d’azote. L’attraction électrostatique entre l’atome d’hydrogène partiellement positif dans une molécule et l’atome partiellement négatif dans une autre molécule donne lieu à une forte interaction dipôle-dipôle appelée liaison hydrogène (exemple : HF⋯HF).
3. Seules des interactions dipôle-dipôle assez faibles des liaisons C-H sont disponibles pour maintenir le n-butane à l’état liquide. Le chloroéthane, cependant, a des interactions dipolaires assez importantes en raison de la liaison Cl-C ; l’interaction est donc plus forte, ce qui conduit à un point d’ébullition plus élevé.
4. −85 °C. L’eau a des liaisons hydrogène plus fortes, elle fond donc à une température plus élevée.
5. Plus le point de fusion est élevé, plus les forces intermoléculaires sont fortes. Dans ce cas, le silane a les forces intermoléculaires les plus fortes tandis que le sulfure a les plus faibles. Cependant, la polarité ne peut pas être déterminée directement en fonction des points de fusion.
6. La liaison H est le principe du FIM qui maintient les brins d’ADN ensemble. La liaison H est située entre le N-H et le C=O.
7.
a. Forces de liaison et de dispersion de l’hydrogène
b. Les forces de dispersion
c. Forces d’attraction et de dispersion dipôle-dipôle
273,15 K (0 °C) et 1 bar (100 kPa)
Force d'attraction ou de répulsion entre les molécules, y compris les forces de dispersion dipôle-dipôle, dipôle induit par le dipôle et de Londres ; ne comprend pas les forces dues à la liaison covalente ou ionique, ni l'attraction entre les ions et les molécules
Force intermoléculaire entre deux dipôles temporaires à fluctuation rapide, causée par la position instantanée des électrons dans les molécules ; significative seulement lorsque les particules sont très proches les unes des autres
Force intermoléculaire entre deux dipôles temporaires à fluctuation rapide, causée par la position instantanée des électrons dans les molécules ; significative seulement lorsque les particules sont très proches les unes des autres
Dipôle temporaire qui se produit pendant un bref instant lorsque les électrons d'un atome ou d'une molécule sont répartis de manière asymétrique
Dipôle temporaire formé lorsque les électrons d'un atome ou d'une molécule sont déformés par le dipôle instantané d'un atome ou d’une molécule voisine
Mesure de la capacité d'une charge à déformer la répartition de la charge d'une molécule (nuage d'électrons)
Force intermoléculaire causée par des molécules ayant un dipôle permanent
Force intermoléculaire qui se produit lorsque des dipôles exceptionnellement forts s'attirent ; ces interactions existent lorsque l'hydrogène est lié à l'un des trois éléments les plus électronégatifs : F, O ou N
Force d'attraction non covalente entre les atomes, les molécules et/ou les ions