7.1 – Introduction aux Taux de Réaction
Dans les unités précédentes, nous avons abordé plusieurs variables différentes pour décrire une réaction chimique – en thermochimie, nous avons vu que nous pouvions utiliser le ΔH pour savoir si une réaction est énergétiquement favorable, et dans notre discussion sur les équilibres chimiques, nous avons vu que nous pouvions utiliser K, la constante d’équilibre, pour savoir si une réaction favorise les produits ou les réactifs. Cependant, nous n’avons pas encore discuté de la manière dont nous pouvons décrire la vitesse d’une réaction. Cette question sera abordée ici lorsque nous parlerons de la cinétique – l’étude des vitesses de réaction et des mécanismes qui expliquent la rapidité ou la lenteur d’une réaction.
La vitesse est une mesure de la variation d’une propriété en fonction du temps. La vitesse est une vitesse familière qui exprime la distance parcourue par un objet en un temps donné. Le salaire est une vitesse qui représente la somme d’argent gagnée par une personne travaillant pendant un temps donné. De même, la vitesse d’une réaction chimique est une mesure de la quantité de réactif consommé ou de produit formé par la réaction dans un temps donné.
La vitesse de réaction est la variation de la quantité d’un réactif ou d’un produit par unité de temps. Les vitesses de réaction sont donc déterminées en mesurant la dépendance temporelle d’une propriété qui peut être liée aux quantités de réactif ou de produit. Les vitesses des réactions qui consomment ou produisent des substances gazeuses, par exemple, sont facilement déterminées en mesurant les changements de volume ou de pression. Pour les réactions impliquant une ou plusieurs substances colorées, les vitesses peuvent être contrôlées par des mesures d’absorption de la lumière. Pour les réactions impliquant des électrolytes aqueux, les vitesses peuvent être mesurés par les changements de la conductivité d’une solution.
Pour les réactifs et les produits en solution (le cas le plus courant), les vitesses de réaction sont généralement exprimées comme la concentration du réactif consommé ou la concentration du produit formé par unité de temps. Les unités sont donc des moles par litre par unité de temps, écrites en M/s, M/min, ou M/h. Pour mesurer les vitesses de réaction, les chimistes lancent la réaction, mesurent la concentration du réactif ou du produit à différents moments au fur et à mesure de la progression de la réaction, reportent éventuellement la concentration en fonction du temps sur un graphique, puis calculent la variation de la concentration par unité de temps.
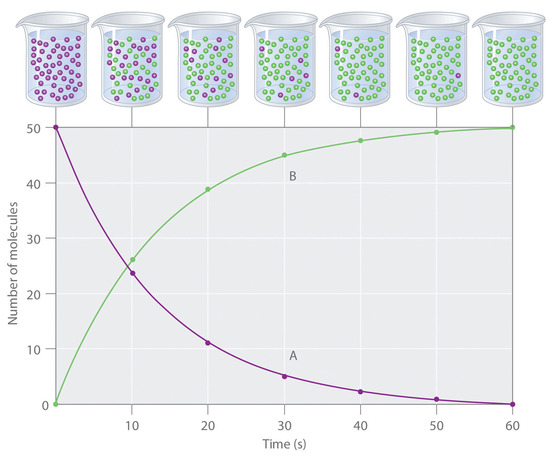
Figure 7.1.1. La progression d’une réaction simple (A → B). Le mélange ne contient initialement que des molécules A (violet). Au fil du temps, le nombre de molécules A diminue et davantage de molécules B (vertes) sont formées (en haut). Le graphique montre l’évolution du nombre de molécules A et B dans la réaction en fonction du temps sur une période de 1 min (en bas).
La progression d’une réaction simple (A → B) est illustré à la Figure 7.1.1; les béchers sont des instantanés de la composition de la solution à intervalles de 10 s. Le nombre de molécules du réactif (A) et du produit (B) est représenté en fonction du temps sur le graphique. Chaque point du graphique correspond à un bécher de la Figure 7.1.1. La vitesse de réaction est la variation de la concentration du réactif ou du produit au cours d’une période de temps. La concentration de A diminue avec le temps, tandis que la concentration de B augmente avec le temps.
vitesse = Δ[B]Δt = -Δ[A]Δt
Équation 7.1.1Relation entre la vitesse et la concentration des réactifs
Les crochets indiquent les concentrations molaires, et le delta grec majuscule (Δ) signifie ” changement dans. ” Étant donné qu’il est courant pour les chimistes de suivre la convention consistant à exprimer toutes les vitesses de réaction sous forme de nombres positifs, un signe négatif est inséré devant Δ[A]/Δt pour convertir la vitesse autrement négative en un nombre positif. La vitesse de réaction calculée pour la réaction A → B à l’aide de l’équation ci-dessus est différente pour chaque intervalle (ce n’est pas vrai pour toutes les réactions, comme indiqué ci-dessous). Par exemple, un changement plus important se produit dans [A] et [B] pendant le premier intervalle de 10 s que pendant le dernier, ce qui signifie que la vitesse de réaction est la plus élevée au début. Il est donc important de garder à l’esprit que les vitesses de réaction diminuent généralement avec le temps, à mesure que les concentrations des réactifs diminuent.
Appliquons ce que nous venons d’apprendre à l’aide d’un exemple de réaction. Si nous mesurons la concentration de peroxyde d’hydrogène, H2O2, dans une solution aqueuse, nous constatons qu’elle évolue lentement au fil du temps, à mesure que le H2O2 se décompose, selon l’équation suivante:
2H2O2 (aq) → 2H2O (l) + O2 (g)
La vitesse à laquelle le peroxyde d’hydrogène est consommé peut être exprimée en termes de vitesse de changement de sa concentration, comme indiqué ici:
vitessededécompositionde H2O2=-changeenconcentrationduréactifintervalledetemps
Équation 7.1.2 Vitesse de décomposition
[H2O2]1 représente la concentration molaire de peroxyde d’hydrogène à un certain moment t1; de même, [H2O2]2 représente la concentration molaire de peroxyde d’hydrogène à un moment ultérieur t2; et Δ[H2O2] représente la variation de la concentration molaire de peroxyde d’hydrogène pendant l’intervalle de temps Δt (c’est-à-dire t2 – t1). Lorsqu’on traite des vitesses de réaction, il est important de tenir compte des coefficients stœchiométriques. Pour la décomposition du peroxyde d’hydrogène, comme H2O et H2O2 ont les mêmes coefficients, nous pouvons conclure que la magnitude de leur vitesse de formation et de décomposition est identique. Quant à l’O2, en utilisant les coefficients stœchiométriques, nous pouvons conclure que la magnitude de sa vitesse de formation est la moitié de celle des 2 autres molécules.
NOTEZ : Rappelez-vous que (comme mentionné précédemment) les vitesses de réaction sont, par convention, positifs. Comme la concentration du réactif diminue au fur et à mesure de la réaction, Δ[H2O2] est une quantité négative; nous plaçons un signe négatif devant l’expression pour exprimer la vitesse de réaction comme une quantité positive.
Facteurs affectant la vitesse des réactions
Les vitesses auxquelles les réactifs sont consommés et les produits sont formés au cours des réactions chimiques varient considérablement. Nous pouvons identifier cinq facteurs qui affectent les vitesses des réactions chimiques: la nature chimique des substances qui réagissent, l’état de subdivision (un gros morceau ou de nombreuses petites particules) des réactifs, la température des réactifs, la concentration des réactifs et la présence d’un catalyseur.
La nature chimique des substances qui réagissent
La vitesse d’une réaction dépend de la nature des substances participantes. Des réactions qui semblent similaires peuvent avoir des vitesses différentes dans les mêmes conditions, selon l’identité des réactifs. Par exemple, lorsque de petits morceaux des métaux fer et sodium sont exposés à l’air, le sodium réagit complètement avec l’air pendant la nuit, alors que le fer est à peine affecté. Les métaux actifs que sont le calcium et le sodium réagissent tous deux avec l’eau pour former de l’hydrogène gazeux et une base. Cependant, le calcium réagit à un rythme modéré, alors que le sodium réagit si rapidement que la réaction est presque explosive.
L’état de subdivision des réactifs
À l’exception des substances à l’état gazeux ou en solution, les réactions se produisent à la limite, ou à l’interface, entre deux phases. Ainsi, la vitesse d’une réaction entre deux phases dépend dans une large mesure de la surface de contact entre elles. Un solide finement divisé a plus de surface disponible pour la réaction qu’un gros morceau de la même substance. Ainsi, un liquide réagira plus rapidement avec un solide finement divisé qu’avec un gros morceau du même solide. Par exemple, les gros morceaux de fer réagissent lentement avec les acides; le fer finement divisé réagit beaucoup plus rapidement (Figure 7.1.2). Les gros morceaux de bois couvent, les petits morceaux brûlent rapidement et la sciure de bois brûle de manière explosive.

(a) (b)
Figure 7.1.2. (a) La poudre de fer réagit rapidement avec de l’acide chlorhydrique dilué et produit des bulles d’hydrogène gazeux car la poudre a une grande surface totale:
2Fe(s) + 6HCl(aq) ⟶ 2FeCl3(aq) + 3H2(g). (b) Un clou en fer réagit plus lentement.
|
Réaction du césium avec l’eau – Démonstration vidéo |
|
Regardez cette vidéo pour voir la réaction du césium avec l’eau au ralenti et une discussion sur la façon dont l’état des réactifs et la taille des particules affectent les vitesses de réaction. |
Température des réactifs
Les réactions chimiques se produisent généralement plus rapidement à des températures plus élevées. Les aliments peuvent se gâter rapidement s’ils sont laissés sur le comptoir de la cuisine. Cependant, la température plus basse à l’intérieur d’un réfrigérateur ralentit ce processus, de sorte que les mêmes aliments restent frais pendant plusieurs jours. En laboratoire, nous utilisons un brûleur ou une plaque chauffante pour augmenter la vitesse des réactions qui se déroulent lentement à des températures ordinaires. Dans de nombreux cas, une augmentation de la température de seulement 10°C permet de doubler approximativement la vitesse d’une réaction dans un système homogène.
Concentrations des réactifs
La vitesse de nombreuses réactions dépend de la concentration des réactifs. Les vitesses augmentent généralement lorsque la concentration d’un ou plusieurs des réactifs augmente. Par exemple, le carbonate de calcium (CaCO3) se détériore suite à sa réaction avec le polluant dioxyde de soufre. La vitesse de cette réaction dépend de la quantité de dioxyde de soufre dans l’air (Figure 7.1.3).

Figure 7.1.3.Les statues fabriquées à partir de composés carbonatés tels que le calcaire et le marbre s’altèrent généralement lentement au fil du temps en raison de l’action de l’eau et des dilatations et contractions thermiques. Cependant, les polluants comme le dioxyde de soufre peuvent accélérer l’altération. Plus la concentration de polluants atmosphériques augmente, plus la détérioration du calcaire est rapide. (crédit : James P Fisher III)
Un oxyde acide, le dioxyde de soufre se combine à la vapeur d’eau dans l’air pour produire de l’acide sulfureux dans la réaction suivante:
SO2 (g) + H2O (g) → H2SO3 (aq)
Le carbonate de calcium réagit avec l’acide sulfureux comme suit:
Dans une atmosphère polluée où la concentration de dioxyde de soufre est élevée, le carbonate de calcium se détériore plus rapidement que dans un air moins pollué. De même, le phosphore brûle beaucoup plus rapidement dans une atmosphère d’oxygène pur que dans l’air, qui ne contient qu’environ 20% d’oxygène.
|
Le phosphore brûlant dans un air ayant une haute [O2] – Démonstration vidéo |
|
Le phosphore brûle rapidement dans l’air, mais il brûle encore plus rapidement si la concentration d’oxygène est plus élevée. Regardez cette vidéo pour voir un exemple. |
La présence d’un catalyseur
Les solutions de peroxyde d’hydrogène moussent lorsqu’elles sont versées sur une blessure ouverte car les substances présentes dans les tissus exposés agissent comme des catalyseurs, augmentant la vitesse de décomposition du peroxyde d’hydrogène. Cependant, en l’absence de ces catalyseurs (par exemple, dans le flacon de l’armoire à la pharmacie), la décomposition complète peut prendre des mois. Un catalyseur est une substance qui augmente la vitesse d’une réaction chimique en diminuant l’énergie d’activation sans être elle-même consommée par la réaction. L’énergie d’activation est la quantité minimale d’énergie nécessaire pour qu’une réaction chimique se déroule dans le sens direct. Un catalyseur augmente la vitesse de réaction en fournissant une autre voie ou un autre mécanisme à suivre pour la réaction. La catalyse sera abordée plus en détail plus loin dans ce chapitre, en relation avec les mécanismes de réaction.
|
Facteurs affectant la vitesse des réactions – Activité interactive |
|
Les réactions chimiques se produisent lorsque des molécules entrent en collision les unes avec les autres et subissent une transformation chimique. Avant de réaliser physiquement une réaction en laboratoire, les scientifiques peuvent utiliser des simulations de modélisation moléculaire pour prédire comment les paramètres évoqués précédemment influenceront la vitesse d’une réaction. Utilisez l’outil interactif PhET Reactions & Rates pour explorer l’influence de la température, la concentration et la nature des réactifs sur les vitesses de réaction. |
Questions
★ Questions
Décrivez l’effet de chacun des éléments suivants sur la vitesse de la réaction du magnésium métallique avec une solution d’acide chlorhydrique: la molarité de l’acide chlorhydrique, la température de la solution et la taille des morceaux de magnésium.
Expliquez pourquoi un œuf cuit plus lentement dans l’eau bouillante à Lake Louise, en Alberta (altitude de 1,6 km) qu’à Charlottetown, à l’Île-du-Prince-Édouard (altitude de 0 à 49 m). (Indice: tenez compte de l’effet de la température sur la vitesse de réaction et de l’effet de la pression sur le point d’ébullition).
Quelle est la différence entre la vitesse moyenne, la vitesse initiale et la vitesse instantanée?
Dans l’industrie nucléaire, le trifluorure de chlore est utilisé pour préparer l’hexafluorure d’uranium, un composé volatil de l’uranium utilisé dans la séparation des isotopes de l’uranium. Le trifluorure de chlore est préparé par la réaction Cl2 (g) + 3F2 (g) ⟶ 2ClF3 (g). Écrire l’équation qui relie les expressions de la vitesse de cette réaction en termes de disparition de Cl2 et F2 et de formation de ClF3.
Réponses
Une molarité plus élevée augmente la vitesse de la réaction. Une température plus élevée augmente la vitesse de la réaction. Les petits morceaux de magnésium métallique réagiront plus rapidement que les gros morceaux car il existe une surface plus réactive.
Les points d’ébullition dans cette question dépendent de l’altitude de nos deux villes. Plus l’altitude est élevée, plus la pression atmosphérique est faible; lorsque nous réduisons la pression sur l’eau bouillante, celle-ci peut bouillir à une température plus basse. Cela affecte la vitesse de cuisson de notre œuf car la température plus basse diminue la vitesse de notre réaction.
La vitesse instantanée est la vitesse d’une réaction à un moment donné, une période de temps si courte que les concentrations des réactifs et des produits changent de façon négligeable. La vitesse initiale est la vitesse instantanée de la réaction au moment où elle commence (lorsque le produit commence tout juste à se former). La vitesse moyenne est la moyenne des vitesses instantanées sur une période de temps.
Mesure de la vitesse à laquelle une réaction chimique a lieu
Substance qui diminue l'énergie d'activation d'une réaction spécifique en fournissant une voie de réaction alternative, augmentant ainsi la vitesse d'une réaction sans être elle-même consommée par la réaction

