4.1 – Introduction à l’équilibre chimique
Une réaction chimique est généralement écrite de manière à suggérer qu’elle se déroule dans une direction, celle dans laquelle nous lisons, mais toutes les réactions chimiques sont réversibles, et la réaction en avant comme en arrière se produit à un degré ou à un autre selon les conditions – c’est la notion d’équilibre chimique que nous allons aborder ici dans ce chapitre.
Équilibre dynamique
Dans un équilibre chimique, les réactions en avant et en arrière se produisent à des rythmes identiques, et les concentrations de produits et de réactifs restent constantes. Si nous effectuons une réaction dans un système fermé de sorte que les produits ne peuvent pas s’échapper, nous constatons souvent que la réaction ne donne pas un rendement de 100 % des produits. Au lieu de cela, certains réactifs restent après que les concentrations ont cessé de changer. À ce stade, lorsque les concentrations des réactifs et des produits ne changent plus, nous disons que la réaction est à l’équilibre. Un mélange de réactifs et de produits se trouve à l’équilibre.
Par exemple, lorsque nous plaçons un échantillon de tétroxyde de diazote (N2O4, un gaz incolore) dans un tube de verre, il forme du dioxyde d’azote (NO2, un gaz brun) par la réaction suivante :
N2O4 (g) ⇌ 2 NO2 (g)
La couleur devient plus sombre à mesure que le N2O4 est converti en NO2. Lorsque le système atteint l’équilibre, le N2O4 et le NO2 sont tous deux présents (figure 4.1.1).
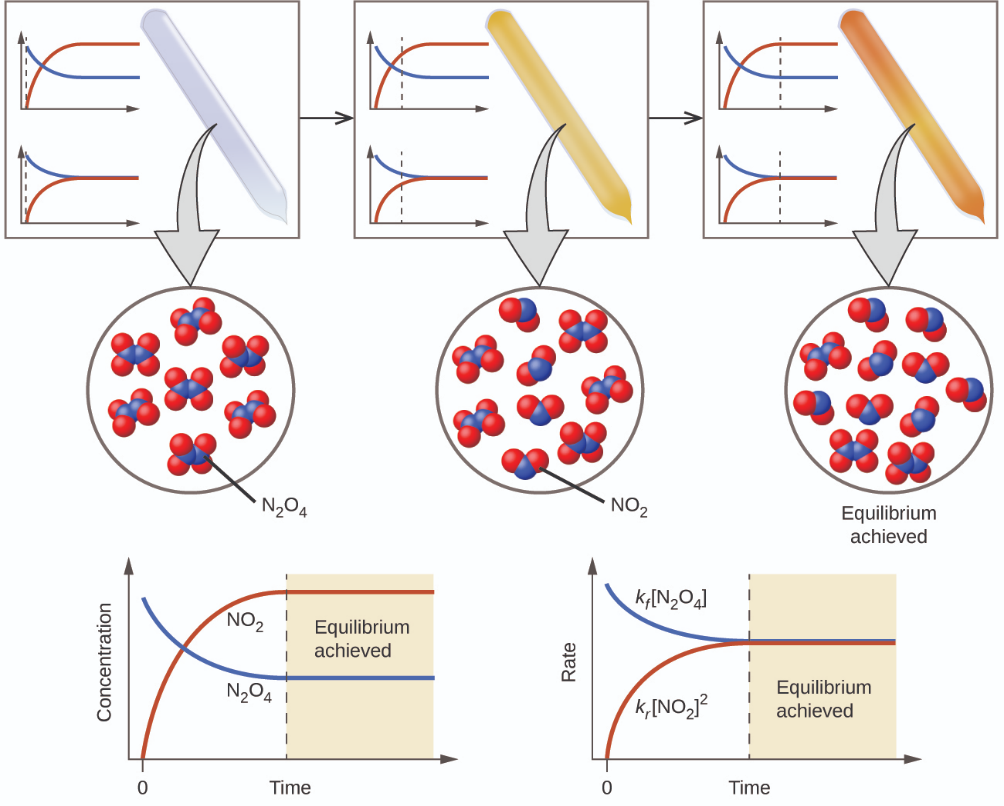
Figure 4.1.1. Un mélange de NO2 et de N2O4 se rapproche de l’équilibre. Le N2O4 incolore réagit pour former du NO2 brun. À mesure que la réaction progresse vers l’équilibre, la couleur du mélange s’assombrit en raison de l’augmentation de la concentration de NO2. (Chem Libre, tiré de : https://chem.libretexts.org/Bookshelves/General_Chemistry/Map%3A_General_Chemistry_(Petrucci_et_al.)/15%3A_Principles_of_Chemical_Equilibrium/15.1%3A_Dynamic_Equilibrium, Creative Commons)
La formation de NO2 à partir de N2O4 est une réaction réversible, qui est identifiée par les flèches d’équilibre (⇌). Toutes les réactions sont réversibles, mais de nombreuses réactions, à toutes fins pratiques, se déroulent dans le sens de l’avancement jusqu’à épuisement des réactifs et ne s’inverseront que dans certaines conditions. Ces réactions sont souvent représentées par une flèche à sens unique allant des réactifs aux produits. De nombreuses autres réactions, telles que la formation de NO2 à partir de N2O4, sont réversibles dans des conditions plus faciles à obtenir et sont donc nommées comme telles. Dans une réaction réversible, les réactifs peuvent se combiner pour former des produits et les produits peuvent réagir pour former les réactifs. Ainsi, non seulement le N2O4 peut se décomposer pour former du NO2, mais le NO2 produit peut réagir pour former du N2O4. Dès que la réaction directe produit du NO2, la réaction inverse commence et le NO2 commence à réagir pour former du N2O4. À l’équilibre, les concentrations de N2O4 et de NO2 ne changent plus car la vitesse de formation de NO2 est exactement égale à la vitesse de consommation de NO2, et la vitesse de formation de N2O4 est exactement égale à la vitesse de consommation de N2O4. Nous arrivons donc à une idée clé : L’équilibre chimique est un processus dynamique. Par exemple, si deux jongleurs se lancent chacun des quilles à la même vitesse que celle à laquelle chacun reçoit les quilles de l’autre, le nombre de quilles que chacun aura à un moment donné restera à peu près constant, mais il y aura toujours un flux d’aller-retour entre eux (figure 4.1.2).

Figure 4.1.2. Ces jongleurs fournissent une illustration de l’équilibre dynamique. Chacun lance des quilles à l’autre au même rythme que celui auquel il reçoit des quilles de cette personne. Comme les quilles sont lancées continuellement dans les deux sens, le nombre de quilles qui se déplacent dans chaque sens est constant, et le nombre de quilles que chaque jongleur a à un moment donné reste (à peu près) constant.
Dans un équilibre chimique, les réactions en avant et en arrière ne s’arrêtent pas, mais continuent à se produire au même rythme, ce qui conduit à des concentrations constantes des réactifs et des produits. La figure 4.1.1 présente des graphiques montrant comment les taux de réaction et les concentrations changent en fonction du temps.
Nous pouvons détecter un état d’équilibre parce que les concentrations de réactifs et de produits ne semblent pas changer. Cependant, il est important que nous vérifions que l’absence de changement est due à l’équilibre et non à une vitesse de réaction si lente que les changements de concentration sont difficiles à détecter.
Nous utilisons une double flèche lorsque nous écrivons une équation pour une réaction réversible. Une telle réaction peut ou non être à l’équilibre. Par exemple, la figure 4.1.1 montre la réaction :
|
N2O4 (g) incolore |
kf ⇌ kr |
2 NO2 (g) rouge-brun |
Lorsque nous souhaitons parler d’un élément particulier d’une réaction réversible, nous utilisons une seule flèche. Par exemple, dans l’équilibre illustré à la figure 4.1.1, la vitesse de la réaction vers l’avant avec la constante de vitesse kf
|
N2O4 (g) incolore |
kf ⇌
|
2 NO2 (g) rouge-brun |
est égal à la vitesse de la réaction inverse avec la constante de vitesse kr
|
N2O4 (g) incolore |
kr ⇌
|
2 NO2 (g) rouge-brun |
Nous parlerons plus en détail des constantes de vitesse au chapitre 7 : Cinétique chimique ; pour l’instant, tout ce que vous devez savoir, c’est que chaque constante de vitesse est unique à une réaction particulière, ce qui permet de définir mathématiquement sa vitesse de réaction.
|
Équilibre et boissons gazeuses |
|
Le lien entre la chimie et les boissons gazeuses remonte à 1767, lorsque Joseph Priestley (1733-1804 ; surtout connu aujourd’hui pour son rôle dans la découverte et l’identification de l’oxygène) a découvert une méthode permettant d’infuser de l’eau avec du dioxyde de carbone pour en faire de l’eau gazeuse. En 1772, Priestly a publié un article intitulé “Impregnating Water with Fixed Air”. Le document décrit l’huile de vitriol qui s’égoutte (aujourd’hui nous appelons cela de l’acide sulfurique, mais quelle belle façon de décrire l’acide sulfurique : “huile de vitriol” signifie “méchanceté liquide”) sur de la craie (carbonate de calcium). Le CO2 qui en résulte tombe dans le récipient d’eau situé sous la cuve dans laquelle la réaction initiale a lieu ; l’agitation aide le CO2 gazeux à se mélanger à l’eau liquide. H2SO4 (l) + CaCO3 (s) ⇌ CO2 (g) + H2O (l) + CaSO4 (aq) Le dioxyde de carbone est légèrement soluble dans l’eau. Il y a une réaction d’équilibre qui se produit lorsque le dioxyde de carbone réagit avec l’eau pour former de l’acide carbonique (H2CO3). Comme l’acide carbonique est un acide faible, il peut s’ioniser en ions hydronium (H3O+) et en ions hydrogénocarbonate (HCO3-). CO2 (aq) + H2O (l) ⇌ H2CO3 (aq) H2O (l) + H2CO3 (aq) ⇌ H3O+ (aq) + HCO3– (aq) Aujourd’hui, le CO2 peut être pressurisé dans les boissons gazeuses, établissant ainsi l’équilibre indiqué ci-dessus. Cependant, une fois que vous ouvrez le récipient de boisson, une cascade de changements d’équilibre se produit. Tout d’abord, le CO2 gazeux présent dans l’espace d’air au-dessus de la bouteille s’échappe, ce qui entraîne un déplacement de l’équilibre entre le CO2 en phase gazeuse et le CO2 dissous ou aqueux, ce qui réduit la concentration de CO2 dans la boisson gazeuse. La diminution du CO2 dissous dans le liquide entraîne la décomposition de l’acide carbonique en CO2 et H2O dissous. La diminution de la concentration d’acide carbonique entraîne un déplacement de l’équilibre final. Tant que la boisson gazeuse se trouve dans un récipient ouvert, le CO2 sort de la boisson sous forme de bulles, libérant le gaz dans l’air (figure 4.1.3). Lorsque le couvercle de la bouteille est ouvert, les réactions du CO2 ne sont plus à l’équilibre et se poursuivent jusqu’à ce qu’il ne reste plus de réactifs. Cela donne une boisson gazeuse avec une concentration en CO2 beaucoup plus faible, souvent appelée “flat”.
Figure 4.1.3. Lorsqu’une boisson gazeuse est ouverte, plusieurs changements d’équilibre se produisent. (crédit : modification du travail par “D Coetzee”/Flickr) |
L’équilibre entre N2O4 et NO2 consiste en un équilibre chimique – un équilibre qui implique deux ou plusieurs substances par une réaction chimique. Cependant, un équilibre constitué d’une seule substance, appelé équilibre physique, peut être établi pour un changement physique – comme une transition de liquide à gaz – ainsi que pour une réaction chimique. Considérons l’évaporation du brome comme un deuxième exemple de système à l’équilibre.
Br2 (l) ⇌ Br2 (g)
La figure 4.1.4 montre un échantillon de brome liquide à l’équilibre avec de la vapeur de brome dans un récipient fermé. Lorsque nous versons du brome liquide dans une bouteille vide dans laquelle il n’y a pas de vapeur de brome, une partie du liquide s’évapore, la quantité de liquide diminue et la quantité de vapeur augmente. Si nous bouchons la bouteille pour qu’aucune vapeur ne s’échappe, la quantité de liquide et de vapeur finira par ne plus varier et un équilibre entre le liquide et la vapeur sera établi. Si la bouteille n’était pas bouchée, la vapeur de brome s’échapperait et aucun équilibre ne serait atteint.

Figure 4.1.4. Un équilibre est illustré entre le brome liquide, Br2 (l), le liquide sombre, et la vapeur de brome, Br2 (g), le gaz brun-rougeâtre. Comme le récipient est scellé, la vapeur de brome ne peut pas s’échapper et l’équilibre est maintenu. (crédit : http://images-of-elements.com/bromine.php)
Dérivation d’une constante pour les équilibres chimiques
Étant donné qu’un état d’équilibre est atteint lorsque la vitesse de réaction avant est égale à la vitesse de réaction arrière, dans un ensemble donné de conditions, il doit y avoir une relation entre la composition du système à l’équilibre et la cinétique d’une réaction (représentée par des constantes de vitesse). Continuons à utiliser l’exemple de la décomposition de N2O4 en NO2 pour le démontrer. Les réactions en amont et en aval de ce système consistent en une seule réaction élémentaire, de sorte que les vitesses de réaction sont les suivantes :
taux vers l’avant = kf [N2O2]
4.1.1
et
taux inverse = kr[NO2]2
4.1.2
Note : Vous apprendrez tout sur les expressions de taux et l’expression des taux de réaction dans le chapitre sur la cinétique, mais pour l’instant, nous allons brièvement expliquer ces expressions. Comme mentionné précédemment, la constante de vitesse, k, est unique à une réaction particulière et aide à définir mathématiquement la vitesse de réaction. La concentration du réactif détermine également la vitesse ; la raison pour laquelle NO2 est au carré dans l’expression pour la vitesse inverse est que 2 molécules de NO2 sont nécessaires pour former N2O4, comme indiqué dans l’équation d’équilibre chimique. Notez que la valeur de l’exposant est basée sur le nombre de molécules de réactif uniquement pour les réactions élémentaires ; là encore, ne vous inquiétez pas de comprendre ce que cela signifie pour l’instant, car cela sera correctement couvert plus tard.
À l’équilibre, le taux à terme est égal au taux inverse (définition de l’équilibre) :
kf[N2O2] = kr[NO2]2
donc
Le rapport des constantes de vitesse nous donne une nouvelle constante, la constante d’équilibre (K), qui est définie comme suit :
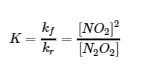
Il existe donc une relation fondamentale entre la cinétique chimique et l’équilibre chimique : dans un ensemble donné de conditions, la composition du mélange d’équilibre est déterminée par les amplitudes des constantes de vitesse pour les réactions avant et arrière. En d’autres termes, cette constante d’équilibre est égale à la constante de vitesse de la réaction directe divisée par la constante de vitesse de la réaction inverse.
Mesure de l’ampleur de la réaction
Comme il existe une relation directe entre la cinétique d’une réaction et les concentrations de produits et de réactifs à l’équilibre, lorsque kf ≫ kr, K a une grande valeur, et la concentration de produits à l’équilibre prédomine. Cela correspond à une réaction essentiellement irréversible. Inversement, lorsque kf ≪ kr, K a une valeur très faible, et la réaction ne produit presque pas de produits comme écrit. Les systèmes pour lesquels kf ≈ kr ont une valeur de K proche de 1 et des concentrations importantes de réactifs et de produits à l’équilibre.
Considérons un équilibre entre les substances A et B : A ⇌ B. Le tableau ci-dessous indique le pourcentage de moles de A et B qui serait présent à l’équilibre pour différentes valeurs de K. Pour des valeurs de K de 10-5 et 105, le pourcentage de moles de A et B est très proche de 100%, respectivement. Par conséquent, gardez la règle empirique suivante pour ce cours : pour K < 10-5, la réaction est dite “favorisée par le réactif” et consiste principalement en un ou plusieurs réactifs avec un ou plusieurs produits minimaux, tandis que pour K > 105, la réaction se poursuit pratiquement jusqu’à son terme avec peu ou pas de réactif(s) restant.
Tableau 4.1.1 Relation entre la magnitude de K et le pourcentage molaire du réactif et du produit.
|
A ⇌ B |
||
|
K |
mol% A |
mol% B |
|
100 000 |
0.001 |
99.999 |
|
10 000 |
0.01 |
99.99 |
|
1 000 |
0.10 |
99.90 |
|
100 |
0.99 |
99.01 |
|
10 |
9.09 |
90.91 |
|
1 |
50.00 |
50.00 |
|
0.1 |
90.91 |
9.09 |
|
0.01 |
99.01 |
0.99 |
|
0.001 |
99.90 |
0.10 |
|
0.0001 |
99.99 |
0.01 |
|
0.00001 |
99.999 |
0.001 |
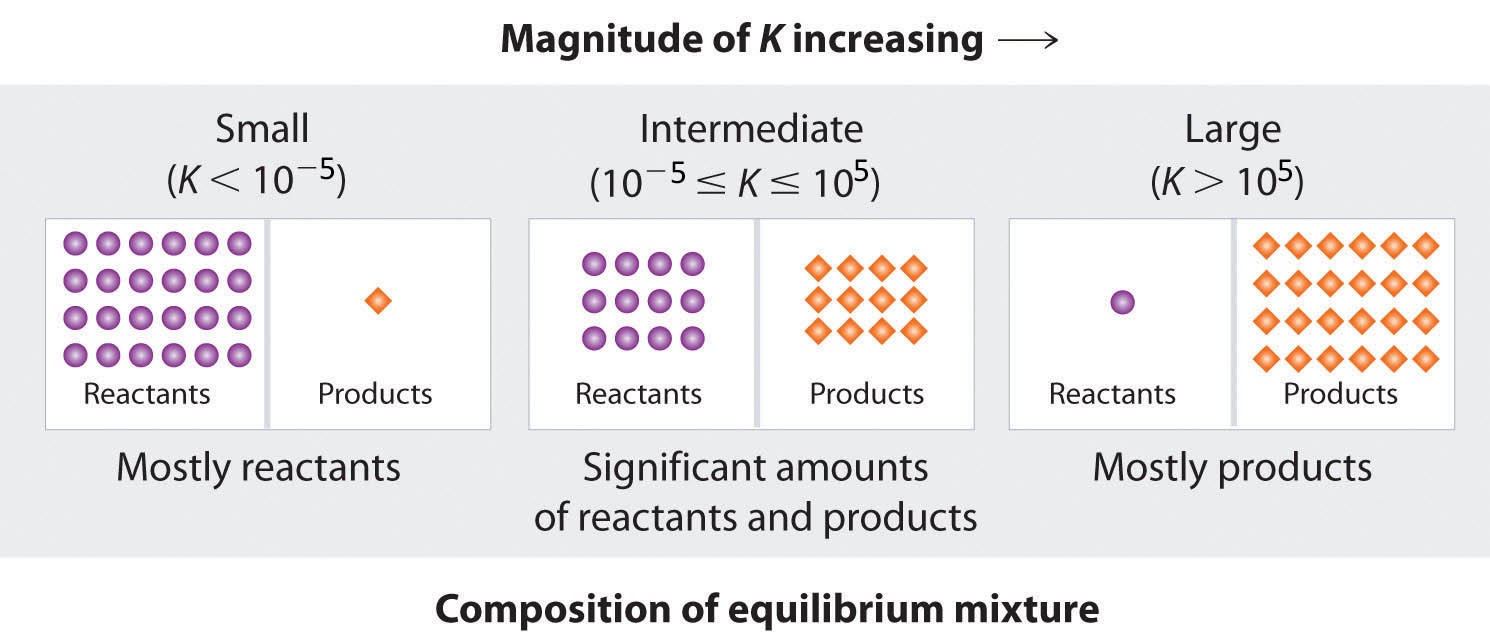
Figure 4.1.5. Plus la valeur de K est élevée, plus la réaction se poursuit vers la droite avant d’atteindre l’équilibre, et plus le rapport entre les produits et les réactifs à l’équilibre est élevé.
Examinons quelques exemples de réactions pour comprendre cela : la réaction entre H2 et Cl2 pour produire du HCl a une constante d’équilibre de 1,6 × 1033 à 300 K. Comme H2 est un bon réducteur et Cl2 un bon oxydant, la valeur de K est extrêmement grande et la réaction se poursuit essentiellement jusqu’à son achèvement. D’autre part, la réaction à 500 K entre F2 et deux atomes de F en phase gazeuse a une constante d’équilibre de 7,4 × 10-13. Cette valeur de K est extrêmement faible, ce qui indique que les réactifs n’ont pas tendance à former facilement des produits – la formation et la présence de réactifs sont fortement favorisées.
|
Quand faut-il utiliser une flèche unidirectionnelle ? |
|
Vous avez peut-être remarqué jusqu’à présent que dans certaines réactions, on utilise des flèches d’équilibre (à deux directions), alors que dans d’autres, on n’utilise que des flèches vers l’avant. Le facteur décisif pour déterminer le format de flèche approprié est la valeur de la constante d’équilibre (K). Le tableau 4.1.1 montre que si la valeur de K est de 105, lorsque l’équilibre est atteint, le système contient environ 0,001% du réactif d’origine. Ce reste est essentiellement négligeable, et nous indiquons donc que cette réaction favorable au produit “va jusqu’au bout”, ce qui indique une formation de produits attendue d’environ 100%. Ainsi, lorsque nous rencontrons des réactions avec des valeurs de K ≥ 105, nous avons tendance à utiliser uniquement des flèches de direction unidirectionnelles vers l’avant. Dans tous les autres scénarios, les directions avant et arrière doivent être prises en compte, et il est donc plus approprié d’utiliser les flèches d’équilibre bidirectionnelles. |
Exemple 4.1.1 – Composition des réactifs/produits à l’équilibre
Prévoir quels systèmes à l’équilibre (a) ne contiendront essentiellement que des produits, (b) ne contiendront essentiellement que des réactifs, et (c) contiendront des quantités appréciables à la fois de produits et de réactifs.
(a) H2 (g) + I2 (g) ⇌ 2 HI (g)K(700 K) = 54
(b) 2 CO2 (g) ⇌ 2 CO (g) + O2 (g)K(1200 K) = 3,1 × 10-18
(c) PCl5 (g) ⇌ PCl3 (g) + Cl2 (g)K(613 K) = 97
(d) 2 O3 (g) ⇌ 3 O2 (g)K(298 K) = 5,9 × 1055
Solution
(a) K est plus proche de 1 (10-5 < K < 105), de sorte que le mélange d’équilibre contiendra des quantités appréciables à la fois de produits et de réactifs.
(b) K << 1 (K < 10-5), de sorte que les réactifs ont peu tendance à former des produits dans les conditions spécifiées ; ainsi, à l’équilibre, le système ne contiendra essentiellement que des réactifs.
(c) K est plus proche de 1 (10-5 < K < 105), de sorte que le mélange d’équilibre contiendra des quantités appréciables à la fois de produits et de réactifs.
(d) K >> 1 (K > 105), de sorte qu’à l’équilibre, il ne sera constitué essentiellement que de produits.
Vérifiez votre apprentissage 4.1.1 – Composition des réactifs/produits à l’équilibre
L’hydrogène et l’azote réagissent pour former de l’ammoniac selon l’équation chimique équilibrée suivante :
N2 (g) + 3 H2 (g) ⇌ 2 NH3 (g)
Les valeurs de la constante d’équilibre à différentes températures ont été rapportées comme suit
-
-
- K25°C = 3,3 × 108
- K177°C = 2,6 × 103
- K327°C = 4,1
-
(a) À quelle température vous attendriez-vous à trouver la plus grande proportion de H2 et de N2 dans le mélange d’équilibre ?
(b) En supposant que les vitesses de réaction soient suffisamment rapides pour que l’équilibre soit atteint rapidement, à quelle température concevriez-vous un réacteur commercial à exploiter pour maximiser le rendement en ammoniac ?
Réponse
(a) 327°C, où K est le plus petit ; (b) 25°C, où K est le plus grand
Questions
★ Questions
- Que signifie qualifier une réaction de “réversible” ?
- Lorsque l’on écrit une équation, comment distingue-t-on une réaction réversible d’une réaction non réversible ?
- Si une réaction est réversible, quand peut-on dire qu’elle a atteint l’équilibre ?
- Un système est-il à l’équilibre si les constantes de vitesse des réactions en avant et en arrière sont égales ?
- Si les concentrations de produits et de réactifs sont égales, le système est-il à l’équilibre ?
Réponses
- La réaction peut se faire aussi bien en sens inverse qu’en sens inverse.
- Entre les deux types de réactions, elles se distinguent par les flèches utilisées dans l’équation. Dans une réaction réversible, “⇌” est approprié, tandis que dans une réaction non réversible, “→” est utilisé.
- Lorsqu’un système a atteint l’équilibre, il n’y a plus de changement dans les concentrations des réactifs et des produits ; les réactions vers l’avant et en sens inverse continuent de se produire, mais à des taux équivalents.
- Pas nécessairement ; les valeurs équivalentes de kf et kr (pour les sens avant et inverse) donnent une valeur constante d’équilibre de 1 (puisque K = kf/kr). Cependant, cela ne signifie pas que le système est à l’équilibre. Seules des concentrations constantes du réactif et des produits signifient que les réactions sont à l’équilibre. Cela ne signifie pas que leurs concentrations doivent être égales, mais dans certains cas, elles peuvent l’être.
- Le concept d’équilibre n’implique pas des concentrations égales, bien que cela soit possible.
État d'une réaction réversible dans laquelle les processus avant et arrière se déroulent à un rythme égal
Réaction chimique qui peut se dérouler dans le sens avant et arrière dans des conditions données


