5.4 – Acides polyprotiques
Nous pouvons classer les acides selon le nombre de protons par molécule qu’ils peuvent abandonner dans une réaction. Les acides tels que HCl, HNO3 et HCN qui contiennent un atome d’hydrogène ionisable dans chaque molécule sont appelés acides monoprotiques. Leurs réactions avec l’eau sont :
HCl (aq) + H2O (l) ⇌ H3O+ (aq) + Cl– (aq)
HNO3 (aq) + H2O (l) ⇌ H3O+ (aq) + NO3– (aq)
HCN (aq) + H2O (l) ⇌ H3O+ (aq) + CN– (aq)
Note : le Ka de HCN est de 6,2 x 10-10. Cela signifie que l’acide ne s’ionise pas complètement dans l’eau et nécessite la flèche d’équilibre.
Bien qu’il contienne quatre atomes d’hydrogène, l’acide acétique, CH3CO2H, est également monoprotique car seul l’atome d’hydrogène du groupe fonctionnel acide carboxylique (COOH) réagit avec les bases :
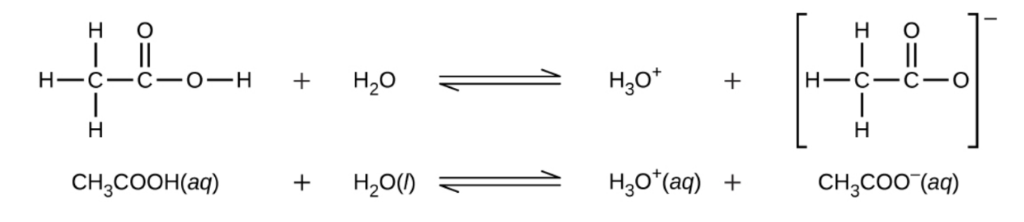
De même, les bases monoprotiques sont des bases qui acceptent un seul proton.
|
|
Acides diprotiques
Les acides diprotiques contiennent deux atomes d’hydrogène ionisables par molécule ; l’ionisation de ces acides se fait en deux étapes. La première ionisation a toujours lieu dans une plus large mesure que la seconde. Par exemple, l’acide sulfurique, un acide fort, s’ionise comme suit :
Première ionisation :
H2SO4 (aq) + H2O (l) ⇌ H3O+ (aq) + HSO4– (aq)
Pour cette réaction, Ka1 > 102, indiquant une ionisation complète à ~100% du premier proton.
Deuxième ionisation :
HSO4– (aq) + H2O (l) ⇌ H3O+ (aq) + SO42- (aq)
Pour cette réaction, Ka2 = 1,0×10-2, ce qui indique que la seconde ionisation n’est que partielle.
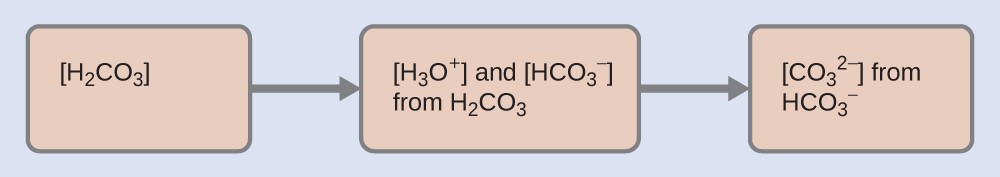
Ce processus d’ionisation par étapes se produit pour tous les acides polyprotiques. Lorsque nous faisons une solution d’un acide diprotique faible, nous obtenons une solution qui contient un mélange d’acides. L’acide carbonique, H2CO3, est un exemple d’acide diprotique faible. La première ionisation de l’acide carbonique produit des ions hydroniums et des ions bicarbonate en petites quantités.
Première ionisation :
H2CO3 (aq) + H2O (l) ⇌ H3O+ (aq) + HCO3– (aq)
Deuxième ionisation :
HCO3– (aq) + H2O (l) ⇌ H3O+ (aq) + CO32- (aq)
est supérieure à
par un factuer de 104, de sorte que H2CO3 est le producteur dominant d’ions hydronium dans la solution. Cela signifie que très peu de HCO3– (formé par l’ionisation de H2CO3) s’ionise une deuxième fois pour donner plus d’ions hydronium (et d’ions carbonate), et les concentrations de H3O+ et de HCO3– sont pratiquement égales dans une solution aqueuse pure de H2CO3.
Confirmons-nous mathématiquement ce concept très important. Les tableaux ICE ci-dessous présentent les deux réactions d’ionisation, en commençant par une solution de H2CO3 à 10,0 M. Remarquez qu’avec la première réaction d’ionisation, nous générons une petite concentration de H3O+ et de HCO3– (même en commençant avec 10,0 M de H2CO3 !) – ceci est à nouveau dû à la valeur relativement faible de Ka1. Ensuite, la deuxième réaction d’ionisation, qui a une valeur Ka encore plus faible, ne provoque pratiquement aucun changement dans la concentration de HCO3– et de H3O+ et génère une quantité négligeable de CO32-.
|
1re IONISATION: H2CO3(aq) + H2O(aq) ⇌ H3O+(aq) + HCO3–(aq) |
|||
|
|
H2CO3 |
[H3O+] |
[HCO3-] |
|
Concentration initiale (M) |
10.0 |
0.0 |
0.0 |
|
x = 0,0021 M |
|||
|
Changement (M) |
10.0 – 0.0021 |
0.0 + 0.0021 |
0.0 + 0.0021 |
|
Concentration À l’équilibre (M) |
9.9979 |
0.0021 |
0.0021 |
|
2ÈME IONISATION: HCO3–(aq) + H2O(aq) ⇌ H3O+(aq) + CO32-(aq) |
|||
|
|
[HCO3–] |
[H3O+] |
[CO32-] |
|
Concentration initiale (M) |
0.0021 |
0.0021 |
0.0 |
|
x = 4,7 × 10-11 M |
|||
|
Changement (M) |
0.0021 – 4.7 × 10-11 |
0.0021 + 4.7 × 10-11 |
0.0 + 4.7 × 10-11 |
|
Concentration à l’équilibre (M) |
~0.0021 |
~0.0021 |
~0.0 |
Si la première constante d’ionisation d’un acide diprotique faible est supérieure à la seconde d’un facteur d’au moins 20, il convient de traiter la première ionisation séparément et de calculer les concentrations qui en résultent avant de calculer les concentrations des espèces résultant de l’ionisation ultérieure. Cela peut simplifier considérablement notre travail car nous pouvons déterminer la concentration de H3O+ et de la base conjuguée de la première ionisation, puis déterminer la concentration de la base conjuguée de la seconde ionisation dans une solution dont les concentrations sont déterminées par la première ionisation.
Exemple 5.4.1 – Ionisation d’un acide diprotique
Lorsque nous achetons de l’eau gazeuse, nous achetons une solution de dioxyde de carbone dans l’eau. La solution est acide car le CO2 réagit avec l’eau pour former de l’acide carbonique, H2CO3. Que sont [H3O+], [HCO3–], et [CO32-] dans une solution saturée de CO2 avec un [H2CO3] initial = 0,033 M ?
H2CO3 (aq) + H2O (l) ⇌ H3O+ (aq) + HCO3– (aq) Ka1 = 4.5 x 10-7
HCO3– (aq) + H2O (l) ⇌ H3O+ (aq) + CO32- (aq) Ka2 = 4.7 x 10-11
Solution
Comme l’indiquent les constantes d’ionisation, le H2CO3 est un acide beaucoup plus fort que le HCO3–, de sorte que le H2CO3 est le principal producteur d’ions hydronium en solution. La solution de ce problème comporte donc deux volets : (1) En suivant les quatre étapes habituelles, nous déterminons la concentration de H3O+ et de HCO3– produite par l’ionisation de H2CO3. (2) Ensuite, nous déterminons la concentration de CO32- dans une solution avec la concentration de H3O+ et HCO3– déterminée en (1). Pour résumer :
Déterminer les concentrations de H3O+ et de HCO3–.
H2CO3 (aq) + H2O (l) ⇌ H3O+ (aq) + HCO3– (aq) Ka1 = 4.5 x 10-7
Quant à l’ionisation de tout autre acide faible :
Un tableau abrégé des changements et des concentrations montre :
H2CO3 + H2O⇌ H3O+ + HCO3–
|
Concentration initiale (M) |
0.033 |
|
~0 |
0 |
|
Changement (M) |
– x |
|
x |
x |
|
Concentration d’équilibre (M) |
0.033 – x |
|
x |
x |
La substitution des concentrations d’équilibre dans l’équilibre nous donne :
KH2CO3=([H3O+][HCO3–])/[H2CO3]=x2/(0.033-x)=4.5×10-7
La résolution de l’équation précédente en faisant nos hypothèses standard donne
x=1.2×10-4
Ainsi:
[H2CO3]=0.033M
[H3O+]=[HCO3–]=1.2×10-4M
Déterminer la concentration de CO32- dans une solution à l’équilibre avec [H3O+] et [HCO3–], tous deux égaux à 1,2 × 10-4 M.
HCO3– (aq) + H2O (l) ⇌ H3O+ (aq) + CO32- (aq)
KHCO3-=([H3O+][CO32-])/[HCO3–]=((1.2×10-4)[CO32-])/1.2×10-4
[CO32-]=((4.7×10-11)(1.2×10-4))/1.2×10-4=4.7×10-11
Pour résumer : Dans la première partie de cet exemple, nous avons constaté que le H2CO3 d’une solution à 0,033 M s’ionise légèrement et qu’à l’équilibre [H2CO3] = 0,033 M ; [H3O+] = 1,2 × 10-4 ; et [HCO3–] = 1,2×10-4 M. Dans la deuxième partie, nous avons déterminé que [CO32-] = 4,7×10-11 M.
Vérifiez votre apprentissage 5.4.1 – Ionisation d’un acide diprotique
La concentration de H2S dans une solution aqueuse saturée à température ambiante est d’environ 0,1 M. Calculez [H3O+], [HS–], et [S2-] dans la solution :
H2S (aq) + H2O (l) ⇌ H3O+ (aq) + HS– (aq) Ka1 = 8.9 x 10-8
HS– (aq) + H2O (l) ⇌ H3O+ (aq) + S2- (aq) Ka2 = 1.0 x 10-19
Réponse
[H2S] = 0.1 M; [H3O+] = [HS−] = 0.000094 M; [S2−] = 1 × 10−19 M ≈ 0 M
On note que la concentration de l’ion sulfure est la même que celle du Ka2. Cela est dû au fait que chaque ionisation ultérieure d’un acide polyprotique se produit à un degré moindre.
Acides triprotiques
Un acide triprotique est un acide qui possède trois protons ionisables qui subissent une ionisation progressive : L’acide phosphorique en est un exemple typique :
Première ionisation :
H3PO4 (aq) + H2O (l) → H3O+ (aq) + H2PO4– (aq) Ka1 = 7.5 x 10-3
Deuxième ionisation :
H2PO4– (aq) + H2O (l) → H3O+ (aq) + HPO42- (aq) Ka2 = 6.2 x 10-5
Troisième ionisation :
HPO42– (aq) + H2O (l) → H3O+ (aq) + PO43- (aq) Ka3 = 4.2 x 10-13
Comme pour les acides diprotiques, les différences dans les constantes d’ionisation de ces réactions nous indiquent qu’à chaque étape successive, le degré d’ionisation est significativement plus faible. C’est une caractéristique générale des acides polyprotiques et les constantes d’ionisation successives diffèrent souvent d’un facteur d’environ 105 à 106.
Cet ensemble de trois réactions d’ionisation peut sembler rendre compliqué le calcul des concentrations d’équilibre dans une solution de H3PO4. Cependant, comme les constantes d’ionisation successives diffèrent d’un facteur de 105 à 106, les calculs peuvent être décomposés en une série de parties similaires à celles des acides diprotiques.
Bases polyprotiques
Les bases polyprotiques peuvent accepter plus d’un ion hydrogène en solution. L’ion carbonate est un exemple de base diprotique, puisqu’il peut accepter jusqu’à deux protons. Les solutions de carbonates de métaux alcalins sont assez alcalines, en raison des réactions :
Première protonation :
H2O (l) + CO32- (aq) ⇌ HCO3– (aq) + OH– (aq) Kb1 = KW/Ka2 = 2.1 × 10-4
Deuxième protonation :
H2O (l) + HCO3– (aq) ⇌ H2CO3 (aq) + OH– (aq) Kb2 = KW/Ka1 = 2.2 × 10-8
Exemple 5.4.2 – Conversion entre Ka et Kb – Bases des acides polyprotiques
Étant donné la réaction d’équilibre chimique suivante, laquelle des expressions suivantes décrit correctement sa constante d’équilibre, K :
PO43- + H2O ⇌ OH- + HPO4-
(a) 1/Ka2
(b) Kw/Ka3
(c) 1/Ka3
(d) Kw/Ka2
Solution
Remarquez comment dans cette réaction, la principale espèce PO43- accepte un proton lorsqu’il réagit avec l’eau – cela signifie qu’il est la base de cette réaction et donc que K est plus spécifiquement Kb. Rappelons que, pour toute paire acide-base conjuguée, la relation entre Ka et Kb est : Kw = Ka × Kb. Nous pouvons déjà exclure les options (a) et (c) car elles n’incluent pas Kw dans l’expression de K.
La réaction indiquée commence avec un ion phosphate (qui est non protoné) qui est converti en son acide monoprotique conjugué HPO4–. La PO43- est sous sa forme la plus déprotonée (pas de protons), cette réaction est donc Kb1 – la première réaction dans laquelle la PO43- capte son tout premier proton. En gardant cela à l’esprit, nous pouvons dire que cette réaction correspond à Ka3. Comme nous travaillons avec l’HPO4– en tant qu’acide et le PO43- en tant que base conjuguée, cet équilibre peut être vu de deux façons : soit nous avons le PO43- en tant que base réagissant avec l’eau pour lui faire prendre son tout premier proton et devenir l’HPO43- (qui est Kb1), soit nous avons l’HPO43- en tant qu’acide réagissant avec l’eau pour perdre son dernier proton et devenir le PO43- (qui est Ka3). Nous pouvons voir que (b) et (d) ont tous deux l’expression correctement arrangée de sorte que Kw/Ka = Kb, cependant, seul (b) utilise Ka3 pour se convertir correctement en Kb1.
Par conséquent, la bonne réponse est (b).
Vérifiez votre apprentissage 5.4.2 – Conversion entre Ka et Kb – Bases des acides polyprotiques
Compte tenu des informations ci-dessous, donnez les équations chimiques équilibrées et calculez les constantes d’équilibre pour les 3 réactions de protonation successives de la base hypothétique, A3- (aq).
H3A (aq) + H2O (l) ⇌ H3O+ (aq) + H2A– (aq) Ka1 = 1.5 x 10-4
H2A– (aq) + H2O (l) ⇌ H3O+ (aq) + HA2– (aq) Ka2 = 2.7 x 10-9
HA2– (aq) + H2O (l) ⇌ H3O+ (aq) + A3– (aq) Ka3 = 8.8 x 10-12
Répondez
A3– (aq) + H2O (l) ⇌ OH– (aq) + HA2– (aq) Kb1 = KW/Ka3 = 1.1 x 10-3
HA2– (aq) + H2O (l) ⇌ OH– (aq) + H2A– (aq) Kb2 = KW/Ka2 = 3.7 x 10-6
H2A– (aq) + H2O (l) ⇌ OH– (aq) + H3A (aq) Kb3 = KW/Ka1 = 6.7 x 10-11
Questions
★ Questions
- Laquelle des concentrations suivantes serait pratiquement égale dans un calcul des concentrations d’équilibre dans une solution de H2CO3, un acide diprotique, à 0,134 M [H3O+], [OH−], [H2CO3], [HCO3−], [CO32−]? Aucun calcul n’est nécessaire pour répondre à cette question.
2. Calculer la concentration de chaque espèce présente dans une solution de H2S à 0,050 M.
3. Calculer la concentration de chaque espèce présente dans une solution 0,010-M d’acide phtalique,C6H4(CO2H)2.
C6H4(CO2H)2(aq)+H2O(l)↔H3O(aq)++C6H4(CO2H)(CO2)(aq)– Ka=1.1×10-3
C6H4(CO2H(CO2)(aq)-+H2O(l)↔H3O(aq)++C6H4(CO2)2(aq)2- Ka=3.9×10-6
★★ Questions
4. L’acide salicylique, HOC6H4CO2H, et ses dérivés sont utilisés depuis longtemps comme analgésiques. L’acide salicylique est présent en petites quantités dans les feuilles, l’écorce et les racines de certains végétaux (plus particulièrement, historiquement, dans l’écorce du saule). Les extraits de ces plantes sont utilisés comme médicaments depuis des siècles. L’acide a été isolé pour la première fois en laboratoire en 1838.
(a) Les deux groupes fonctionnels de l’acide salicylique s’ionisent dans l’eau, avec Ka = 1,0 × 10-3 pour le groupe -CO2H et 4,2 × 10-13 pour le groupe -OH. Quel est le pH d’une solution saturée de l’acide (solubilité = 1,8 g/L).
(b) L’aspirine a été découverte grâce aux efforts déployés pour produire un dérivé de l’acide salicylique qui ne serait pas irritant pour la paroi de l’estomac. L’aspirine est l’acide acétylsalicylique, CH3CO2C6H4CO2H. Le groupe fonctionnel -CO2H est toujours présent, mais son acidité est réduite, Ka = 3,0 × 10-4. Quel est le pH d’une solution d’aspirine à la même concentration qu’une solution saturée d’acide salicylique (voir partie a).
(c) Dans certaines conditions, l’aspirine réagit avec l’eau et forme une solution d’acide salicylique et d’acide acétique :
CH3CO2C6H4CO2H (aq) + H2O (l) ⇌ HOC6H4CO2H (aq) + CH3CO2H (aq)
(i) Lequel des acides, l’acide salicylique ou l’acide acétique, produit le plus d’ions hydronium dans une telle solution ?
(ii) Quelles sont les concentrations de molécules et d’ions dans une solution produite par l’hydrolyse de 0,50 g d’aspirine dissoute dans suffisamment d’eau pour donner 75 ml de solution ?
5. L’ion HTe– est une espèce amphiprotique ; il peut agir soit comme un acide, soit comme une base.
(a) Qu’est-ce que le Ka pour la réaction acide de la HTe– avec l’H2O ?
(b) Quelle est la valeur de Kb pour la réaction dans laquelle le HTe– fonctionne comme une base dans l’eau ?
(c) Démontrer si la seconde ionisation de H2Te peut ou non être négligée dans le calcul de [HTe–] dans une solution de H2Te à 0,10 M.
Réponses
- [H3O+] et [HCO3−] sont pratiquement égaux
2. [HS] = 7.1 x 10−5 M, [H3O+] = 7.1 x 10−5 M, [S−2] = 1.29 x 10−13 M, [H2S] = 0.0499 M
[C6H4(CO2)22-(aq)]=3.9×10-6 M, [OH-]=3.6×10-12 M
4 (a) pH = 2.44, (b) pH = 2.70,
(c) (i) acide salicylique (ii) La concentration d’aspirine et d’acide acétique est de 2,1 x 10-4 M
5 (a) Ka2=1.5×10-11
(b) Kb=4.3×10-12
(c) ([Te2-][H3O+(aq)])/[HTe–]=((x)(0.0141+x))/(0.0141-x)≈((x)(0.0141))/(0.0141)=1.5×10-11
La résolution de x donne 1.5×10-11 M. Par conséquent, par rapport à 0,014 M, cette valeur est négligeable (1.1×10-7%).
Acide contenant un atome d'hydrogène ionisable par molécule
Acide contenant deux atomes d'hydrogène ionisables par molécule
Acide qui contient trois atomes d'hydrogène ionisables par molécule
Procédé dans lequel un acide polyprotique est ionisé par la perte séquentielle de protons
Base capable d'accepter deux protons

 NOTE : Les
NOTE : Les