3.1 – Introduction à la thermochimie
Plus de 90 % de l’énergie que nous utilisons provient du soleil. Chaque jour, le soleil fournit à la terre près de 10 000 fois la quantité d’énergie nécessaire pour répondre à tous les besoins énergétiques de la planète pour cette journée. Notre défi consiste à trouver des moyens de convertir et de stocker l’énergie solaire entrante afin qu’elle puisse être utilisée dans des réactions ou des processus chimiques à la fois pratiques et non polluants. Les plantes et de nombreuses bactéries captent l’énergie solaire par photosynthèse. Nous libérons l’énergie stockée dans les plantes lorsque nous brûlons du bois ou des produits végétaux tels que l’éthanol. Nous utilisons également cette énergie pour alimenter notre corps en mangeant des aliments qui proviennent directement des plantes ou des animaux qui ont obtenu leur énergie en mangeant des plantes. La combustion du charbon et du pétrole libère également l’énergie solaire stockée : Ces combustibles sont des matières végétales et animales fossilisées.
Ce chapitre présente les idées de base d’un domaine scientifique important qui concerne la quantité de chaleur absorbée ou libérée lors de changements chimiques et physiques – un domaine appelé thermochimie. Les concepts présentés dans ce chapitre sont largement utilisés dans presque tous les domaines scientifiques et techniques. Les scientifiques de l’alimentation les utilisent pour déterminer le contenu énergétique des aliments. Les biologistes étudient l’énergie des organismes vivants, comme la combustion métabolique du sucre en dioxyde de carbone et en eau. Les industries du pétrole, du gaz et des transports, les fournisseurs d’énergie renouvelable et bien d’autres encore s’efforcent de trouver de meilleures méthodes pour produire de l’énergie pour nos besoins commerciaux et personnels. Les ingénieurs s’efforcent d’améliorer l’efficacité énergétique, de trouver de meilleurs moyens de chauffer et de refroidir nos maisons, de réfrigérer nos aliments et nos boissons, et de répondre aux besoins en énergie et en refroidissement des ordinateurs et des appareils électroniques, entre autres applications. La compréhension des principes thermochimiques est essentielle pour les chimistes, les physiciens, les biologistes, les géologues, tous les types d’ingénieurs et presque tous ceux qui étudient ou pratiquent une quelconque science.
Qu’est-ce que l’énergie ?
L’énergie peut être définie comme la capacité à produire de la chaleur ou à effectuer un travail. Un type de travail (W) est le processus qui consiste à faire bouger la matière contre une force opposée. Par exemple, nous effectuons un travail lorsque nous gonflons un pneu de vélo : nous déplaçons la matière (l’air de la pompe) contre la force opposée de l’air déjà présent dans le pneu.

Comme la matière, l’énergie se présente sous différentes formes. Un schéma classifie l’énergie en deux types : l'énergie potentielle, l’énergie qu’un objet possède en raison de sa position relative, de sa composition ou de son état, et l‘énergie cinétique, l’énergie qu’un objet possède en raison de son mouvement. L’eau au sommet d’une chute ou d’un barrage possède de l’énergie potentielle en raison de sa position ; lorsqu’elle coule vers le bas à travers des générateurs, elle possède de l’énergie cinétique qui peut être utilisée pour effectuer des travaux et produire de l’électricité dans une centrale hydroélectrique (figure 3.1. 1). Une batterie a de l’énergie potentielle parce que les produits chimiques qu’elle contient peuvent produire de l’électricité qui peut être utilisée pour des travaux.
Figure 3.1.1. (a) L’eau qui est plus élevée en altitude, par exemple au sommet des chutes du Niagara, a une énergie potentielle plus élevée que l’eau à une altitude plus basse. Lorsque l’eau tombe, une partie de son énergie potentielle est convertie en énergie cinétique. (b) Si l’eau passe par des générateurs au pied d’un barrage, comme les centrales hydroélectriques Sir Adam Beck à Niagara Falls, Ontario, montrées ici, son énergie cinétique est convertie en énergie électrique. (crédit a : Photo par Ivan Torres de Pexels ; crédit b : Le complexe Adam Beck de l’Ontario Power Generation a été modifié (recadré) et est utilisé sous une licence CC BY 2.0).
L’énergie peut être convertie d’une forme à une autre, mais toute l’énergie présente avant un changement existe toujours sous une forme quelconque après le changement. Cette observation est exprimée dans la loi de la conservation de l’énergie : lors d’un changement chimique ou physique, l’énergie ne peut être ni créée ni détruite, bien qu’elle puisse être modifiée dans sa forme. (C’est également une version de la première loi de la thermodynamique, comme vous l’apprendrez plus tard).
Lorsqu’une substance est convertie en une autre, il y a toujours une conversion associée d’une forme d’énergie en une autre. La chaleur est généralement libérée ou absorbée, mais parfois la conversion implique de la lumière, de l’énergie électrique ou une autre forme d’énergie. Par exemple, l’énergie chimique (un type d’énergie potentielle) est stockée dans les molécules de sucre comme le saccharose. Lorsque les molécules de sucre réagissent avec l’O2 à l’aide d’un agent réducteur (par exemple, le chlorate de potassium, KClO3), la réaction chimique entraîne la libération de l’énergie chimique stockée dans les liaisons moléculaires et sa conversion en d’autres formes d’énergie, notamment en chaleur (la combustion étant un processus exothermique) et en lumière (voir l’encadré “Combustion des oursons en gélatine“).
|
Combustion d’oursengélatine |
|
Regardez cette vidéo de démonstration expérimentale* où un ours en gélatine est brûlé en utilisant du chlorate de potassium fondu comme agent réducteur. Le chlorate de potassium est ajouté et chauffé jusqu’à ce qu’il soit fondu (observé à 1h07). Remarquez ce qui se passe lorsque l’ours en gélatine vert est ajouté au chlorate de potassium fondu vers 1h18. * [C pour Chimie]. (2010, 13 février). “Expérience de l’ours en guimauve” avec du chlorate de potassium fondu [fichier vidéo]. Consulté sur https://www.youtube.com/watch?v=7Xu2YZzufTM |
Selon la loi de conservation de la matière (voir un chapitre précédent), il n’y a pas de changement détectable de la quantité totale de matière lors d’une modification chimique. Lorsque des réactions chimiques se produisent, les changements d’énergie sont relativement modestes et les changements de masse sont trop faibles pour être mesurés, de sorte que les lois de conservation de la matière et de l’énergie tiennent bien la route. Cependant, dans les réactions nucléaires, les changements d’énergie sont beaucoup plus importants (par millions environ), les changements de masse sont mesurables et les conversions matière-énergie sont importantes. Afin d’englober à la fois les changements chimiques et nucléaires, nous combinons ces lois en une seule déclaration : La quantité totale de matière et d’énergie dans l’univers est fixe.
Unités d’énergie
Historiquement, l’énergie était mesurée en unités de calories (cal). Une calorie est la quantité d’énergie nécessaire pour faire augmenter la température d’un gramme d’eau de 1°C (1 kelvin). Cependant, cette quantité dépend de la pression atmosphérique et de la température de départ de l’eau. La facilité de mesure des changements énergétiques en calories a fait que la calorie est encore fréquemment utilisée. La calorie (avec un C majuscule), ou grande calorie/nutritionnelle, couramment utilisée pour quantifier le contenu énergétique des aliments, est une kilocalorie (1 kcal), ou 1000 cal (voir l’encadré “Mesurer les calories nutritionnelles si vous êtes intéressé). L’unité SI de chaleur, de travail et d’énergie est le joule. Un joule (J) est défini comme la quantité d’énergie utilisée lorsqu’une force de 1 newton déplace un objet d’un mètre. Il est nommé en l’honneur du physicien anglais James Prescott Joule. Un joule équivaut à 1 kg m2/s2, ce qui est également appelé 1 newton-mètre. Un kilojoule (kJ) équivaut à 1000 joules. Pour uniformiser sa définition, 1 calorie a été fixée à 4,184 joules.
1 calorie = 4,184 J
Une grande partie des problèmes que vous traiterez dans cette unité exprimeront l’énergie en joules, cependant, il est très important de se rappeler comment convertir entre joules et calories. Malgré la prédominance du joule dans le temps comme unité SI officielle pour l’énergie, l’unité calorique est encore largement utilisée dans le secteur industriel aujourd’hui et de nombreuses données tabulaires pour les composés expriment encore des valeurs en termes de calories. Soyez donc conscient des unités d’énergie avec lesquelles vous travaillez et ayez la possibilité d’effectuer des conversions d’unités lorsque cela est nécessaire.
|
Mesure des calories nutritionnelles |
|
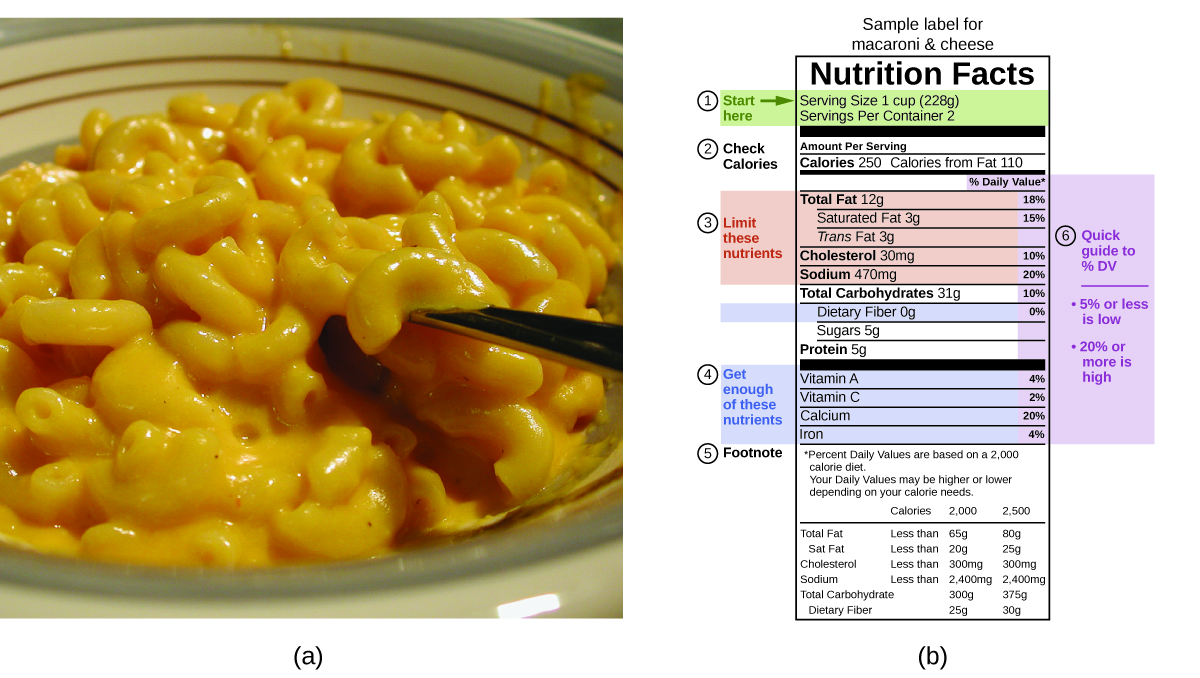
Dans votre vie quotidienne, vous êtes peut-être plus familier avec l’énergie donnée en Calories, ou calories nutritionnelles, qui servent à quantifier la quantité d’énergie contenue dans les aliments. Une calorie (cal) = exactement 4,184 joules, et une calorie (notez la majuscule) = 1 000 cal, ou 1 kcal. (C’est approximativement la quantité d’énergie nécessaire pour chauffer 1 kg d’eau à 1°C). Les macronutriments présents dans les aliments sont les protéines, les glucides et les graisses ou huiles. Les protéines fournissent environ 4 calories par gramme, les hydrates de carbone fournissent également environ 4 calories par gramme, et les graisses et les huiles fournissent environ 9 calories/g. Les étiquettes nutritionnelles sur les emballages des aliments indiquent la teneur en calories d’une portion de l’aliment, ainsi que la répartition en calories de chacun des trois macronutriments (figure 3.1. 2). Figure 3.1.2 (a) Le macaroni au fromage contient de l’énergie sous forme de macronutriments dans les aliments. (b) Les informations nutritionnelles de l’aliment sont indiquées sur l’étiquette de l’emballage. Au Canada (et aux États-Unis), le contenu énergétique est indiqué en Calories ; le reste du monde utilise généralement des kilojoules. (crédit a : modification du travail par “Rex Roof”/Flickr) Dans l’exemple présenté au point b), l’énergie totale par portion de 228 g est calculée par : (5 g de protéines × 4 Calories/g) + (31 g de glucides × 4 Calories/g) + (12 g de lipides × 9 Calories/g) = 252 Calories Ainsi, vous pouvez utiliser les étiquettes des aliments pour compter vos calories. Mais d’où viennent ces valeurs ? Et quelle est leur précision ? Le contenu calorique des aliments peut être déterminé en utilisant la calorimétrie à la bombe, c’est-à-dire en brûlant les aliments et en mesurant l’énergie qu’ils contiennent. Un échantillon d’aliment est pesé, mélangé dans un mixeur, lyophilisé, réduit en poudre et comprimé en un pellet. Le pellet est brûlé dans un calorimètre à bombe, et le changement de température mesuré est converti en énergie par gramme de nourriture (la calorimétrie à bombe est traitée de manière beaucoup plus détaillée dans la section “Calorimétrie”). Aujourd’hui, le contenu calorique sur les étiquettes des aliments est calculé selon une méthode appelée système Atwater qui utilise le contenu calorique moyen des différents composants chimiques des aliments, à savoir les protéines, les glucides et les graisses. Les quantités moyennes sont celles indiquées dans l’équation et sont dérivées des différents résultats donnés par la calorimétrie à la bombe des aliments entiers. La quantité de glucides est déduite d’une certaine quantité pour la teneur en fibres, qui est un glucide non-digérable. Pour déterminer le contenu énergétique des aliments, les quantités de glucides, de protéines et de lipides sont multipliées par la moyenne des calories par gramme pour chacun des produits et additionnées pour obtenir l’énergie totale. |
L’énergie dans l’univers
Avant de pouvoir commencer à étudier et à comprendre le flux d’énergie dans le contexte d’une réaction chimique, nous devons faire la distinction entre un système, la petite partie bien définie de l’univers qui nous intéresse (comme une réaction chimique), et son environnement, qui est l’environnement immédiat (comme la cuve de réaction, la paillasse, etc.). L’univers est défini comme étant tout, à la fois l’environnement et le système (figure 3.1.3). Dans la discussion qui suit, le mélange de substances chimiques qui subit une réaction est toujours le système, et le flux de chaleur peut aller du système vers l’environnement ou inversement.
Figure 3.1.3. Le système est la partie de l’univers que nous souhaitons étudier, comme une réaction chimique à l’intérieur d’un flacon. L’environnement est le reste de l’univers, y compris le récipient dans lequel la réaction a lieu.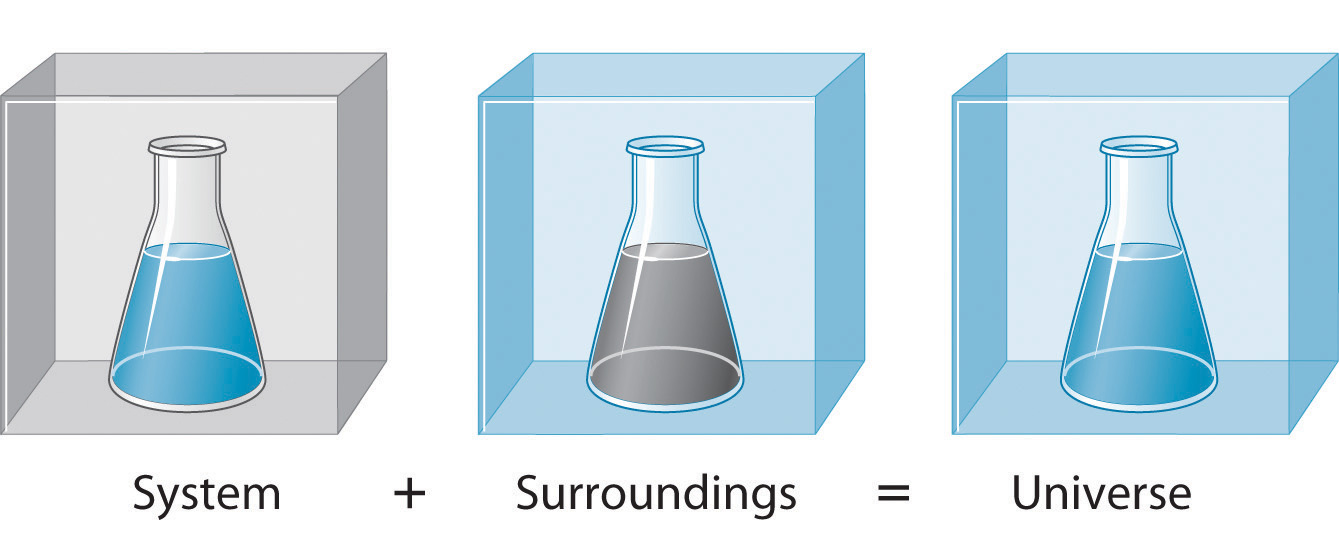
Trois types de systèmes sont importants en chimie. Un système ouvert peut échanger à la fois de la matière et de l’énergie avec son environnement. Une casserole d’eau bouillante est un système ouvert car un brûleur fournit de l’énergie sous forme de chaleur, et la matière sous forme de vapeur d’eau est perdue lorsque l’eau bout. Un système fermé peut échanger de l’énergie mais pas de la matière avec son environnement. Le sachet scellé d’un plat cuisiné que l’on fait tomber dans une casserole d’eau bouillante est un système fermé car l’énergie thermique est transférée au système à partir de l’eau bouillante mais aucune matière n’est échangée (sauf si le sachet fuit, auquel cas il ne s’agit plus d’un système fermé). Un système isolé n’échange ni énergie ni matière avec l’environnement. L’énergie est toujours échangée entre un système et son environnement, bien que ce processus puisse se dérouler très lentement. Un système véritablement isolé n’existe pas réellement. Un thermos isolé contenant du café chaud ressemble à un système isolé, mais le café finit par se refroidir à mesure que la chaleur est transférée à l’environnement. Dans tous les cas, la quantité de chaleur perdue par un système est égale à la quantité de chaleur gagnée par son environnement et vice versa. En d’autres termes, comme nous l’avons dit précédemment dans notre introduction à l’énergie : l’énergie totale d’un système plus son environnement (c’est-à-dire l’univers) est constante/fixe, ce qui doit être vrai si l’énergie est conservée.
Questions
★ Questions
- Le berceau de Newton, une décoration de bureau qui consiste en 5 sphères métalliques suspendues à des fils qui peuvent se balancer librement les uns dans les autres, démontre la conservation de l’énergie en montrant que l’énergie peut être transférée à travers chaque sphère pour en faire bouger une à plusieurs centimètres de distance. Ce phénomène devrait pouvoir se répéter à l’infini, mais il finit par s’arrêter. Est-ce une violation de la loi sur la conservation de l’énergie ? Si non, où l’énergie est-elle allée?
- L’idée des machines à mouvement perpétuel (machines théoriques qui continuent à fonctionner pour toujours en recyclant toute leur énergie) fascine les humains depuis des siècles. Pourquoi cela n’est-il pas possible en pratique?
- Une tasse de fraises contient 53 Cal (calories nutritionnelles). Combien d’énergie cela représente-t-il en Joules?
- Vous venez de faire cuire un gâteau dans votre four. Identifiez le système, l’environnement et l’univers.
Réponses
- Cela n’enfreint pas la loi sur la conservation de l’énergie, car l’énergie est transférée à différents types d’appareils plutôt que de rester sous la forme dont le système a strictement besoin. Dans ce cas, elle peut se transformer en énergie sonore, thermique, etc. Cela l’empêche de se perpétuer.
- La machine à mouvement perpétuel est un cas similaire à la question 1. Il est impossible d’isoler un système pour s’assurer que le transfert d’énergie reste ce qu’il est censé être. La machine finira par s’arrêter car elle implique la transformation d’énergies en d’autres qui ne sont pas nécessaires à ce système, comme le son, l’énergie thermique, etc.
- 1.3 × 104 J
- Système = gâteau, environnement = four, univers = gâteau et four
Étude de la mesure de la quantité de chaleur absorbée ou libérée lors d'une réaction chimique ou d'un changement physique
Capacité à fournir de la chaleur ou à effectuer des travaux
Transfert d'énergie dû à des modifications de variables externes et macroscopiques telles que la pression et le volume, ou à la mise en mouvement de la matière contre une force opposée
Énergie d'une particule ou d'un système de particules dérivée de la position relative, de la composition ou de l'état
Énergie d'un corps en mouvement, en joules, égale à mv2 (où m = masse et v = vitesse)
Unité de chaleur ou autre énergie ; la quantité d'énergie nécessaire pour élever 1 gramme d'eau de 1 degré Celsius ; 1 cal est défini comme
Unité SI d'énergie ; 1 J = 1 kg m2 s-2 et 4,184 J = 1 cal
Partie de la matière subissant un changement chimique ou physique qui est étudiée
Toute question autre que le système étudié
Système qui échange à la fois de la matière et de l'énergie avec son environnement
Système qui peut échanger de l'énergie mais qui n'a pas d'importance avec son environnement
Système qui n'échange ni énergie ni matière avec l'environnement