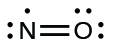9.4 – Représenter des molécules et des ions avec des structures de Lewis
Jusqu’à présent dans ce chapitre, nous avons discuté des différents types de liaisons qui se forment entre les atomes et/ou les ions. Dans tous les cas, ces liaisons impliquent le partage ou le transfert d’électrons de la couche de valence entre les atomes. Dans cette section, nous allons explorer la méthode typique de représentation des liaisons et des structures chimiques, à savoir les structures de Lewis pour les composés ioniques et les structures de Lewis pour les composés moléculaires.
Structures de Lewis – Composés ioniques
Rappelez-vous que les structures de Lewis peuvent être utilisés pour illustrer la formation de cations à partir d’atomes, comme indiqué ici pour le sodium et le calcium :

De même, ils peuvent être utilisés pour montrer la formation d’anions à partir d’atomes, comme ici pour le chlore et le soufre :

La Figure 9.4.1 montre l’utilisation des structures de Lewis pour illustrer le transfert d’électrons lors de la formation de composés ioniques.
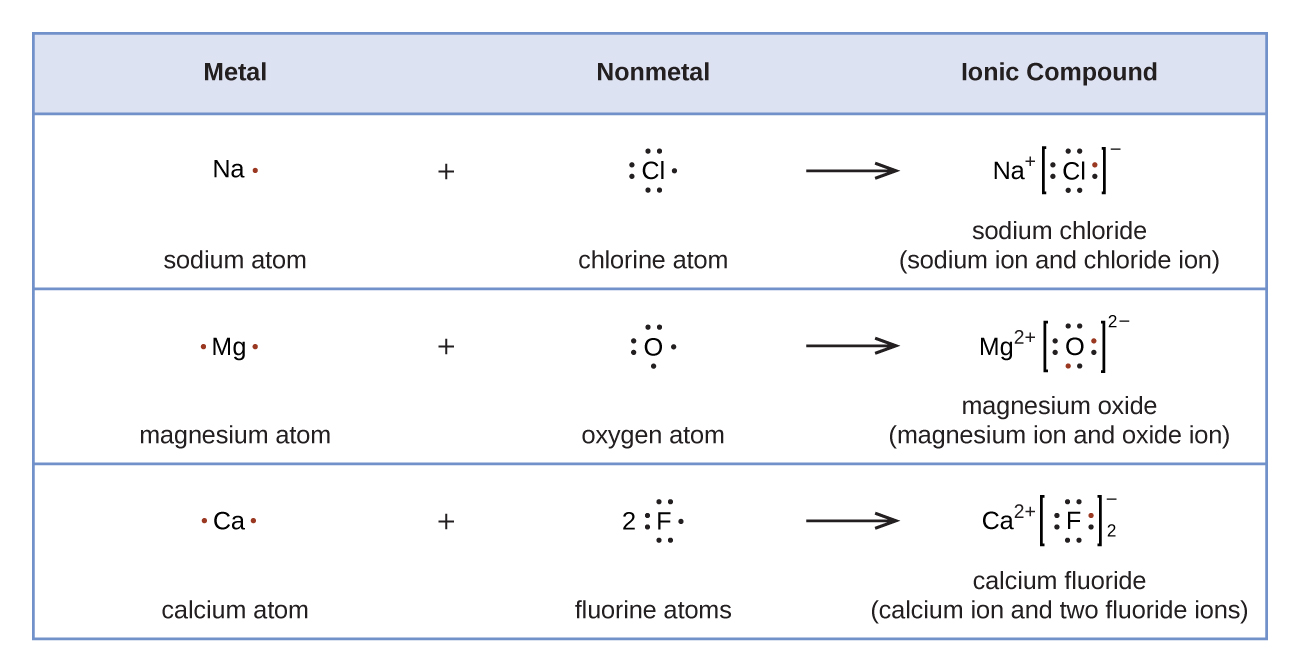
Figure 9.4.1. Les cations se forment lorsque les atomes perdent des électrons, représentés par des points de Lewis moins nombreux, tandis que les anions se forment lorsque les atomes gagnent des électrons. Le nombre total d’électrons ne change pas.
Structures de Lewis – Composés moléculaires
Nous utilisons également les structures de Lewis pour indiquer la formation de liaisons covalentes, qui sont représentées dans les structures de Lewis, des dessins qui décrivent les liaisons dans les molécules et les ions polyatomiques. Par exemple, lorsque deux atomes de chlore forment une molécule de chlore, ils partagent une paire d’électrons :
La structure de Lewis indique que chaque atome de Cl possède trois paires d’électrons qui ne sont pas utilisées dans la liaison (appelées paires solitaires) et une paire d’électrons partagée (écrite entre les atomes). Un tiret (ou un trait) est parfois utilisé pour indiquer une paire d’électrons partagée :
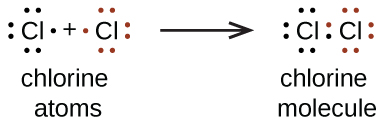

Une seule paire d’électrons partagée est appelée une liaison simple. Chaque atome de Cl interagit avec huit électrons de valence: les six dans les paires solitaires et les deux dans la liaison simple.
La règle de l’octet
Les autres molécules halogènes (F2, Br2, I2 et At2) forment des liaisons comme celles de la molécule de chlore: une liaison simple entre les atomes et trois paires d’électrons solitaires par atome. Cela permet à chaque atome d’halogène d’avoir une configuration électronique de gaz noble. La tendance des atomes du groupe principal à former suffisamment de liaisons pour obtenir huit électrons de valence est connue sous le nom de règle de l'octet.
Le nombre de liaisons qu’un atome peut former peut souvent être prédit à partir du nombre d’électrons nécessaires pour atteindre un octet (huit électrons de valence); cela est particulièrement vrai pour les non-métaux de la deuxième période du tableau périodique (C, N, O et F). Par exemple, chaque atome d’un élément du groupe 14 possède quatre électrons dans sa couche la plus externe et a donc besoin de quatre électrons supplémentaires pour atteindre un octet. Ces quatre électrons peuvent être obtenus en formant quatre liaisons covalentes, comme illustré ci-dessous pour le carbone dans le CCl4 (tétrachlorure de carbone) et le silicium dans le SiH4 (silane). Comme l’hydrogène n’a besoin que de deux électrons pour remplir sa couche de valence, il constitue une exception à la règle de l’octet. Les éléments de transition, les lanthanides et les actinides ne suivent pas non plus la règle de l’octet.
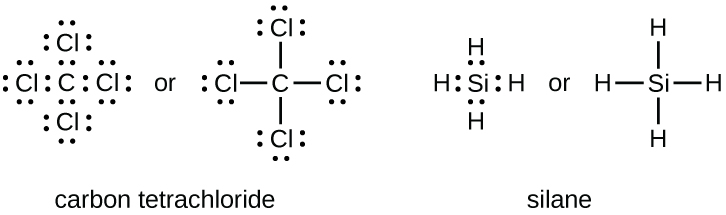
Les éléments du groupe 15, comme l’azote, possèdent cinq électrons de valence dans la structure atomique de Lewis: une paire solitaire et trois électrons non-liés. Pour obtenir un octet, ces atomes forment trois liaisons covalentes, comme dans NH3 (ammoniac). L’oxygène et les autres atomes du groupe 16 obtiennent un octet en formant deux liaisons covalentes:
Liaisons doubles et triples 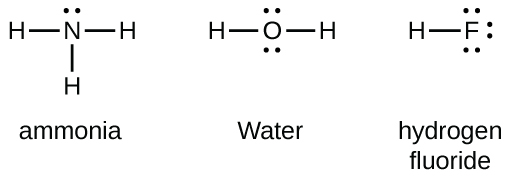
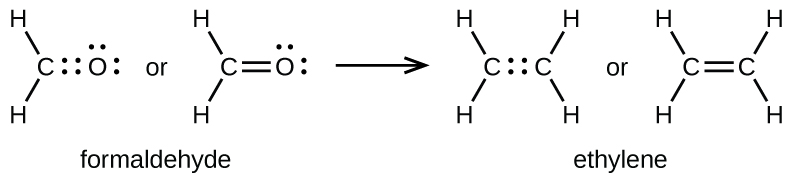
Comme indiqué précédemment, lorsqu’une paire d’atomes partage une paire d’électrons, on parle de liaison simple. Cependant, une paire d’atomes peut avoir besoin de partager plus d’une paire d’électrons afin d’obtenir l’octet requis. Une double liaison se forme lorsque deux paires d’électrons sont partagées entre une paire d’atomes, comme entre les atomes de carbone et d’oxygène dans CH2O (formaldéhyde) et entre les deux atomes de carbone dans C2H4 (éthylène):
Une triple liaison se forme lorsque trois paires d’électrons sont partagées par une paire d’atomes, comme dans le monoxyde de carbone (CO) et l’ion cyanure (CN–):
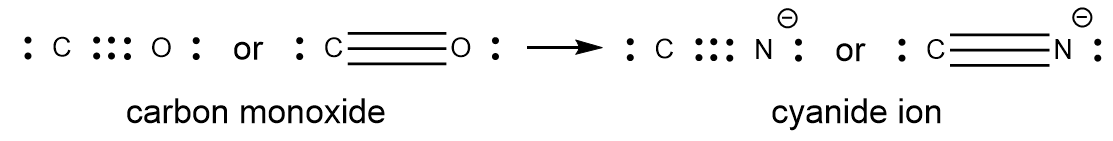
Dans le modèle de liaison de Lewis, nous décrivons fréquemment le nombre de paires d’électrons qui maintiennent deux atomes ensemble comme l’ordre de liaison. Pour une liaison simple, telle que la liaison C-C dans H3C-CH3, l’ordre de la liaison est de un. Pour une liaison double (telle que H2C=CH2), l’ordre des liaisons est de deux. Pour une liaison triple, telle que HC≡CH, l’ordre des liaisons est de trois. Des ordres de liaison fractionnaires sont également possibles, ce que nous verrons plus tard dans notre discussion sur les structures de résonance.
Écrire des structures de Lewis avec la règle de l’octet
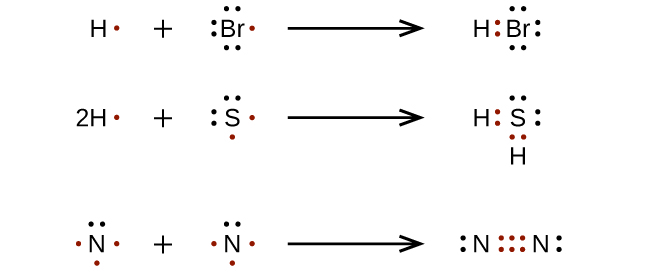
Pour les molécules et les ions moléculaires très simples, nous pouvons écrire les structures de Lewis en associant simplement les électrons non-liés sur les atomes constitutifs. Voir ces exemples:
Pour les molécules et les ions moléculaires plus complexes, il est utile de suivre la procédure pas à pas décrite ici:
Déterminez le nombre total d’électrons de valence (couche extérieure). Pour les cations, soustrayez un électron pour chaque charge positive. Pour les anions, ajoutez un électron pour chaque charge négative.
Dessinez une structure squelette de la molécule ou de l’ion, en disposant les atomes autour d’un atome central. (En général, l’élément le moins électronégatif doit être placé au centre). Reliez chaque atome à l’atome central par une liaison simple (une paire d’électrons).
Distribuez les électrons restants comme paires solitaires sur les atomes terminaux (sauf l’hydrogène), en complétant un octet autour de chaque atome.
Placez tous les électrons restants sur l’atome central.
Réorganisez les électrons des atomes extérieurs pour qu’ils établissent des liaisons multiples avec l’atome central afin d’obtenir des octets où possible.
Déterminons les structures de Lewis de SiH4, CHO2–, NO+, et OF2 comme exemples en suivant cette procédure :
1. Déterminez le nombre total d’électrons de valence (couche extérieure) dans la molécule ou l’ion.
Pour une molécule, nous ajoutons le nombre d’électrons de valence sur chaque atome de la molécule :
SiH4
Si: 4 électrons de valence/atome x 1 atome = 4
+ H: 1 électron de valence/atome x 4 atomes = 4
= 8 électrons de valence
Pour un ion négatif, tel que CHO2–, on ajoute le nombre d’électrons de valence sur les atomes au nombre de charges négatives sur l’ion (un électron est gagné pour chaque charge négative):
CHO2–
C: 4 électrons de valence/atome x 1 atome = 4
H: 1 électron de valence/atome x 1 atome = 1
O: 6 électrons de valence/atome x 2 atomes = 12
+1 électron supplémentaire = 1
= 18 électrons de valence
Pour un ion positif, tel que NO+, on additionne le nombre d’électrons de valence sur les atomes de l’ion, puis on soustrait le nombre de charges positives sur l’ion (un électron est perdu pour chaque charge positive) du nombre total d’électrons de valence:
NO+
N: 5 électrons de valence/atome x 1 atome = 5
O: 6 électrons de valence/atome x 1 atomes = 6
+-1 électron (charge positive) = -1
= 10 électrons de valence
Comme OF2 est une molécule neutre, nous ajoutons simplement le nombre d’électrons de valence :
OF2
O: 6 électrons de valence/atome x 1 atome = 6
+F: 7 électrons de valence/atome x 2 atomes = 14
= 20 électrons de valence
2. Dessinez une structure squelette de la molécule ou de l’ion, en disposant les atomes autour d’un atome central et en reliant chaque atome à l’atome central par une liaison simple (une paire d’électrons). (Notez que nous désignons les ions par des parenthèses autour de la structure, indiquant la charge à l’extérieur des parenthèses):
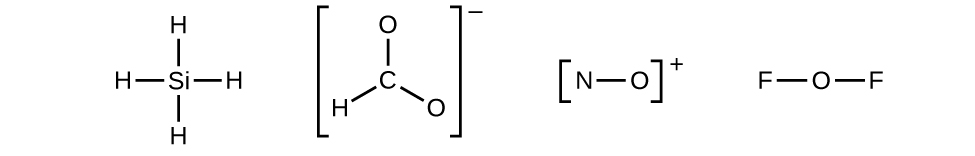
Lorsque plusieurs arrangements d’atomes sont possibles, comme pour CHO2–, nous devons utiliser des preuves expérimentales pour en choisir le bon. En général, les éléments les moins électronégatifs ont plus de chances d’être des atomes centraux. Dans CHO2–, l’atome de carbone le moins électronégatif occupe la position centrale avec les atomes d’oxygène et d’hydrogène qui l’entourent. D’autres exemples incluent P dans POCl3, S dans SO2, et Cl dans ClO4–. Une exception: l’hydrogène n’est jamais un atome central. En tant qu’élément le plus électronégatif, le fluor ne peut pas non plus être un atome central.
3. Distribuez les électrons restants sous forme de paires solitaires sur les atomes terminaux (sauf l’hydrogène) pour compléter leurs couches de valence avec un octet d’électrons.
Il n’y a plus d’électrons sur le SiH4, il est donc inchangé :
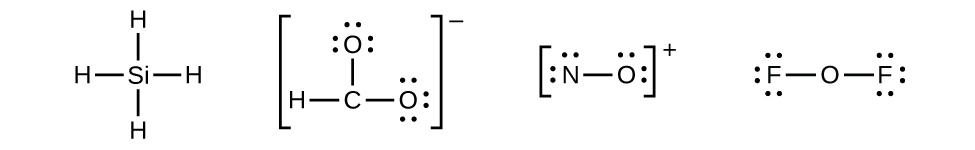
4. Placez tous les électrons restants sur l’atome central.
Pour SiH4, CHO2–, et NO+, il n’y a pas d’électrons restants; nous avons déjà placé tous les électrons déterminés à l’Étape 1.
Pour OF2, il nous restait 16 électrons à l’Étape 3, et nous en avons placé 12, ce qui en laisse 4 à placer sur l’atome central :
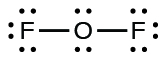
5. Réorganisez les électrons des atomes extérieurs pour qu’ils établissent des liaisons multiples avec l’atome central afin d’obtenir des octets à chaque fois possible.
SiH4: Si a déjà un octet, donc rien à faire.
CHO2–: Nous avons distribué les électrons de valence comme paires solitaires sur les atomes d’oxygène, mais l’atome de carbone n’a pas d’octet:
NO+: Pour cet ion, nous avons ajouté huit électrons de valence, mais aucun des deux atomes n’a d’octet. Nous ne pouvons pas ajouter d’autres électrons puisque nous avons déjà utilisé le total que nous avons trouvé à l’Étape 1. Nous devons donc déplacer les électrons pour former une liaison multiple :
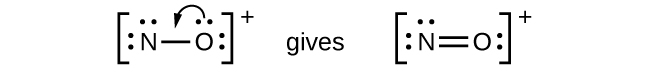
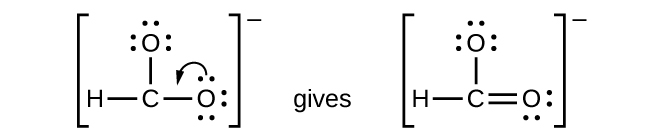
Cela ne produit toujours pas d’octet, nous devons donc déplacer une autre paire, formant ainsi une triple liaison :
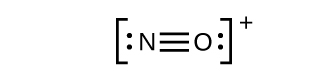
Dans OF2, chaque atome a un octet comme dessiné, donc rien ne change.
Exemple 9.4.1 – Rédaction des structures de Lewis – 1
La mission Cassini-Huygens de la NASA a détecté un important nuage de cyanure d’hydrogène (HCN) toxique sur Titan, l’une des lunes de Saturne. Titan contient également de l’éthane (H3CCH3), de l’acétylène (HCCH) et de l’ammoniac (NH3). Quelles sont les structures de Lewis de ces molécules?
Solution
1. Calculez le nombre d’électrons de valence.
HCN: (1 × 1) + (4 × 1) + (5 × 1) = 10
H3CCH3: (1 × 3) + (2 × 4) + (1 × 3) = 14
HCCH: (1 × 1) + (2 × 4) + (1 × 1) = 10
NH3: (5 × 1) + (3 × 1) = 8
2. Dessinez un squelette et reliez les atomes par des liaisons simples. Rappelez-vous que H n’est jamais un atome central:
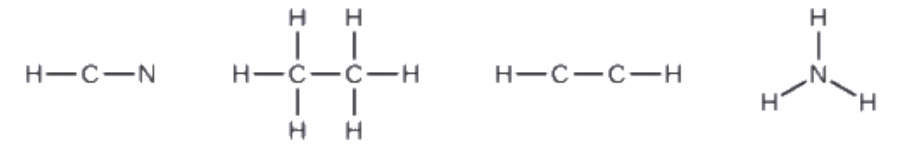
3. Si nécessaire, distribuez des électrons aux atomes terminaux: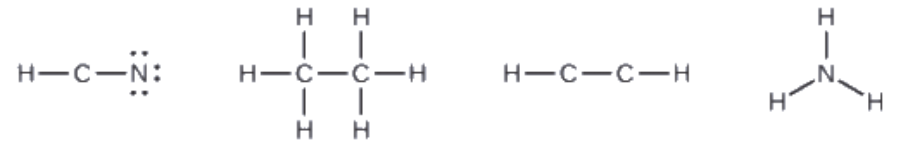
HCN: six électrons placés sur N
H3CCH3: il ne reste plus d’électrons
HCCH: aucun atome terminal capable d’accepter des électrons.
NH3: aucun atome terminal capable d’accepter des électrons
4. Si nécessaire, placez les électrons restants sur l’atome central: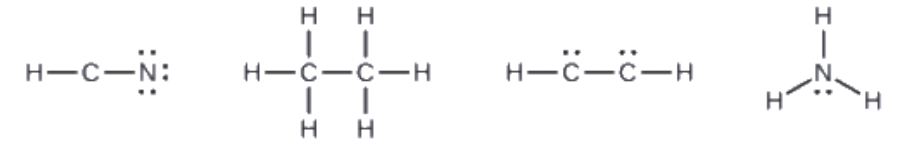
HCN : il ne reste plus d’électrons
H3CCH3: il ne reste plus d’électrons
HCCH: quatre électrons placés sur le carbone
NH3: deux électrons placés sur l’azote
5. Si nécessaire, réarrangez les électrons pour former des liaisons multiples afin d’obtenir un octet sur chaque atome:
HCN: forme deux liaisons C-N supplémentaires
H3CCH3: tous les atomes ont le nombre correct d’électrons
HCCH: forment une triple liaison entre les deux atomes de carbone.
NH3: tous les atomes ont le nombre correct d’électrons
Vérifiez votre apprentissage 9.4.1 – Rédaction des structures de Lewis – 1
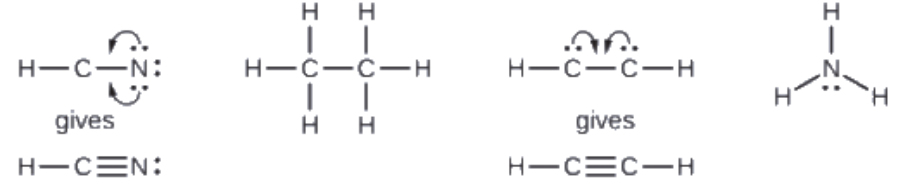
Le monoxyde de carbone, CO, et le dioxyde de carbone, CO2, sont tous deux des produits de la combustion de combustibles fossiles. Ces deux gaz posent également des problèmes: Le CO est toxique et le CO2 a été impliqué dans le changement climatique mondial. Quelles sont les structures de Lewis de ces deux molécules?
Réponse
![]()
Exemple 9.4.2 – Rédaction des structures de Lewis – 2
Dessiner la structure électronique de Lewis pour chaque espèce.
(a) NCl3
(b) S22−
(c) NOCl
Solution
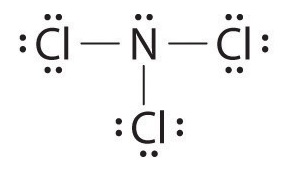
(a) L’azote est moins électronégatif que le chlore, et les atomes d’halogène sont généralement terminaux, donc l’azote est l’atome central. L’atome d’azote (groupe 15) a 5 électrons de valence et chaque atome de chlore (groupe 17) a 7 électrons de valence, soit un total de 26 électrons de valence. En utilisant 2 électrons pour chaque liaison N-Cl et en ajoutant trois paires solitaires à chaque Cl, on obtient (3 × 2) + (3 × 2 × 3) = 24 électrons. Nous plaçons ensuite les 2 électrons restants sur le N central:
(b) Dans une molécule ou un ion diatomique, nous n’avons pas à nous soucier d’un atome central. Chaque atome de soufre (groupe 16) contient 6 électrons de valence, et nous devons ajouter 2 électrons pour la charge -2, ce qui donne un total de 14 électrons de valence. En utilisant 2 électrons pour la liaison S-S, nous disposons les 12 électrons restants sous forme de trois paires solitaires sur chaque atome de soufre, ce qui donne à chaque atome S un octet d’électrons:
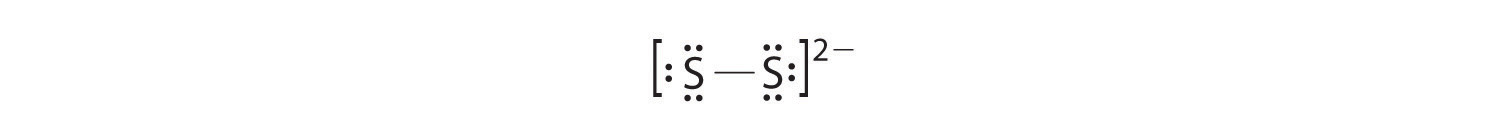
(c) Comme l’azote est moins électronégatif que l’oxygène ou le chlore, il est l’atome central. L’atome N (groupe 15) a 5 électrons de valence, l’atome O (groupe 16) a 6 électrons de valence et l’atome Cl (groupe 17) a 7 électrons de valence, ce qui donne un total de 18 électrons de valence. En plaçant une paire d’électrons de liaison entre chaque paire d’atomes liés, on utilise 4 électrons et on obtient ce qui suit:
O – N – Cl
L’ajout de trois paires solitaires à l’oxygène et au chlore utilise 12 électrons supplémentaires, ce qui laisse 2 électrons à placer comme paire solitaire sur l’azote:
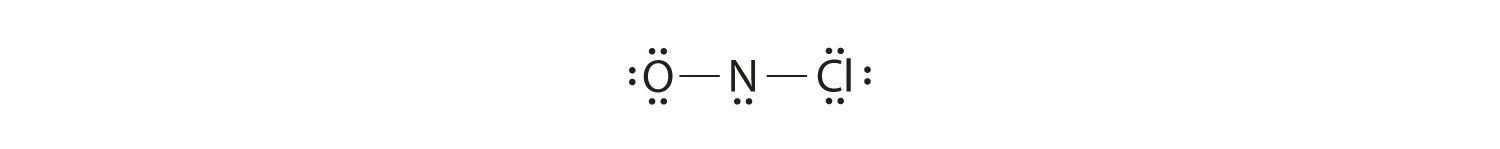
Comme cette structure de Lewis ne comporte que 6 électrons autour de l’azote central, une paire d’électrons solitaires sur un atome terminal doit être utilisée pour former une paire liante. Nous pouvons utiliser une paire d’électrons solitaires sur O ou Cl. Comme nous avons vu de nombreuses structures dans lesquelles O forme une double liaison mais aucune avec une double liaison à Cl, il est raisonnable de choisir une paire solitaire sur O pour donner ce qui suit:
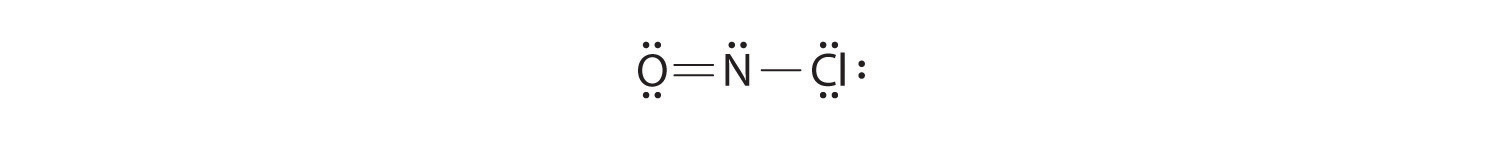
Tous les atomes ont maintenant une configuration octet.
Vérifiez votre apprentissage 9.4.2 – Rédaction des structures de Lewis – 2
Dessiner les structures électroniques de Lewis pour le CO2 et le SCl2, un liquide rouge instable à l’odeur désagréable, utilisé dans la fabrication du caoutchouc.
Réponse
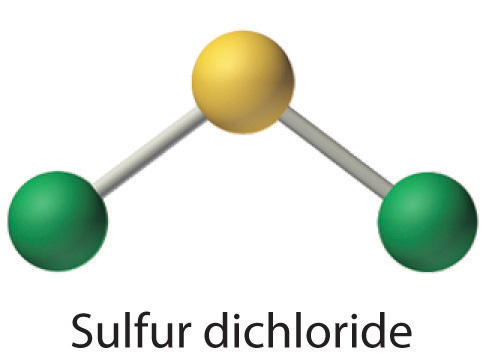
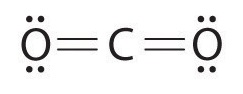
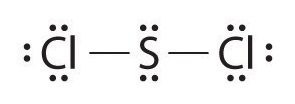

Exceptions à la règle de l’octet
De nombreuses molécules covalentes ont des atomes centraux qui ne possèdent pas huit électrons dans leurs structures de Lewis. Ces molécules se répartissent en trois catégories:
Les molécules à électrons impairs ont un nombre impair d’électrons de valence, et ont donc un électron non-lié.
Les molécules déficientes en électrons ont un atome central qui possède moins d’électrons que nécessaire pour une configuration de gaz noble.
Les molécules hypervalentes ont un atome central qui possède plus d’électrons que nécessaire pour une configuration de gaz noble.
Molécules à électrons impairs
On appelle les molécules qui contiennent un nombre impair d’électrons des radicaux libres. Le monoxyde d’azote, NO, est un exemple de molécule à électrons impairs. Cette espèce est notamment produite dans les moteurs à combustion interne lorsque l’oxygène et l’azote réagissent à haute température.
Pour dessiner la structure de Lewis d’une molécule à électrons impairs comme le NO, nous suivons les cinq mêmes étapes que pour les autres molécules, mais avec quelques changements mineurs:
1.Déterminez le nombre total d’électrons de valence (couche extérieure). La somme des électrons de valence est de 5 (de N) + 6 (de O) = 11. Le nombre impair nous indique immédiatement que nous avons un radical libre. Nous savons donc que tous les atomes ne peuvent pas avoir huit électrons dans leur couche de valence.
2.Dessinez un squelette de la molécule. Nous pouvons facilement dessiner un squelette avec une liaison simple N-O:
N-O
3.Distribuer les électrons restants sous forme de paires solitaires sur les atomes terminaux. Dans ce cas, il n’y a pas d’atome central, donc nous distribuons les électrons autour des deux atomes. Dans ces situations, nous donnons huit électrons à l’atome le plus électronégatif; l’oxygène a donc une couche de valence remplie:
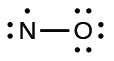
4.Placez tous les électrons restants sur l’atome central. Comme il n’y a pas d’électrons restants, cette étape ne s’applique pas.
5.Réorganisez les électrons pour qu’ils établissent des liaisons multiples avec l’atome central afin d’obtenir des octets partout où cela est possible. Nous savons qu’une molécule à électrons impairs ne peut pas avoir un octet pour chaque atome, mais nous voulons que chaque atome soit aussi proche d’un octet que possible. Dans ce cas, l’azote n’a que cinq électrons autour de lui. Pour se rapprocher d’un octet pour l’azote, nous prenons une des paires solitaires de l’oxygène et l’utilisons pour former une double liaison NO. (Nous ne pouvons pas prendre une autre paire d’électrons solitaires de l’oxygène et former une triple liaison car l’azote aurait alors neuf électrons)
Molécules déficientes en électrons
Nous rencontrerons également quelques molécules contenant des atomes centraux qui n’ont pas une couche de valence remplie. Il s’agit généralement de molécules dont les atomes centraux appartiennent aux groupes 2 et 13, dont les atomes extérieurs sont des atomes d’hydrogène ou d’autres atomes qui ne forment pas de liaisons multiples. Par exemple, dans les structures de Lewis du dihydrure de béryllium, BeH2, et du trifluorure de bore, BF3, les atomes de béryllium et de bore ne possèdent chacun que quatre et six électrons, respectivement. Il est possible de dessiner une structure comportant une double liaison entre un atome de bore et un atome de fluor dans le BF3, ce qui satisfait à la règle de l’octet, mais les données expérimentales indiquent que la longueur des liaisons est plus proche de celle attendue pour les liaisons simples B-F. Cela suggère que la meilleure structure de Lewis comporte trois atomes de bore et un atome de fluor. Cela suggère que la meilleure structure de Lewis comporte trois liaisons simples B-F et un atome de bore déficient en électrons. La réactivité du composé est également cohérente avec un bore déficient en électrons. Cependant, les liaisons B-F sont légèrement plus courtes que ce qui est attendu pour des liaisons simples B-F, ce qui indique qu’une certaine double liaison est présente dans la molécule réelle.
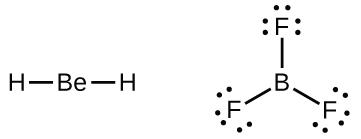
Un atome comme l’atome de bore dans BF3, qui ne possède pas huit électrons, est très réactif. Il se combine facilement avec une molécule contenant un atome avec une paire d’électrons solitaires. Par exemple, NH3 réagit avec BF3 parce que la paire d’électrons solitaires de l’azote peut être partagée avec l’atome de bore:
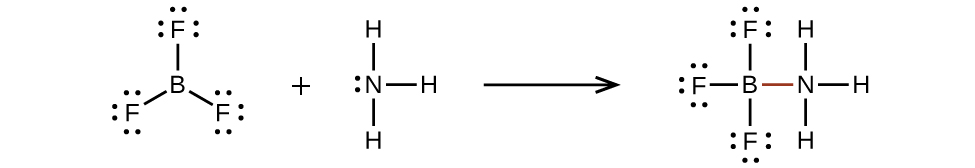
Molécules hypervalentes
Les éléments de la deuxième période du tableau périodique (n = 2) ne peuvent accueillir que huit électrons dans les orbitales de leur couche de valence car ils ne possèdent que quatre orbitales de valence (une orbitale 2s et trois orbitales 2p). Les éléments de la troisième période et des périodes supérieures (n ≥ 3) possèdent plus de quatre orbitales de valence et peuvent partager plus de quatre paires d’électrons avec d’autres atomes car ils possèdent des orbitales d vides dans la même couche. Les molécules formées à partir de ces éléments sont parfois appelées molécules hypervalentes (ou désignées comme ayant des octets étendus). La Figure 9.4.2 montre les structures de Lewis de deux molécules hypervalentes, PCl5 et SF6.
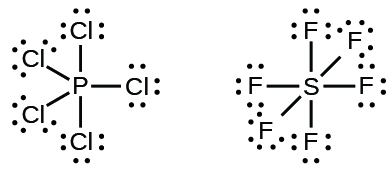
Figure 9.4.2. Dans le PCl5, l’atome central, le phosphore, partage cinq paires d’électrons. Dans le SF6, le soufre partage six paires d’électrons.
Dans certaines molécules hypervalentes, telles que IF5 et XeF4, certains des électrons de la couche externe de l’atome central sont des paires solitaires:
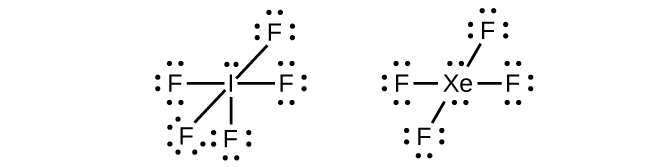
Vous vous demandez peut-être pourquoi les structures ont été dessinées avec des angles autres que 90º dans le schéma ci-dessus. Les angles indiqués reflètent la géométrie relative des atomes et des paires solitaires dans la molécule globale. Cela deviendra plus clair après la section expliquant la théorie VSEPR. Lorsque nous dessinons les structures de Lewis pour ces molécules, nous constatons qu’il nous reste des électrons après avoir rempli les couches de valence des atomes extérieurs avec huit électrons. Ces électrons supplémentaires doivent être assignés à l’atome central.
Exemple 9.4.3 – Rédaction des structures de Lewis: Violations de la règle de l’octet
Le xénon est un gaz noble, mais il forme un certain nombre de composés stables. Nous avons examiné XeF4 précédemment. Quelles sont les structures de Lewis de XeF2 et XeF6?
Solution
Nous pouvons dessiner la structure de Lewis de toute molécule covalente en suivant les six étapes discutées précédemment. Dans ce cas, nous pouvons condenser les dernières étapes, car elles ne s’appliquent pas toutes.
1. Calculez le nombre d’électrons de valence:
XeF2 : 8 + (2 × 7) = 22
XeF6: 8 + (6 × 7) = 50
2. Dessinez un squelette reliant les atomes par des liaisons simples. Le xénon sera l’atome central car le fluor ne peut pas être un atome central:
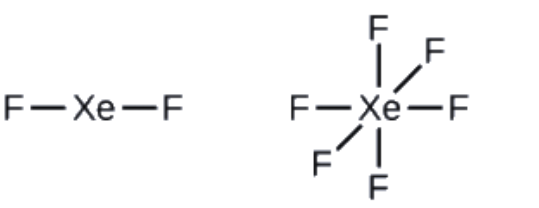
3. Distribuez les électrons restants.
XeF2: Nous plaçons trois paires d’électrons solitaires autour de chaque atome F, ce qui représente 12 électrons et donne à chaque atome F 8 électrons. Il reste donc six électrons (trois paires solitaires). Ces paires solitaires doivent être placées sur l’atome de Xe. Ceci est acceptable car les atomes de Xe ont des orbitales d vides dans la couche de valence et peuvent accueillir plus de huit électrons. La structure de Lewis de XeF2 montre deux paires de liaison et trois paires d’électrons solitaires autour de l’atome de Xe:
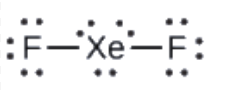
XeF6: Nous plaçons trois paires d’électrons solitaires autour de chaque atome de F, ce qui représente 36 électrons. Il reste deux électrons, et cette paire solitaire est placée sur l’atome de Xe:
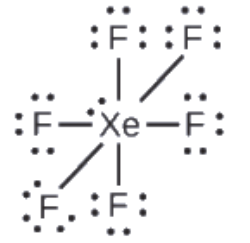
Vérifiez votre apprentissage 9.4.3 – Rédaction des structures de Lewis: Violations de la règle de l’octet
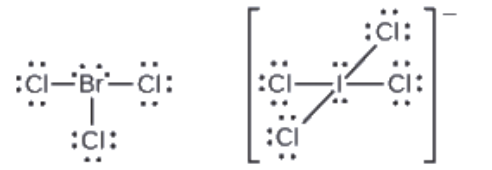
Les halogènes forment une classe de composés appelés interhalogènes, dans lesquels les atomes d’halogène se lient de manière covalente les uns aux autres. Dessiner les structures de Lewis pour les interhalogènes BrCl3 et ICl4–.
Réponse
Calcul de la charge formelle
Comme nous l’avons vu dans certains cas, il existe apparemment plus d’une structure valable pour une molécule. Nous introduisons le concept de charges formelles pour nous aider à prédire la structure de Lewis la plus appropriée lorsque plus d’une structure est raisonnable.
La charge formelle d’un atome dans une molécule est la charge hypothétique que l’atome aurait si nous pouvions redistribuer les électrons des liaisons de manière égale entre les atomes. Une autre façon de le dire est que la charge formelle est obtenue en prenant le nombre d’électrons de valence d’un atome neutre, en soustrayant les électrons non–liés, puis en soustrayant le nombre de liaisons reliées à cet atome dans la structure de Lewis.
Ainsi, nous calculons la charge formelle comme suit:
charge formelle = # d’électrons de valence (atome libre) – # paire d’électrons solitaires – 12# d’électrons liants
Nous pouvons revérifier les calculs de charges formelles en déterminant la somme des charges formelles pour l’ensemble de la structure. La somme des charges formelles de tous les atomes d’une molécule doit être nulle; la somme des charges formelles d’un ion doit être égale à la charge de l’ion.
Nous devons nous rappeler que la charge formelle calculée pour un atome n’est pas la charge réelle de l’atome dans la molécule. La charge formelle n’est qu’une procédure comptable utile; elle n’indique pas la présence de charges réelles.
Exemple 9.4.4 – Calcul de la charge formelle à partir des structures de Lewis – 1
Attribuez des charges formelles à chaque atome de l’ion interhalogène ICl4–.
Solution
1. Nous divisons les paires d’électrons de liaison de manière égale pour toutes les liaisons I-Cl :
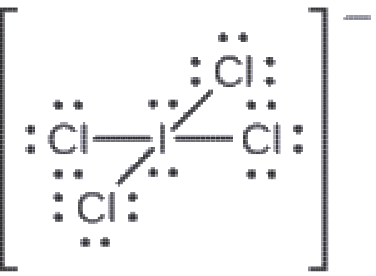
2. Nous attribuons des paires d’électrons solitaires à leurs atomes. Chaque atome de Cl a maintenant sept électrons qui lui sont assignés, et l’atome de I en a huit.
3. Soustrayez ce nombre du nombre d’électrons de valence de l’atome neutre:
I: 7 – 8 = –1
Cl: 7 – 7 = 0
La somme des charges formelles de tous les atomes est égale à -1, ce qui est identique à la charge de l’ion (-1).
Vérifiez votre apprentissage 9.4.4
Calculez la charge formelle de chaque atome de la molécule de monoxyde de carbone:
:C≡O :
Réponse
C -1, O +1
Exemple 9.4.5 – Calcul de la charge formelle à partir des structures de Lewis – 2
Attribuez des charges formelles à chaque atome de la molécule interhalogène BrCl3.
Solution
1. Assignez un des électrons de chaque liaison Br-Cl à l’atome de Br et un à l’atome de Cl dans cette liaison:
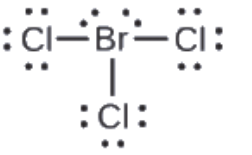
2. Attribuez les paires solitaires à leur atome. Maintenant, chaque atome de Cl a sept électrons et l’atome de Br a sept électrons.
3. Soustrayez ce nombre du nombre d’électrons de valence de l’atome neutre. On obtient ainsi la charge formelle:
Br: 7 – 7 = 0
Cl: 7 – 7 = 0
Tous les atomes de BrCl3 ont une charge formelle de zéro, et la somme des charges formelles est égale à zéro, comme dans une molécule neutre.
Vérifiez votre apprentissage 9.4.5 – Calcul de la charge formelle à partir des structures de Lewis – 2
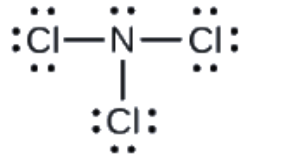
Déterminez la charge formelle de chaque atome de NCl3.
Réponse
N: 0; les trois atomes de Cl: 0
Utiliser la charge formelle pour prédire la structure moléculaire
La disposition des atomes dans une molécule ou un ion est appelé structure moléculaire. Dans de nombreux cas, suivre les étapes de rédaction des structures de Lewis peut conduire à plus d’une structure moléculaire possible – différentes liaisons multiples et différents placements d’électrons à paire solitaire ou différentes dispositions des atomes, par exemple. Quelques directives concernant la charge formelle peuvent être utiles pour décider laquelle des structures possibles est la plus probable pour une molécule ou un ion particulier:
Une structure moléculaire dans laquelle toutes les charges formelles sont nulles est favorisée à une structure dans laquelle certaines charges formelles ne sont pas nulles.
Si la structure de Lewis doit avoir des charges formelles non nulles, l’arrangement avec les plus petites charges formelles non nulles est favorisé.
Les structures de Lewis sont favorisées lorsque les charges formelles adjacentes sont nulles ou de signe opposé.
Lorsque nous devons choisir entre plusieurs structures de Lewis avec des distributions similaires de charges formelles, la structure avec les charges formelles négatives sur les atomes les plus électronégatifs est favorisée.
Pour voir comment ces directives s’appliquent, considérons quelques structures possibles pour le dioxyde de carbone, CO2. Nous savons, grâce à notre discussion précédente, que l’atome le moins électronégatif occupe généralement la position centrale, mais les charges formelles nous permettent de comprendre pourquoi cela se produit. Nous pouvons dessiner trois possibilités pour la structure: carbone au centre et doubles liaisons, carbone au centre avec une liaison simple et triple, et oxygène au centre avec des doubles liaisons:
En comparant les trois charges formelles, nous pouvons définitivement identifier la structure de gauche comme préférable car elle n’a que des charges formelles de zéro (Directive 1). 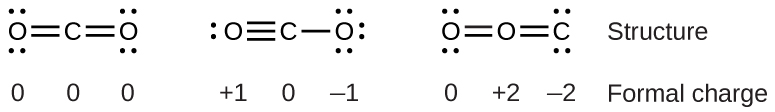
Autre exemple, l’ion thiocyanate, un ion formé d’un atome de carbone, d’un atome d’azote et d’un atome de soufre, pourrait avoir trois structures moléculaires différentes: CNS–, NCS–, ou CSN–. Les charges formelles présentes dans chacune de ces structures moléculaires peuvent nous aider à choisir la disposition la plus probable des atomes. Les structures de Lewis possibles et les charges formelles pour chacune des trois structures possibles de l’ion thiocyanate sont présentées ici:
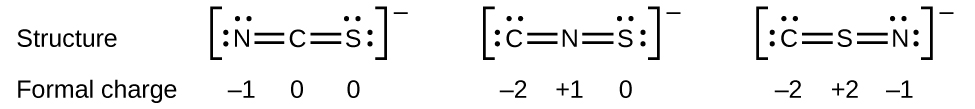
Notez que la somme des charges formelles dans chaque cas est égale à la charge de l’ion (-1). Cependant, le premier arrangement d’atomes est favorisé parce qu’il a le plus petit nombre d’atomes avec des charges formelles non nulles (Directive 2). De plus, elle place l’atome le moins électronégatif au centre, et la charge négative sur l’élément le plus électronégatif (Directive 4).
Exemple 9.4.6 – Utilisation de la charge formelle pour déterminer la structure moléculaire
Le protoxyde d’azote, N2O, communément appelé gaz hilarant, est utilisé comme anesthésiant dans les interventions chirurgicales mineures, telles que l’extraction de routine des dents de sagesse. Quelle est la structure probable de l’oxyde nitreux?

Solution
La détermination de la charge formelle donne les résultats suivants:

La structure avec un atome d’oxygène terminal répond le mieux aux critères de la distribution la plus stable de la charge formelle:

Le nombre d’atomes avec des charges formelles est minimisé (Directive 2), et il n’y a pas de charge formelle supérieure à un (Directive 2). Ceci est à nouveau cohérent avec la préférence d’avoir l’atome le moins électronégatif en position centrale.
Vérifiez votre apprentissage 9.4.6 – Utilisation de la charge formelle pour déterminer la structure moléculaire
Quelle est la structure moléculaire la plus probable de l’ion nitrite (NO2–)?
Solution
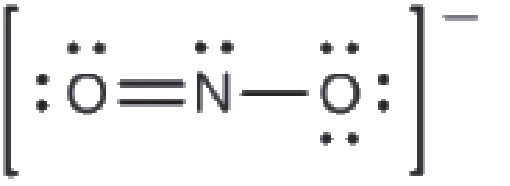
Résonance
Vous avez peut-être remarqué que l’anion nitrite de l’exemple ci-dessus peut avoir deux structures possibles avec les atomes dans les mêmes positions. Les électrons impliqués dans la double liaison N-O, cependant, sont dans des positions différentes:
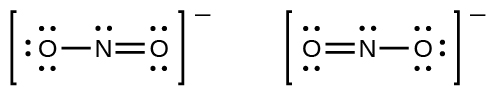
Si les ions nitrites contiennent effectivement une liaison simple et une liaison double, on peut s’attendre à ce que les deux longueurs de liaison soient différentes. Une double liaison entre deux atomes est plus courte (et plus forte) qu’une liaison simple entre ces deux mêmes atomes. Les expériences montrent toutefois que les deux liaisons N-O de NO2– ont la même force et la même longueur, et que toutes leurs autres propriétés sont identiques.
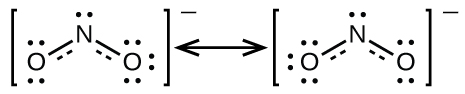
Il n’est pas possible d’écrire une seule structure de Lewis pour NO2– dans laquelle l’azote a un octet et les deux liaisons sont équivalentes. À la place, nous utilisons le concept de résonance: si deux structures de Lewis ou plus avec la même disposition des atomes peuvent être écrites pour une molécule ou un ion, la distribution réelle des électrons est une moyenne de celle montrée par les différentes structures de Lewis. La distribution réelle des électrons dans chacune des liaisons azote-oxygène de NO2– est la moyenne d’une liaison double et d’une liaison simple. En termes d’ordre de liaison, cela correspond à la moyenne entre un ordre de liaison de 1 et 2; nous disons donc que chaque liaison azote-oxygène a un ordre de liaison de 1,5.
Nous appelons les structures de Lewis individuelles des formes de résonance. La structure électronique réelle de la molécule (la moyenne des formes de résonance) est appelée hybride de résonance des formes de résonance individuelles. Une flèche à double tête entre les structures de Lewis indique qu’il s’agit de formes de résonance. Ainsi, la structure électronique de l’ion NO2– est représentée comme suit:
Nous devons nous rappeler qu’une molécule décrite comme un hybride de résonance ne possède jamais une structure électronique décrite par l’une ou l’autre des formes de résonance. Elle ne fluctue pas entre les formes de résonance; au contraire, la structure électronique réelle est toujours la moyenne de celle présentée par toutes les formes de résonance. George Wheland, l’un des pionniers de la théorie de la résonance, a utilisé une analogie historique pour décrire la relation entre les formes de résonance et les hybrides de résonance. Un voyageur médiéval, qui n’avait jamais vu de rhinocéros, l’a décrit comme un hybride de dragon et de licorne, car il avait de nombreuses propriétés en commun avec les deux. De même qu’un rhinocéros n’est ni un dragon à certains moments, ni une licorne à d’autres, un hybride de résonance n’est à aucun moment l’une de ses formes de résonance. Comme le rhinocéros, il s’agit d’une entité réelle dont l’existence a été démontrée par des preuves expérimentales. Il a certaines caractéristiques en commun avec ses formes de résonance, mais les formes de résonance elles-mêmes sont des images pratiques et imaginaires (comme la licorne et le dragon).
L’anion carbonate, CO32-, fournit un deuxième exemple de résonance:
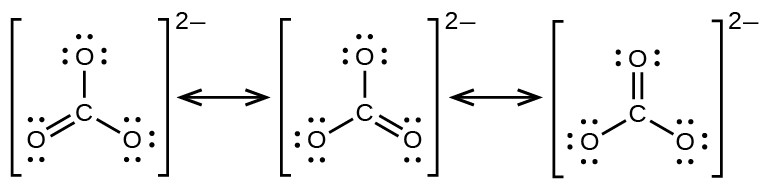
Un atome d’oxygène doit avoir une double liaison avec le carbone pour compléter l’octet sur l’atome central. Cependant, tous les atomes d’oxygène sont équivalents, et la double liaison peut se former à partir de n’importe lequel des trois atomes. Cela donne lieu à trois formes de résonance de l’ion carbonate. Comme nous pouvons écrire trois structures de résonance identiques, nous savons que la disposition réelle des électrons dans l’ion carbonate est la moyenne des trois structures. Là encore, les expériences montrent que les trois liaisons C-O sont exactement les mêmes, chacune étant la moyenne de deux liaisons simples et d’une liaison double. Cela correspond à un ordre de liaison de 4/3, soit
|
Dessiner des structures de résonance – Pratique supplémentaire |
|
Ce site interactif en ligne comprend de nombreux exemples pour s’entraîner à dessiner des structures de résonance. |
★ Questions
1. Dessinez les structures de Lewis pour chacun des ions suivants:
a) As3–
b) I–
c) Be2+
d) O2–
e) Ga3+
f) Li+
g) N3–
2. Dessinez les structures de Lewis des ions dans chacun des composés ioniques suivants et les structures de Lewis de l’atome à partir duquel ils sont formés:
a) MgS
b) Al2O3
c) GaCl3
d) K2O
e) Li3N
f) KF
3. Dessinez les structures de Lewis pour les éléments suivants:
a) O2
b) H2CO
c) AsF3
d) ClNO
e) SiCl4
f) H3O+
g) NH4+
h) BF4−
i) HCCH
j) ClCN
k) C22+
4. Dessinez les structures de Lewis pour les éléments suivants:
a) SeF6
b) XeF4
c) SeCl3+
d) Cl2BBCl2 (contains a B–B bond)
5. Dessinez la structure de Lewis de la molécule diatomique P2, une forme instable de phosphore que l’on trouve dans la vapeur de phosphore à haute température.
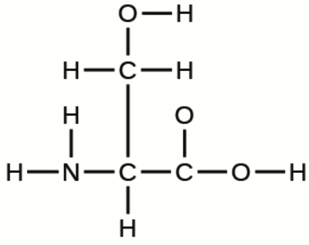
6. La disposition des atomes dans plusieurs molécules biologiquement importantes est donnée ci-dessous. Complétez les structures de Lewis de ces molécules en ajoutant des liaisons multiples et des paires solitaires. N’ajoutez pas d’autres atomes.
a) L’acide aminé sérine:
b) L’urée:
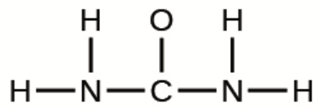
c) Acide pyruvique:
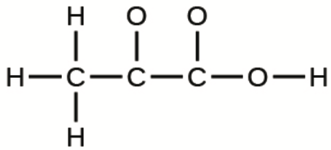
d) Uracile:
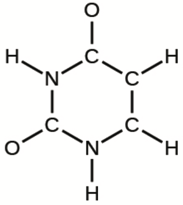
e) L’acide carbonique:
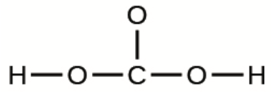
7. En quoi les liaisons simples, doubles et triples sont-elles similaires? En quoi diffèrent-elles?
★★ Questions
8. Corrigez l’affirmation suivante : ” Les liaisons dans le PbCl2 solide sont ioniques; la liaison dans une molécule de HCl est covalente. Ainsi, tous les électrons de valence du PbCl2 sont situés sur les ions Cl–, et tous les électrons de valence d’une molécule de HCl sont partagés entre les atomes H et Cl.”
9. Le méthanol, H3COH, est utilisé comme carburant dans certaines voitures de course. L’éthanol, C2H5OH, est largement utilisé comme carburant au Brésil. Le méthanol et l’éthanol produisent tous deux du CO2 et du H2O lors de leur combustion. Écrivez les équations chimiques de ces réactions de combustion en utilisant les structures de Lewis au lieu des formules chimiques.
10. Le tétrachlorure de carbone était autrefois utilisé dans les extincteurs pour les incendies électriques. Il n’est plus utilisé à cette fin en raison de la formation du gaz toxique phosgène, Cl2CO. Dessinez les structures de Lewis du tétrachlorure de carbone et du phosgène.
11. Un composé dont la masse molaire est d’environ 42 g/mol contient 85,7% de carbone et 14,3% d’hydrogène en masse. Dessinez la structure de Lewis d’une molécule de ce composé.
Réponses
1.
a) Huit électrons
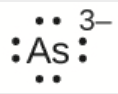
b) Huit électrons

c) Pas d’électrons, Be2+
d) Huit électrons
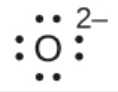
e) Pas d’électrons, Ga3+
f) Pas d’électrons, Li+
g) Huit électrons
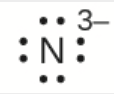
2.
a) 
b) 
c) 
d) 
e) 
f) 
3. Dans ce cas, la structure de Lewis ne permet pas de représenter le fait que les études expérimentales ont montré la présence de deux électrons non-liés dans chaque molécule d’oxygène.
a) 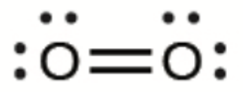
b) 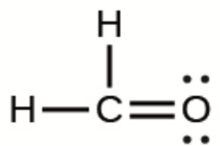
c) 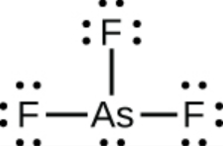
d) 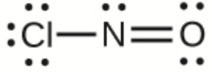
e) 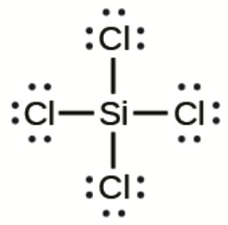
f) 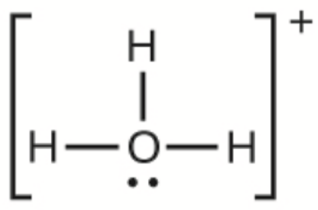
g) 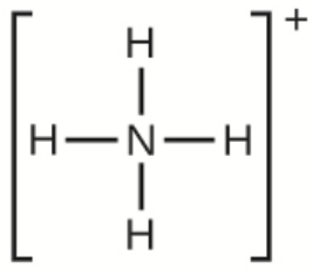
h) 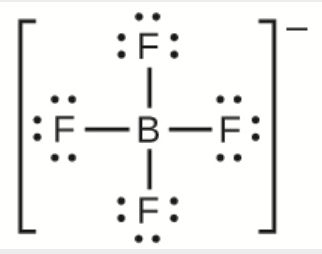
i) 
j) 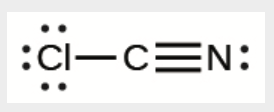
k) 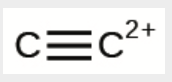
4.
a) 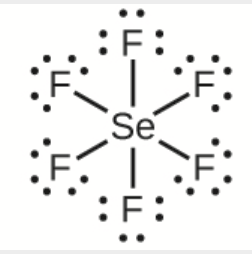
b) 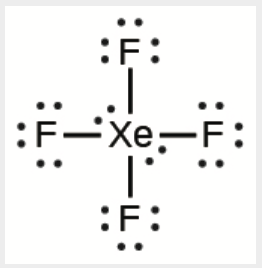
c) 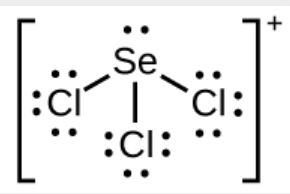
d) 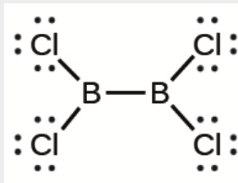
5. 
6.
a) 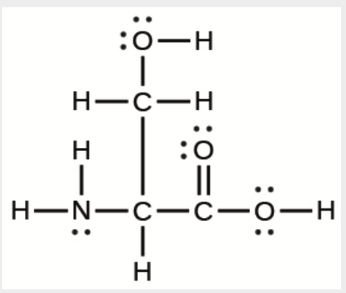
b) 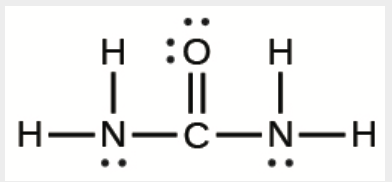
c) 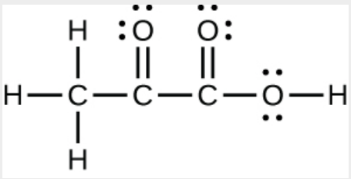
d) 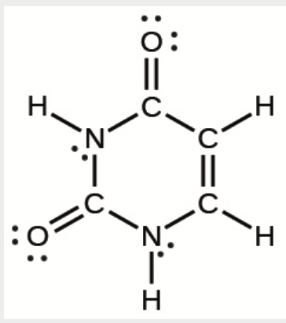
e) 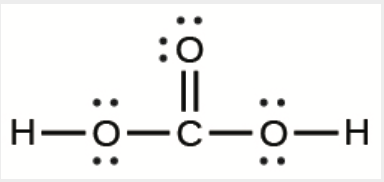
7. Chaque liaison comprend un partage d’électrons entre les atomes. Deux électrons sont partagés dans une liaison simple; quatre électrons sont partagés dans une liaison double; et six électrons sont partagés dans une liaison triple.
8. Deux électrons de valence par atome de Pb sont transférés aux atomes de Cl; l’ion Pb2+ résultant a une configuration de couche de valence 6s2. Deux des électrons de valence de la molécule de HCl sont partagés, et les six autres sont situés sur l’atome de Cl sous forme de paires d’électrons célibataires.
9.
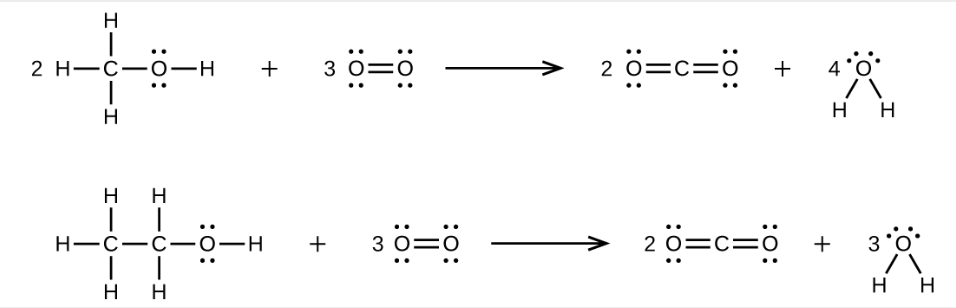
10.
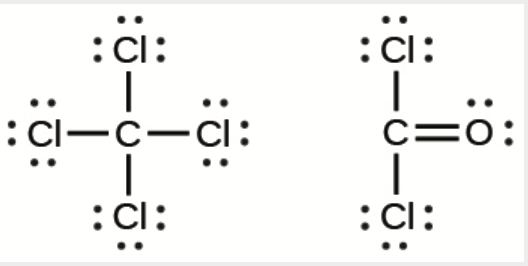
11.
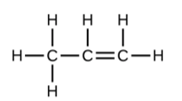
Diagramme montrant les paires isolées et les paires d'électrons de liaison dans une molécule ou un ion
Deux (une paire) d'électrons de valence qui ne sont pas utilisés pour former une liaison covalente
Liaison dans laquelle une seule paire d'électrons est partagée entre deux atomes
Directive qui stipule que les atomes du groupe principal formeront des structures dans lesquelles huit électrons de valence interagissent avec chaque noyau, en comptant les électrons de liaison comme interagissant avec les deux atomes reliés par la liaison
Liaison covalente dans laquelle deux paires d'électrons sont partagées entre deux atomes
Liaison dans laquelle trois paires d'électrons sont partagées entre deux atomes
Nombre de paires d'électrons entre deux atomes ; il peut être déterminé par le nombre de liaisons dans une structure de Lewis ou par la différence entre le nombre d'électrons de liaison et d'anti-liaison divisé par deux
Molécule qui contient un nombre impair d'électrons
Décrit une molécule hypervalente, qui contient au moins un élément du groupe principal ayant plus de huit électrons dans sa coquille de valence
Décrit une molécule hypervalente, qui contient au moins un élément du groupe principal ayant plus de huit électrons dans sa coquille de valence
Charge qui résulterait sur un atome en prenant le nombre d'électrons de valence sur l'atome neutre et en soustrayant les électrons non liés et le nombre de liaisons (la moitié des électrons liés)
Arrangement des atomes dans une molécule ou un ion ; dans la théorie VSEPR, il s'agit d'une structure qui ne comprend que le placement des atomes dans la molécule
Situation dans laquelle une structure de Lewis est insuffisante pour décrire la liaison dans une molécule et où la moyenne des structures multiples est observée
Deux ou plusieurs structures de Lewis qui ont le même arrangement d'atomes mais des arrangements différents d'électrons
Moyenne des formes de résonance indiquées par les différentes structures de Lewis