4.4 – Le principe de Le Châtelier
Comme vous le savez déjà, les réactions d’équilibre se déroulent dans les deux sens (les réactifs vont aux produits et les produits vont aux réactifs). Nous pouvons dire qu’une réaction est à l’équilibre si le quotient de réaction (Q) est égal à la constante d’équilibre (K). Nous abordons ensuite ce qui se passe lorsqu’un système à l’équilibre est perturbé de sorte que Q n‘est plus égal à K. Si un système à l’équilibre est soumis à une perturbation ou à un stress (comme un changement de concentration), la position d’équilibre change. Comme ce stress affecte les concentrations des réactifs et des produits, la valeur de Q n’est plus égale à la valeur de K. Pour rétablir l’équilibre, le système se déplace soit vers les produits (si Q < K), soit vers les réactifs (si Q > K) jusqu’à ce que Q retrouve la même valeur que K.
Ce processus est décrit par le principe de Le Châtelier : lorsqu’un système chimique à l’équilibre est perturbé, il revient à l’équilibre en contrebalançant la perturbation. Comme décrit dans le paragraphe précédent, la perturbation provoque un changement de Q ; la réaction se déplace pour rétablir Q = K.
Prévoir la direction d’une réaction réversible
Le principe du Châtelier peut être utilisé pour prédire les changements de concentrations d’équilibre lorsqu’un système à l’équilibre est soumis à une contrainte. Cependant, si nous avons un mélange de réactifs et de produits qui n’ont pas encore atteint l’équilibre, les changements nécessaires pour atteindre l’équilibre peuvent ne pas être aussi évidents. Dans un tel cas, nous pouvons comparer les valeurs de Q et K pour le système afin de prévoir les changements.
Effet du changement de concentration sur l’équilibre
Un système chimique à l’équilibre peut être temporairement déséquilibré par l’ajout ou le retrait d’un ou de plusieurs réactifs ou produits. Les concentrations des réactifs et des produits subissent alors des modifications supplémentaires pour ramener le système à l’équilibre.
La contrainte sur le système dans la figure 4.4.1 est la réduction de la concentration d’équilibre du SCN- : une diminution de la concentration de ce réactif entraînerait une augmentation de Q supérieure à K. En conséquence, le principe de Le Châtelier nous conduit à prévoir que la concentration de Fe(SCN)2+ devrait diminuer, en augmentant la concentration de SCN- jusqu’à revenir à sa concentration initiale, et en augmentant la concentration de Fe3+ au-dessus de sa concentration d’équilibre initiale.

Figure 4.4.1. a) Le tube à essai contient 0,1 M Fe3+. b) L’ion thiocyanate a été ajouté à la solution en a), formant l’ion rouge Fe(SCN)2+, selon l’équilibre chimique : Fe3+(aq) + SCN-(aq) ⇌ Fe(SCN)2+(aq). (c) Du nitrate d’argent a été ajouté à la solution du point (b), précipitant une partie du SCN- sous forme de solide blanc AgSCN, selon : Ag+ (aq) + SCN-(aq) ⇌ AgSCN (s). La diminution de la concentration du SCN- déplace le premier équilibre de la solution vers la gauche, diminuant la concentration (et la couleur de l’éclaircissement) du Fe(SCN)2+. (crédit : modification du travail de Mark Ott)
L’effet d’un changement de concentration sur un système à l’équilibre est illustré plus loin par l’équilibre de cette réaction chimique :
H2 (g) + I2 (g) ⇌ 2 HI (g) KC = 50,0 à 400◦C
Les valeurs numériques de cet exemple ont été déterminées expérimentalement. Un mélange de gaz à 400°C avec [H2] = [I2] = 0,221 M et [HI] = 1,563 M est à l’équilibre ; pour ce mélange, Qc = KC = 50,0. Si H2 est introduit dans le système si rapidement que sa concentration double instantanément (nouveau [H2] = 0,442 M), la réaction se déplacera de manière à atteindre un nouvel équilibre, où [H2] = 0,374 M, [I2] = 0,153 M, et [HI] = 1,692 M. Cela donne

Nous avons mis l’accent sur ce système en introduisant de l’H2 supplémentaire. Le stress est atténué lorsque la réaction se déplace vers la droite, en utilisant une partie (mais pas la totalité) de l’excès d’H2, en réduisant la quantité d’I2 non combiné et en formant de l’HI supplémentaire.
Effet du changement de pression/volume sur l’équilibre
Parfois, nous pouvons changer la position d’équilibre en modifiant la pression d’un système. Cependant, les changements de pression n’ont un effet mesurable que dans les systèmes où des gaz sont impliqués, et seulement lorsque la réaction chimique produit un changement dans le nombre total de molécules de gaz dans le système. Un moyen facile de reconnaître un tel système est de rechercher différents nombres de moles de gaz du côté des réactifs et des produits de l’équilibre. Lors de l’évaluation de la pression (ainsi que des facteurs connexes comme le volume), il est important de se rappeler que les constantes d’équilibre sont définies en fonction de la concentration (pour KC) ou de la pression partielle (pour KP). Certaines modifications de la pression totale, comme l’ajout d’un gaz inerte qui ne fait pas partie de l’équilibre, modifieront la pression totale mais pas les pressions partielles des différents gaz dans l’expression des constantes d’équilibre. Ainsi, l’ajout d’un gaz qui ne fait pas partie de l’équilibre ne perturbera pas l’équilibre.
Lorsque nous augmentons la pression d’un système gazeux à l’équilibre, soit en diminuant le volume du système, soit en ajoutant plus d’un des composants du mélange d’équilibre, nous introduisons une contrainte en augmentant les pressions partielles d’un ou de plusieurs des composants. Selon le principe du Châtelier, un changement d’équilibre qui réduit le nombre total de molécules par unité de volume sera favorisé car cela soulage le stress. La réaction inverse serait favorisée par une diminution de la pression.
Considérez ce qui se passe lorsque nous augmentons la pression sur un système dans lequel le NO, l’O2 et le NO2 sont à l’équilibre :
2 NO (g) + O2 (g) ⇌ 2 NO2 (g)
La formation de quantités supplémentaires de NO2 diminue le nombre total de molécules dans le système car chaque fois que deux molécules de NO2 se forment, un total de trois molécules de réactifs (NO et O2) sont consommées. Cela réduit la pression totale exercée par le système et réduit, mais ne soulage pas complètement, le stress de l’augmentation de la pression. D’autre part, une diminution de la pression sur le système favorise la décomposition du NO2 en NO et O2, ce qui tend à rétablir la pression.
Considérons maintenant cette réaction :
N2 (g) + O2 (g) ⇌ 2 NO (g)
Comme le nombre total de molécules dans le système ne change pas pendant la réaction, une modification de la pression ne favorise ni la formation ni la décomposition du monoxyde d’azote gazeux.
|
Effet du changement de pression sur l’équilibre – Démonstration vidéo |
|
Regardez cette vidéo pour observer le changement de couleur qui se produit lorsqu’on applique une pression sur un mélange équilibré de NO2 (brun) et de N2O4 (incolore). N2O4 (g) ⇌ 2 NO2 (g) Remarquez comment, quelque temps après l’application de la pression, la couleur du mélange s’éclaircit – si l’on y pense en utilisant le principe du Châtelier, l’augmentation de la pression est le stress qui doit être compensé par la diminution de la pression dans le système – cela peut être obtenu en réduisant le nombre de moles de gaz dans le système. Cela signifie que la réaction à gauche est poussée vers l’avant, où les molécules de NO2 réagissent pour former plus de N2O4 qui est incolore et donne donc au mélange une couleur plus claire (c’est-à-dire un degré accru d’incoloration). |
Effet du changement de température sur l’équilibre
La modification de la concentration ou de la pression perturbe un équilibre parce que le quotient de réaction s’éloigne de la valeur d’équilibre. La modification de la température d’un système à l’équilibre a un effet différent : Un changement de température modifie en fait la valeur de la constante d’équilibre. Cependant, nous pouvons prédire qualitativement l’effet du changement de température en le traitant comme une contrainte sur le système et en appliquant le principe de Le Châtelier.
Lorsque l’hydrogène réagit avec l’iode gazeux, la chaleur est dégagée.
H2 (g) + I2 (g) ⇌ 2 HI (g) ΔH = -9,4 kJ (exothermique)
Comme cette réaction est exothermique, nous pouvons l’écrire avec la chaleur comme produit.
H2 (g) + I2 (g) ⇌ 2 HI (g) + chaleur
L’augmentation de la température de la réaction augmente l’énergie interne du système. Ainsi, l’augmentation de la température a pour effet d’augmenter la quantité d’un des produits de cette réaction. La réaction se déplace vers la gauche pour soulager le stress, et il y a une augmentation de la concentration de H2 et I2 et une réduction de la concentration de HI. L’abaissement de la température de ce système réduit la quantité d’énergie présente, favorise la production de chaleur et la formation d’iodure d’hydrogène.
Lorsque nous modifions la température d’un système à l’équilibre, la constante d’équilibre de la réaction change. Abaisser la température du système HI augmente la constante d’équilibre : au nouvel équilibre, la concentration de HI a augmenté et les concentrations de H2 et I2 ont diminué. L’augmentation de la température diminue la valeur de la constante d’équilibre, qui passe de 67,5 à 357 °C à 50,0 à 400 °C. La température affecte l’équilibre entre NO2 et N2O4 dans cette réaction
N2O4 (g) ⇌ 2 NO2 (g) ΔH = 57,20 kJ
La valeur positive de ΔH nous indique que la réaction est endothermique et pourrait s’écrire
Chaleur + N2O4 (g) ⇌ 2 NO2 (g)
À des températures plus élevées, le mélange gazeux a une couleur brun foncé, indiquant une quantité importante de molécules de NO2 brunes. Si, toutefois, nous exerçons une contrainte sur le système en refroidissant le mélange (en retirant de l’énergie), l’équilibre se déplace vers la gauche pour fournir une partie de l’énergie perdue par le refroidissement. La concentration de N2O4 incolore augmente, et la concentration de NO2 brun diminue, ce qui provoque l’effacement de la couleur brune.
Dépendance de la température du K
Comme nous venons de le noter, la température est spéciale en ce sens qu’elle affecte la valeur de la constante d’équilibre d’une réaction. Par conséquent, les constantes d’équilibre dépendent de la température. Cette relation, qui relie également K et les enthalpies et entropies standard, est connue sous le nom d’équation de van't Hoff. Elle est exprimée par
![]()
4.4.1
où
- K est la constante d’équilibre
- ΔH° est le changement d’enthalpie standard, en unités d’énergie (par exemple J)
- R est la constante des gaz (telle que vue dans l’unité des gaz) exprimée en unités d’énergie par Kelvin (par exemple J/K)
- T est la température en Kelvin
ΔSº est une propriété thermodynamique tout comme l’enthalpie (ΔHº), connue sous le nom de variation standard de l’entropie (S), exprimée en unités d’énergie par Kelvin (par exemple J/K). Ce sujet dépasse le cadre de ce cours (vous en apprendrez plutôt sur l’entropie en détail dans votre cours de chimie physique de 2ème année), mais pour l’instant, tout ce que vous devez savoir, c’est qu’elle est une mesure de la dispersion ou de la distribution de la matière et/ou de l’énergie dans un système, et qu’elle est souvent décrite comme représentant le “désordre” du système. Plus le désordre est grand dans un système, plus l’entropie est grande. Par exemple, l’entropie d’un gaz est plus grande que celle d’un liquide, et l’entropie d’un liquide est plus grande que celle d’un solide. En outre, les substances chauffantes augmentent le désordre de ses particules constitutives et donc leur entropie.
En examinant l’équation ci-dessus, remarquez comment elle peut être formatée sous la forme y = mx + b. Cela nous donne une relation linéaire entre ln K (y) et 1/T (x). Par conséquent, les changements d’enthalpie et d’entropie thermodynamiques (∆Hº et ∆Sº) pour une réaction réversible peuvent être déterminés en traçant les données de ln K par rapport à 1/T sans l’aide de la calorimétrie. Le graphique de l’inertie K en fonction de 1/T montre qu’il devrait s’agir d’une ligne avec une pente –ΔHo/R (ce qui représente m) et une ordonnée à l’origine ΔSo/R (ce qui représente b). Bien entendu, l’hypothèse principale est que seul K dépend de T ; ΔHo et ΔSo ne dépendent que très faiblement de T, ce qui est généralement valable sur une plage de température étroite.
En supposant que ΔH° et ΔS° sont indépendants de la température, pour une réaction exothermique (ΔH° < 0), la pente du graphique est positive et la magnitude de ln K augmente avec l’augmentation de la température, alors que pour une réaction endothermique (ΔH° > 0), la pente du graphique est négative et la magnitude de ln K diminue avec l’augmentation de la température (figure 4.4.2).
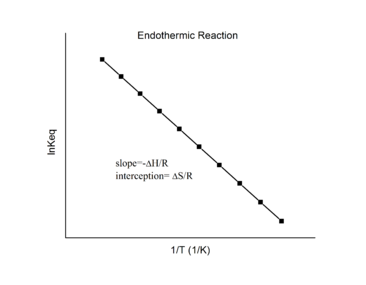
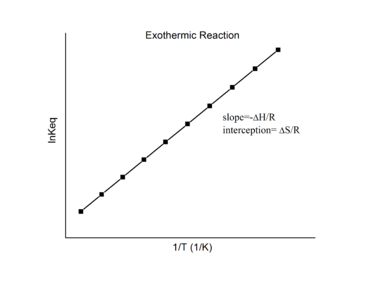
Figure 4.4.2. Réaction endothermique (à gauche) et réaction exothermique sur les graphiques de van’t Hoff (à droite). (CC BY-SA 3.0)
La relation quantitative exprimée dans l’équation de van’t Hoff est en accord avec les prévisions qualitatives faites en appliquant le principe du Châtelier. Parce que la chaleur est produite dans une réaction exothermique, l’ajout de chaleur (en augmentant la température) déplacera l’équilibre vers la gauche, favorisant les réactifs et diminuant la magnitude de K. Inversement, parce que la chaleur est consommée dans une réaction endothermique, l’ajout de chaleur déplacera l’équilibre vers la droite, favorisant les produits et augmentant la magnitude de K. L’équation de van’t Hoff montre également que la magnitude de ΔH° dicte la vitesse à laquelle K change en fonction de la température. En revanche, la magnitude et le signe de ΔS° affectent la magnitude de K mais pas sa dépendance à la température.
Si nous connaissons la valeur de K à une température donnée et la valeur de ΔH° pour une réaction, nous pouvons estimer la valeur de K à toute autre température, même en l’absence d’informations sur ΔS°. Supposons, par exemple, que K1 et K2 soient les constantes d’équilibre pour une réaction à des températures T1 et T2, respectivement. En appliquant l’équation de van’t Hoff, on obtient la relation suivante à chaque température :

En soustrayant le K1 du K2, on obtient :

Cette équation van’t Hoff modifiée est une équation que nous appellerons “équation van’t Hoff à deux points”. Ainsi, en calculant ΔH° à partir des enthalpies de formation tabulées et en mesurant la constante d’équilibre à une température (K1), nous pouvons calculer la valeur de la constante d’équilibre à n’importe quelle autre température (K2), en supposant que ΔH° et ΔS° sont indépendants de la température. Il y a également quelques autres points à considérer lors de l’utilisation de l’équation de van’t Hoff à deux points – voir la note ci-dessous.
|
NOTE : |
|
Pour déterminer les valeurs les plus précises de ΔH° et ΔS° pour une réaction particulière dans un cadre expérimental, un bon scientifique mesurerait plusieurs valeurs de K à différentes températures pour recueillir de nombreux points de données. Cela leur permet de visualiser une relation plus précise entre ln K et 1/T dans un diagramme de van’t Hoff. Si le scientifique est pressé, la collecte de seulement deux points de données et l’utilisation de la version en deux points de l’équation de van’t Hoff devrait encore suffire dans la plupart des cas. Cependant, pour que cela fonctionne, nous devons supposer que la relation entre ln K et 1/T est parfaitement linéaire entre les deux températures T1 et T2. Cette linéarité est généralement le cas lorsque les deux températures sont relativement proches l’une de l’autre, mais elle s’effondre plus les deux températures sont éloignées l’une de l’autre. |
Exemple 4.4.1 – Utilisation de l’équation van’t Hoff
La constante d’équilibre pour la formation de NH3 à partir de H2 et N2 à 25°C est KP = 5,4 × 105. Qu’est-ce que le KP à 500°C ? (ΔHº = -91,8 kJ)
Solution
Si nous fixons T1 = 25°C = 298 K et T2 = 500°C = 773 K, alors en utilisant l’équation de van’t Hoff, nous obtenons ce qui suit :
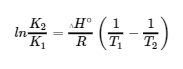
Ainsi, à 500°C, l’équilibre favorise fortement les réactifs par rapport aux produits.
Vérifiez votre apprentissage 4.4.1 – Utilisation de l’équation van’t Hoff
Vous calculez KP = 2,2 × 1012 pour la réaction du NO avec l’O2 pour donner du NO2 à 25°C. Utilisez les valeurs de ΔHf° fournies à l’annexe G pour calculer le KP pour cette réaction à 1000°C.
Répondez :
5.6 × 10−4
Effet des catalyseurs sur l’équilibre
Comme nous l’apprendrons plus tard et plus en détail au cours de notre étude de la cinétique, un catalyseur accélère la vitesse d’une réaction et se régénère au cours du processus. Les catalyseurs fonctionnent en fournissant un mécanisme de réaction alternatif qui a une énergie d’activation plus faible que celle que l’on trouverait en l’absence du catalyseur. Notez la définition de l’énergie d’activation : il s’agit de la quantité minimale d’énergie requise pour qu’une réaction chimique se déroule soit dans le sens direct des réactifs aux produits, soit dans le sens inverse des produits aux réactifs.
Cette énergie d’activation réduite par un catalyseur entraîne une augmentation de la vitesse comme le décrit l’équation d’Arrhenius (que nous aborderons en détail au chapitre 7 : Cinétique chimique). Notez qu’un catalyseur diminue l’énergie d’activation pour les réactions en amont et en aval et donc accélère les réactions en amont et en aval. Par conséquent, la présence d’un catalyseur permet à un système d’atteindre l’équilibre plus rapidement, mais elle n’a aucun effet sur la position de l’équilibre telle qu’elle est reflétée dans la valeur de sa constante d’équilibre.
|
|
Une application des concepts d’équilibre – Le processus Haber
L’interaction des changements de concentration ou de pression, de température et de la présence d’un catalyseur sur un équilibre chimique est illustrée dans la synthèse industrielle de l’ammoniac à partir de l’azote et de l’hydrogène selon l’équation
N2 (g) + 3 H2 (g) ⇌ 2 NH3 (g)
Une grande quantité d’ammoniac est fabriquée par cette réaction. Chaque année, l’ammoniac figure parmi les dix premiers produits chimiques, en masse, fabriqués dans le monde. Environ 2 milliards de livres sont fabriquées aux États-Unis chaque année. L’ammoniac joue un rôle essentiel dans notre économie mondiale. Il est utilisé dans la production d’engrais et est lui-même un engrais important pour la croissance du maïs, du coton et d’autres cultures. De grandes quantités d’ammoniac sont converties en acide nitrique, qui joue un rôle important dans la production d’engrais, d’explosifs, de plastiques, de colorants et de fibres, et qui est également utilisé dans l’industrie sidérurgique.
On sait depuis longtemps que l’azote et l’hydrogène réagissent pour former de l’ammoniac. Cependant, ce n’est qu’au début du XXe siècle, après avoir compris les facteurs qui influencent son équilibre, qu’il est devenu possible de fabriquer de l’ammoniac en quantités utiles par la réaction de l’azote et de l’hydrogène.
Pour être pratique, un processus industriel doit donner un grand rendement de produit relativement rapidement. Une façon d’augmenter le rendement de l’ammoniac est d’augmenter la pression sur le système dans lequel N2, H2 et NH3 sont à l’équilibre ou sont en train de s’équilibrer.
N2 (g) + 3 H2 (g) ⇌ 2 NH3 (g)
La formation de quantités supplémentaires d’ammoniac réduit la pression totale exercée par le système et réduit quelque peu le stress de l’augmentation de la pression.
Bien que l’augmentation de la pression d’un mélange de N2, H2 et NH3 augmente le rendement de l’ammoniac, à basse température, la vitesse de formation de l’ammoniac est lente. À température ambiante, par exemple, la réaction est si lente que si nous préparions un mélange de N2 et de H2, aucune quantité détectable d’ammoniac ne se formerait au cours de notre vie. La formation d’ammoniac à partir d’hydrogène et d’azote est un processus exothermique :
N2 (g) + 3 H2 (g) ⇌ 2 NH3 (g) ΔHº = -92,2 kJ
Ainsi, augmenter la température pour augmenter le taux diminue le rendement. Si nous abaissons la température pour modifier l’équilibre afin de favoriser la formation de plus d’ammoniac, l’équilibre est atteint plus lentement en raison de la forte diminution de la vitesse de réaction avec la baisse de la température.
Une partie de la vitesse de formation perdue en opérant à des températures plus basses peut être récupérée en utilisant un catalyseur. L’effet net du catalyseur sur la réaction est de provoquer un équilibre plus rapide.
Dans la production commerciale d’ammoniac, des conditions d’environ 500 °C, 150-900 atm, et la présence d’un catalyseur sont utilisées pour donner le meilleur compromis entre le taux, le rendement et le coût de l’équipement nécessaire pour produire et contenir des gaz à haute pression et à haute température (figure 4.4.3).
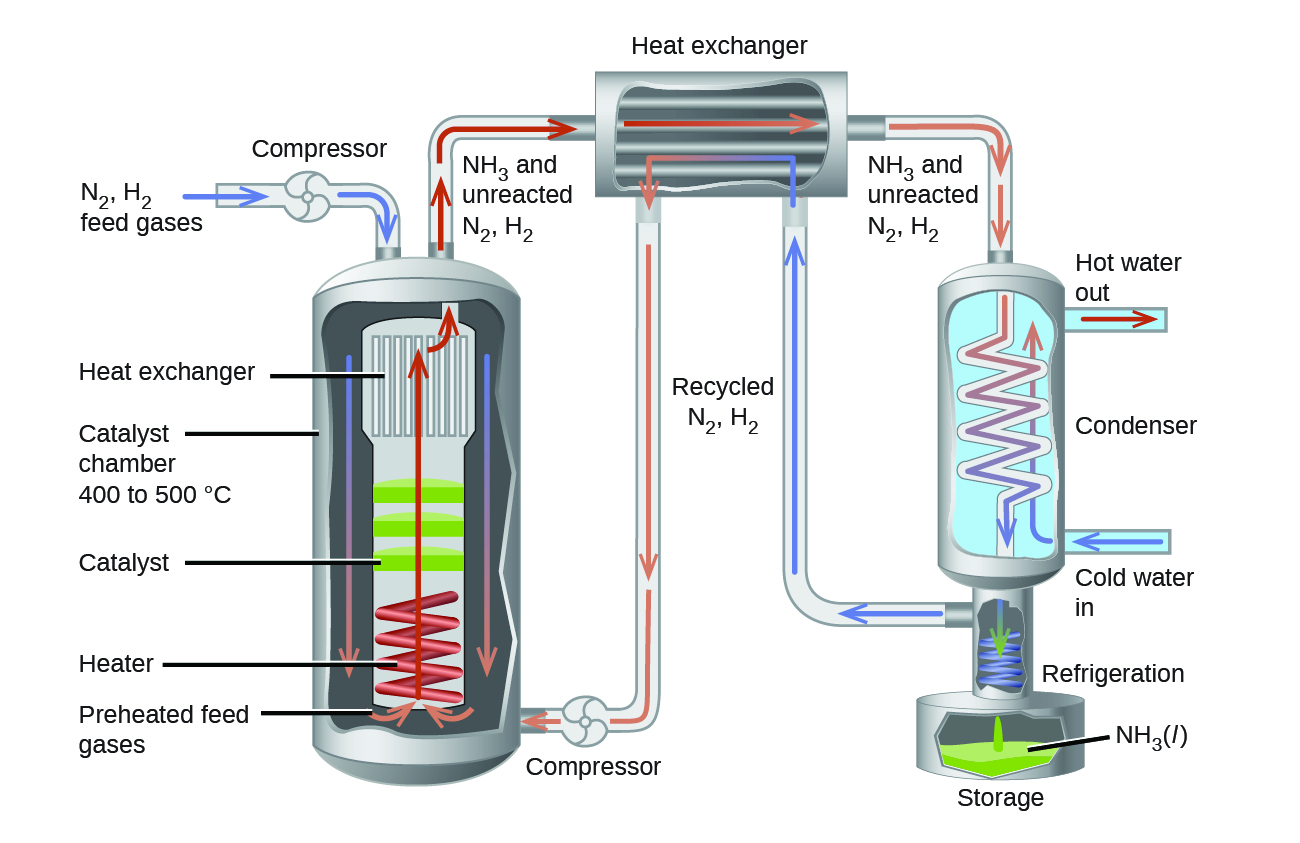
Figure 4.4.3. La production commerciale d’ammoniac nécessite un équipement lourd pour supporter les températures et les pressions élevées requises. Ce schéma illustre la conception d’une usine d’ammoniac.
Résumé – Le principe du Châtelier
Le tableau suivant résume comment chaque perturbation va rétablir l’équilibre du système et son effet (le cas échéant) sur K.
Tableau 4.4.1 Effets des perturbations de l’équilibre et de K
|
Effets des perturbations de l’équilibre et du K |
|||
|
Perturbation |
Changement observé alors que l’équilibre est rétabli |
Direction de la réaction |
Effet sur K |
|
réactif ajouté |
le réactif ajouté est partiellement consommé |
vers les produits |
aucun |
|
produit ajouté |
le produit ajouté est partiellement consommé |
vers les réactifs |
aucun |
|
diminution du volume/augmentation de la pression du gaz |
la pression diminue |
vers le côté avec moins de moles de gaz |
aucun |
|
augmentation du volume/diminution de la pression du gaz |
la pression augmente |
vers le côté avec plus de moles de gaz |
aucun |
|
l’augmentation de la température |
la chaleur est absorbée |
vers des produits pour les réactions endothermiques, vers des réactifs pour les réactions exothermiques |
changements |
|
baisse de la température |
de la chaleur est dégagée |
vers les réactifs pour les réactions endothermiques, vers les produits pour les réactions exothermiques |
changements |
Exemple 4.4.2 – Prévisions qualitatives des changements d’équilibre – 1
Considérez la réaction suivante :
2 SO2 (g) + O2 (g) ⇌ 2 SO3 (g) ∆Hº < 0
Expliquez comment chacun des éléments suivants affectera la quantité de SO3 (g) :
a) Augmentation de la pression
b) Augmentation de la température
c) Augmentation de la quantité d’O2 (g)
Solution
(a) Il y a trois moles de gaz du côté des réactifs et seulement deux moles de gaz du côté des produits. La position d’équilibre va se déplacer pour diminuer la pression totale exercée par le système et contrecarrer le stress de l’augmentation de la pression. Le fait d’avoir moins de moles de gaz présentes diminue la pression. Par conséquent, la réaction vers l’avant est favorisée et la quantité de SO3 (g) augmente.
(b) ∆Hº < 0, donc la réaction est exothermique et produit donc de la chaleur et nous pouvons réécrire l’équation d’équilibre chimique comme suit :
2 SO2 (g) + O2 (g) ⇌ 2 SO3 (g) + chaleur
La position d’équilibre se déplacera pour contrecarrer l’augmentation de la température en évacuant la chaleur du système. Par conséquent, la réaction inverse est favorisée pour produire plus de réactifs, et la quantité de SO3 (g) diminuera en conséquence.
(c) La position d’équilibre se déplacera pour diminuer la quantité d’O2 (g) présente afin de contrecarrer l’augmentation de l’O2 (g). Il est préférable d’utiliser l’excès d’O2 (g) pour diminuer sa quantité dans le système. Par conséquent, la réaction en amont est favorisée pour donner plus de produit, et la quantité de SO3 (g) augmentera.
Vérifiez votre apprentissage 4.4.2 – Prévisions qualitatives des changements d’équilibre – 1
Compte tenu des situations suivantes, déterminez ce qu’il adviendra de la quantité d’H2 qui sera présente dans un mélange d’équilibre dans la réaction
3 Fe (s) + 4 H2O (g) ⇌ Fe3O4 (s) + 4 H2 (g) ∆H° = -150 kJ
a) Diminution de la température du mélange
b) Introduction d’un plus grand nombre de Fe(s)
c) Réduire de moitié le volume du conteneur
d) Ajout d’un catalyseur
Réponse
(a) la quantité de H2 (g) augmente ; (b) pas de changement de la quantité de H2 (g) (rappelons que les solides et les liquides purs ont des activités égales à 1 et n’ont donc aucune influence sur la position d’équilibre !
Vérifiez votre apprentissage 4.4.3 – Prévisions qualitatives des changements d’équilibre – 1
Considérer la réaction d’équilibre
A (g) + ½ B (g) ⇌ 2 C (g) ∆H° = -52 kJ
Parmi les options suivantes, laquelle serait la plus efficace pour encourager la réaction en amont ?
(a) Enlever C + ajouter du feu
(b) Augmenter le volume + ajouter de la chaleur
(c) Ajouter C + enlever la chaleur
(d) Diminuer le volume + ajouter de la chaleur
(e) Augmentation du volume + ajout d’un A
(f) Enlever B + enlever la chaleur
Réponse
(e) Augmentation du volume + ajout d’un A
|
Au cas où vous seriez intéressé… Equilibres dans le jardin |
|
Les hortensias sont des plantes à fleurs communes dans le monde entier. Bien que de nombreux hortensias soient blancs, il existe une espèce commune (Hydrangea macrophylla) dont les fleurs peuvent être soit rouges soit bleues, comme le montre la figure ci-jointe. Comment se fait-il qu’une plante puisse avoir des fleurs de différentes couleurs comme celle-ci ?
Figure 4.4.4. Cette espèce d’hortensia a des fleurs qui peuvent être soit rouges soit bleues. Pourquoi cette différence de couleur ? Source : “Hydrangea” par Janne Moren est sous licence Creative Commons Paternité-Pas d’Utilisation Commerciale-Partage des Conditions Initiales à l’Identique 2.0 Générique. Il est intéressant de noter que la couleur des fleurs est due à l’acidité du sol dans lequel l’hortensia est planté. Un jardinier avisé peut ajuster le pH du sol et modifier la couleur des fleurs. Cependant, ce ne sont pas les ions H3O+ ou OH– eux-mêmes qui affectent la couleur des fleurs. C’est plutôt la présence d’ions d’aluminium qui provoque le changement de couleur. La solubilité de divers sels d’aluminium dans le sol – et donc la capacité des plantes à absorber les ions Al3+ – dépend de l’acidité du sol. Si le sol est relativement acide, l’aluminium est plus soluble et les plantes peuvent l’absorber plus facilement. Dans ces conditions, les fleurs d’hortensias sont bleues car les ions Al interagissent avec les pigments anthocyaniques de la plante. Dans les sols plus basiques, l’aluminium est moins soluble, et dans ces conditions, les fleurs d’hortensias sont rouges. Les jardiniers qui modifient le pH de leur sol pour changer la couleur de leurs fleurs d’hortensias utilisent donc le principe de Le Chatelier : la quantité d’acide dans le sol modifie l’équilibre de la solubilité de l’aluminium, qui à son tour affecte la couleur des fleurs. Nous examinerons plus en détail l’effet du pH sur la solubilité du sel au chapitre 6. |
Questions
★ Questions
- L’équation suivante représente une décomposition réversible :
CaCO3 (s) ⇌ CaO (s) + CO2 (g)
Dans quelles conditions la décomposition dans un conteneur fermé va-t-elle s’achever de sorte qu’il ne reste plus de CaCO3 ?
2. Expliquer comment reconnaître les conditions dans lesquelles les changements de pression affecteraient les systèmes à l’équilibre.
3. Quelle propriété d’une réaction pouvons-nous utiliser pour prédire l’effet d’un changement de température sur la valeur d’une constante d’équilibre ?
4. Qu’arriverait-il à la couleur de la solution de la partie (b) de la figure 4.4.1. si une petite quantité de NaOH était ajoutée et que le Fe(OH)3 précipitait ? Expliquez votre réponse.
5. La réaction suivante se produit lorsqu’un brûleur d’une cuisinière à gaz est allumé:
CH4 (g) + 2 O2 (g) ⇌ CO2 (g) + 2 H2O (g)
Un équilibre entre CH4, O2, CO2 et H2O est-il établi dans ces conditions ? Expliquez votre réponse.
6. Une étape nécessaire à la fabrication de l’acide sulfurique est la formation de trioxyde de soufre, SO3, à partir du dioxyde de soufre, SO2, et de l’oxygène, O2, illustrés ici. À haute température, le taux de formation de SO3 est plus élevé, mais la quantité de SO3 à l’équilibre (concentration ou pression partielle) est plus faible qu’à basse température.
SO2 (g) + O2 (g) ⇌ 2 SO3 (g)
a. L’équilibre constant de la réaction augmente-t-il, diminue-t-il ou reste-t-il à peu près le même lorsque la température augmente ?
b. La réaction est-elle endothermique ou exothermique ?
7. Suggérez quatre façons d’augmenter la concentration d’hydrazine, N2H4, dans un équilibre décrit par l’équation suivante :
N2 (g) + 2 H2 (g) ⇌ N2H4 (g) ΔH = 95 kJ
8. Suggérez quatre façons d’augmenter la concentration de PH3 dans un équilibre décrit par l’équation suivante :
P4 (g) + 6 H2 (g) ⇌ 4 PH3 (g) ΔH = 110,5 kJ
9. Comment une augmentation de la température affectera-t-elle chacun des équilibres suivants ? Comment une diminution du volume de la cuve de réaction affectera-t-elle chacun d’entre eux ?
a. 2 H2O (g) ⇌ 2 H2 (g) + O2 (g) ΔH = 484 kJ
b. N2 (g) + 3 H2 (g) ⇌ 2 NH3 (g) ΔH = -92,2 kJ
c. 2 Br (g) ⇌ Br2 (g) ΔH = -224 kJ
d. H2 (g) + I2 (s) ⇌ 2 HI (g) ΔH = 53 kJ
★★ Questions
10. Le gaz de l’eau est un mélange 1:1 de monoxyde de carbone et d’hydrogène gazeux. Il est appelé gaz de l’eau parce qu’il est formé à partir de vapeur et de carbone chaud dans la réaction suivante : H2O (g) + C (s) ⇌ H2 (g) + CO (g). Le méthanol, un combustible liquide qui pourrait éventuellement remplacer l’essence, peut être préparé à partir de gaz de l’eau et d’hydrogène à haute température et à haute pression en présence d’un catalyseur approprié.
a. Écrivez l’expression de la constante d’équilibre (KC) pour la réaction réversible
2 H2 (g) + CO (g) ⇌ CH3OH (g) ΔH = -90,2 kJ
b. Qu’arrivera-t-il aux concentrations de H2, CO et CH3OH à l’équilibre si l’on ajoute plus de H2 ?
c. Qu’arrivera-t-il aux concentrations de H2, CO et CH3OH à l’équilibre si le CO est éliminé ?
d. Qu’arrivera-t-il aux concentrations de H2, CO et CH3OH à l’équilibre si l’on ajoute du CH3OH ?
e. Qu’arrivera-t-il aux concentrations de H2, CO et CH3OH à l’équilibre si la température du système est augmentée ?
f. Qu’arrivera-t-il aux concentrations de H2, CO et CH3OH à l’équilibre si l’on ajoute plus de catalyseur ?
11. Le fer métallique pur peut être produit par la réduction de l’oxyde de fer(III) avec de l’hydrogène gazeux.
a. Écrivez l’expression de la constante d’équilibre (KC) pour la réaction réversible
Fe2O3 (s) + 3 H2 (g) ⇌ 2 Fe (s) + 3 H2O (g) ΔH = 98,7 kJ
b. Qu’arrivera-t-il à la concentration de chaque réactif et produit à l’équilibre si l’on ajoute plus de Fe ?
c. Qu’arrivera-t-il à la concentration de chaque réactif et produit à l’équilibre si l’on élimine l’H2O ?
d. Qu’arrivera-t-il à la concentration de chaque réactif et produit à l’équilibre si l’on ajoute de l’H2 ?
e. Qu’arrivera-t-il à la concentration de chaque réactif et produit à l’équilibre si la pression sur le système est augmentée en réduisant le volume de la cuve de réaction ?
f. Qu’arrivera-t-il à la concentration de chaque réactif et produit à l’équilibre si la température du système est augmentée ?
12. L’acide acétique est un acide faible qui réagit avec l’eau selon cette équation :
CH3CO2H (aq) + H2O (aq) ⇌ H3O+ (aq) + CH3CO2 (aq)
L’un des éléments suivants augmentera-t-il le pourcentage d’acide acétique qui réagit et produit l’ion CH3CO2- ?
a. Ajout de HCl
b. Ajout de NaOH
c. Ajout de NaCH3CO2
13. Proposez deux façons de réduire la concentration d’équilibre de Ag+ dans une solution de Na+, Cl–, Ag+ et NO3-, en contact avec de l’AgCl solide.
Na+ (aq) + Cl– (aq) + Ag+ (aq) + NO3- (aq) ⇌ AgCl (s) + Na+ (aq) + NO3- (aq)
ΔH = – 65,9 kJ
14. Comment augmenter la pression de la vapeur d’eau dans l’équilibre suivant ?
H2O (l) ⇌ H2O (g) ΔH = 41 kJ
15. Du sulfate d’argent solide supplémentaire, un solide légèrement soluble, est ajouté à une solution d’ions argent et d’ions sulfate à l’équilibre avec le sulfate d’argent solide.
2 Ag+ (aq) + SO42- (aq) ⇌ Ag2SO4 (s)
Laquelle des situations suivantes se produira ?
a. Les concentrations d’Ag+ ou de SO42- ne changeront pas.
b. Le sulfate d’argent ajouté se dissout.
c. Du sulfate d’argent supplémentaire se formera et précipitera de la solution lorsque les ions Ag+ et SO42- se combineront.
d. La concentration en ions Ag+ augmentera et la concentration en ions SO42- diminuera.
16. L’acide aminé alanine a deux isomères, α-alanine et β-alanine. Lorsque des masses égales de ces deux composés sont dissoutes dans des quantités égales d’un solvant, la solution de α–alanine gèle à la température la plus basse. Quelle forme, α-alanine ou β-alanine, possède la plus grande constante d’équilibre pour l’ionisation (HX ⇌ H+ + X–) ?
Réponses
- La quantité de CaCO3 doit être si faible que la PCO2 est inférieure au KP lorsque le CaCO3 s’est complètement décomposé. En d’autres termes, la quantité initiale de CaCO3 ne peut pas générer complètement la totalité de la PCO2 nécessaire à l’équilibre.
- Lorsqu’il y a une quantité inégale de gaz dans les produits par rapport aux réactifs, cela aurait un effet sur le système à l’équilibre.
- Le changement d’enthalpie peut être utilisé. Si la réaction est exothermique, la chaleur produite peut être considérée comme un produit. Si la réaction est endothermique, la chaleur ajoutée peut être considérée comme un réactif. La chaleur additionnelle ferait revenir une réaction exothermique vers les réactifs, mais ferait passer une réaction endothermique vers les produits. Le refroidissement d’une réaction exothermique entraîne le déplacement de la réaction vers le côté du produit ; le refroidissement d’une réaction endothermique l’entraînerait vers le côté des réactifs.
- Le SCN– commencerait à être retiré de la réaction, et le système se déplacerait vers les réactifs. La solution commencera à ressembler à la solution (a).
- Non, il n’est pas à l’équilibre. Comme le système n’est pas confiné, des produits s’échappent continuellement de la région de la flamme ; des réactifs sont également ajoutés en permanence à partir du brûleur et de l’atmosphère environnante.
- (a) Avec l’augmentation de la température, P ∝ T, la pression augmente et la réaction se déplace vers les produits en diminuant la constante d’équilibre, (b) Exothermique
- Ajouter N2 ; ajouter H2 ; diminuer le volume du récipient ; chauffer le mélange.
- Augmenter la température, augmenter la pression, introduire plus d’hydrogène gazeux, diminuer le volume, éliminer le PH3
- (a) (i) décalage vers la droite, (ii) décalage vers la gauche, (b) (i)décalage vers la gauche, (ii) décalage vers la droite, (c) (i) décalage vers la gauche, (ii) décalage vers la droite, (d) (i) décalage vers la droite, (ii) décalage vers la gauche
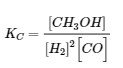
b. [H2] augmente, [CO] diminue, [CH3OH] augmente
c. [H2] augmente, [CO] diminue, [CH3OH] diminue
d. Augmentation de [H2], augmentation de [CO], augmentation de [CH3OH].
e. [H2] augmente, [CO] augmente, [CH3OH] diminue
f. aucun changement
11. (a) KC = [H2O]3 / [H2]3, (b) aucun effet, (c) déplacement vers les produits, (d) déplacement vers les produits, (e) la réaction n’est pas affectée par la pression, (f) déplacement vers les produits
12. B
13. Ajoutez à la solution du NaCl ou un autre sel qui produit du Cl–. Le refroidissement de la solution force l’équilibre vers la droite, ce qui précipite davantage de AgCl (s).
14. Diminuer la température
15. A
16. α-alanine
Un équilibre soumis à un stress va se déplacer de manière à contrer le stress et à rétablir l'équilibre
Relation linéaire entre ln K et les enthalpies et entropies standard, décrivant la dépendance en température de la constante d'équilibre
Niveau de caractère aléatoire (ou de désordre) d'un système, ou mesure de la dispersion de l'énergie des molécules dans le système

 L
L
