1.2 – Détermination des formules chimiques
Maintenant que vous avez acquis une bonne compréhension 1) des bases de la liaison chimique dans les composés ioniques et covalents et 2) du concept de la mole et de sa relation avec les masses et les masses molaires, nous pouvons maintenant intégrer ces connaissances dans cette section. Ici, nous commençons notre discussion sur l’expression et la compréhension des formules chimiques des composés et l’utilisation de ces formules pour écrire des équations chimiques équilibrées.
Formules chimiques
Une formule moléculaire est une représentation d’une molécule qui utilise des symboles chimiques pour indiquer les types d’atomes, suivis d’indices pour montrer le nombre d’atomes de chaque type dans la molécule. (Un indice n’est utilisé que lorsque plus d’un atome d’un type donné est présent). Les formules moléculaires sont également utilisées comme abréviations pour les noms des composés.
La formule structurale d’un composé donne les mêmes informations que sa formule moléculaire (les types et le nombre d’atomes dans la molécule) mais montre également comment les atomes sont reliés dans la molécule. La formule structurale du méthane contient les symboles d’un atome C et de quatre atomes H, indiquant le nombre d’atomes dans la molécule (figure 1.2.1). L’utilisation de lignes dans les formules structurales représente les liaisons covalentes qui maintiennent les atomes ensemble (par le partage des électrons entre les atomes). Nous discuterons des liaisons chimiques et verrons plus tard comment prédire l’arrangement des atomes dans une molécule. Pour l’instant, sachez simplement que les lignes sont une indication de la façon dont les atomes sont reliés dans une molécule. Un modèle en forme de boule et de bâton montre l’arrangement géométrique des atomes avec des tailles atomiques non à l’échelle, et un modèle de remplissage de l’espace montre les tailles relatives des atomes.
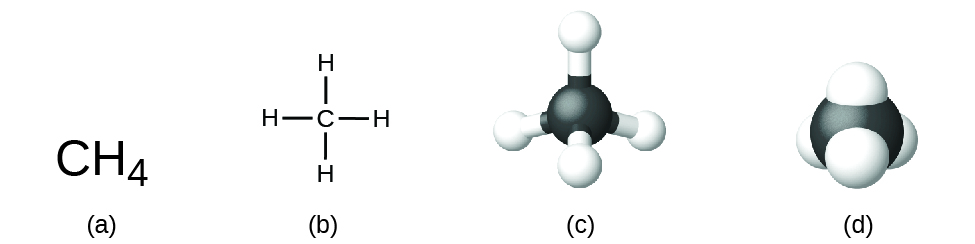
Figure 1.2.1 Une molécule de méthane peut être représentée par (a) une formule moléculaire, (b) une formule structurale, (c) un modèle de type “balle et bâton” et (d) un modèle de remplissage de l’espace. Les atomes de carbone et d’hydrogène sont représentés par des sphères noires et blanches, respectivement.
Bien que de nombreux éléments soient constitués d’atomes individuels discrets (par exemple le carbone et les gaz nobles comme l’hélium, le néon et l’argon), certains existent à l’état naturel sous forme de molécules composées de deux ou plusieurs atomes de l’élément liés chimiquement entre eux. Par exemple, la plupart des échantillons des éléments hydrogène, oxygène et azote sont composés de molécules qui contiennent deux atomes chacune (appelées molécules diatomiques) et ont donc les formules moléculaires H2, O2 et N2, respectivement. En d’autres termes, dans leur état standard naturel, l’oxygène et l’azote existent sous forme de molécules diatomiques et très rarement sous forme d’atomes uniques d’oxygène ou d’azote dans leur état standard naturel. Les autres éléments que l’on trouve couramment sous forme de molécules diatomiques sont le fluor (F2), le chlore (Cl2), le brome (Br2) et l’iode (I2). La forme la plus courante de l’élément soufre est composée de molécules qui comportent huit atomes de soufre ; sa formule moléculaire est S8 (figure 1.2.2).
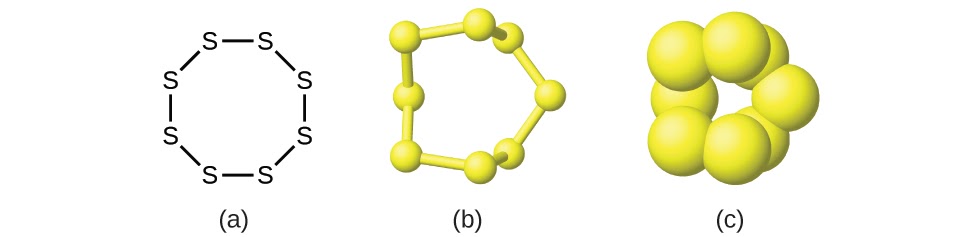 Figure 1.2.2 Une molécule de soufre est composée de huit atomes de soufre et s’écrit donc S8. Elle peut être représentée par (a) une formule structurelle, (b) un modèle de type “balle et bâton” et (c) un modèle de remplissage de l’espace. Les atomes de soufre sont représentés par des sphères jaunes.
Figure 1.2.2 Une molécule de soufre est composée de huit atomes de soufre et s’écrit donc S8. Elle peut être représentée par (a) une formule structurelle, (b) un modèle de type “balle et bâton” et (c) un modèle de remplissage de l’espace. Les atomes de soufre sont représentés par des sphères jaunes.
Il est extrêmement important de noter, à mesure que vous progressez en chimie, qu’un indice suivant un symbole et un nombre devant un symbole ne représentent pas la même chose. Par exemple, H2 et 2H représentent des espèces nettement différentes. H2 est une formule moléculaire ; il représente une molécule diatomique d’hydrogène, constituée de deux atomes de l’élément qui sont liés par covalence. L’expression 2H, en revanche, indique deux atomes d’hydrogène séparés qui ne sont pas combinés en tant qu’unité. L’expression 2H2 représente deux molécules d’hydrogène diatomique (figure 1.2.3).
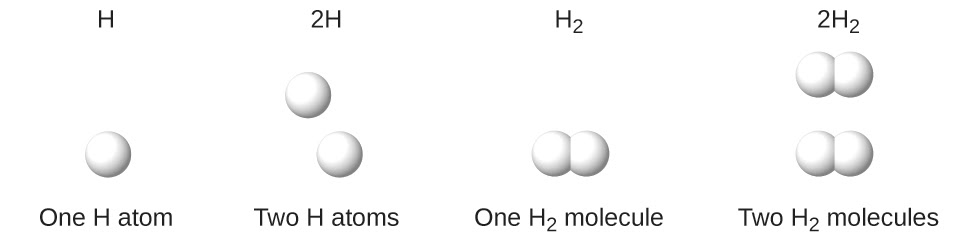
Figure 1.2.3 Les symboles H, 2H, H2 et 2H2 représentent des entités très différentes.
Il est important de noter que la formule empirique n’est pas la même que la formule moléculaire (dont il a été question au début de cette section) ; dans une formule moléculaire, les indices indiquent le nombre réel d’atomes de chaque élément dans une molécule du composé alors que la formule empirique ne donne que le rapport en nombre entier le plus simple des atomes/ions dans le composé.
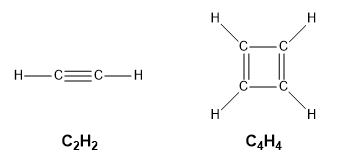
Les formules empiriques sont souvent une première étape dans la détermination d’une formule moléculaire. L’exemple suivant met en évidence la différence entre les formules empiriques et les formules moléculaires. Une molécule, en revanche, est constituée d’atomes liés par covalence pour former une seule unité discrète. Si nous prenons une molécule d’éthyne, C2H2, et multiplions sa formule par 2 pour obtenir C4H4, nous n’obtenons plus d’éthyne mais du cyclobutadiène, C4H4, qui a une structure différente et des propriétés différentes :
Comme nous le verrons plus en détail dans le dernier chapitre sur la liaison moléculaire, les composés ioniques forment des structures réticulaires qui ont toujours un nombre entier multiple d’unités de formule répétées. Tant que nous ajoutons des multiples en nombre entier d’unités de formule du même composé ionique, nous pourrions hypothétiquement avoir une structure de réseau infiniment grande. Par conséquent, par souci de simplicité, nous utilisons la formule empirique pour décrire le rapport d’ions le plus simple. Le sel de table est désigné sous le nom de NaCl car dans toute structure réticulaire de taille quelconque, que vous ayez 10 Na+ et 10 Cl– ou 1000 Na+ et 1000 Cl–, il doit toujours y avoir un cation sodium (Na+) pour chaque anion chlorure (Cl–). Même si l’on écrit Na10Cl10, il sera toujours simplifié en NaCl, et l’identité du composé reste la même.
En résumé, les formules empiriques vous donnent le rapport des différents éléments dans une molécule et les formules moléculaires vous donnent le nombre réel d’atomes dans la molécule.
Prenons un autre exemple : la formule moléculaire de l’acide acétique, le composant qui donne au vinaigre son goût piquant, est le C2H4O2. Cette formule indique qu’une molécule d’acide acétique (figure 1.2.4) contient deux atomes de carbone, quatre atomes d’hydrogène et deux atomes d’oxygène. Le rapport des atomes est de 2:4:2. La division par le plus petit dénominateur commun (2) donne le rapport d’atomes le plus simple, en nombre entier, 1:2:1. La formule empirique est donc CH2O (mais souvenez-vous : cette formule ne désigne pas la structure réelle de la molécule – CH2O correspond au formaldéhyde, qui est utilisé pour la conservation des spécimens biologiques et même des corps de personnes décédées !) Notez qu’une formule moléculaire est toujours un multiple entier d’une formule empirique.
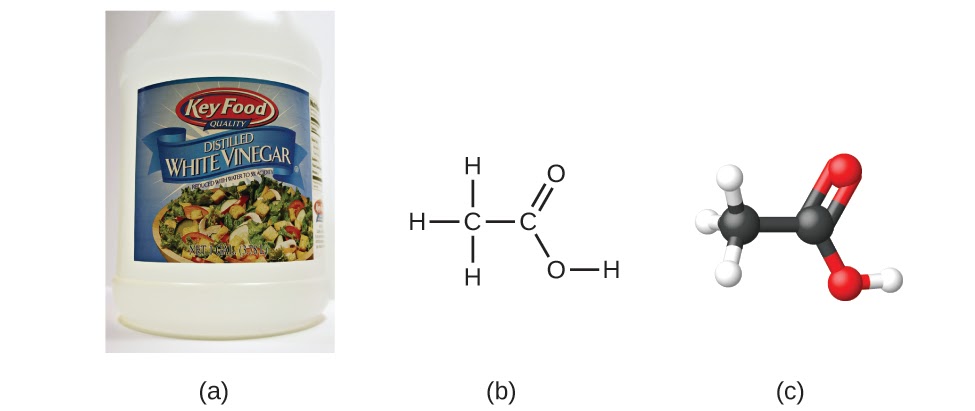
Figure 1.2.4. (a) Le vinaigre contient de l’acide acétique, C2H4O2, qui a une formule empirique de CH2O. Il peut être représenté par (b) une formule structurale et (c) un modèle en forme de boule et de bâton. (crédit a : modification du travail par “HomeSpot HQ”/Flickr)
Détermination des formules empiriques
L’approche la plus courante pour déterminer la formule chimique d’un composé consiste à mesurer d’abord les masses de ses éléments constitutifs. Cependant, nous devons garder à l’esprit que les formules chimiques représentent le nombre relatif, et non la masse, des atomes de la substance. Par conséquent, toute donnée expérimentale impliquant la masse doit être utilisée pour calculer le nombre correspondant d’atomes dans le composé. Pour ce faire, nous pouvons utiliser les masses molaires pour convertir la masse de chaque élément en un certain nombre de moles. Nous considérons ensuite les moles de chaque élément les unes par rapport aux autres, en convertissant ces nombres en un rapport de nombres entiers qui peut être utilisé pour dériver la formule empirique de la substance.
Prenons un échantillon d’un composé dont on a déterminé qu’il contient 1,71 g de C et 0,287 g de H. Les nombres d’atomes correspondants (en moles) sont :
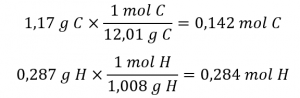
Ainsi, nous pouvons représenter avec précision ce composé par la formule C0,142H0,248. Bien entendu, selon la convention acceptée, les formules contiennent des indices entiers, ce qui peut être obtenu en divisant chaque indice par l’indice le plus petit :
(Rappelons que les indices de “1” ne sont pas écrits mais plutôt sous-entendus si aucun autre chiffre n’est présent).
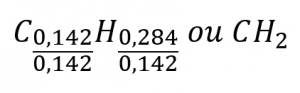
La formule empirique de ce composé est donc CH2. Il peut s’agir ou non de la formule moléculaire du composé également ; cependant, nous aurions besoin d’informations supplémentaires pour faire cette détermination (comme nous le verrons plus loin dans cette section).
Prenons un autre exemple : un échantillon d’un composé contenant 5,31 g de Cl et 8,40 g de O. En suivant la même approche, on obtient une formule empirique provisoire de :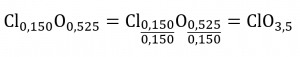
Dans ce cas, la division par le plus petit indice nous laisse encore un indice décimal dans la formule empirique. Pour le convertir en un nombre entier, nous devons multiplier chacun des indices par deux, en conservant le même rapport atomique et en obtenant Cl2O7 comme formule empirique finale.
En résumé, les formules empiriques sont dérivées des masses d’éléments mesurées expérimentalement par :
1. Déterminer le nombre de moles de chaque élément à partir de sa masse
2. Diviser la quantité molaire de chaque élément par la plus petite quantité molaire pour obtenir les indices d’une formule empirique provisoire
3. Multiplication de tous les coefficients par un nombre entier, si nécessaire, afin d’obtenir le plus petit rapport en nombre entier des indices
La figure 1.2.5 présente cette procédure sous forme de diagramme de flux pour une substance contenant les éléments A et X.
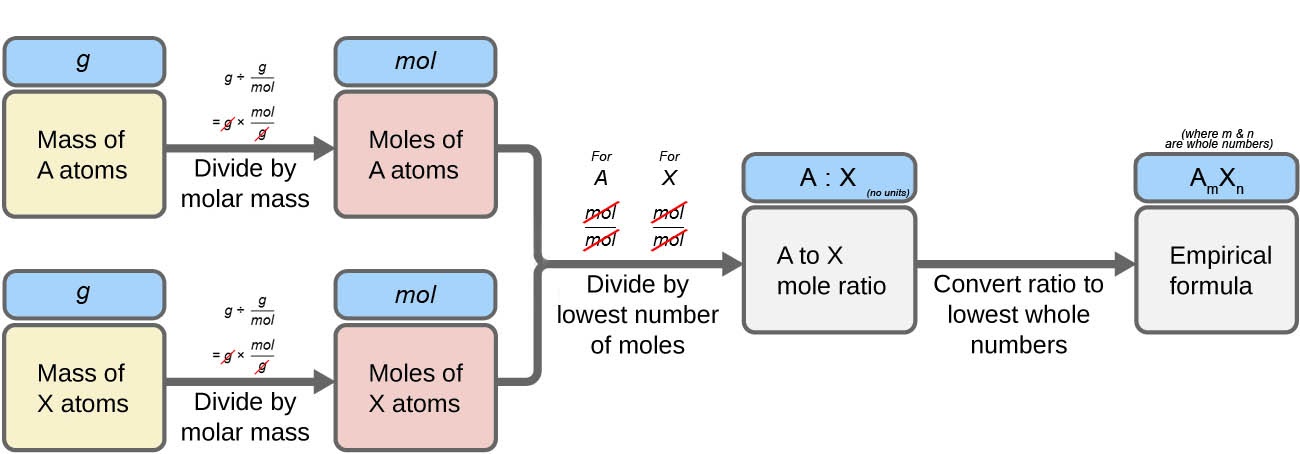
Figure 1.2.5. La formule empirique d’un composé peut être dérivée des masses de tous les éléments de l’échantillon.
Exemple 1.2.1 – Déterminer la formule empirique d’un composé à partir de la masse de ses éléments
Un échantillon de l’hématite, un minéral noir (Figure 1.2.6), un oxyde de fer présent dans de nombreux minerais de fer, contient 34,97 g de fer et 15,03 g d’oxygène. Quelle est la formule empirique de hematite ?

Figure 1.2.6. L’hématite est un oxyde de fer qui est utilisé en bijouterie. (crédit : Mauro Cateb)
Solution
Pour ce problème, on nous donne la masse en grammes de chaque élément. Commencez par trouver les moles de chacun:
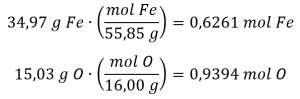
Ensuite, on obtient le rapport molaire fer/oxygène en le divisant par le nombre de moles le moins élevé :
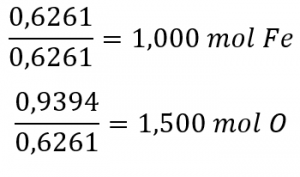
Le rapport est de 1,000 mol de fer pour 1,500 mol d’oxygène (Fe1O1,5). Enfin, multipliez le rapport par deux pour obtenir le plus petit indice de nombre entier possible tout en conservant le rapport fer/oxygène correct :
2 (Fe1O1.5) = Fe2O3
La formule empirique est Fe2O3.
Vérifiez votre apprentissage 1.2.1 – Déterminer la formule empirique d’un composé à partir de la masse de ses éléments
Quelle est la formule empirique d’un composé si un échantillon contient 0,130 g d’azote et 0,370 g d’oxygène ?
Réponse :
N2O5
Déterminer les formules empiriques à partir de la composition en pourcentage
Pour ce qui est de l’élaboration de formules empiriques, il faut considérer les cas où la composition en pourcentage d’un composé est disponible plutôt que les masses absolues des éléments constitutifs du composé. Dans de tels cas, le pourcentage de composition peut être utilisé pour calculer les masses des éléments présents dans n’importe quelle masse de composé; ces masses peuvent ensuite être utilisées pour dériver la formule empirique de la manière habituelle.
Exemple 1.2.2 – Détermination d’une formule empirique à partir de la composition en pourcentage
La fermentation bactérienne du grain pour produire de l’éthanol forme un gaz dont la composition en pourcentage est de 27,29 % C et 72,71% O (figure 1.2.7). Quelle est la formule empirique de ce gaz?

Figure 1.2.7. Un oxyde de carbone est éliminé de ces cuves de fermentation par les gros tuyaux en cuivre situés au sommet. (crédit : “Dual Freq“/Wikimedia Commons)
Solution
Comme l’échelle des pourcentages est de 100, il est plus pratique de calculer la masse des éléments présents dans un échantillon de 100 g. Le calcul est “plus pratique” car, selon la définition de la composition en pourcentage, la masse d’un élément donné en grammes est numériquement équivalente au pourcentage de masse de l’élément. Cette équivalence numérique résulte de la définition de l’unité “pourcentage”, dont le nom est dérivé de l’expression latine “pour centum” qui signifie “par cent”. Compte tenu de cette définition, les pourcentages massiques fournis peuvent être plus facilement exprimés sous forme de fractions :
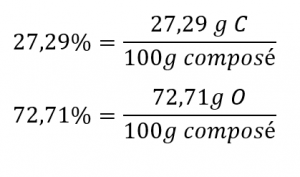
Les quantités molaires de carbone et d’hydrogène dans un échantillon de 100 g sont calculées en divisant la masse de chaque élément par sa masse molaire :
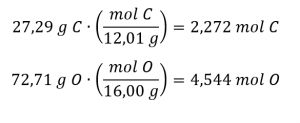
Les coefficients de la formule empirique provisoire sont obtenus en divisant chaque quantité molaire par la plus petite des deux :
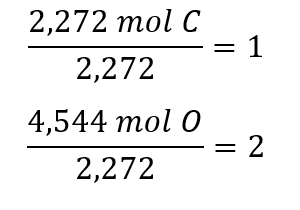
Comme le rapport résultant est d’un atome de carbone pour deux atomes d’oxygène, la formule empirique est CO2.
Vérifiez votre apprentissage 1.2.2 – Détermination d’une formule empirique à partir de la composition en pourcentage
Quelle est la formule empirique d’un composé contenant 40,0 % de C, 6,71 % de H et 53,28 % de O ?
Réponse :
CH2O
Dérivation de formules empiriques à partir de l’analyse de la combustion
La composition élémentaire des hydrocarbures (composés organiques constitués entièrement d’atomes de carbone et d’hydrogène) et des composés apparentés contenant C, H et d’autres éléments peut être déterminée par l’analyse de la combustion. Dans l’analyse par combustion, un échantillon pesé du composé est chauffé à haute température sous un courant d’oxygène gazeux (O2), ce qui entraîne sa combustion complète pour donner des produits gazeux d’identité connue. La combustion complète des hydrocarbures, par exemple, donnera du dioxyde de carbone et de l’eau comme seuls produits. Les produits de combustion gazeux sont balayés par des dispositifs de collecte séparés et pré-pesés contenant des composés qui absorbent sélectivement chaque produit (figure 1.2.8). L’augmentation de masse de chaque dispositif correspond à la masse du produit absorbé et peut être utilisée dans un calcul stœchiométrique approprié pour dériver la masse de l’élément concerné.
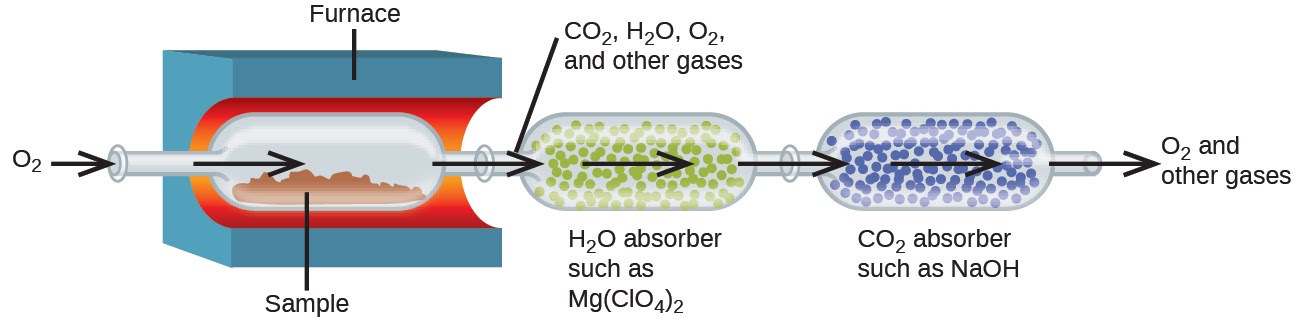
Figure 1.2.8 Ce schéma illustre les composantes de base d’un appareil d’analyse de combustion pour déterminer la teneur en carbone et en hydrogène d’un échantillon.
|
Problèmes d’analyse de la combustion – Hypothèse sous-jacente |
|
Vous rencontrerez fréquemment des problèmes d’analyse de la combustion lorsque vous vous entraînerez à déterminer des formules empiriques (et plus tard moléculaires) à partir de données obtenues sur la collecte de produits de combustion. Pour tous les problèmes d’analyse de la combustion que vous rencontrerez, gardez toujours à l’esprit l’hypothèse sous-jacente suivante : la réaction de combustion est complète. En d’autres termes, supposez qu’il n’y a pas d’autres produits secondaires produits dans la réaction de combustion ; seuls les composés du produit mentionnés dans le problème sont formés. Par conséquent, pour les hydrocarbures et les composés contenant C, H et O, cela signifie que seuls du dioxyde de carbone gazeux et de l’eau sont produits. Pour les autres composés contenant d’autres éléments tels que le S et le N, vous pouvez vous attendre à voir d’autres composés se former également, notamment le SO2 et le NO2 ; ceux-ci seront mentionnés dans la question pour vous aider à déterminer l’identité du composé inconnu. S’il s’agissait d’une combustion incomplète, des produits secondaires tels que le monoxyde de carbone, le carbone (suie) et l’oxyde nitrique (NO) se formeraient, ce qui rendrait extrêmement difficile, voire impossible, la détermination de la composition des éléments et de l’identité de votre échantillon. |
Exemple 1.2.3 – Analyse de la combustion
Le polyéthylène est un polymère d’hydrocarbure utilisé pour produire des sacs de stockage de nourriture et de nombreux autres articles en plastique souple. L’analyse de la combustion d’un échantillon de 0,00126 g de polyéthylène donne 0,00394 g de CO2 et 0,00161 g de H2O. Quelle est la formule empirique du polyéthylène ?
Solution
L’hypothèse principale de cet exercice est que tout le carbone de l’échantillon brûlé est converti en dioxyde de carbone (CO2), et tout l’hydrogène de l’échantillon est converti en eau, H2O (notez que l’échantillon, étant un hydrocarbure, est représenté par CxHy) :
CxHy (s) + excès d’O2 (g) ⟶ x CO2 (g) + y 2 H2O (g)
Notez qu’une équation équilibrée n’est pas nécessaire pour la tâche à accomplir. Pour obtenir la formule empirique du composé, seuls les indices x et y sont nécessaires.
Tout d’abord, calculer les quantités molaires de carbone et d’hydrogène dans l’échantillon, en utilisant les masses fournies de dioxyde de carbone et d’eau, respectivement. Avec ces quantités molaires, la formule empirique du composé peut être écrite comme décrit dans le chapitre précédent de ce texte. Un aperçu de cette approche est donné dans l’organigramme suivant :
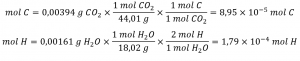
La formule empirique du composé est ensuite dérivée en identifiant les plus petits multiples en nombre entier pour ces quantités molaires. Le rapport molaire H sur C est
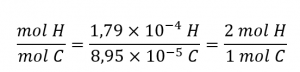
et la formule empirique pour le polyéthylène est CH2.
Vérifiez votre apprentissage 1.2.3 – Analyse de la combustion
Un échantillon de 0,00215 g de polystyrène, un polymère composé de carbone et d’hydrogène, a produit 0,00726 g de CO2 et 0,00148 g de H2O par analyse de combustion. Quelle est la formule empirique du polystyrène ?
Réponse
CH
Vérifiez votre apprentissage 1.2.4 – Analyse de la combustion
L’acide salicylique est utilisé pour fabriquer de l’aspirine. Elle ne contient que du carbone, de l’oxygène et de l’hydrogène. La combustion d’un échantillon de 43,5 mg de ce composé a produit 97,1 mg de CO2 et 17,0 mg de H2O. Quelle est la formule empirique de l’acide salicylique ?
Solution
L’hypothèse principale de cet exercice est que tout le carbone de l’échantillon brûlé est converti en dioxyde de carbone (CO2), tout l’hydrogène de l’échantillon est converti en eau (H2O) et tout l’oxygène est converti en dioxyde de carbone ou en eau.
Tout d’abord, calculer les quantités molaires de carbone et d’hydrogène dans l’échantillon, en utilisant les masses fournies de dioxyde de carbone et d’eau, respectivement :
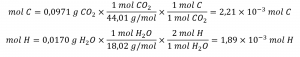
En connaissant les masses molaires du carbone et de l’hydrogène, nous pouvons convertir ces valeurs molaires en masses; par conséquent, celles-ci représenteront la masse de carbone et d’hydrogène dans l’échantillon :
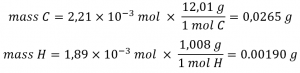 Si nous connaissons la masse de l’échantillon et la masse de carbone et d’hydrogène individuellement dans l’échantillon, la masse restante doit être de l’oxygène, dont nous trouvons la quantité molaire :
Si nous connaissons la masse de l’échantillon et la masse de carbone et d’hydrogène individuellement dans l’échantillon, la masse restante doit être de l’oxygène, dont nous trouvons la quantité molaire :
masseO = masseéchantillon – masseC – masseH
massO = 0,0435 g – 0,0265 g – 0,00190 g
massO= 0,0151 g
![]()
La formule empirique du composé est ensuite dérivée en identifiant les plus petits multiples en nombre entier pour ces quantités molaires. Le rapport molaire C:O et H:O est
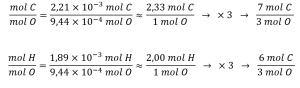
Ainsi, la formule empirique de l’acide salicylique est C7H6O3.
Vérifiez votre apprentissage 1.2.5 – Analyse de la combustion
Un échantillon de 2,0714 g contenant du carbone, de l’hydrogène et de l’oxygène a été brûlé dans un appareil d’analyse de la combustion ; 1,928 g de H2O et 4,709 g de CO2 ont été produits. Séparément, la masse molaire de l’échantillon s’est avérée être de 116,16 g/mol. Déterminez la formule empirique de l’échantillon.
Réponse :
Formule empirique : C3H6O
Détermination des formules moléculaires
Rappelons que les formules empiriques sont des symboles représentant les nombres relatifs des éléments d’un composé. Pour déterminer le nombre absolu d’atomes qui composent une seule molécule d’un composé covalent, il faut connaître à la fois sa formule empirique et sa masse moléculaire ou masse molaire. Ces quantités peuvent être déterminées expérimentalement par diverses techniques de mesure. La masse moléculaire, par exemple, est souvent dérivée du spectre de masse du composé (voir la discussion de cette technique dans l’encadré ci-dessous). La masse molaire peut être mesurée par un certain nombre de méthodes expérimentales, dont beaucoup seront présentées dans les chapitres suivants de ce texte.
|
Au cas où vous seriez intéressé…Spectrométrie de masse |
|
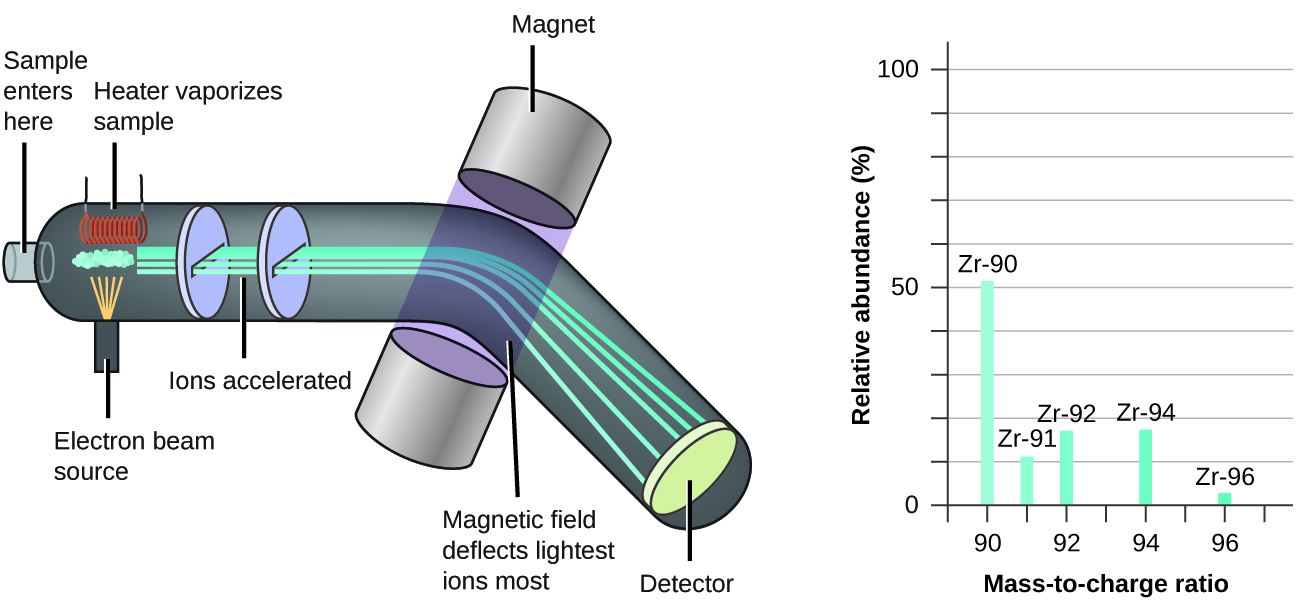
La spectrométrie de masse (MS) est largement utilisée en chimie, en médecine légale, en médecine, en sciences de l’environnement et dans de nombreux autres domaines pour analyser et aider à identifier les substances dans un échantillon de matériau. Dans un spectromètre de masse typique (figure 1.2.9) : L’échantillon est vaporisé et exposé à un faisceau d’électrons de haute énergie qui provoque la charge électrique des atomes (ou des molécules) de l’échantillon, généralement par la perte d’un ou plusieurs électrons. Les cations traversent un champ électrique ou magnétique (variable) qui dévie la trajectoire de chaque cation dans une mesure qui dépend à la fois de sa masse et de sa charge (de la même manière que la trajectoire d’un gros roulement à billes en acier qui passe devant un aimant est moins déviée que celle d’un petit acier BB). Les ions sont détectés, et un graphique du nombre relatif d’ions générés en fonction de leur rapport masse/charge (un spectre de masse) est établi – la hauteur de chaque caractéristique verticale ou pic dans un spectre de masse est proportionnelle à la fraction de cations ayant le rapport masse/charge spécifié.
Figure 1.2.9. L’analyse du zirconium dans un spectromètre de masse produit un spectre de masse avec des pics montrant les différents isotopes du Zr. Depuis son utilisation initiale lors du développement de la théorie atomique moderne, la spectroscopie de masse est devenue un outil puissant pour l’analyse chimique dans un large éventail d’applications. Pour plus d’informations, vous pouvez consulter les vidéos suivantes (podcast vidéo n°1 ; vidéo éducative n°2 de la Société royale de chimie) qui expliquent et animent le processus de spectrométrie de masse. |
Les formules moléculaires sont obtenues en comparant la masse moléculaire ou molaire du composé à la masse de la formule empirique. Comme son nom l’indique, la masse d’une formule empirique est la somme des masses atomiques moyennes de tous les atomes représentés dans une formule empirique. Si nous connaissons la masse moléculaire (ou molaire) de la substance, nous pouvons la diviser par la masse de la formule empirique afin d’identifier le nombre d’unités de formule empirique par molécule, que nous désignons par n :
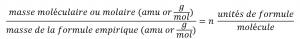
La formule moléculaire est ensuite obtenue en multipliant chaque indice de la formule empirique par n, comme le montre la formule empirique générique AxBy :
(AxBy)n = AnxBny
Prenons par exemple un composé covalent dont la formule empirique est déterminée comme étant CH2O. La masse de la formule empirique de ce composé est d’environ 30 amu (la somme de 12 amu pour un atome de C, 2 amu pour deux atomes de H, et 16 amu pour un atome de O). Si la masse moléculaire du composé est déterminée comme étant de 180 amu, cela indique que les molécules de ce composé contiennent six fois le nombre d’atomes représentés dans la formule empirique :
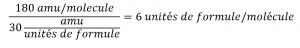
Les molécules de ce composé sont ensuite représentées par des formules moléculaires dont les indices sont six fois plus élevés que ceux de la formule empirique :
(CH2O)6 = C6H12O6
Notez que cette même approche peut être utilisée lorsque la masse molaire (g/mol) est utilisée au lieu de la masse moléculaire (amu). Dans ce cas, nous considérons simplement une mole d’unités de formule empirique et de molécules, par opposition à des unités et des molécules uniques.
Exemple 1.2.4 – Détermination des formules moléculaires
La nicotine (figure 1.2.10), qui est principalement responsable de la nature addictive des cigarettes, contient 74,02 % de C, 8,710 % de H et 17,27 % de N. Si 40,57 g de nicotine contiennent 0,2500 mol de nicotine, quelle est la formule moléculaire ?
.
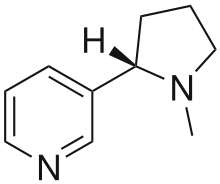
Figure 1.2.10 Structure 3D et 2D de la nicotine
Solution
La détermination de la formule moléculaire à partir des données fournies nécessitera une comparaison de la masse de la formule empirique du composé avec sa masse molaire. Dans un premier temps, utilisez la composition en pourcentage pour obtenir la formule empirique du composé. En supposant que cela soit pratique, un échantillon de 100 g de nicotine donne les quantités molaires suivantes de ses éléments :
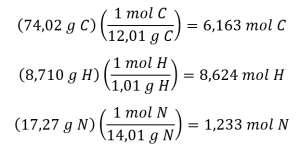
Ensuite, nous calculons les rapports molaires de ces éléments par rapport à l’élément le moins abondant, N.
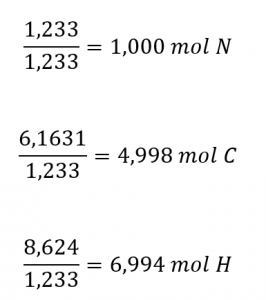 Les rapports molaires C-N et H-N sont suffisamment proches des nombres entiers, et la formule empirique est donc C5H7N. La masse de la formule empirique pour ce composé est donc de 81,13 uma/unité de formule, ou 81,13 g/unité de formule molaire.
Les rapports molaires C-N et H-N sont suffisamment proches des nombres entiers, et la formule empirique est donc C5H7N. La masse de la formule empirique pour ce composé est donc de 81,13 uma/unité de formule, ou 81,13 g/unité de formule molaire.
Nous calculons la masse molaire de la nicotine à partir de la masse donnée et de la quantité molaire du composé :
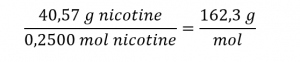
La comparaison de la masse molaire et de la masse de la formule empirique indique que chaque molécule de nicotine contient deux unités de formule :
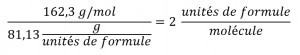
Ainsi, nous pouvons déduire la formule moléculaire de la nicotine de la formule empirique en multipliant chaque indice par deux :
(C5H7N)2 = C10H14N2
Vérifiez votre apprentissage 1.2.6 – Détermination des formules moléculaires
Un important fabricant de colorants textiles a mis au point un nouveau colorant jaune. Le colorant a une composition en pourcentage de 75,95 % C, 17,72 % N et 6,33 % H en masse avec une masse molaire d’environ 240 g/mol. Déterminez la formule moléculaire du colorant.
Réponse
C15H15N3
Il est important d’être conscient qu’il est possible que les mêmes atomes soient disposés de différentes manières : Les composés ayant la même formule moléculaire peuvent avoir des liaisons différentes d’un atome à l’autre et donc des structures et des propriétés différentes, ce sont les isomères. Vous en apprendrez beaucoup plus sur les différents types d’isomères dans le document CHM 1321 (Chimie organique I).
Écrire et équilibrer des équations chimiques
Lorsque les atomes gagnent ou perdent des électrons pour produire des ions ou se combinent avec d’autres atomes pour former des molécules, leurs symboles sont modifiés ou combinés pour générer des formules chimiques (comme nous l’avons vu jusqu’à présent dans cette section) qui représentent correctement ces espèces. L’extension de cette symbolique pour représenter à la fois les identités et les quantités relatives des substances subissant une modification/réaction chimique (ou physique) implique l’écriture et l’équilibrage d’une équation chimique. Prenons comme exemple la réaction entre une molécule de méthane (CH4) et deux molécules d’oxygène diatomique (O2) pour produire une molécule de dioxyde de carbone (CO2) et deux molécules d’eau (H2O). L’équation chimique représentant ce processus est fournie dans la moitié supérieure de la figure 1.2.11, avec des modèles moléculaires remplissant l’espace dans la moitié inférieure de la figure.
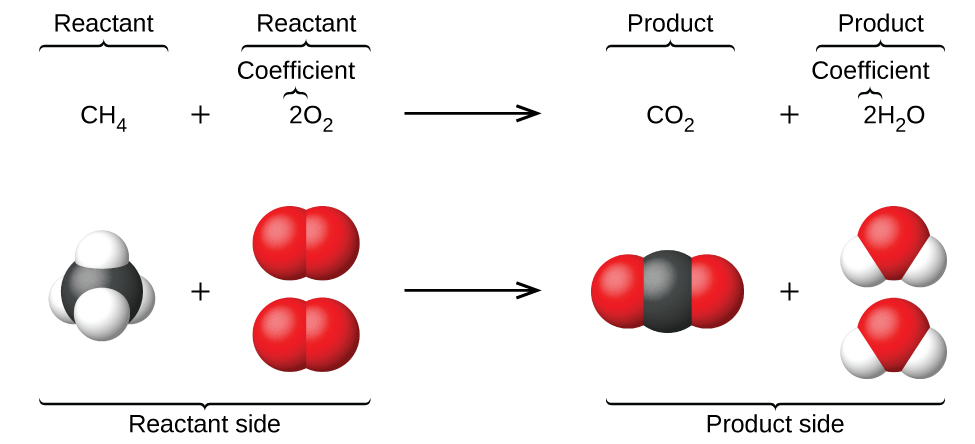
Figure 1.2.11 La réaction entre le méthane et l’oxygène pour produire du dioxyde de carbone et de l’eau (en bas) peut être représentée par une équation chimique utilisant des formules (en haut).
Cet exemple illustre les aspects fondamentaux de toute équation chimique :
1. Les substances en réaction sont appelées réactifs, et leurs formules sont placées sur le côté gauche de l’équation.
2. Les substances générées par la réaction sont appelées des produits, et leurs formules sont placées du côté droit de l’équation.
3. Les signes plus (+) séparent les formules individuelles des réactifs et des produits, et une flèche (⟶) sépare les côtés réactif et produit (gauche et droite) de l’équation.
4. Les nombres relatifs d’espèces de réactifs et de produits sont représentés par des coefficients (nombres placés immédiatement à gauche de chaque formule). Un coefficient de 1 est généralement omis.
Il est courant d’utiliser les plus petits coefficients de nombres entiers possibles dans une équation chimique, comme c’est le cas dans cet exemple. Il faut toutefois savoir que ces coefficients représentent les nombres relatifs de réactifs et de produits et qu’ils peuvent donc être correctement interprétés comme des ratios. Le méthane et l’oxygène réagissent pour donner du dioxyde de carbone et de l’eau dans un rapport de 1:2:1:2. Ce rapport est respecté si les nombres de ces molécules sont, respectivement, 1-2-1-2, ou 2-4-2-4, ou 3-6-3-6, et ainsi de suite (figure 1.2.12). De même, ces coefficients peuvent être interprétés par rapport à n’importe quelle unité de quantité (nombre), et cette équation peut donc être correctement lue de plusieurs façons, notamment :
Une molécule de méthane et deux molécules d’oxygène réagissent pour donner une molécule de dioxyde de carbone et deux molécules d’eau.
Une douzaine de molécules de méthane et deux douzaines de molécules d’oxygène réagissent pour donner une douzaine de molécules de dioxyde de carbone et deux douzaines de molécules d’eau.
Une mole de molécules de méthane et 2 moles de molécules d’oxygène réagissent pour donner 1 mole de molécules de dioxyde de carbone et 2 moles de molécules d’eau.
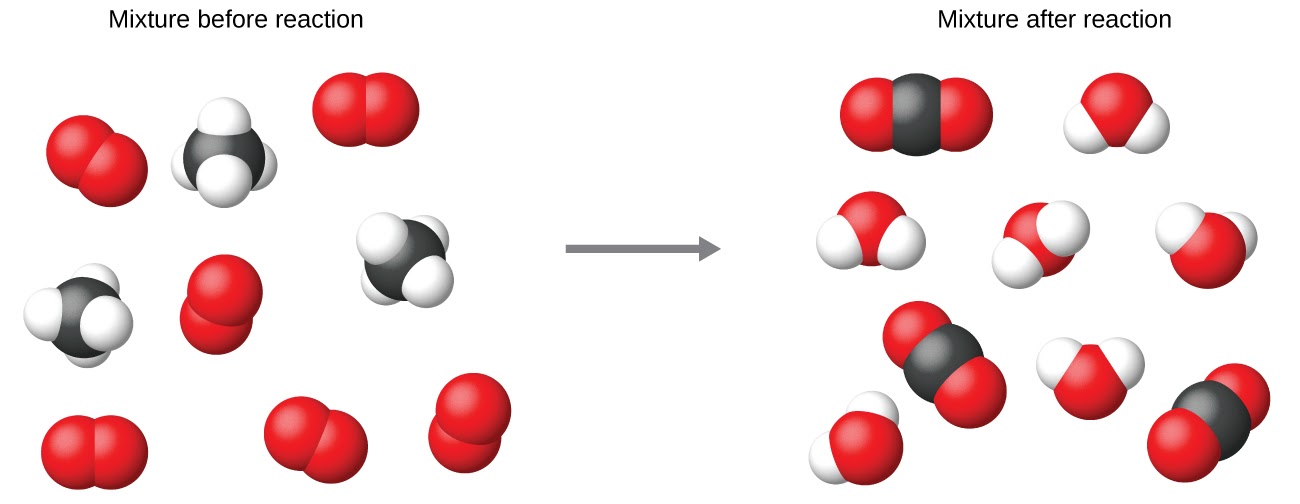 Figure 1.2.12 Indépendamment du nombre absolu de molécules impliquées, les rapports entre le nombre de molécules de chaque espèce qui réagissent (les réactifs) et les molécules de chaque espèce qui se forment (les produits) sont les mêmes et sont donnés par l’équation de la réaction chimique.
Figure 1.2.12 Indépendamment du nombre absolu de molécules impliquées, les rapports entre le nombre de molécules de chaque espèce qui réagissent (les réactifs) et les molécules de chaque espèce qui se forment (les produits) sont les mêmes et sont donnés par l’équation de la réaction chimique.
Équilibrer les équations
L’équation chimique décrite au point 4.1 est équilibrée, ce qui signifie que des nombres égaux d’atomes pour chaque élément participant à la réaction sont représentés du côté du réactif et du produit. C’est une exigence à laquelle l’équation doit satisfaire pour être conforme à la loi de conservation de la matière. Elle peut être confirmée en additionnant simplement les nombres d’atomes de chaque côté de la flèche et en comparant ces sommes pour s’assurer qu’elles sont égales. Notez que le nombre d’atomes pour un élément donné est calculé en multipliant le coefficient de toute formule contenant cet élément par l’indice de l’élément dans la formule. Si un élément apparaît dans plus d’une formule d’un côté donné de l’équation, le nombre d’atomes représentés dans chacune doit être calculé et ensuite additionné. Par exemple, les deux espèces de produits dans l’exemple de réaction de la figure 1.2.11, CO2 et H2O, contiennent l’élément oxygène, et donc le nombre d’atomes d’oxygène du côté produit de l’équation est
![]()
Il est confirmé que l’équation de la réaction entre le méthane et l’oxygène pour produire du dioxyde de carbone et de l’eau est équilibrée selon cette approche, comme le montre le tableau ci-dessous :
CH4 + 2 O2 ⟶ CO2 + 2 H2O
|
Élément |
Réactifs |
Produits |
Équilibré? |
|
C |
1 x 1 = 1 |
1 x 1 = 1 |
1 = 1, oui |
|
H |
4 x 1 = 4 |
2 x 2 = 4 |
4 = 4, oui |
|
O |
2 x 2 = 4 |
(1 x 2) + (2 x 1) = 4 |
4 = 4, oui |
Une équation chimique équilibrée peut souvent être dérivée d’une description qualitative d’une réaction chimique par une approche assez simple appelée équilibrage par inspection. Prenons par exemple la décomposition de l’eau pour obtenir de l’hydrogène et de l’oxygène moléculaires. Ce processus est représenté qualitativement par une équation chimique déséquilibrée:
H2O → H2 + O2 (déséquilibré)
La comparaison du nombre d’atomes H et O de chaque côté de cette équation confirme son déséquilibre :
|
Élément |
Réactifs |
Produits |
Équilibré? |
|
H |
1 x 2 = 2 |
1 x 2 = 2 |
2 = 2, oui |
|
O |
1 x 1 = 1 |
1 x 2 = 2 |
1 ≠ 2, non |
Les nombres d’atomes H du côté réactif et du côté produit de l’équation sont égaux, mais les nombres d’atomes O ne le sont pas. Pour atteindre l’équilibre, les coefficients de l’équation peuvent être modifiés selon les besoins. Il faut bien sûr garder à l’esprit que les indices de la formule définissent, en partie, l’identité de la substance, et qu’ils ne peuvent donc pas être modifiés sans altérer la signification qualitative de l’équation. Par exemple, changer la formule du réactif de H2O à H2O2 permettrait d’équilibrer le nombre d’atomes, mais cela modifierait également l’identité du réactif (il s’agit maintenant de peroxyde d’hydrogène et non d’eau). L’équilibre des atomes d’O peut être obtenu en changeant le coefficient pour H2O à 2.
2 H2O → H2 + O2 (déséquilibré)
|
Élément |
Réactifs |
Produits |
Équilibré ? |
|
H |
2 x 2 = 4 |
1 x 2 = 2 |
4 ≠ 2, non |
|
O |
2 x 1 = 2 |
1 x 2 = 2 |
2 = 2, oui |
L’équilibre de l’atome H a été perturbé par ce changement, mais il est facilement rétabli en modifiant le coefficient du produit H2 à 2.
2 H2O → 2 H2 + O2 (équilibré)
|
Élément |
Réactifs |
Produits |
Équilibré? |
|
H |
2 x 2 = 4 |
2 x 2 = 4 |
4 = 4, oui |
|
O |
2 x 1 = 2 |
1 x 2 = 2 |
2 = 2, oui |
Ces coefficients donnent des nombres égaux d’atomes H et O du côté des réactifs et des produits, et l’équation équilibrée est donc :
2 H2O → 2 H2 + O2
Exemple 1.2.5 – Équilibrer les équations
Écrivez une équation équilibrée pour la réaction de l’azote moléculaire (N2) et de l’oxygène (O2) pour former le pentoxyde de diazote.
Solution
D’abord, écrivez l’équation déséquilibrée.
N2 + O2 → N2O5 (déséquilibré)
Ensuite, comptez le nombre de chaque type d’atome présent dans l’équation déséquilibrée.
|
Élément |
Réactifs |
Produits |
Équilibré? |
|
N |
1 x 2 = 2 |
1 x 2 = 2 |
2 = 2, oui |
|
O |
1 x 2 = 2 |
1 x 5 = 5 |
2 ≠ 5, oui |
Bien que l’azote soit équilibré, des changements de coefficients sont nécessaires pour équilibrer le nombre d’atomes d’oxygène. Pour équilibrer le nombre d’atomes d’oxygène, une première tentative raisonnable serait de changer les coefficients pour O2 et N2O5 en nombres entiers qui donneront 10 atomes d’oxygène (le plus petit multiple commun pour les indices des atomes d’oxygène dans ces deux formules).
N2 + 5 O2 → 2 N2O5 (déséquilibré)
|
Élément |
Réactifs |
Produits |
Équilibré? |
|
N |
1 x 2 = 2 |
2 x 2 = 4 |
2 ≠ 4, non |
|
O |
5 x 2 = 10 |
2 x 5 = 10 |
10 = 10, oui |
L’équilibre des atomes d’azote a été perturbé par ce changement ; il est rétabli en modifiant le coefficient du réactif N2 à 2.
2 N2 + 5 O2 → 2 N2O5 (équilibré)
|
Élément |
Réactifs |
Produits |
Équilibré? |
|
N |
2 x 2 = 4 |
2 x 2 = 4 |
4 = 4, oui |
|
O |
5 x 2 = 10 |
2 x 5 = 10 |
10 = 10, oui |
Les nombres d’atomes N et O de chaque côté de l’équation sont maintenant égaux, et l’équation est donc équilibrée.
Vérifiez votre apprentissage 1.2.7 – Équilibrer les équations
Écrivez une équation équilibrée pour la décomposition du nitrate d’ammonium en azote moléculaire, oxygène moléculaire et eau. (Conseil : équilibrer l’oxygène en dernier, puisqu’il est présent dans plus d’une molécule à droite de l’équation).
Réponse
2 NH4NO3 ⟶ 2 N2 + O2 + 4 H2O
Il est parfois pratique d’utiliser des fractions au lieu d’entiers comme coefficients intermédiaires dans le processus d’équilibrage d’une équation chimique. Lorsque l’équilibre est atteint, tous les coefficients de l’équation peuvent alors être multipliés par un nombre entier pour convertir les coefficients fractionnaires en nombres entiers sans perturber l’équilibre des atomes. Par exemple, considérons la réaction de l’éthane (C2H6) avec l’oxygène pour obtenir H2O et CO2, représentés par l’équation déséquilibrée :
C2H6 + O2 → H2O + CO2 (déséquilibré)
En suivant la méthode d’inspection habituelle, on peut d’abord équilibrer les atomes C et H en modifiant les coefficients pour les deux espèces de produits, comme indiqué :
C2H6 + O2 → 3 H2O + 2 CO2 (déséquilibré)
Cela donne sept atomes O du côté du produit de l’équation, un nombre impair – aucun coefficient entier ne peut être utilisé avec le réactif O2 pour donner un nombre impair, donc un coefficient fractionnaire, 7/2, est utilisée pour obtenir une équation équilibrée provisoire :
C2H6 + 7/2 O2 → 3 H2O + 2 CO2 (déséquilibré)
Une équation équilibrée conventionnelle à coefficients entiers seulement est obtenue en multipliant chaque coefficient par 2 :
2 C2H6 + 7 O2 → 6 H2O + 4 CO2
Enfin, en ce qui concerne les équations équilibrées, il faut se rappeler que la convention impose l’utilisation des plus petits coefficients de nombres entiers. Bien que l’équation de la réaction entre l’azote moléculaire et l’hydrogène moléculaire pour produire de l’ammoniac soit, en effet, équilibrée,
3 N2 + 9 H2 → 6 NH3
les coefficients ne sont pas les plus petits entiers possibles représentant les nombres relatifs de molécules de réactifs et de produits. En divisant chaque coefficient par le plus grand facteur commun, 3, on obtient l’équation préférée :
N2 + 3 H2 → 2 NH3
|
Équilibrer les équations chimiques – Pratique complémentaire |
|
L’équilibrage des équations chimiques est une compétence extrêmement importante et fondamentale que vous devrez maîtriser pour réussir en chimie générale et dans de nombreux autres cours de chimie. |
Informations complémentaires sur les équations chimiques
Les états physiques des réactifs et des produits dans les équations chimiques sont très souvent indiqués par une abréviation parentérale suivant les formules. Les abréviations courantes sont s pour les solides, l pour les liquides, g pour les gaz, et aq pour les substances dissoutes dans l’eau (solutions aqueuses). Ces notations sont illustrées dans l’exemple d’équation suivant :
2 Na (s) + 2 H2O (l) → 2 NaOH (aq) + H2 (g)
Cette équation représente la réaction qui a lieu lorsque le sodium métal est placé dans l’eau. Le sodium solide réagit avec l’eau liquide pour produire de l’hydrogène moléculaire gazeux et le composé ionique hydroxyde de sodium (un solide sous forme pure, mais facilement dissous dans l’eau).
Les conditions spéciales nécessaires à une réaction sont parfois désignées par l’inscription d’un mot ou d’un symbole au-dessus ou au-dessous de la flèche de l’équation. Par exemple, une réaction effectuée par chauffage peut être indiquée par la lettre grecque majuscule delta (Δ) au-dessus de la flèche.
CaCO3 (s) ![]() CaO (s) + CO2 (g)
CaO (s) + CO2 (g)
D’autres exemples de ces conditions particulières seront abordés plus en détail dans les chapitres suivants.
Questions
★ Questions
1. Écrivez les formules moléculaires et empiriques des composés suivants :
a. 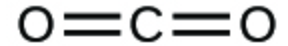
b. 
c. 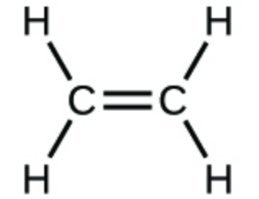
d. 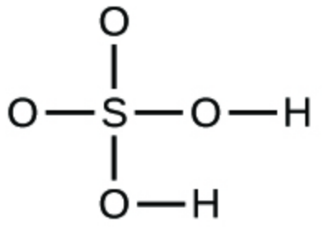
2. Ouvrez la simulation “Construire une molécule” et sélectionnez l’onglet “Grandes molécules”. Sélectionnez un “Kit” d’atomes approprié pour construire une molécule avec deux atomes de carbone et six atomes d’hydrogène. Faites glisser les atomes dans l’espace au-dessus du “Kit” pour fabriquer une molécule. Un nom apparaîtra lorsque vous aurez fabriqué une molécule réelle qui existe (même si ce n’est pas celle que vous voulez). Vous pouvez utiliser les ciseaux pour séparer les atomes si vous souhaitez modifier les connexions. Cliquez sur “3D” pour voir la molécule, et regardez les possibilités de remplissage de l’espace et de boule et bâton.
a. Dessinez la formule structurale de cette molécule et indiquez son nom.
b. Pouvez-vous arranger ces atomes de quelque manière que ce soit pour obtenir un composé différent ? Si oui, dessinez sa formule structurale et indiquez son nom.
c. Comment les molécules (a) et (b) sont-elles dessinées de la même façon ? En quoi diffèrent-elles ? Comment s’appellent-elles (le type de relation entre ces molécules, pas leur nom).
3. Calculez les quatre chiffres significatifs suivants :
a. La composition en pourcentage de l’ammoniac, du NH3
b. La composition en pourcentage de l’« hypo » photographique, Na2S2O3
c. Le pourcentage d’ion calcium dans le Ca3(PO4)2
★★ Questions
4. Déterminez les formules empiriques des composés ayant les compositions en pourcentage suivantes :
a. 43,6 % de phosphore et 56,4 % d’oxygène
b. 28,7 % K, 1,5 % H, 22,8 % P et 47,0 % O
5. Le dichloroéthane, un composé souvent utilisé pour le nettoyage à sec, contient du carbone, de l’hydrogène et du chlore. Il a une masse molaire de 99 g/mol. L’analyse d’un échantillon montre qu’il contient 24,3 % de carbone et 4,1 % d’hydrogène. Quelle est sa formule moléculaire?
6. Un grand fabricant de teintures textiles a mis au point une nouvelle teinture jaune. Le colorant a une composition en pourcentage de 75,95 % C, 17,72 % N et 6,33 % H en masse avec une masse molaire d’environ 240 g/mol. Déterminez la formule moléculaire du colorant.
7. Combien de moles de CO2 et de H2O seront produites par l’analyse de la combustion de 0,010 mole de styrène ?
8. La combustion d’un échantillon de 34,8 mg de benzaldéhyde, qui ne contient que du carbone, de l’hydrogène et de l’oxygène, a produit 101 mg de CO2 et 17,7 mg de H2O.
a. Quelle était la masse de carbone et d’hydrogène dans l’échantillon ?
b. En supposant que l’échantillon original ne contenait que du carbone, de l’hydrogène et de l’oxygène, quelle était la masse de l’oxygène dans l’échantillon ?
c. Quel était le pourcentage massique d’oxygène dans l’échantillon ?
d. Quelle est la formule empirique du benzaldéhyde ?
e. La masse molaire du benzaldéhyde est de 106,12 g/mol. Quelle est sa formule moléculaire ?
★ Questions (partie 2)
9. Équilibrez les équations suivantes :
a. PCl5 (s) + H2O (l) → POCl3 (l) + HCl (aq)
b. Cu (s) + HNO3 (aq) → Cu(NO3)2 (aq) + H2O (l) + NO (g)
c. H2 (g) + I2 (s) → HI (s)
d. Fe (s) + O2 (g) → Fe2O3 (s)
e. Na (s) + H2O (l) → NaOH (aq) + H2 (g)
f. (NH4)2Cr2O7 (s) → Cr2O3 (s) + N2 (g) +H2O (g)
g. P4 (s) + Cl2 (g) → PCl3 (l)
h. PtCl4 (s) → Pt (s) + Cl2 (g)
10. Rédigez une équation moléculaire équilibrée décrivant chacune des réactions chimiques suivantes.
a. Le carbonate de calcium solide est chauffé et se décompose en oxyde de calcium solide et en dioxyde de carbone gazeux.
b. Le butane gazeux, C4H10, réagit avec l’oxygène diatomique pour produire du dioxyde de carbone gazeux et de la vapeur d’eau.
c. Les solutions aqueuses de chlorure de magnésium et d’hydroxyde de sodium réagissent pour produire de l’hydroxyde de magnésium solide et du chlorure de sodium aqueux.
d. La vapeur d’eau réagit avec le sodium métallique pour produire de l’hydroxyde de sodium solide et de l’hydrogène gazeux.
★★ Questions (Partie 2)
11. Un nouveau procédé pour obtenir du magnésium à partir de l’eau de mer implique plusieurs réactions. Rédigez une équation chimique équilibrée pour chaque étape du processus.
a. La première étape est la décomposition du carbonate de calcium solide des coquillages pour former de l’oxyde de calcium solide et du dioxyde de carbone gazeux.
b. La deuxième étape est la formation d’hydroxyde de calcium solide, seul produit issu de la réaction de l’oxyde de calcium solide avec l’eau liquide.
c. L’hydroxyde de calcium solide est ensuite ajouté à l’eau de mer, réagissant avec le chlorure de magnésium dissous pour donner de l’hydroxyde de magnésium solide et du chlorure de calcium aqueux.
d. L’hydroxyde de magnésium solide est ajouté à une solution d’acide chlorhydrique, ce qui produit du chlorure de magnésium dissous et de l’eau liquide.
e. Enfin, le chlorure de magnésium est fondu et électrolysé pour donner du magnésium métal liquide et du chlore gazeux diatomique.
Réponses
1. (a) CO2 moléculaire, CO2 empirique ; (b) C2H2 moléculaire, CH empirique ; (c) C2H4 moléculaire, CH2 empirique ; (d) H2SO4 moléculaire, H2SO4 empirique
2. (a) Éthane
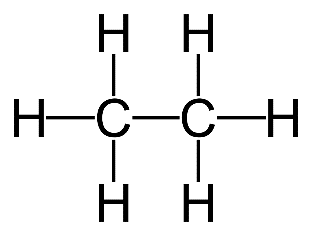
(b) Il n’y a pas d’autres façons d’agencer les atomes.
3. (a) 17,8% H, 82,2% N (b) 29,1% Na, 30,4% O, 40,6% S (c) 38,8% Ca, 41,3% O, 20,0% P
4. (a) P2O5 (b) KH2PO4
5. C2H4Cl2
6. C15H15N3
7. Moles de CO2 : 0,08 mol de CO2, moles de H2O : 0,04 mol de H2O
8. (a) 27,6 mg C et 1,98 mg H ; (b) 5,2 mg O ; (c) 15% ; (d) C7H6O ; (e) C7H6O
9. (a) PCl5 (s) + H2O (l) → POCl3 (l) + 2 HCl (aq)
(b) 3 Cu (s) + 8 HNO3 (aq) → 3 Cu(NO3)2 (aq) + 4 H2O (l) + 2 NO (g)
(c) H2 (g) + I2 (s) → 2 HI (s)
(d) 4 Fe (s) + 3 O2 (g) → 2 Fe2O3 (s)
(e) 2 Na (s) + 2 H2O (l) → 2 NaOH (aq) + H2 (g)
(f) (NH4)2Cr2O7 (s) → Cr2O3 (s) + N2 (g) + 4 H2O (g)
(g) P4 (s) + 6 Cl2 (g) → 4 PCl3 (l)
(h) PtCl4 (s) → Pt (s) + 2 Cl2 (g)
10. (a) CaCO3 (s) → CaO (s) + CO2 (g)
(b) 2 C4H10 (g) + 13 O2 (g) → 8 CO2 (g) + 10 H2O (g)
(c) MgCl2 (aq) + 2 NaOH (aq) → Mg(OH)2 (s) + 2 NaCl (aq)
(d) 2 H2O (g) + 2 Na (s) → 2 NaOH (s) + H2 (g)
11. (a) CaCO3 (s) → CaO (s) + CO2 (g)
(b) CaO (s) + H2O (l) → Ca(OH)2 (s)
(c) Ca(OH)2 (s) + MgCl2 (aq) → Mg(OH)2 (s) + CaCl2 (aq)
(d) Mg(OH)2 + 2HCl (aq) → MgCl2 (aq) + 2H2O (l)
(e) MgCl2 → Mg2 + 2HCl (aq), Cathode : Mg2+ + 2e– → Mg (s), Anode : 2Cl– (aq) → Cl2 (g) + 2e-
Formule indiquant la composition d'une molécule d'un composé et donnant le nombre réel d'atomes de chaque élément dans une molécule du composé.
Montre les atomes d'une molécule et comment ils sont reliés
Formule montrant la composition d'un composé donnée comme le rapport en nombre entier le plus simple des atomes
Technique gravimétrique utilisée pour déterminer la composition élémentaire d'un composé par la collecte et le pesage de ses produits de combustion gazeux
Réaction chimique redox dans laquelle un réactif se combine avec l'oxygène pour produire des oxydes de tous les autres éléments en tant que produits ; produit des quantités importantes d'énergie sous forme de chaleur et, parfois, de lumière
Équation chimique avec un nombre égal d'atomes pour chaque élément du réactif et du produit
Somme des masses atomiques moyennes pour tous les atomes représentés dans une formule empirique
Composés ayant la même formule chimique mais des structures différentes
Une façon concise, à l'aide de symboles ou de formules, de représenter une réaction chimique
Substance subissant un changement chimique ou physique ; indiquée sur le côté gauche de la flèche dans une équation chimique
Substance formée par un changement chimique ou physique ; représentée sur le côté droit de la flèche dans une équation chimique
Le nombre placé devant les symboles ou les formules d'une équation chimique indiquant leur quantité relative et placé lorsqu'il y a plus d'une molécule d'une substance