5.5 – Hydrolyse des solutions de sel
Comme nous l’avons vu dans la section sur les réactions chimiques, lorsqu’un acide et une base sont mélangés, ils subissent une réaction de neutralisation. Le mot “neutralisation” semble impliquer qu’une solution stœchiométriquement équivalente d’un acide et d’une base aurait un pH neutre. C’est parfois vrai, mais les sels qui se forment dans ces réactions peuvent avoir des propriétés acides ou basiques qui leur sont propres, comme nous allons le voir maintenant.
Neutralisation des acides et des bases
Lorsque nous mélangeons des solutions d’un acide et d’une base, une réaction de neutralisation acide-base se produit. Toutes les réactions de neutralisation acide-base sont supposées être complètes à 100 % à des fins stœchiométriques. Prenons par exemple la réaction acide-base suivante :
HCl (aq) + NaOH (aq) → NaCl (aq) + H2O (l)
Notez la flèche à sens unique, qui indique qu’il s’agit d’une réaction très favorable au produit. Pourquoi n’utilisons-nous pas plutôt une flèche d’équilibre ? Décomposons la réaction ci-dessus en ses différentes étapes pour l’expliquer :
Le HCl s’ionise complètement dans l’eau. Cela signifie qu’il n’y a pas de HCl réel dans la solution, il se dissout complètement en H3O+ et Cl– :
HCl (aq) → H3O+ (aq) + Cl–(aq)
Le NaOH s’ionise aussi complètement dans l’eau et ne laisse que Na+ et OH– en solution :
NaOH (aq) → Na+ (aq) + OH–(aq)
Dans la neutralisation acide-base, les produits de l’étape 1 réagissent avec les produits de l’étape 2, pour donner l’équation ionique complète suivante :
H3O+ (aq) + Cl–(aq) + Na+ (aq) + OH–(aq) → 2H2O (l) + Cl–(aq) + Na+(aq)
Une fois les ions du spectateur éliminés, vous obtenez l’équation ionique nette :
H3O+ (aq) + OH–(aq) → 2H2O (l)
Notez que c’est l’inverse de l’autoionisation de l’eau, c’est-à-dire K = 1/Kw = 1014. Cette valeur K est si importante que l’on suppose que la réaction est complète, ce qui permet de tracer une flèche à sens unique.
Application de la neutralisation acide-base 1 : antiacides de l’estomac
Nos estomacs contiennent une solution d’environ 0,03 M de HCl, qui nous aide à digérer les aliments que nous mangeons. La sensation de brûlure associée aux brûlures d’estomac est due à l’acide de l’estomac qui s’écoule par la valve musculaire située au sommet de l’estomac vers la partie inférieure de l’œsophage. La paroi de l’œsophage n’est pas protégée des effets corrosifs de l’acide gastrique de la même manière que la paroi de l’estomac, et les résultats peuvent être très douloureux. Lorsque nous avons des brûlures d’estomac, nous nous sentons mieux si nous réduisons l’excès d’acide dans l’œsophage en prenant un antiacide. Comme vous l’avez peut-être deviné, les antiacides sont des bases. L’un des antiacides les plus courants est le carbonate de calcium, le CaCO3. La réaction,
CaCO3 (aq) + 2HCl (aq) → CaCl2 (aq) + H2O (l) + CO2 (g)
Non seulement il neutralise l’acide gastrique, mais il produit également du CO2(g), ce qui peut entraîner une éructation satisfaisante.
Application de la neutralisation acide-base 2 : Aspects culinaires de la chimie
La cuisine est essentiellement une chimie synthétique qui se trouve être sans danger pour la santé. Il existe un certain nombre d’exemples de chimie acide-base dans le monde culinaire. Un exemple est l’utilisation du bicarbonate de soude en boulangerie. Le NaHCO3 est une base. Lorsqu’il réagit avec un acide tel que le jus de citron, le babeurre ou la crème aigre dans une pâte à frire, des bulles de gaz carbonique se forment à partir de la décomposition de l’acide carbonique résultant, et la pâte “monte”. La poudre à lever est une combinaison de bicarbonate de sodium et d’un ou plusieurs sels acides qui réagissent lorsque les deux produits chimiques entrent en contact avec l’eau de la pâte.
Beaucoup de gens aiment mettre du jus de citron ou du vinaigre, tous deux acides, sur du poisson cuit (figure 5.5.1). Il s’avère que le poisson contient des amines volatiles (bases) dans son système, qui sont neutralisées par les acides pour donner des sels d’ammonium non volatils. Cela réduit l’odeur du poisson, et ajoute également un goût “aigre” que nous semblons apprécier.

Figure 5.5.1. Une réaction de neutralisation a lieu entre l’acide citrique dans les citrons ou l’acide acétique dans le vinaigre, et les bases dans la chair du poisson.
La marinade est une méthode utilisée pour conserver les légumes en utilisant un environnement acide produit naturellement. Le légume, tel qu’un concombre, est placé dans un bocal hermétique immergé dans une solution saline. La solution de saumure favorise la croissance des bactéries bénéfiques et supprime la croissance des bactéries nocives. Les bactéries bénéfiques se nourrissent de l’amidon du concombre et produisent de l’acide lactique comme déchet dans un processus appelé fermentation. L’acide lactique finit par augmenter l’acidité de la saumure à un niveau qui tue toutes les bactéries nocives, qui ont besoin d’un environnement basique. Sans les bactéries nocives qui consomment les concombres, ceux-ci peuvent durer beaucoup plus longtemps que s’ils n’étaient pas protégés. Un sous-produit du processus de saumurage modifie la saveur des légumes, l’acide leur donnant un goût aigre.
Les réactions de neutralisation acide-base peuvent être résumées par l’équation chimique générale suivante :
acide (aq) + base (aq) → sel (aq) + eau
où la force motrice de la réaction (c’est pourquoi nous utilisons une flèche à sens unique) est la formation de l’eau. Là encore, le terme de neutralisation implique que le produit, une solution aqueuse d’un sel ionique, a un pH neutre. Cependant, même si nous mélangeons des quantités stœchiométriquement équivalentes, nous pouvons parfois constater que la solution qui en résulte n’est pas neutre. Elle peut contenir soit un excès d’ions hydronium, soit un excès d’ions hydroxyde, car la nature du sel formé détermine si la solution est acide, neutre ou basique.
Exemple 5.5.1 – Prévision des sels formés lors des neutralisations acide-base
Prévoir le sel produit lorsque les neutralisations suivantes seront terminées :
HCOOH et NaOH
HCN et NH3
HCl et CH3NH2
Solution
Le HCOOH est un acide faible et le NaOH est une base forte. Le sel qui en résulte sera HCOONa.
Le HCN est un acide faible et le NH3 est une base faible. Le sel résultant sera le NH4CN.
HCl est un acide fort et CH3NH2 est une base faible. Le sel résultant sera CH3NH2Cl.
Vérifiez votre apprentissage 5.5.1 – Prévision des sels formés lors des neutralisations acide-base
Prévoir le sel produit lorsque les neutralisations suivantes seront terminées.
RbOH et HCl
HNO2 et NaOH
CH3COOH et NH3
NH3 et HCl
HI et CH3NH2
Réponse
RbCl
NaNO2
NH4CH3COO
NH4Cl
Hydrolyse des sels
En tant que terme général de la chimie, le mot hydrolyse désigne le clivage d’une liaison (-lyse) par l’action de l’eau (hydro-). Dans le contexte des sels ioniques, ils peuvent s’hydrolyser dans l’eau pour produire des solutions aqueuses acides ou basiques, selon la nature du sel. Prenons un composé ionique générique, XY (s). Ce sel est dissous dans l’eau et s’ionise pour former un cation, X+ (aq) et un anion, Y- (aq). En examinant les charges sur les ions, nous voyons que, si l’hydrolyse se produit, le cation produit l’ion H3O+ et l’anion produit l’ion OH– (figure 5.5.2).
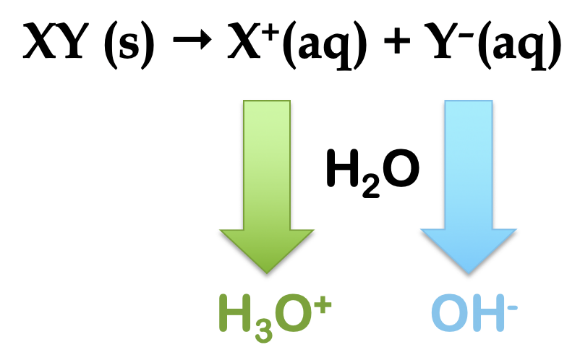
Figure 5.5.2. Schéma général de réaction pour l’hydrolyse d’un sel, XY. En cas de réaction avec l’eau, le cation produit l’ion hydronium et l’anion produit l’ion hydroxyde.
Par conséquent, nous pouvons envisager 4 scénarios possibles pour l’hydrolyse de n’importe quel sel, XY :
Si X+ s’hydrolyse mais pas Y-, alors H3O+ est produit et la solution est ACIDIQUE
Si Y- s’hydrolyse mais pas X+, alors OH– est produit et la solution est BASIC
Si ni X+ ni Y- ne s’hydrolyse, le pH de la solution ne change pas
Si X+ et Y- s’hydrolysent tous deux, la modification du pH de la solution ne peut être déterminée immédiatement (nous devrons effectuer d’autres calculs).
Examinons d’abord comment et quand les sels s’ionisent, puis examinons des exemples de sels dans chacun des 4 scénarios ci-dessus.
Paires acide-base conjuguées et hydrolyse
Comme nous l’avons vu dans les sections précédentes, dans les paires acide-base conjuguées, si une espèce est forte, l’autre est comparativement faible ; par exemple, un acide fort (très bon donneur de protons) a une base conjuguée faible (très mauvais accepteur de protons). Comme nous l’avons vu, cela conduit à des équilibres acide-base qui évoluent dans des directions privilégiées, de l’acide et de la base les plus forts vers l’acide et la base les plus faibles. Prenons encore une fois le HCl comme exemple : c’est un acide très fort et il s’ionise complètement dans l’eau :
HCl (aq) + H2O (aq) → H3O+ (aq) + Cl– (aq)
Dans cette réaction, le HCl est un acide fort (un excellent donneur de protons), ce qui fait de sa base conjuguée, Cl–, un très mauvais accepteur de protons. Cela signifie que, si nous ajoutions la base conjuguée, Cl–, à de l’eau à la place, nous ne nous attendrions pas à ce qu’elle se comporte comme une base de Brønsted-Lowry : elle ne réagirait PAS avec l’eau pour capter un proton et produire du OH– :
Cl– (aq) + H2O (aq) ⇌ HCl (aq) + OH– (aq)
La réaction ci-dessus est une pure absurdité : nous savons que le HCl est un puissant donneur de protons et ne resterait donc pas en solution (il réagirait immédiatement avec le OH- généré pour retourner aux réactifs). En d’autres termes, puisque le Cl- est la base conjuguée faible d’un acide fort, il ne s’hydrolyse pas (il réagit avec l’eau).
Comparons maintenant ce résultat à celui de l’acide acétique, CH3COOH, un acide faible qui ne s’ionise que partiellement en solution :
CH3COOH (aq) + H2O (aq) ⇆ H3O+ (aq) + CH3COO– (aq)
Comme nous l’avons vu, il s’agit d’une réaction privilégiée, ce qui signifie qu’à l’équilibre, la majorité de l’acide préfère être sous sa forme neutre et syndiquée. Comme CH3COOH est un acide faible (mauvais donneur de protons), nous devons conclure que sa base conjuguée, CH3COO– (, doit être une bonne base (bon accepteur de protons). Par conséquent, si nous ajoutions l’ion acétate directement à l’eau à la place, nous nous attendrions à ce qu’il se comporte comme une base de Brønsted-Lowry : il réagirait avec l’eau pour capter un proton et produire du OH- :
CH3COO– (aq) + H2O (aq)⇆ CH3COOH (aq) + OH– (aq)
Comme nous savons que l’acide acétique préfère être sous sa forme neutre et syndiquée, nous pouvons nous attendre à ce que la réaction ci-dessus se produise de manière appréciable et forme une quantité non négligeable d’ion hydroxyde à l’équilibre. En d’autres termes, l’ion acétate s’hydrolyse dans l’eau, produisant un OH– et donnant ainsi une solution aqueuse basique.
Alors que la discussion ci-dessus a comparé un acide fort et un acide faible, nous pouvons étendre les mêmes arguments à une base forte et une base faible, et arriver aux conclusions suivantes sur l’hydrolyse des ions :
Les bases conjuguées des acides forts ne s’hydrolysent PAS
Les bases conjuguées des acides faibles s’hydrolysent
Les acides conjugués des bases fortes ne s’hydrolysent PAS
Les acides conjugués des bases faibles s’hydrolysent
Règles pour l’hydrolyse
Forts de cette compréhension de la force relative des paires acide-base conjuguées, nous pouvons maintenant revenir à notre discussion sur les sels (XY) et les 4 scénarios possibles d’hydrolyse ionique. Pour déterminer l’effet d’un sel sur le pH d’une solution, nous devons suivre les étapes suivantes :
Déterminer le cation et l’anion produits lors de la dissolution du sel.
Déterminer si le cation s’hydrolyse ou non. Le cation X+ s’hydrolyse dans deux situations :
Il s’agit de l’acide conjugué d’une base faible, qui va générer du H3O+ directement par le don d’un proton à l’eau.
Il s’agit d’un petit cation métallique hautement chargé, qui génère indirectement du H3O+ par un mécanisme différent (remarque : cette situation n’est pas aussi courante et est examinée plus en détail à la fin de cette section)
Déterminez si l’anion s’hydrolyse ou non. L’anion Y- s’hydrolyse s’il est la base conjuguée d’un acide faible, et génère directement OH- par l’acceptation d’un proton de l’eau.
Si les deux s’hydrolysent, effectuer une analyse supplémentaire pour trouver l’effet global sur le pH
Hydrolyse des sels : Prévision qualitative des changements de pH
Examinons plusieurs exemples et appliquons la procédure ci-dessus pour déterminer le caractère acido-basique de différents sels.
Exemple 1 : NaCl
Le chlorure de sodium se dissout dans l’eau pour produire des cations de sodium et des anions de chlorure :
NaCl (s) → Na+ (aq) + Cl- (aq)
Le cation, Na+, ne s’hydrolyse pas : ce n’est pas l’acide conjugué d’une base faible (il ne peut pas agir comme donneur de protons !) et ce n’est pas un petit ion métallique hautement chargé :
Na+ (aq) + H2O (l) → pas d’hydrolyse
Comme nous l’avons déjà vu, l’anion, Cl-, est la base conjuguée d’un acide fort (HCl), et donc il ne s’hydrolyse pas non plus :
Cl- (aq) + H2O (l) → pas d’hydrolyse
Par conséquent, comme ni le cation ni l’anion ne s’hydrolysent, il n’y a pas de production de H3O+ ou de OH-, et donc globalement, l’ajout de NaCl à une solution aqueuse n’aura aucun effet sur le pH. Le NaCl est donc appelé un sel NEUTRE.
Exemple 2 : NH4Br
Le bromure d’ammonium se dissout dans l’eau pour produire des cations d’ammonium et des anions de bromure :
NH4Br (s) → NH4+ (aq) + Br– (aq)
Le cation, NH4+, s’hydrolyse : il s’agit de l’acide conjugué d’une base faible, NH3, et réagit donc avec l’eau en équilibre pour produire du H3O+ :
NH4+ (aq) + H2O (l) ⇌ NH3 (aq) + H3O+ (aq)
L’anion, Br-, est la base conjuguée d’un acide fort (HBr), et donc il ne s’hydrolyse pas :
Br– (aq) + H2O (l)→ pas d’hydrolyse
Par conséquent, comme le cation s’hydrolyse mais que l’anion ne s’hydrolyse pas, globalement, l’ajout de NH4Br à une solution aqueuse produira du H3O+ et le pH diminuera. Le NH4Br est donc appelé un sel ACIDE.
Exemple 3 : KCN
Le cyanure de potassium se dissout dans l’eau pour produire des cations de potassium et des anions de cyanure :
KCN (s) → K+ (aq) + CN– (aq)
Le cation, K+, ne s’hydrolyse pas : ce n’est pas l’acide conjugué d’une base faible, et ce n’est pas un petit ion métallique hautement chargé :
K+ (aq) + H2O (l) → pas d’hydrolyse
L’anion, CN–, s’hydrolyse : c’est la base conjuguée d’un acide faible (HCN), et réagit donc avec l’eau en équilibre pour produire du OH- :
CN– (aq) + H2O (aq) ⇌ HCN (aq) + OH– (aq)
Par conséquent, puisque l’anion s’hydrolyse mais que le cation ne s’hydrolyse pas, globalement, l’ajout de KCN à une solution aqueuse produira un peu de OH- et le pH augmentera. Le KCN est donc appelé un sel BASIQUE.
Exemple 4 : NH4CN
Le cyanure d’ammonium se dissout dans l’eau pour produire des cations d’ammonium et des anions de cyanure :
NH4CN (s) → NH4+ (aq) + CN– (aq)
Comme on l’a vu plus haut, le cation, NH4+, s’hydrolyse :
NH4+ (aq) + H2O (l) ⇌ NH3 (aq) + H3O+ (aq)
Comme on l’a vu plus haut, l’anion CN– s’hydrolyse également :
CN– (aq) + H2O (aq) ⇌ HCN (aq) + OH– (aq)
Par conséquent, puisque le cation ET l’anion s’hydrolysent tous deux avec l’eau, nous devons maintenant déterminer l’étendue des deux équilibres ci-dessus. En d’autres termes, le cation ammonium produit-il plus de H3O+ que le OH– produit par l’anion cyanure ou vice-versa ? Lequel de ces deux équilibres est le plus favorable au produit ? Pour répondre à cette question, il suffit de calculer et de comparer les constantes d’équilibre des deux réactions ci-dessus :
NH4+ (aq) + H2O (l) ⇌ NH3 (aq) + H3O+ (aq)
CN– (aq) + H2O (aq) ⇆ HCN (aq) + OH– (aq)
En comparant les deux valeurs K, on constate que le Kb de l‘anion est supérieur au Ka du cation. Le second équilibre est plus favorable au produit que le premier et, dans l’ensemble, plus de OH– que de H3O+ est produit en solution par suite de l’hydrolyse des deux ions. Par conséquent, l’ajout de NH4CN à une solution aqueuse entraîne une augmentation du pH et il est donc classé comme un sel BASIQUE.
Exemple 5.5.2 – Prévision qualitative des changements de pH
Prévoir si les solutions aqueuses des sels suivants sont acides, basiques ou neutres :
(a) KBr
(b) NaHCO3
(c) NH4Cl
(d) Na2HPO4
(e) NH4F
Solution
Considérez chacun des ions séparément en fonction de son effet sur le pH de la solution, comme indiqué ici :
(a) Le cation K+ et l’anion Br– ne s’hydrolysent pas, puisqu’ils sont respectivement le cation d’une base forte (KOH) et l’anion d’un acide fort (HBr). La solution est neutre.
(b) Le cation Na+ ne s’hydrolyse pas et n’affecte pas le pH de la solution, tandis que l’anion HCO3– est amphiprotique. Le Ka de HCO3– est de 4,7 × 10-11, et son Kb est de
1.0×10-14/4.3×10-7=2.3×10-8
Depuis Kb >> Ka, cette espèce est plus apte à accepter les protons qu’à en faire don. Par conséquent, l’anion bicarbonate se comportera comme une base et la solution est basique.
(c) L’ion NH4+ est acide et l’ion Cl– ne s’hydrolyse pas. La solution sera acide.
(d) Le cation Na+ ne s’hydrolyse pas et n’affecte pas le pH de la solution, tandis que l’anion HPO42- est amphiprotique. Le Ka de l’HPO42- est de 4,2 × 10-13, et son Kb est de
1.0×10-14/6.2×10-8=1.6×10-7
Parce que Kb >> Ka, la solution est fondamentale.
(e) L’ion NH4+ est répertorié comme étant acide, et l’ion F- est répertorié comme étant une base, il faut donc comparer directement le Ka et le Kb des deux ions. Le Ka de NH4+ est de 5,6 × 10-10, ce qui semble très petit, mais le Kb de F– est de 1,4 × 10-11, donc la solution est acide, puisque Ka > Kb.
Vérifiez votre apprentissage 5.5.2 – Prévision qualitative des changements de pH
Déterminez si les solutions aqueuses des sels suivants sont acides, basiques ou neutres :
(a) K2CO3
(b) CaCl2
(c) KH2PO4
(d) (NH4)2CO3
(e) Mg(NO3)2
Réponse
(a) basique ; (b) neutre ; (c) acide ; (d) basique ; (e) neutre
Hydrolyse des sels : Prévision quantitative des changements de pH
Les exemples ci-dessus illustrent parfaitement la manière dont nous pouvons déterminer rapidement les propriétés acido-basiques des sels ioniques dans les solutions aqueuses. Mais que faire si nous devons calculer l’effet exact sur le pH d’une solution ? L’exemple ci-dessous montre comment nous pouvons combiner la procédure décrite avec les étapes de résolution de problèmes d’équilibre utilisées précédemment pour trouver le pH final des solutions salines.
Exemple 5.5.3 – Prévision quantitative des changements de pH
L’aniline est une amine qui est utilisée pour fabriquer des colorants. Elle est isolée sous forme de chlorhydrate d’aniline, C6H5NH3Cl, un sel préparé par la réaction de la base faible aniline et de l’acide chlorhydrique. Quel est le pH d’une solution de chlorhydrate d’aniline à 0,233 M ?
Solution
Le chlorhydrate d’aniline se dissout dans l’eau pour produire des cations C6H5NH3+ et des anions chlorure :
C6H5NH3Cl (s) → C6H5NH3+ (aq) + Cl– (aq)
Nous savons que l’anion, Cl–, ne s’hydrolyse pas :
Cl– (aq) + H2O (l) → pas d’hydrolyse
Cependant, le cation C6H5NH3+ est l’acide conjugué d’une base faible, C6H5NH2, et il s’hydrolyse donc :
C6H5NH3+ (aq) + H2O (l) ⇌ H3O+ (aq) + C6H5NH2 (aq)
Ainsi, en suivant notre procédure précédente, nous prévoyons à ce stade un pH ACIDIQUE pour ce sel. Cependant, pour trouver le pH exact de la solution 0,233 M, notre prochaine étape dans cet exemple est de déterminer le Ka pour l’ion C6H5NH3+. La valeur de Ka pour cet acide n’est pas indiquée dans l’annexe H, mais nous pouvons la déterminer à partir de la valeur de Kb pour l’aniline, C6H5NH2, qui est donnée comme 4,3 × 10-10 (annexe I) :
Ka(pour C6H5NH3+)×Kb(pour C6H5NH2)=Kw=1.0×10-14
Ka(pour C6H5NH3+)=Kw/Kb(pour C6H5NH2)=(1.0×10-14)/(4.3×10-10)=2.3×10-5
Nous avons maintenant la constante d’ionisation et la concentration initiale de l’acide faible, toutes les informations nécessaires pour déterminer la concentration d’équilibre de H3O+, et le pH :
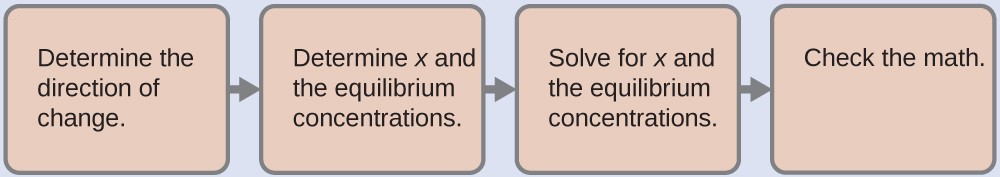
Avec ces étapes, nous trouvons [H3O+] = 2,3 × 10-3 M et pH = 2,64, ce qui correspond au pH acide que nous avions prévu qualitativement au départ. Vous devez effectuer les calculs vous-même pour confirmer ces valeurs.
Vérifiez votre apprentissage 5.5.3 – Prévision quantitative des changements de pH
On vous donne une solution de 0,100 M de nitrate d’ammonium, NH4NO3.
Prévoir qualitativement : s’agit-il d’un sel neutre, acide ou basique ?
Utilisez les données de l’annexe I pour déterminer le Ka de l’ion ammonium.
Quelle est la concentration en ions hydronium de la solution ?
Quel est le pH de la solution ?
Réponse
Acide ; (b) Ka (pour NH4+) = 5,6 × 10-10 ; (c) [H3O+] = 7,5 × 10-6 M ; (d) pH = 5,13
Exemple 5.5.4 – Prévision quantitative des changements de pH
Quel est le pH d’une solution d’hypochlorite de calcium, Ca(OCl)2, à 0,100 M ?
Solution
L’hypochlorite de calcium se dissout dans l’eau pour produire des cations de calcium et des anions d’hypochlorite (notez la stœchiométrie) :
Ca(OCl)2 (s) → Ca2+ (aq) + 2 OCl– (aq)
Le cation, Ca2+, ne s’hydrolyse pas : ce n’est pas l’acide conjugué d’une base faible, et ce n’est pas un petit ion métallique hautement chargé :
Ca2+ (aq) + H2O (l) → pas d’hydrolyse
L’anion, OCl–, s’hydrolyse : c’est la base conjuguée d’un acide faible (HOCl), et réagit donc avec l’eau en équilibre pour produire un peu de OH- :
OCl– (aq) + H2O (aq) ⇆ HOCl (aq) + OH– (aq)
Par conséquent, à ce stade, nous prévoyons un pH de base pour la solution. L’étape suivante consiste à trouver le Kb pour l’ion OCl– en utilisant le Ka pour HOCl de l’annexe H :
Kb(for OCl–)=Kw/Ka(for HOCl)=(1.0×10-14)/(4.0×10-8)=2.5×10-7
En combinant cette valeur avec la concentration initiale de l’anion hypochlorite ([OCl–]i = 0,200 M, en raison de la stœchiométrie), nous pouvons utiliser un tableau ICE pour trouver qu’à l’équilibre, [OH–] = 2,2 x 10-4 M et pH = 10,35, ce qui correspond à notre prévision initiale.
Vérifiez votre apprentissage 5.5.4 – Prévision quantitative des changements de pH
Quel est le pH d’une solution de LiCN à 0,083 M ?
Réponse
11.06
L’ionisation des ions métalliques hydratés
Comme mentionné précédemment dans cette section, certains ions métalliques s’hydrolysent, mais par un autre mécanisme indirect (c’est-à-dire pas de transfert direct de protons aux molécules d’eau). Si nous mesurons le pH des solutions de divers ions métalliques, nous constaterons qu’occasionnellement, ces ions agissent comme des acides faibles lorsqu’ils sont en solution. L’ion aluminium en est un exemple. Lorsque le nitrate d’aluminium se dissout dans l’eau, l’ion aluminium réagit avec l’eau pour donner un ion aluminium hydraté, Al(H2O)63+, dissous dans l’eau en vrac. Cela signifie que l’ion aluminium a les interactions les plus fortes avec les six molécules d’eau les plus proches (ce qu’on appelle la première enveloppe de solvatation), même s’il interagit également avec les autres molécules d’eau qui entourent ce groupe d’ Al(H2O)63+:
Al(NO3)3 (s) + 6H2O (l) ⇌ Al(H3O+)63+ (aq) + 3NO3– (aq)
Remarque : on voit souvent la formule de cet ion écrite simplement « Al3+(aq) », sans noter explicitement que six molécules d’eau sont liées à l’ion aluminium (comme dans les anciens manuels, la formule de l’ion hydronium, H3O+, était simplifiée en H+(aq)).
Les ions métalliques hydratés peuvent se comporter comme des acides de Brønsted-Lowry par un transfert indirect de protons avec l’eau. Il est clair que l’atome d’aluminium lui-même ne peut pas donner de proton – ce qui changerait l’identité du noyau, le transformant en magnésium ! Par conséquent, pour agir comme un acide de Brønsted-Lowry, une des molécules d’eau liées agit comme donneur de protons à une autre molécule d’eau externe, devenant un groupe OH– et générant un équivalent de H3O+ dans le processus. Ceci est illustré dans la figure 5.5.3 ci-dessous – notez que la charge de l’ion complexe est passée de +3 à +2, en raison de la perte d’une charge positive.
Al(H2O)63+(aq)+H2O(l)↔H3O+(aq)+Al(H2O)5(OH)2+(aq) Ka=1.4×10-5
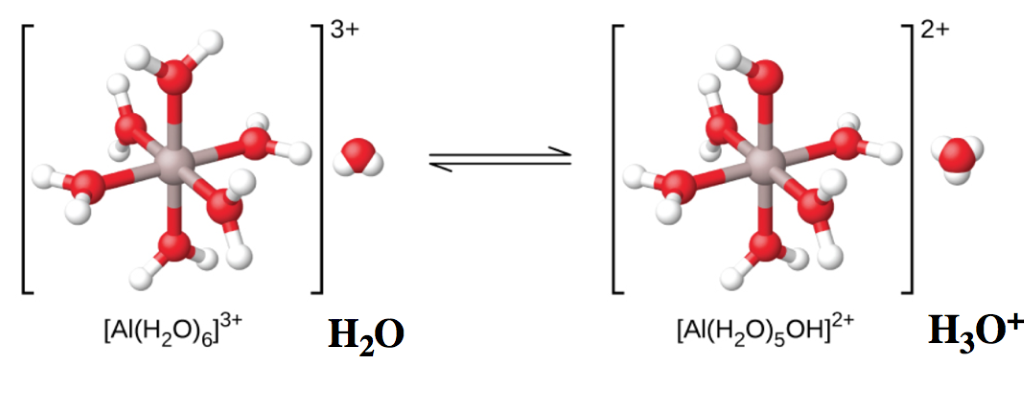
Figure 5.5.3. Lorsqu’un ion d’aluminium réagit avec l’eau, l’ion d’aluminium hydraté devient un acide faible. Notez que le ligand H2O supérieur se transforme en un OH–. De plus, la charge globale du complexe a diminué.
Quels autres cations métalliques sont donc capables de présenter un comportement acide similaire ? Il est difficile de savoir avec certitude si un cation métallique est acide ou non sans disposer de preuves expérimentales. Cependant, en général, une bonne règle empirique est que les cations métalliques ayant une forte densité de charge ont tendance à être significativement acides. Comme son nom l’indique, la densité de charge d’un ion est le rapport entre la charge de l’ion et le volume de l’ion, équation 5.5.1 :
Équation 5.5.1. Densité de charge = Charge de l’ion/Volume de l’ion
Les cations métalliques ayant des charges élevées (par exemple ≥ +2) et de petits rayons ioniques auront globalement des densités de charge élevées, et présenteront donc souvent un caractère acide. Voici d’autres exemples d’ions métalliques hydratés acides :
Fe(H2O)63+ (aq) + H2O (l) ⇌ H3O+ (aq) + Fe(H2O)5(OH)2+ (aq) pKa = 2.74
Cu(H2O)62+ (aq) + H2O (l) ⇌ H3O+ (aq) + Cu(H2O)5(OH)+ (aq) pKa = ~6.3
Zn(H2O)42+ (aq) + H2O (l) ⇌ H3O+ (aq) + Zn(H2O)5(OH)+ (aq) pKa = 9.6
Pour illustrer davantage l’acidité de ces ions métalliques hydratés, voici la valeur du pH d’une solution de 0,10 M de chacun d’entre eux :
Fe(H2O)63+(aq) pH = 1.89
Cu(H2O)62+(aq) pH = 3.66
Zn(H2O)42+(aq)pH = 5.30
|
Prévoir les propriétés acido-basiques d’un sel contenant un cation métallique peut être quelque peu délicat. Nous pouvons déterminer la charge du cation métallique très facilement, simplement à partir de la formule du composé. Cependant, son hydrolyse ou non dépend de la densité de la charge, et cela dépend aussi de la connaissance de la taille de l’ion, qui n’est pas toujours évidente. En général, les cations métalliques du groupe 1 (Li+, Na+, K+, etc.) ont des charges trop faibles pour s’hydrolyser par le mécanisme décrit ci-dessus. Parmi les cations métalliques du groupe 2, seul Be2+ est acide en raison de sa très petite taille. Les métaux de transition ayant plusieurs états d’oxydation ont tendance à être plus acides lorsqu’ils sont dans l’état d’oxydation le plus élevé ; par exemple, l’ion Co2+ est acide, alors que l’ion Co+ ne l’est pas. Demandez donc à votre professeur si vous allez résoudre des problèmes impliquant des ions métalliques acides, et si nécessaire, un tableau des valeurs Ka pertinentes vous sera fourni.
|
Exemple 5.5.5 – Hydrolyse de [Al(H2O)6]3+
Calculer le pH d’une solution de chlorure d’aluminium de 0,10 M, qui se dissout complètement pour donner l’ion aluminium hydraté [Al(H2O)6]3+ en solution.
Solution
Malgré l’aspect inhabituel de l’acide, il s’agit d’un problème typique d’ionisation de l’acide.
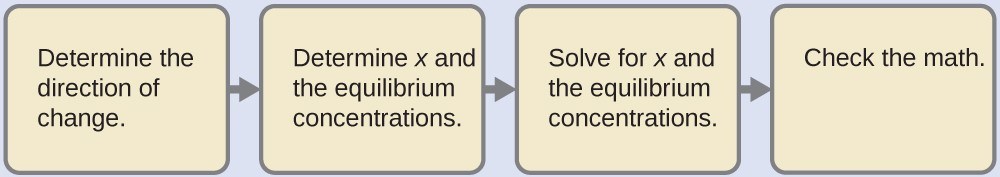
Déterminer la direction du changement. L’équation pour la réaction et Ka sont :
Al(H2O)63+(aq) + H2O (l) ⇌ H3O+ (aq) + Al(H2O)5(OH)2+(aq) Ka = 1.4 x 10-5
La réaction se déplace vers la droite pour atteindre l’équilibre.
Déterminer les concentrations x et d’équilibre. Utilisez le tableau :
Al(H2O)6 + H2O ⇌ H3O+ + Al(H2O)5(OH)
|
Concentration initiale (M) |
0.10 |
|
~0 |
0 |
|
Changement (M) |
– x |
|
x |
x |
|
Concentration à l’équilibre (M) |
0.10 – x |
|
x |
x |
Résoudre x et les concentrations d’équilibre. Substituer les expressions des concentrations d’équilibre dans l’équation des rendements des constantes d’ionisation :
Ka=([H3O+][Al(H2O)5(OH)2+(aq)])/[Al(H2O)63+(aq)]=x2/(0.10-x)=1.4×10-5
La résolution de cette équation donne :
x=1.2×10-3M
C’est ce que nous trouvons :
[H3O+]= 0+x=1.2×10-3 M
pH = -log[H3O+]= 2.92 (une solution acide)
Vérifiez le travail. Les contrôles arithmétiques ; lorsque 1,2 × 10-3 M est substitué à x, le résultat = Ka.
Vérifiez votre apprentissage 5.5.5 – Hydrolyse de [Al(H2O)6]3+
Qu’est-ce que [Al(H2O)5(OH)2+] dans une solution de Al(NO3)3 à 0,15 M qui contient également suffisamment de l’acide fort HNO3 pour porter [H3O+] à 0,10 M ?
Réponse
2.1 × 10−5 M
Questions
★ Questions
- Déterminez si les solutions aqueuses des sels suivants sont acides, basiques ou neutres :
(a) Al(NO3)3
(b) RbI
(c) KHCO2
(d) CH3NH3Br
2. Déterminez si les solutions aqueuses des sels suivants sont acides, basiques ou neutres :
(a) FeCl3
(b) K2CO3
(c) NH4Br
(d) KClO4
★★ Questions
3. La novocaïne, C13H21O2N2Cl, est le sel de la base procaïne et de l’acide chlorhydrique. La constante d’ionisation de la procaïne est de 7 × 10-6. Une solution de novocaïne est-elle acide ou basique ? Que sont [H3O+], [OH–] et le pH d’une solution de novocaïne à 2,0 % en masse, en supposant que la densité de la solution est de 1,0 g/ml.
Réponses
1. (a) acide, (b) neutre, (c) basique, (d) acide
2. (a) acide ; (b) basique ; (c) acide ; (d) neutre
3. Acide,[H3O+] = 3.2 x 10−5 M, [OH−] = 3.1 x 10−10 M, pH = 4.50
Réaction d'un acide et d'une base pour produire de l'eau et un sel


