2.2 – Les gaz et le tableau périodique
La structure géométrique et les propriétés physiques et chimiques des atomes, des ions et des molécules ne dépendent généralement pas de leur état physique ; les molécules d’eau individuelles dans la glace, l’eau liquide et la vapeur, par exemple, sont toutes identiques. En revanche, les propriétés macroscopiques d’une substance dépendent fortement de son état physique, qui est déterminé par les forces intermoléculaires et des conditions telles que la température et la pression.
La figure 2.2.1. montre les emplacements dans le tableau périodique des éléments que l’on trouve couramment à l’état gazeux, liquide et solide. À l’exception de l’hydrogène, les éléments qui se présentent naturellement sous forme de gaz se trouvent sur le côté droit du tableau périodique. Parmi ceux-ci, tous les gaz rares (groupe 18) sont des gaz monovalents, tandis que les autres éléments gazeux sont des molécules diatomiques (H2, N2, O2, F2 et Cl2). L’oxygène peut également former un second allotrope, la molécule triatomique hautement réactive ozone (O3), qui est également un gaz. En revanche, le brome (sous forme de Br2) et le mercure (Hg) sont des liquides dans des conditions normales (25 °C et 1,0 atm, communément appelés “température et pression ambiantes”). Le gallium (Ga), qui ne fond qu’à 29,76 °C, peut être transformé en liquide simplement en tenant un récipient à la main ou en le conservant dans une pièce non climatisée par une chaude journée d’été. Les autres éléments sont tous des solides dans des conditions normales.
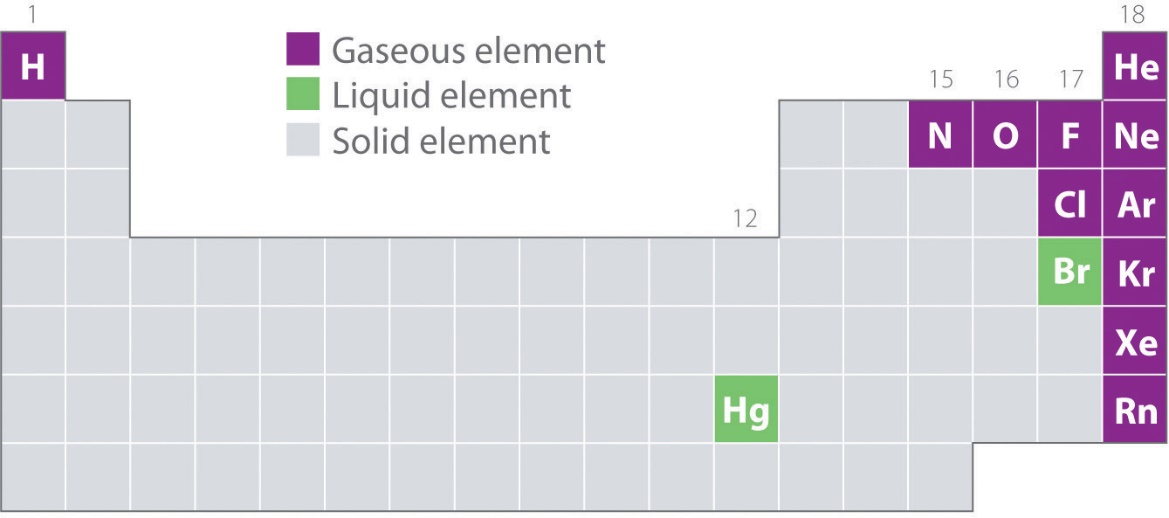
Figure 2.2.1. Éléments qui se présentent naturellement sous forme de gaz, de liquides et de solides à 25 °C et 1 atm. Les gaz nobles et le mercure se présentent sous forme d’espèces monatomiques, tandis que tous les autres gaz et le brome sont des molécules diatomiques.
Tous les éléments gazeux (autres que les gaz nobles monatomiques) sont des molécules. Dans un même groupe (1, 15, 16 et 17), les éléments les plus légers sont des gaz. Toutes les substances gazeuses sont caractérisées par de faibles interactions entre les molécules ou les atomes qui les composent. Lorsque nous faisons référence aux éléments non gazeux, nous utilisons le terme de vapeur. Le terme vapeur fait référence à la forme gazeuse d’une substance qui est un liquide ou un solide dans des conditions normales. L’azote (N2) et l’oxygène (O2) sont donc appelés des gaz, mais l’eau gazeuse dans l’atmosphère est appelée vapeur d’eau.
Questions
★ Questions
1. Le néon, un gaz à température ambiante, se condense en un liquide à 25 K. Quelles sont les propriétés chimiques du néon qui sont affectées par ce changement de phase ?
2. Comme l’oxygène, le carbone existe aussi dans de multiples allotropes naturels. Certains d’entre eux sont-ils à l’état gazeux dans des conditions normales ?
Réponses
1. Aucune, les propriétés chimiques inhérentes à un élément restent inchangées lorsqu’il y a changement de phase.
2. Non. Les trois principales allotropes du carbone – le graphite, le diamant et les fullerènes – sont toutes solides dans des conditions normales.
Matière en phase gazeuse due à l'évaporation

