7.2 – Mesurer & ; Exprimer les Taux de Réaction
La méthode pour déterminer la vitesse de réaction est relativement simple. Puisque la vitesse de réaction est basée sur le changement dans le temps, elle doit être déterminée à partir de valeurs tabulées ou trouvées expérimentalement. Avec les données obtenues, il est possible de calculer la vitesse de réaction de manière algébrique ou graphique. Vous trouverez ci-dessous des conseils généraux et des exemples de mesure de la vitesse d’une réaction.
Mesurer le changement de temps est facile; un chronomètre ou tout autre dispositif de mesure du temps est suffisant. Cependant, la détermination du changement de concentration des réactifs ou des produits implique des processus plus compliqués. Le changement de concentration dans un système peut généralement être acquis de deux manières:
En surveillant l’épuisement du réactif au fil du temps, ou
En surveillant la formation du produit au fil du temps
Le fait qu’un expérimentateur surveille les réactifs ou les produits n’a pas d’importance car cela n’a aucun effet sur la réaction globale. Cependant, comme les réactifs diminuent au cours de la réaction et que les produits augmentent, il existe une différence de signe entre les deux vitesses. La concentration des réactifs diminue au fur et à mesure de la réaction, ce qui donne un nombre négatif pour le changement de concentration. Les produits, en revanche, augmentent en concentration avec le temps, ce qui donne un nombre positif. Graphiquement, la forme générale des courbes de la concentration en fonction du temps pour les réactifs et les produits ressemble à ceci:
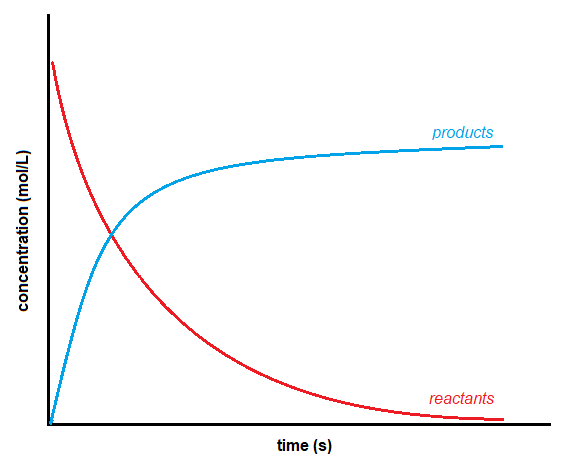
Figure 7.2.1 Concentration en fonction du temps
Puisque la convention est d’exprimer la vitesse de réaction sous forme d’un nombre positif, pour résoudre un problème, il faut fixer la vitesse globale de la réaction égale à la vitesse négative de disparition d’un réactif.
La vitesse globale dépend également des coefficients stœchiométriques.
Il convient de noter que le processus de mesure de la concentration peut être grandement simplifié en tirant parti des différentes propriétés physiques ou chimiques (c’est-à-dire la différence de phase, le potentiel de réduction, etc.) des réactifs ou des produits impliqués dans la réaction en utilisant les méthodes ci-dessus. Nous avons souligné l’importance de prendre en compte le signe de la réaction pour obtenir une vitesse de réaction positive. Nous allons maintenant nous intéresser à l’importance des coefficients stœchiométriques.
La vitesse d’une réaction peut être rapportée de manière très différente selon le produit ou le réactif choisi pour être surveillé. Étant donné une réaction:
aA + bB → cC + dD
la vitesse générale de cette réaction est définie comme suit
Équation 7.2.1 Vitesse de réaction générale
Suivre le cours d’une réaction
Il existe deux façons différentes de suivre le cours d’une réaction.
Des échantillons du mélange peuvent être prélevés à intervalles réguliers et titrés pour déterminer l’évolution de la concentration de l’un des réactifs.
Une propriété physique de la réaction qui change au fur et à mesure que la réaction se poursuit peut être mesurée: par exemple, le volume de gaz produit.
Ces approches doivent être considérées séparément.
Considérons que le bromoéthane réagit avec une solution d’hydroxyde de sodium comme suit:
CH3CH2Br + OH– → CH3CH2OH + Br–
Au cours de la réaction, le bromoéthane et l’hydroxyde de sodium sont tous deux consommés. Cependant, il est relativement facile de mesurer la concentration d’hydroxyde de sodium à un moment donné en effectuant un titrage avec un acide standard: par exemple, avec de l’acide chlorhydrique de concentration connue. Le processus commence avec des concentrations connues d’hydroxyde de sodium et de bromoéthane, et il est souvent pratique qu’elles soient égales. Comme la réaction est 1:1, si les concentrations sont égales au départ, elles le resteront tout au long de la réaction. Des échantillons sont prélevés à l’aide d’une pipette à intervalles réguliers pendant la réaction et titrés avec de l’acide chlorhydrique standard en présence d’un indicateur approprié.
Le problème de cette approche est que la réaction se poursuit pendant le temps nécessaire au titrage. De plus, une seule tentative de titrage est possible car, pendant le temps de prélever un autre échantillon, les concentrations ont changé. Il existe deux façons de contourner ce problème:
La réaction peut être ralentie en la diluant, en ajoutant l’échantillon à un plus grand volume d’eau froide avant le titrage. Ensuite, le titrage est effectué le plus rapidement possible. Cette méthode est plus efficace si la réaction est effectuée au-dessus de la température ambiante. En la refroidissant et en la diluant, on la ralentit encore plus.
Si possible (et c’est possible dans ce cas), il est préférable d’arrêter complètement la réaction avant de titrer. Dans ce cas, ceci peut être accompli en ajoutant l’échantillon, à un volume connu, un excès d’acide chlorhydrique standard. Ceci consomme tout l’hydroxyde de sodium présent dans le mélange et arrête la réaction.
À ce stade, la solution obtenue est titrée avec une solution standard d’hydroxyde de sodium pour déterminer la quantité d’acide chlorhydrique restant dans le mélange. Cela permet de calculer la quantité d’acide utilisée, et donc la quantité d’hydroxyde de sodium qui devait être présente dans le mélange réactionnel initial. Cette technique est connue sous le nom de rétrotitrage.
Ce processus génère un ensemble de valeurs tabulées pour la concentration de (dans cet exemple) l’hydroxyde de sodium en fonction du temps. Les concentrations de bromoéthane sont, bien sûr, les mêmes que celles obtenues si les mêmes concentrations de chaque réactif étaient utilisées. Ces valeurs sont tracées pour donner un graphique concentration-temps, comme celui ci-dessous:
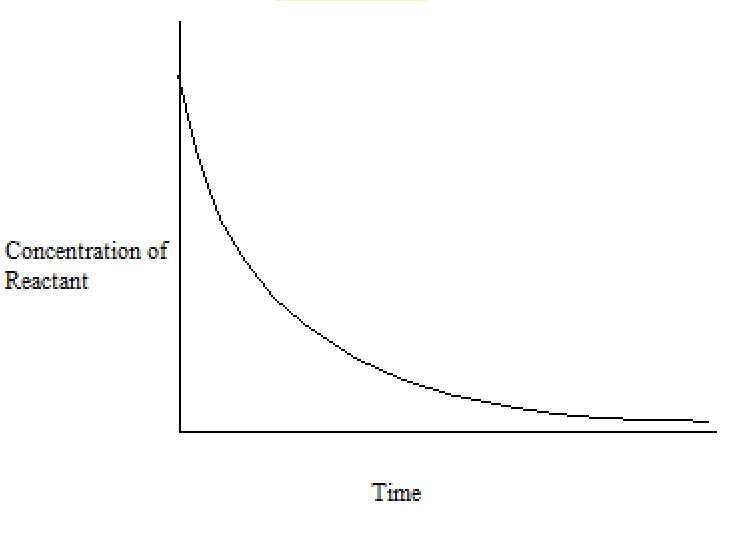
À partir des résultats tabulés ou d’un graphique comme celui ci-dessus, nous pouvons calculer différents types de vitesses de réaction: les vitesses de réaction moyennes et instantanées.
Vitesse de réaction moyennes et instantanées
Les vitesses de réaction ont la forme générale de (changement de concentration/changement de temps). Il existe deux types de vitesses de réaction (la troisième méthode utilisant les vitesses initiales sera abordée séparément). L’une est appelée vitesse moyenne de réaction, souvent désignée par (Δ[conc.] / Δt), tandis que l’autre est appelée vitesse instantanée de réaction, désignée soit par:
limΔt→0Δ[concentration]Δt
ou
d[concentration]dt
La vitesse moyenne de réaction, comme son nom l’indique, est une vitesse moyenne, obtenue en prenant le changement de concentration sur une période de temps, par exemple: -0,3 M / 15 minutes. Il s’agit d’une approximation de la vitesse de réaction dans l’intervalle; cela ne signifie pas nécessairement que la réaction a cette vitesse spécifique tout au long de l’intervalle de temps ou même à tout instant pendant ce temps. La vitesse de réaction instantanée, quant à lui, représente une valeur plus précise. La vitesse instantanée de réaction est définie comme le changement de concentration d’un intervalle de temps infiniment petit, exprimé par l’expression limité ou dérivée ci-dessus. En d’autres termes, il s’agit de la vitesse à laquelle une réaction se déroule à un moment donné.
Prenons l’analogie d’une voiture qui ralentit à l’approche d’un panneau d’arrêt. La valeur indiquée sur l’indicateur de vitesse à un moment donné – appelé t1 – pendant la décélération est une vitesse instantanée. Au fur et à mesure que le temps passe, la vitesse instantanée continue de diminuer jusqu’à atteindre zéro, lorsque la voiture (ou la réaction) s’arrête. Contrairement à la vitesse instantanée, la vitesse moyenne de la voiture n’est pas indiquée par le compteur de vitesse; mais elle peut être calculée comme le rapport entre la distance parcourue et le temps nécessaire pour amener le véhicule à un arrêt complet (Δt). Comme la voiture qui décélère, la vitesse moyenne d’une réaction chimique se situera quelque part entre sa vitesse initiale et sa vitesse finale.
Rappelez-vous l’exemple de la section précédente concernant la décomposition de H2O2 en H2O et O2. Si nous mesurons la concentration de peroxyde d’hydrogène, H2O2, dans une solution aqueuse, nous constatons qu’elle change lentement au fil du temps, à mesure que le H2O2 se décompose, selon l’équation:
2H2O2 (aq) → 2H2O (l) + O2 (g)
La vitesse à laquelle le peroxyde d’hydrogène se décompose peut être exprimée en termes de vitesse de variation de sa concentration, comme indiqué ici:
tauxdedécompositiondeH2O2 = -changementdeconcentrationduréactifintervalledetemps
Notez: Il n’y a pas de ½ devant puisque nous ne regardons pas la vitesse globale de la réaction. Ici nous regardons spécifiquement la vitesse de décomposition de H2O2 (aq).
Imaginons maintenant qu’à intervalles réguliers, nous déterminions expérimentalement la concentration de H2O2 présente dans le mélange réactionnel – la Figure 7.2.2 ci-dessous fournit un exemple de données recueillies pendant la décomposition de H2O2.
|
Temps (h) |
[H2O2] (mol L-1) |
Δ[H2O2] (mol L-1) |
Δt (h) |
Vitesse de décomposition (M/h) |
|
0,00 |
1,000 |
-0,500 |
6,00 |
0,0833 |
|
6,00 |
0,500 |
-0,500 ↔ -0,250 |
6,00 |
0,0833 ↔ 0,0417 |
|
12,00 |
0,250 |
-0,250 ↔ -0,125 |
6,00 |
0,0417 ↔ 0,0208 |
|
18,00 |
0,125 |
-0,125 ↔ -0,062 |
6,00 |
0,0208 ↔ 0,0103 |
|
24,00 |
0,0625 |
-0,062 |
6,00 |
0,0103 |
Figure 7.2.2. La vitesse de décomposition de H2O2 dans une solution aqueuse diminue lorsque la concentration de H2O2 diminue.
Pour obtenir les résultats tabulés pour cette décomposition, la concentration de peroxyde d’hydrogène a été mesurée toutes les 6 heures au cours d’une journée à une température constante de 40°C. Les vitesses de réaction ont été calculés pour chaque intervalle de temps en divisant le changement de concentration par l’intervalle de temps correspondant, comme indiqué ici pour la première période de 6 heures:
-Δ[H2O2]Δt = -(0.500 mol/L – 1.000mol/L)(6.00h – 0.00h) = 0.0833 molL-1h-1
Remarquez que les vitesses de réaction varient avec le temps, diminuant au fur et à mesure que la réaction progresse. Les résultats pour la dernière période de 6 heures donnent une vitesse de réaction de:
-Δ[H2O2]Δt = -(0.0625 mol/L – 0.125mol/L)(24.00h – 18.00h) = 0.0104 molL-1h-1
Les deux calculs ci-dessus impliquent la détermination d’une vitesse moyenne de réaction puisque nous examinons les valeurs de concentration au début et à la fin d’une période de temps. Par conséquent, ces valeurs calculées sont une vitesse moyenne de réaction sur cet intervalle de temps particulier (par exemple, la période entre 18h00 et 24h00 couvrant le dernier intervalle de temps de 6 heures).
Graphiquement, la détermination d’une vitesse moyenne de réaction suit le même principe: une ligne est tracée entre deux points de la courbe de concentration en fonction du temps (Figure 7.2.3). Ces deux points représentent les deux valeurs de concentration à deux instants différents dans le temps. En calculant la pente de cette ligne, on utilise la même formule pour calculer une vitesse de réaction moyenne – Δ[conc.] / Δt.
vitessemoyenne = pente
vitessemoyenne = ΔyΔx
vitessemoyenne = Δ[conc]Δt
vitessemoyenne = ([conc]2 – [conc]1)(t2 – t1)
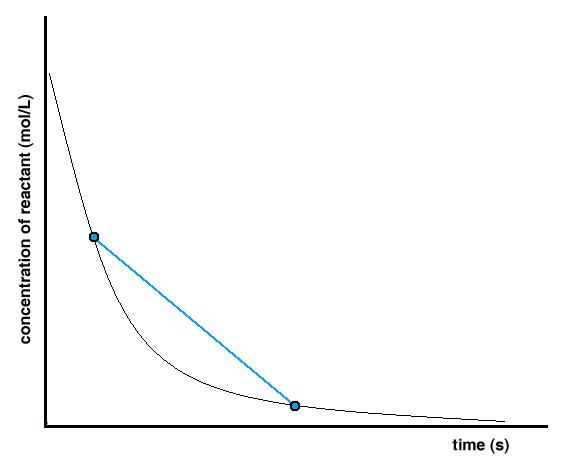
Figure 7.2.3. Détermination de la vitesse moyenne de réaction à partir d’un graphique de concentration en fonction du temps. t1t2[conc]1[conc]2
La vitesse instantanée d’une réaction peut être déterminée de deux façons. Si les conditions expérimentales permettent de mesurer les variations de concentration sur des intervalles de temps très courts, les vitesses moyennes calculées de la manière décrite précédemment fournissent une assez bonne approximation des vitesses instantanées. On peut aussi utiliser une procédure graphique qui, en fait, donne les résultats que l’on obtiendrait si les mesures sur de courts intervalles de temps étaient possibles (Figure 7.2.4). Pour en revenir à notre exemple de décomposition de H2O2, si nous représentons graphiquement la concentration de peroxyde d’hydrogène en fonction du temps, la vitesse instantanée de décomposition de H2O2 à un instant t est donnée par la pente d’une ligne droite tangente à la courbe à cet instant (Figure 7.2.5). Nous pouvons utiliser le calcul pour évaluer les pentes de ces lignes tangentes, mais la procédure à suivre dépasse le cadre de ce chapitre.
vitesseinstantanéeàt = pente
vitesseinstantanéeàt = ΔyΔx
vitesseinstantanéeàt = Δ[conc]Δt
vitesseinstantanéeàt = ([conc]2 – [conc]1)(t2 – t1)
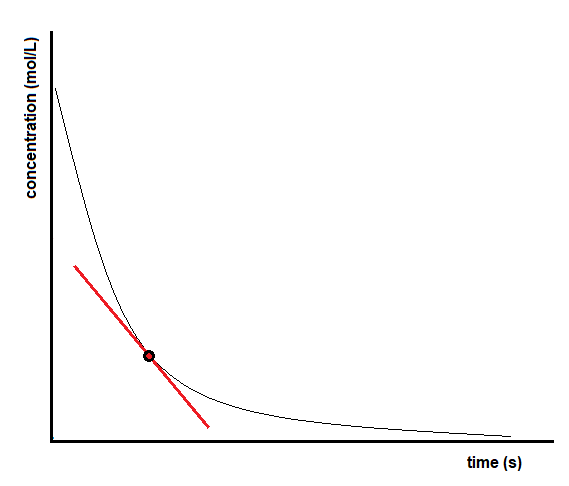
Figure 7.2.4.Détermination de la vitesse instantanée de réaction à partir d’un graphique de concentration en fonction du temps. t1t2t[conc]2[conc]1
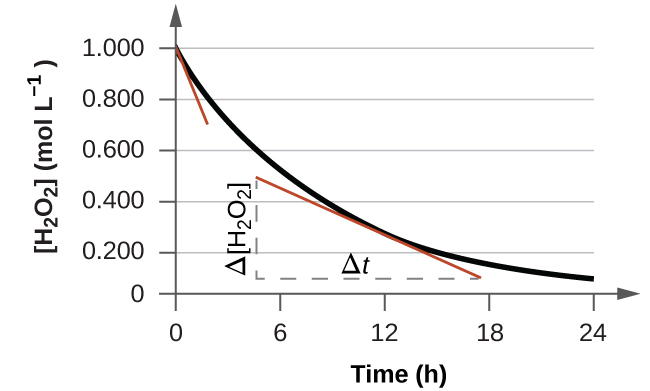
Figure 7.2.5. Ce graphique montre le tracé de la concentration en fonction du temps pour une solution 1,000 M de H2O2. La vitesse à un instant donné est égale à la pente d’une ligne tangente à cette courbe à cet instant. Les tangentes sont indiquées à t = 0 h (“vitesse initiale“) et à t = 10 h (“vitesse instantanée” à ce moment précis).
Vitesse initiale de la réaction
La vitesse initiale de la réaction est la vitesse à laquelle les réactifs sont d’abord mis en contact. Rappelez-vous l’analogie d’une voiture qui ralentit à l’approche d’un panneau d’arrêt. La vitesse initiale du véhicule – analogue au début d’une réaction chimique – serait la lecture du compteur de vitesse au moment où le conducteur commence à appuyer sur les freins (t0).
Comme la vitesse instantanée mentionnée ci-dessus, la vitesse initiale peut être obtenue soit expérimentalement, soit graphiquement. Pour déterminer expérimentalement la vitesse initiale, les scientifiques doivent mettre les réactifs en contact et mesurer la vitesse de réaction aussi rapidement que possible. Si cela n’est pas possible, ils peuvent trouver la vitesse initiale graphiquement. Pour ce faire, il faut trouver la pente de la ligne tangente à la courbe de réaction lorsque t = 0 (Figure 7.2.6).
vitesseinitiale = pente
vitesseinitiale = ΔyΔx
vitesseinitiale = Δ[conc]Δt
vitesseinitiale = ([conc]2 – [conc]1)(t2 – t1)
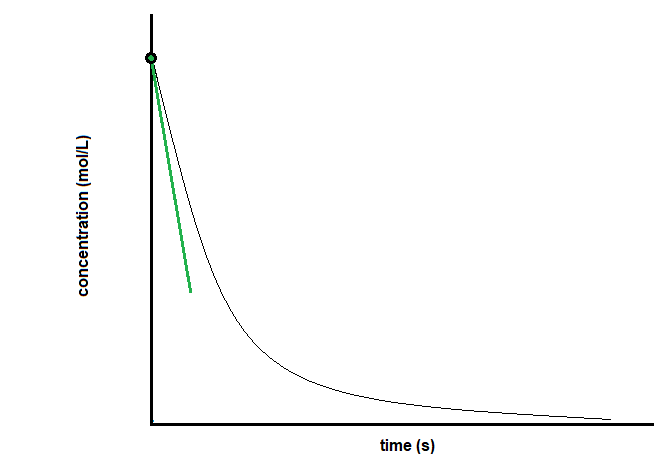
Figure 7.2.6.Détermination de la vitesse initiale de réaction à partir d’un graphique de concentration en fonction du temps. t0t1[conc]1[conc]0
|
Vitesses de réaction en analyse: Bandes de test pour l’analyse d’urine |
|
Les médecins utilisent souvent des bandes de test jetables pour mesurer les quantités de diverses substances dans l’urine d’un patient (Figure 7.2.7). Ces bandes de test contiennent divers réactifs chimiques, intégrés dans de petits coussinets à différents endroits de la bande, qui changent de couleur lorsqu’ils sont exposés à des concentrations suffisantes de substances spécifiques. Les instructions d’utilisation des bandes de test soulignent souvent qu’un temps de lecture adéquat est essentiel pour obtenir des résultats optimaux. Cette insistance sur le temps de lecture suggère que les aspects cinétiques des réactions chimiques qui se produisent sur la bande sont des considérations importantes. Le test de dépistage du glucose urinaire repose sur un processus en deux étapes représentées par les équations chimiques illustrées ici: La première équation décrit l’oxydation du glucose dans l’urine pour produire de la glucolactone et du peroxyde d’hydrogène. Le peroxyde d’hydrogène produit oxyde ensuite l’ion iodure incolore pour donner de l’iode brun, qui peut être détecté visuellement. Certaines bandes comprennent une substance supplémentaire qui réagit avec l’iode pour produire un changement de couleur plus distinct. Les deux réactions du test illustrées ci-dessus sont intrinsèquement très lentes, mais leur vitesse est augmentée par des enzymes spéciales incorporées dans la bande de test. Il s’agit d’un exemple de catalyse, un sujet abordé plus loin dans ce chapitre. Une bande de test de glucose typique utilisée dans l’urine a besoin environ 30 secondes pour l’achèvement des réactions formant une couleur. Une lecture trop rapide du résultat peut amener à conclure que la concentration en glucose de l’échantillon d’urine est plus faible qu’elle ne l’est en réalité (résultat faux-négatif). Attendre trop longtemps pour évaluer le changement de couleur peut conduire à un faux–positif en raison de l’oxydation plus lente (non catalysée) des ions iodure par d’autres substances présentes dans l’urine. Figure 7.2.6. Les bandes de test sont couramment utilisées pour détecter la présence de substances spécifiques dans l’urine d’une personne. De nombreuses bandes de test comportent plusieurs coussinets contenant divers réactifs pour permettre la détection de plusieurs substances sur une seule bande. (crédit: Iqbal Osman) |
Taux d'une réaction chimique calculé comme le rapport entre un changement mesuré de la quantité ou de la concentration d'une substance et l'intervalle de temps au cours duquel le changement s'est produit
Vitesse d'une réaction chimique à tout moment, déterminée par la pente de la droite tangentielle à un graphique de concentration en fonction du temps
Vitesse instantanée d'une réaction chimique à t = 0 s (immédiatement après le début de la réaction)


