3.6 – Loi de Hess
Une façon de signaler la chaleur absorbée ou libérée serait de compiler un ensemble massif de tableaux de référence qui énumèrent les changements d’enthalpie pour toutes les réactions chimiques possibles, ce qui demanderait un effort incroyable. Heureusement, la loi de Hess, dont nous parlerons dans ce chapitre, nous permet de calculer la variation d’enthalpie pour pratiquement toutes les réactions chimiques imaginables en utilisant un ensemble relativement restreint de données tabulées, comme celles qui suivent :
Enthalpie de la combustion (ΔHcomb) : Changement d’enthalpie qui se produit lors d’une réaction de combustion. Les changements d’enthalpie ont été mesurés pour la combustion de pratiquement toutes les substances qui brûlent dans l’oxygène ; ces valeurs sont généralement rapportées comme l’enthalpie de combustion par mole de substance.
Enthalpie de la formation (ΔHf) : Changement d’enthalpie dû à la formation d’une molécule à partir de ses éléments à l’état naturel dans des conditions standard (c’est-à-dire l’état dans lequel ils sont le plus stables à 25 C et 1 bar). Comme elles sont basées sur leurs éléments, l’enthalpie de formation pour les éléments à l’état naturel est toujours égale à zéro.
Enthalpie de la fusion (ΔHfus) : Changement d’enthalpie qui accompagne la fusion (fusion) d’une mole d’une substance ; ces valeurs ont été mesurées pour presque tous les éléments et pour la plupart des composés simples.
Enthalpie de la vaporisation (ΔHvap) : Changement d’enthalpie qui accompagne la vaporisation de 1 mole d’une substance. Le changement d’enthalpie qui accompagne la vaporisation d’une mole d’une substance ; ces valeurs ont également été mesurées pour presque tous les éléments et pour la plupart des composés volatils.
Enthalpie de la solution (ΔHsoln) : Changement d’enthalpie qui se produit lorsqu’une quantité déterminée de soluté se dissout dans une quantité donnée de solvant. L’enthalpie change lorsqu’une quantité spécifiée de soluté se dissout dans une quantité donnée de solvant.
Le changement d’enthalpie peut être visualisé à l’aide du diagramme énergétique suivant. Le changement d’énergie représente le changement d’enthalpie après qu’une réaction chimique ait eu lieu.
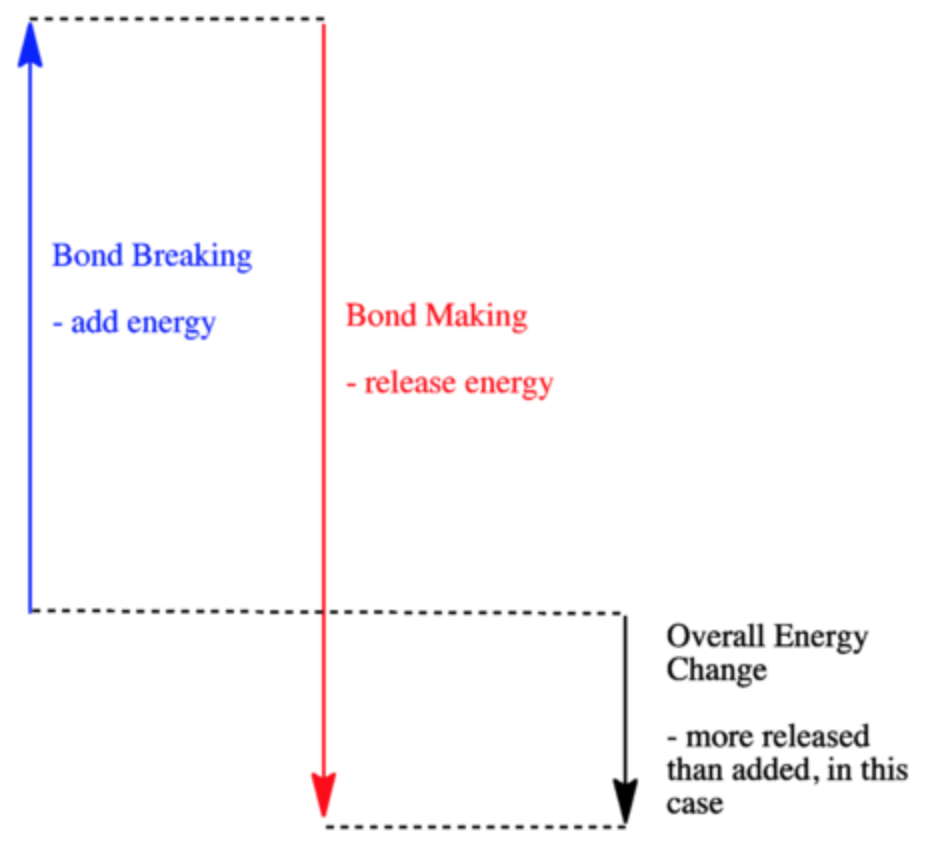
Figure 3.6.1. Diagramme de l’énergie de liaison montrant la variation d’énergie d’une réaction exothermique. (Chem Libre, de : https://chem.libretexts.org/Bookshelves/Physical_and_Theoretical_Chemistry_Textbook_Maps/Supplemental_Modules_(Physical_and_Theoretical_Chemistry)/Thermodynamics/Fundamentals_of_Thermodynamics/Enthalpy_Changes_in_Reactions, Creative Commons)
Enthalpie de la combustion
L'enthalpie standard de combustion (ΔH°C) est le changement d’enthalpie lorsque 1 mole d’une substance brûle (se combine vigoureusement avec l’oxygène) dans des conditions d’état standard ; elle est parfois appelée “chaleur de combustion”. Par exemple, l’enthalpie de combustion de l’éthanol, -1366,8 kJ/mole, est la quantité de chaleur produite lorsqu’une mole d’éthanol subit une combustion complète à 25 °C et 1 bar de pression, donnant des produits également à 25 °C et 1 bar.
C2H5OH (l) + 3 O2 (g) → 2 CO2 + 3 H2O (l) ΔH298∘ = – 1366,8 kJ
Il convient de noter qu’historiquement, l’unité de pression standard était 1 atmosphère (101,325 kPa), mais que l’UICPA l’a remplacée en 1982 par 1 bar (100 kPa). Sachez que ces deux valeurs sont encore couramment utilisées comme pression standard.
Les enthalpies de combustion de nombreuses substances ont été mesurées ; quelques-unes d’entre elles sont énumérées dans le tableau 3.6.1. De nombreuses substances facilement disponibles ayant de grandes enthalpies de combustion sont utilisées comme combustibles, notamment l’hydrogène, le carbone (comme le charbon ou le charbon de bois), et les hydrocarbures (composés contenant uniquement de l’hydrogène et du carbone), comme le méthane, le propane, et les principaux composants de l’essence.
Tableau 3.6.1 Enthalpies molaires standard de la combustion
|
Enthalpies molaires de combustion standard |
||
|
Substance |
Réaction à la combustion |
Enthalpie de la combustion, ΔH°C (kJ à 25°C) |
|
carbone |
C (s) + O2 (g) → CO2 (g) |
−393.5 |
|
hydrogène |
H2 (g) + 1/2 O2 (g) → H2O (l) |
−285.8 |
|
magnésium |
Mg (s) + 1/2 O2 (g) → MgO (s) |
−601.6 |
|
soufre |
S (s) + O2 (g) → SO2 (g) |
−296.8 |
|
monoxyde de carbone |
CO (g) + 1/2 O2 (g) → CO2 (g) |
−283.0 |
|
méthane |
CH4 (g) + 2 O2 (g) → CO2 (g) + 2 H2O (l) |
−890.8 |
|
acétylène |
C2H2 (g) + 5/2 O2 (g) → 2 CO2 (g) + H2O (l) |
−1301.1 |
|
éthanol |
C2H5OH (l) + 3 O2 (g) → 2 CO2 (g) + 3 H2O (l) |
−1366.8 |
|
méthanol |
CH3OH (l) + 3/2 O2 (g) → CO2 (g) + 2 H2O (l) |
−726.1 |
|
isooctane |
C8H18 (l) + 25/2 O2 (g) → 8 CO2 (g) + 9 H2O (l) |
−5461 |
Exemple 3.6.1 – Utilisation de l’enthalpie de la combustion
Comme l’illustre la figure 3.6.2, la combustion de l’essence est un processus hautement exothermique. Déterminons la quantité approximative de chaleur produite par la combustion de 1,00 L d’essence, en supposant que l’enthalpie de combustion de l’essence est la même que celle de l’isooctane, un composant commun de l’essence. La densité de l’isooctane est de 0,692 g/mL.

Figure 3.6.2. La combustion de l’essence est très exothermique. (crédit : modification du travail par “AlexEagle“/Flickr)
Solution
En partant d’une quantité connue (1,00 L d’isooctane), nous pouvons effectuer des conversions entre unités jusqu’à ce que nous arrivions à la quantité de chaleur ou d’énergie souhaitée. L’enthalpie de combustion de l’isooctane fournit l’une des conversions nécessaires. Le tableau ci-dessus donne cette valeur comme -5460 kJ pour une mole d’isooctane (C8H18).
L’utilisation de ces données,
![]()
La combustion de 1,00 L d’isooctane produit 33 100 kJ de chaleur. (Cette quantité d’énergie est suffisante pour faire fondre 99,2 kg de glace).
Note : Si vous faites ce calcul étape par étape, vous trouverez :
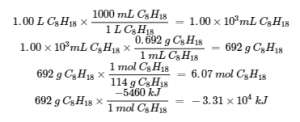
Vérifiez votre apprentissage 3.6.1 – Utilisation de l’enthalpie de la combustion
Quelle est la quantité de chaleur produite par la combustion de 125 g d’acétylène ?
Réponse
6,25 × 103 kJ
Nouvelles technologies énergétiques à base d’algues (biocarburants)
Les réserves de combustibles fossiles diminuant et leur extraction devenant plus coûteuse, la recherche de sources de combustibles de remplacement pour l’avenir est en cours. Parmi les biocarburants les plus prometteurs figurent ceux qui sont dérivés des algues (figure 3.6.3.). Les espèces d’algues utilisées sont non toxiques, biodégradables et comptent parmi les organismes à croissance la plus rapide au monde. Environ 50 % du poids des algues est constitué d’huile, qui peut être facilement convertie en carburant comme le biodiesel. Les algues peuvent produire 26 000 gallons de biocarburant par hectare, soit beaucoup plus d’énergie par acre que les autres cultures. Certaines souches d’algues peuvent se développer dans une eau saumâtre qui n’est pas utilisable pour d’autres cultures. Les algues peuvent produire du biodiesel, du biogazoline, de l’éthanol, du butanol, du méthane et même du carburant pour avions.

Figure 3.6.3. (a) Les petits organismes d’algues peuvent être (b) cultivés en grandes quantités et éventuellement (c) transformés en un carburant utile tel que le biodiesel. (Crédit (a): modification des travaux de Micah Sittig ; crédit (b) : modification des travaux de Robert Kerton ; crédit (c) : modification des travaux de John F. Williams)
Selon le ministère américain de l’énergie, seuls 39 000 kilomètres carrés (environ 0,4 % de la masse terrestre des États-Unis ou moins de 1/7 de la zone utilisée pour la culture du maïs) peuvent produire suffisamment de carburant à base d’algues pour remplacer tout le carburant à base de pétrole utilisé aux États-Unis. Le coût des carburants à base d’algues est de plus en plus compétitif – par exemple, l’armée de l’air américaine produit du carburant pour avion à partir d’algues pour un coût total inférieur à 5 dollars américains le gallon. Le procédé utilisé pour produire du carburant à base d’algues est le suivant : cultiver les algues (qui utilisent la lumière du soleil comme source d’énergie et leCO2 comme matière première) ; récolter les algues ; extraire les composés du carburant (ou les composés précurseurs) ; traiter si nécessaire (par exemple, effectuer une réaction de transestérification pour fabriquer du biodiesel) ; purifier et distribuer (figure 3.6.3.).
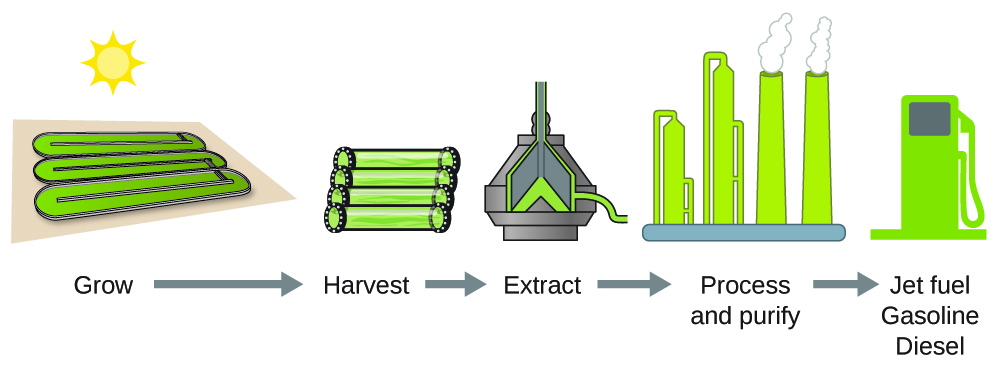
Figure 3.6.4. Les algues convertissent la lumière du soleil et le dioxyde de carbone en pétrole qui est récolté, extrait, purifié et transformé en une variété de carburants renouvelables.
Cliquez ici pour en savoir plus sur le processus de création de biocarburant à base d’algues.
Enthalpie standard de la formation
Enthalpie standard de formation ΔHf° est un changement d’enthalpie pour une réaction dans laquelle exactement une mole d’une substance pure est formée à partir d’éléments libres dans leurs états les plus stables dans des conditions standard. Ces valeurs sont particulièrement utiles pour calculer ou prévoir les changements d’enthalpie pour les réactions chimiques qui sont peu pratiques ou dangereuses à réaliser, ou pour les processus pour lesquels il est difficile de faire des mesures. Si nous disposons de valeurs pour les enthalpies standard de formation appropriées, nous pouvons déterminer le changement d’enthalpie pour toute réaction, ce que nous allons pratiquer ici dans cette section.
L’enthalpie standard de formation du CO2 (g) est de -393,5 kJ/mol. C’est le changement d’enthalpie pour la réaction exothermique :
C (s) + O2 (g) → CO2 (g) ΔHf∘ = ΔH298∘ = – 393,5 kJ
en commençant par les réactifs à une pression de 1 bar et 25 °C (avec le carbone présent sous forme de graphite, la forme de carbone la plus stable dans ces conditions) et en terminant par une mole de CO2, également à 1 bar et 25 °C. Pour le dioxyde d’azote, NO2 (g), ΔHf° est de 33,2 kJ/mol. C’est le changement d’enthalpie pour la réaction :
Une équation de réaction avec 1/2 mole de N2 et 1 mole de O2 est correcte dans ce cas car l’enthalpie standard de formation se réfère toujours à 1 mole de produit, NO2 (g).
Vous trouverez un tableau des enthalpies standard de formation de nombreuses substances courantes à l’annexe G. Ces valeurs indiquent que les réactions de formation vont de très exothermiques (telles que -2984 kJ/mole pour la formation de P4O10), à fortement endothermiques (telles que +226,7 kJ/mole pour la formation d’acétylène, C2H2). Par définition, l’enthalpie standard de formation d’un élément sous sa forme la plus stable est égale à zéro dans des conditions standard, qui est de 1 bar pour les gaz et de 1 M pour les solutions. Les formes de référence utilisées pour la plupart des éléments sont simplement l’élément lui-même (par exemple l’argent : Ag (s)), mais certaines sont plus inhabituelles. Ces exceptions sont résumées dans le tableau ci-dessous.
Tableau 3.6.2 Formulaires de référence des éléments inhabituels
|
Formulaires de référence des éléments |
|
|
Élément |
Formulaire de référence |
|
hydrogène |
H2 (g) |
|
azote |
N2 (g) |
|
oxygen |
O2 (g) |
|
fluor |
F2 (g) |
|
chlore |
Cl2 (g) |
|
brome |
Br2 (l) |
|
iode |
I2 (s) |
|
carbone |
C (graphite, s) |
|
phosphore |
P (blanc, s) |
|
soufre |
S8 (s) |
Exemple 3.6.2 – Évaluation d’une enthalpie de formation
L’ozone, O3 (g), se forme à partir de l’oxygène, O2 (g), par un processus endothermique. Le rayonnement ultraviolet est la source d’énergie qui déclenche cette réaction dans la haute atmosphère. En supposant que les réactifs et les produits de la réaction sont dans leur état standard, déterminez l’enthalpie standard de formation, ΔHf° de l’ozone à partir des informations suivantes :
3 O2 (g) → 2 O3 (g) ΔH298∘ = + 286 kJ
Solution
ΔHf° est le changement d’enthalpie pour la formation d’une mole d’une substance à son état standard à partir des éléments à leur état standard. Ainsi, ΔHf° pour O3 (g) est le changement d’enthalpie pour la réaction :
Pour la formation de 2 mol de O3 (g), ΔH°298 = + 286 kJ. Ce rapport, ![]() , la valeur de l’enthalpie de formation de l’O3(g) peut être utilisée comme un facteur de conversion pour trouver la chaleur produite lorsque 1 mole d’O3(g) est formée, ce qui est l’enthalpie de formation de l’O3 (g) :
, la valeur de l’enthalpie de formation de l’O3(g) peut être utilisée comme un facteur de conversion pour trouver la chaleur produite lorsque 1 mole d’O3(g) est formée, ce qui est l’enthalpie de formation de l’O3 (g) :
![]()
Par conséquent, ΔHf° [O3 (g) ] = + 143 kJ/mol.
Vérifiez votre apprentissage 3.6.2 – Évaluation d’une enthalpie de formation
L’hydrogène gazeux, H2, réagit de manière explosive avec le chlore gazeux, Cl2, pour former du chlorure d’hydrogène, HCl (g). Quel est le changement d’enthalpie pour la réaction d’une mole de H2 (g) avec une mole de Cl2 (g) si les réactifs et les produits se trouvent dans des conditions d’état standard ? L’enthalpie standard de formation de HCl (g) est de -92,3 kJ/mol.
Réponse
H2 (g) + Cl2 (g) → 2 HCl (g) ΔH298∘ = – 184,6 kJ
Exemple 3.6.3 – Rédaction d’équations de réaction pourΔHf
Écrivez les équations de la réaction de la chaleur de formation pour :
(a) C2H5OH (l)
(b) Ca3(PO4)2 (s)
Solution
Si l’on se souvient que les équations de réaction de ΔHf° servent à former 1 mole du composé à partir de ses éléments constitutifs dans des conditions standard, nous avons :
(a) 2 C (s, graphite) + 3 H2 (g) + 1/2 O2 (g) → C2H5OH (l)
(b) 3 Ca (s) + 1/2 P4 (s) + 4 O2 (g) → Ca3(PO4)2 (s)
Note : L’état standard du carbone est le graphite, et le phosphore existe sous forme de P4.
Vérifiez votre apprentissage 3.6.3 – Rédaction d’équations de réaction pourΔHf
Écrivez les équations de la réaction de la chaleur de formation pour :
(a) C2H5OC2H5 (l)
(b) Na2CO3 (s)
Réponse
(a) 4 C (s, graphite) + 5 H2 (g) + 1/2 O2 (g) → C2H5OC2H (l)
(b) 2 Na (s) + C (s, graphite) + 3/2 O2 (g) → Na3CO3 (s)
La loi de Hess
Il y a deux façons de déterminer la quantité de chaleur impliquée dans un changement chimique : la mesurer expérimentalement ou la calculer à partir d’autres changements d’enthalpie déterminés expérimentalement. Certaines réactions sont difficiles, voire impossibles, à étudier et à mesurer de manière précise par voie expérimentale. Et même lorsqu’une réaction n’est pas difficile à réaliser ou à mesurer, il est pratique de pouvoir déterminer la chaleur impliquée dans une réaction sans avoir à réaliser une expérience.
Ce type de calcul implique généralement l’utilisation de la loi de Hess, qui stipule Si un processus peut être écrit comme la somme de plusieurs processus par étapes, le changement d’enthalpie du processus total est égal à la somme des changements d’enthalpie des différentes étapes. La loi de Hess est valable parce que l’enthalpie est une fonction d’état : Les changements d’enthalpie dépendent uniquement de l’endroit où un processus chimique commence et se termine, mais pas du chemin qu’il prend du début à la fin. Par exemple, on peut penser que la réaction du carbone avec l’oxygène pour former du dioxyde de carbone se produit soit directement, soit par un processus en deux étapes. Le processus direct est écrit :
C (s) + O2 (g) → CO2 (g) ΔH298∘ = – 394 kJ
Dans ce processus en deux étapes, il y a d’abord formation de monoxyde de carbone :
C (s) + 1/2 O2 (g) → CO2 (g) ΔH298∘ = – 111 kJ
Ensuite, le monoxyde de carbone réagit encore pour former du dioxyde de carbone :
CO (g) + 1/2 O2 (g) → CO2 (g) ΔH298∘ = – 283 kJ
L’équation décrivant la réaction globale est la somme de ces deux changements chimiques :
Étape 1 : C (s) + 1/2 O2 (g) → CO2 (g) ΔH298∘ = – 111 kJ
Étape 2 : CO (g) + 1/2 O2 (g) → CO2 (g) ΔH298∘ = – 283 kJ
Somme : C (s) + O2 (g) + CO (g) → CO (g) + CO2 (g)
Étant donné que le CO produit à l’étape 1 est consommé à l’étape 2, la variation nette est :
C (s) + O2 (g) → CO2 (g) ΔH298∘ = – 394 kJ
Selon la loi de Hess, le changement d’enthalpie de la réaction sera égal à la somme des changements d’enthalpie des étapes. Nous pouvons appliquer les données des enthalpies expérimentales de combustion du tableau 3.6.1 pour trouver le changement d’enthalpie de l’ensemble de la réaction à partir de ses deux étapes :
C (s) + 1/2 O2 (g) → CO2 (g) ΔH298∘ = – 111 kJ

Le résultat est présenté dans la figure 3.6.5. Nous voyons que ΔH de la réaction globale est la même qu’elle se produise en une ou deux étapes (c’est-à-dire qu’il s’agit d’une fonction d’état). Ce résultat (ΔH global de la réaction = somme des valeurs de ΔH pour les “étapes” de la réaction globale) est vrai en général pour les processus chimiques et physiques.
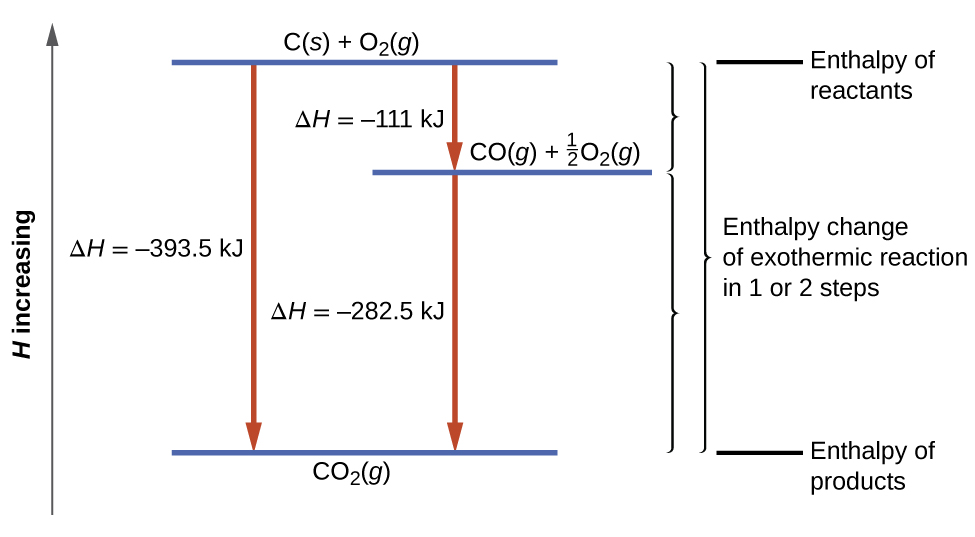
Figure 3.6.5. La formation de CO2(g) à partir de ses éléments peut être considérée comme se déroulant en deux étapes, qui s’additionnent pour former la réaction globale, telle que décrite par la loi de Hess. Les lignes bleues horizontales représentent les enthalpies. Pour un processus exothermique, les produits sont à une enthalpie inférieure à celle des réactifs.
Avant de poursuivre notre pratique en utilisant la loi de Hess, rappelons deux caractéristiques importantes de ΔH.
ΔH est directement proportionnel aux quantités de réactifs ou de produits. Par exemple, le changement d’enthalpie pour la réaction formant 1 mole de NO2 (g) est de +33,2 kJ :
Lorsque 2 moles de NO2 (deux fois plus) sont formées, le ΔH sera deux fois plus grand :
N2 (g) + 2 O2 (g) → 2 NO2 (g) ΔH = +66,4 kJ
En général, si nous multiplions ou divisons une équation par un nombre, alors la variation d’enthalpie doit également être multipliée ou divisée par le même nombre.
ΔH pour une réaction dans un sens est égal en magnitude et de signe opposé à ΔH pour la réaction dans le sens inverse. Par exemple, étant donné que
H2 (g) + Cl2 (g) → 2 HCl (g) ΔH = – 184,6 kJ
Ensuite, pour la réaction “inverse”, le changement d’enthalpie est également “inversé” :
2 HCl (g) → H2 (g) + Cl2 (g) ΔH = + 184,6 kJ
Exemple 3.6.4 – Calcul par étapes de ΔHf° en utilisant la loi de Hess
Déterminer l’enthalpie de formation, ΔHf°, du FeCl3 (s) à partir des changements d’enthalpie du processus en deux étapes suivantes qui se produit dans des conditions d’état standard :
Fe (s) + Cl2 (g) → FeCl2 (s) ΔH = – 341,8 kJ
FeCl2 (s) + 1/2 Cl2 (g) → FeCl3 (s) ΔH = – 57,7 kJ
Solution
Nous essayons de trouver l’enthalpie standard de formation de FeCl3 (s), qui est égale à ΔH° pour la réaction :
Fe (s) + 3/2 Cl2 (g) → FeCl3 (s) ΔH∘ = ?
En examinant les réactions, nous constatons que la réaction pour laquelle nous voulons trouver ΔH° est la somme des deux réactions dont les valeurs de ΔH sont connues, nous devons donc additionner leurs enthalpies :
Fe (s) + Cl2 (g) → FeCl2 (s) ΔH∘ = – 341,8 kJ
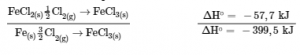
L’enthalpie de formation, ΔHf°, de FeCl3 (s) est de -399,5 kJ/mol.
Vérifiez votre apprentissage 3.6.4 – Calcul par étapes de ΔHf° en utilisant la loi de Hess
Calculer ΔH pour le processus :
N2 (g) + 2 O2 (g) → 2 NO2 (g)
à partir des informations suivantes :
N2 (g) + 2 O2 (g) → 2 NO2 (g) ΔH = 180,5 kJ
NON (g) + 1/2 O2 (g) → NO2 (g) ΔH = – 57.06 kJ
Réponse
66,4 kJ
Voici un exemple moins simple qui illustre le processus de réflexion nécessaire à la résolution de nombreux problèmes de la loi de Hess. Il montre comment on peut trouver de nombreuses enthalpies standard de formation (et d’autres valeurs de ΔH) si elles sont difficiles à déterminer expérimentalement.
Exemple 3.6.5 – Un problème plus difficile avec la loi de Hess
Le monofluorure de chlore peut réagir avec le fluor pour former du trifluorure de chlore :
(i) ClF (g) + F2 (g) → ClF3 (g) ΔH∘ = ?
Utilisez les réactions ici pour déterminer le ΔH° pour la réaction (i) :
(ii) 2 OF2 (g) → O2 (g) + 2 F2 (g) ΔH(ii)∘ = – 49,4 kJ
(iii) 2 ClF2 (g) + O2 (g) → Cl2O (g) + OF2 (g) ΔH(iii)∘ = + 205,6 kJ
(iv) ClF3 (g) + O2 (g) → 1/2 Cl2O (g) + 3/2 OF2 (g) ΔH(iv)∘ = + 266,7 kJ
Solution
Notre objectif est de manipuler et de combiner les réactions (ii), (iii) et (iv) de manière à ce qu’elles s’additionnent pour former la réaction (i). En allant de gauche à droite dans (i), nous voyons d’abord que le ClF (g) est nécessaire comme réactif. Cela peut être obtenu en multipliant la réaction (iii) par 1/2 ce qui signifie que la variation de ΔH° est également multipliée par 1/2:
ClF (g) + 1/2 O2 (g) → 1/2 Cl2O (g) + 1/2 OF2 (g)
ΔH(iii)∘ = 1/2(+ 205,6 kJ) = + 102,8 kJ
Ensuite, nous voyons que le F2 est également nécessaire en tant que réactif. Pour cela, il faut inverser et réduire de moitié la réaction (ii), ce qui signifie que le ΔH° change de signe et est réduit de moitié :
Pour obtenir la ClF3 en tant que produit, inverser (iv), en changeant le signe de ΔH° :
Vérifiez maintenant que ces réactions s’additionnent pour donner la réaction que nous souhaitons :
ClF (g) + 1/2 O2 (g) → 1/2 Cl2O (g) + 1/2 OF2 (g)
ΔH(iii)∘ = 1/2(+ 205,6 kJ) = + 102,8 kJ
1/2 O2 (g) + F2 (g) → OF2 (g) ΔH(ii)∘ = + 24,7 kJ

Réactifs 1/2 O2 et 1/2 O2 annuler produit O2 ; produit 1/2 Cl2O annule le réactif 1/2 Cl2O ; et réactif 3/2 OF2 est annulé par les produits 1/2 OF2 et OF2. Il ne reste donc que les réactifs ClF (g) et F2 (g) et le produit ClF3 (g), qui sont ce que nous voulons. Puisque la somme de ces trois réactions modifiées donne la réaction qui nous intéresse, la somme des trois valeurs modifiées de ΔH° donnera le ΔH° souhaité :
ΔH∘ = (+ 102,8 kJ) + (24,7 kJ) + (- 266,7 kJ) = – 139,2 kJ
Vérifiez votre apprentissage 3.6.6 – Un problème plus difficile avec la loi de Hess
Le chlorure d’aluminium peut être formé à partir de ses éléments :
(i) 2 Al (s) + 3 Cl2 (g) → 2 AlCl3 (s) ΔH∘=?
Utilisez les réactions ici pour déterminer le ΔH° pour la réaction (i) :
(ii) HCl (g) → HCl (aq) ΔH(ii)∘ = – 74,8 kJ
(iii) H2 (g) + Cl2 (g) → 2 HCl (g) ΔH(iii)∘ = – 185 kJ
(iv) AlCl3 (aq) → AlCl3 (s) ΔH(iv)∘ = + 323 kJ/mol
(v) 2 Al (s) + 6 HCl (aq) → 2 AlCl3 (aq) + 3 H2 (g) ΔH(v)∘ = + 1049 kJ
Réponse
-1407 kJ
Nous pouvons également utiliser la loi de Hess pour déterminer le changement d’enthalpie de toute réaction si les enthalpies correspondantes de formation des réactifs et des produits sont disponibles. Les réactions par étapes que nous considérons sont (i) des décompositions des réactifs en leurs éléments constitutifs (pour lesquels les changements d’enthalpie sont proportionnels au négatif des enthalpies de formation des réactifs), suivies par (ii) des recombinaisons des éléments pour donner les produits (avec des changements d’enthalpie proportionnels aux enthalpies de formation des produits). Le changement d’enthalpie standard de la réaction globale est donc égal à (ii) la somme des enthalpies de formation standard de tous les produits plus (i) la somme des négatifs des enthalpies de formation standard des réactifs. Cette formule est généralement légèrement réorganisée pour s’écrire comme suit, ∑ représentant “la somme de” et n représentant les coefficients stœchiométriques :
ΔHréaction∘ = Σn × ΔHf∘(produits) – Σn × ΔHf∘(réactifs)
L’exemple suivant montre en détail pourquoi cette équation est valable, et comment l’utiliser pour calculer le changement d’enthalpie pour une réaction d’intérêt.
Exemple 3.6.7 – Utiliser la loi de Hess
Quel est le changement d’enthalpie standard pour la réaction :
3 NO2 (g) + H2O (l) → 2 HNO3 (aq) + NO (g) ΔH∘ = ?
Solution :
Utilisez la forme spéciale de la loi de Hess donnée précédemment :
ΔHréaction∘ = Σn × ΔHf∘(produits) – Σn × ΔHf∘(réactifs)
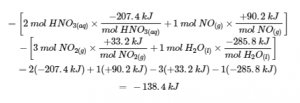
Solution
Soutenir la validité de l’équation générale
On peut aussi écrire cette réaction comme la somme des décompositions de 3 NO2 (g) et 1 H2O (l) en leurs éléments constitutifs, et la formation de 2 HNO3 (aq) et 1 NO (g) à partir de leurs éléments constitutifs. Nous avons écrit ces réactions et noté leurs relations avec les valeurs de ΔHf° pour ces composés (de l’annexe G) :
3 NO2 (g) → 3/2 N2 (g) + 3 O2 (g) ΔH1∘ = – 99,6 kJ
H2O (l) → H2 (g) + 1/2 O2 (g) ΔH2∘ = + 285,8 kJ [- 1 × ΔHf∘(H2O)]
H2 (g) + N2 (g) + 1/2 O2 (g) → 2 HNO3 (aq)
ΔH3∘ = – 414,8 kJ [- 1 × ΔHf∘(HNO3)]
En additionnant ces équations de réaction, on obtient la réaction qui nous intéresse :
3 NO2 (g) + H2O (l) → 2 HNO3 (aq) + NO (g)
La somme de leurs changements d’enthalpie donne la valeur que nous voulons déterminer :
ΔHrxn∘ = ΔH1∘ + ΔH2∘ + ΔH3∘ + ΔH4∘ = (- 99.6 kJ) + (+ 285.8 kJ) +(- 414.8 kJ) + (+ 90.2 kJ)
= – 138,4 kJ
Le changement d’enthalpie standard pour cette réaction est donc ΔH° = -138,4 kJ.
Notez que ce résultat a été obtenu en (1) multipliant le ΔHf° de chaque produit par son coefficient stœchiométrique et en additionnant ces valeurs, (2) en multipliant le ΔHf° de chaque réactif par son coefficient stœchiométrique et en additionnant ces valeurs, puis (3) en soustrayant le résultat trouvé en (2) du résultat trouvé en (1). C’est également la procédure à suivre pour utiliser l’équation générale, comme indiqué.
Pour une explication plus approfondie de cette approche, consultez la vidéo suivante.
Vérifiez votre apprentissage 3.6.7 – Utiliser la loi de Hess
Calculer la chaleur de combustion d’une mole d’éthanol, C2H5OH (l), lorsque H2O (l) et CO2 (g) sont formés. Utilisez les enthalpies de formation suivantes : C2H5OH (l), -278 kJ/mole ; H2O (l), -286 kJ/mole ; et CO2 (g), -394 kJ/mole.
Réponse
-1368 kJ/mol
Questions
★ Questions
- Quelle quantité de chaleur est produite lorsque 100 ml de HCl 0,250 M (densité, 1,00 g/mL) et 200 ml de NaOH 0,150 M (densité, 1,00 g/mL) sont mélangés ?
HCl (aq) + NaOH (aq) → NaCl (aq) + H2O (l) ΔH298∘ = – 58 kJ
Si les deux solutions sont à la même température et que la capacité thermique des produits est de 4,19 J/g °C, de combien la température augmentera-t-elle ? Quelle hypothèse avez-vous faite dans votre calcul?
2. Avant l’introduction des chlorofluorocarbures, le dioxyde de soufre (enthalpie de vaporisation, 6,00 kcal/mol) était utilisé dans les réfrigérateurs domestiques. Quelle masse de SO2 doit être évaporée pour éliminer autant de chaleur que l’évaporation de 1,00 kg de CCl2F2 (l’enthalpie de vaporisation est de 17,4 kJ/mol) ? Les réactions de vaporisation du SO2 et du CCl2F2 sont respectivement le SO2 (l) ⟶ SO2 (g) et le CCl2F (l)⟶CCl2F2 (g).
3. Les maisons peuvent être chauffées en pompant de l’eau chaude par des radiateurs. Quelle masse d’eau fournira la même quantité de chaleur lorsqu’elle est refroidie de 95,0 à 35,0 °C, que la chaleur fournie lorsque 100 g de vapeur sont refroidis de 110 °C à 100 °C.
4. L’enthalpie standard de formation de H2O (g) diffère-t-elle de celle de ΔH° pour la réaction 2 H2 (g) + O2 (g) ⟶ 2 H2O (g) ?
5. Joseph Priestly a préparé de l’oxygène en 1774 en chauffant de l’oxyde de mercure(II) rouge avec la lumière du soleil focalisée à travers une lentille. Quelle quantité de chaleur est nécessaire pour décomposer exactement 1 mole de HgO (s) rouge en Hg (l) et O2 (g) dans des conditions normales ?
6. Combien de kilojoules de chaleur seront libérées lorsqu’exactement une mole de manganèse, Mn, est brûlée pour former du Mn3O4(s) dans des conditions d’état standard ?
★★ Questions
7. La séquence de réactions suivante se produit lors de la production commerciale d’acide nitrique aqueux :
4 NH3 (g) + 5 O2 (g) → 4 NO (g) + 6 H2O (l) ΔH = -907 kJ
2 NO (g) + O2 (g) → 2 NO (g) ΔH = – 113 kJ
3 NO2 + H2O (l) → 2 HNO3 (aq) + NO (g) ΔH = – 139 kJ
Déterminez la variation totale d’énergie pour la production d’une mole d’acide nitrique aqueux par ce procédé.
8. Le graphite et le diamant brûlent tous deux.
C (s, diamant) + O2 (g) → CO2 (g)
Pour la conversion du graphite en diamant :
C (s, diamant) → CO2 (g) ΔH298∘ = 1,90 kJ
Qu’est-ce qui produit le plus de chaleur, la combustion du graphite ou la combustion du diamant ?
9. À partir des chaleurs molaires de formation de l’annexe G, déterminez la quantité de chaleur nécessaire pour évaporer une mole d’eau :
H2O (l) → H2O (g)
10. Calculer ΔH298∘ pour le processus
Sb (s) + 5/2 Cl2 (g) → SbCl5 (g)
à partir des informations suivantes :
Sb (s) + 3/2 Cl2 (g) → SbCl5 (g) ΔH298∘ = – 314 kJ
SbCl3 (s) + Cl2 (g) → SbCl5 (g) ΔH298∘ = – 80 kJ
11. Calculer ΔH298° pour le processus
Zn (s) + S (s) + 2 O2 (g) → ZnSO4 (s)
à partir des informations suivantes :
Zn (s) + S (s) → ZnS (s) ΔH298∘ = – 206,0 kJ
ZnS (s) + 2 O2 (g) → ZnSO4 (s) ΔH298∘ = – 776,8 kJ
12. Calculer l’enthalpie molaire standard de formation de NO(g) à partir des données suivantes :
N2 (g) + 2 O2 → 2 NO2 (g) ΔH298∘ = 66,4 kJ
2 NO (g) + O2 → 2 NO2 (g) ΔH298∘ = – 114,1 kJ
13. En utilisant les données de l’annexe G, calculez la variation d’enthalpie standard pour chacune des réactions suivantes :
a. N2 (g) + O2 (g) → 2 NO (g)
b. Si (s) + 2 Cl2 (g) → SiCl4 (g)
c. Fe2O3 (s) + 3 H2 (g) → 2 Fe (s) + 3 H2O (l)
d. 2 LiOH (s) + Co2 (g) → Li2CO3 (s) + H2O (g)
14. Les réactions suivantes peuvent être utilisées pour préparer des échantillons de métaux. Déterminez le changement d’enthalpie dans des conditions d’état standard pour chacune d’entre elles.
a. 2 Ag2O (s) → 4 Ag (s) + O2 (g)
b. SnO (s) + CO (g) → Sn (s) + CO2 (g)
c. Cr2O3 (s) + 3 H2 (g) → 2 Cr (s) + 3 H2O (l)
d. 2 Al (s) + Fe2O3 (s) → Al2O3 (s) + 2 Fe (s)
15. Calculer l’enthalpie de combustion du propane, C3H8 (g), pour la formation de H2O (g) et CO2 (g). L’enthalpie de formation du propane est de -104 kJ/mol.
16. Le propane et le butane sont tous deux utilisés comme combustibles gazeux. Quel composé produit le plus de chaleur par gramme lorsqu’il est brûlé ?
★★★ Questions
17. L’éthanol, le C2H5OH, est utilisé comme carburant pour les véhicules à moteur, notamment au Brésil.
a. Écrivez l’équation équilibrée pour la combustion de l’éthanol en CO2(g) et H2O(g), et, en utilisant les données de l’annexe G, calculez l’enthalpie de combustion d’une mole d’éthanol.
b. La densité de l’éthanol est de 0,7893 g/mL. Calculer l’enthalpie de combustion d’exactement 1 L d’éthanol.
c. En supposant que le kilométrage d’une automobile est directement proportionnel à la chaleur de combustion du carburant, calculez la distance qu’une automobile pourrait parcourir avec 1 L d’essence par rapport à 1 L d’éthanol. Supposons que l’essence possède la chaleur de combustion et la densité du n-octane, C8H18 (ΔHf°=-208,4kJ/mol ; densité = 0,7025 g/mL).
18. Parmi les substances qui réagissent avec l’oxygène et qui ont été considérées comme des carburants potentiels pour fusée, on trouve le diborane [B2H6, produit B2O3 (s) et H2O (g)], le méthane [CH4, produit CO2 (g) et H2O (g)], et l’hydrazine [N2H4, produit N2 (g) et H2O (g)]. Sur la base de la chaleur dégagée par 1,00 g de chaque substance dans sa réaction avec l’oxygène, lequel de ces composés offre les meilleures possibilités en tant que carburant pour fusée ? Le ΔHf° de B2H6 (g), CH4 (g), et N2H4 (l) se trouve à l’annexe G.
19. L’oxydation du sucre glucose, C6H12O6, est décrite par l’équation suivante :
C6H12O6 (s) + 6 O2 (g) → 6 CO2 (g) + 6 H2O (l) ΔH = – 2816 kJ
Le métabolisme du glucose donne les mêmes produits, bien que le glucose réagisse avec l’oxygène en une série d’étapes dans le corps.
a. Quelle quantité de chaleur en kilojoules peut être produite par le métabolisme de 1,0 g de glucose ?
b. Combien de calories peuvent être produites par le métabolisme de 1,0 g de glucose ?
20. Au cours d’un récent mois d’hiver à Sheboygan, dans le Wisconsin, il a fallu obtenir 3500 kWh de chaleur fournie par un fourneau à gaz naturel d’une efficacité de 89% pour maintenir une petite maison au chaud (l’efficacité d’un fourneau à gaz est le pourcentage de la chaleur produite par la combustion qui est transféré dans la maison).
a. Supposons que le gaz naturel soit du méthane pur et déterminons le volume de gaz naturel en pieds cubes qui était nécessaire pour chauffer la maison. La température moyenne du gaz naturel était de 56 °F ; à cette température et à une pression de 1 atm, le gaz naturel a une densité de 0,681 g/L.
b. Combien de gallons de GPL (gaz de pétrole liquéfié) seraient nécessaires pour remplacer le gaz naturel utilisé ? Supposons que le GPL soit du propane liquide [C3H8 : densité, 0,5318 g/mL ; enthalpie de combustion, 2219 kJ/mol pour la formation de CO2 (g) et H2O (l)] et que le four utilisé pour brûler le GPL ait la même efficacité que le four à gaz.
c. Quelle est la masse de dioxyde de carbone produite par la combustion du méthane utilisé pour chauffer la maison ?
d. Quelle est la masse d’eau produite par la combustion du méthane utilisé pour chauffer la maison ?
e. Quel volume d’air est nécessaire pour fournir l’oxygène nécessaire à la combustion du méthane utilisé pour chauffer la maison ? L’air contient 23% d’oxygène en masse. La densité moyenne de l’air au cours du mois était de 1,22 g/L.
f. Combien de kilowattheures (1 kWh = 3,6 × 106 J) d’électricité seraient nécessaires pour fournir la chaleur nécessaire au chauffage de la maison ? Notez que l’électricité est efficace à 100 % pour produire de la chaleur à l’intérieur d’une maison.
g. Bien que l’électricité soit efficace à 100 % pour produire de la chaleur à l’intérieur d’une maison, la production et la distribution de l’électricité ne le sont pas à 100 %. L’efficacité de la production et de la distribution de l’électricité produite dans une centrale au charbon est d’environ 40 %. Un certain type de charbon fournit 2,26 kWh par livre lors de la combustion. Quelle masse de ce charbon en kilogrammes sera nécessaire pour produire l’énergie électrique nécessaire au chauffage de la maison si l’efficacité de la production et de la distribution est de 40 % ?
Réponses
3. 7.43 g
4. Non.
5. 90,8 kJ
6. 459,6 kJ
7. -495 kJ/mol
8. La combustion du diamant produit plus de chaleur
9. 44,01 kJ/mol
10. -394 kJ
11. – 207 kJ
12. 90,3 mol-1 de NO
13. (a) 90,4 kJ/mol, (b) 105 kJ/mol, (c) -538,37 kJ/mol, (d) 94,49 kJ/mol
14. (a) 62,2 kJ/mol, (b) 3,2 kJ/mol, (c) 271 kJ/mol, (d) -847,6 kJ/mol
15. – 2044 kJ
16. Propane
17. (a) C2H5OH + 3 O2 (g) → 2 CO2 (g) + 3 H2O (g), -1234,8 kJ/mol, (b) -21187,56 kJ, (c) 44% plus loin
18. En partant du principe que le meilleur carburant pour fusée est celui qui dégage le plus de chaleur, le B2H6 est le candidat idéal.
19. (a) 15,63 kJ/g, (b) 3,74 cal/g
20. (a) 13260 pieds cubes, (b) 141,2 gallons, (c) 701,52 kg, (d) 574,32 kg, (e) 3635637,26 L, (f) 3500 kWh, (g) 1756,34 kg
Chaleur dégagée lorsqu'une mole d'un composé subit une combustion complète dans des conditions normales
Composé composé uniquement d'hydrogène et de carbone ; principal composant des combustibles fossiles
Si un processus peut être représenté comme la somme de plusieurs étapes, le changement d'enthalpie du processus est égal à la somme des changements d'enthalpie des étapes

