8.6 – Propriétés atomiques générales
Dans de nombreux cas, les éléments qui appartiennent au même groupe (colonne verticale) du tableau périodique forment des ions ayant la même charge parce qu’ils ont le même nombre d’électrons de valence. Ainsi, le tableau périodique devient un outil permettant de se souvenir des charges de nombreux ions. Par exemple, tous les ions fabriqués à partir de métaux alcalins, la première colonne du tableau périodique, ont une charge de 1+. Les ions fabriqués à partir de métaux alcalino-terreux, le deuxième groupe du tableau périodique, ont une charge 2+. De l’autre côté du tableau périodique, dans l’avant-dernière colonne, les halogènes forment des ions ayant une charge 1. La Figure 8.6.1. montre comment la charge de nombreux ions peut être prédite par l’emplacement d’un élément dans le tableau périodique. Notez la convention qui consiste à écrire d’abord le nombre puis le signe d’un ion à charge multiple. Le cation barium s’écrit Ba2+, et non Ba+2.
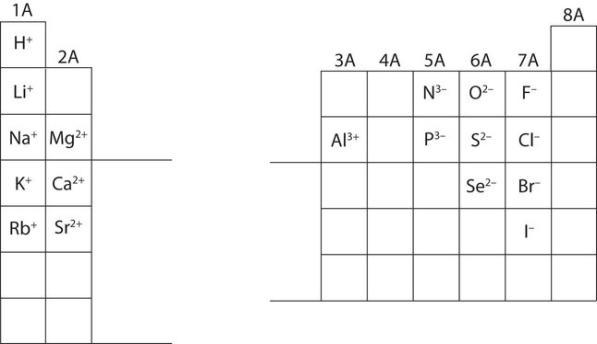
Figure 8.6.1. Prévision des charges ioniques. La charge qu’un atome acquiert lorsqu’il devient un ion est liée à la structure du tableau périodique. Dans un groupe (famille) d’éléments, les atomes forment des ions d’une certaine charge.
Propriétés magnétiques
Le moment magnétique d’un système mesure la force et la direction de son magnétisme. Le terme lui-même fait généralement référence au moment du dipôle magnétique. Tout ce qui est magnétique, comme un barreau aimanté ou une boucle de courant électrique, possède un moment magnétique. Un moment magnétique est une quantité vectorielle, avec une magnitude et une direction. Un électron possède un moment dipolaire magnétique électronique, généré par la propriété de spin intrinsèque de l’électron, qui en fait une charge électrique en mouvement. Il existe de nombreuses formes magnétiques différentes : le paramagnétisme, le diamagnétisme, le ferromagnétisme et l’antiferromagnétisme. Seuls le paramagnétisme et le diamagnétisme sont abordés ici.
Paramagnétisme
Le paramagnétisme désigne l’état magnétique d’un atome comportant un ou plusieurs électrons non appariés. Les électrons non appariés sont attirés par un champ magnétique dû aux moments de dipôle magnétique des électrons. La règle de Hund stipule que les électrons doivent occuper chaque orbitale individuellement avant qu’une orbitale ne soit doublement occupée. Cela peut laisser l’atome avec de nombreux électrons non appariés. Comme les électrons non appariés peuvent s’orienter dans les deux sens, ils présentent des moments magnétiques qui peuvent s’aligner avec un aimant. Cette capacité permet aux atomes paramagnétiques d’être attirés par les champs magnétiques. L’oxygène diatomique, O2, est un bon exemple de paramagnétisme (que l’on comprend mieux avec la théorie des orbitales moléculaires). La vidéo suivante montre de l’oxygène liquide attiré dans un champ magnétique créé par un aimant puissant.
Comme le montre la vidéo, l’oxygène moléculaire, O2, étant paramagnétique, il est attiré par l’aimant. En revanche, l’azote moléculaire, N2, n’a pas d’électrons non appariés et est diamagnétique (voir ci-dessous) ; il n’est donc pas affecté par l’aimant.
Remarque: Le paramagnétisme est une forme de magnétisme par laquelle les matériaux sont attirés par un champ magnétique appliqué de l’extérieur.
Il existe quelques exceptions à la règle du paramagnétisme; celles-ci concernent certains métaux de transition, dans lesquels l’électron non apparié ne se trouve pas dans une orbitale d. Parmi ces métaux, on peut citer Sc3+, Ti4+, Zn2+ et Cu+. Ces métaux ne sont pas définis comme paramagnétiques: ils sont considérés comme diamagnétiques car tous les électrons d sont appariés. Les composés paramagnétiques présentent parfois des propriétés magnétiques globales dues à l’agglomération des atomes métalliques. Ce phénomène est connu sous le nom de ferromagnétisme, mais cette propriété n’est pas abordée ici.
Diamagnétisme
Les substances diamagnétiques sont caractérisées par des électrons appariés – sauf dans le cas précédemment discuté des métaux de transition, il n’y a pas d’électrons non appariés. Selon le principe d’exclusion de Pauli, qui stipule que deux électrons identiques ne peuvent prendre le même état quantique au même moment, les spins des électrons sont orientés dans des directions opposées. Les champs magnétiques des électrons s’annulent donc ; il n’y a pas de moment magnétique net, et l’atome ne peut pas être attiré dans un champ magnétique. En fait, les substances diamagnétiques sont faiblement repoussées par un champ magnétique, comme le démontre la feuille de carbone pyrolytique de la Figure 8.6.2.

Figure 8.6.2. Carbone pyrolytique en lévitation : Un petit morceau (~6 mm) de graphite pyrolytique en lévitation au-dessus d’un réseau d’aimants permanents au néodyme (cubes de 5 mm sur une pièce d’acier). Notez que les pôles des aimants sont alignés verticalement et alternent (deux avec le nord vers le haut, et deux avec le sud vers le haut, en diagonale). Image utilisée avec la permission de Wikipedia.
Remarque : les matériaux diamagnétiques sont repoussés par le champ magnétique appliqué.
Le diamagnétisme, à un degré plus ou moins élevé, est une propriété de tous les matériaux et contribue toujours faiblement à la réponse du matériau à un champ magnétique. Pour les matériaux qui présentent une autre forme de magnétisme (comme le paramagnétisme), la contribution diamagnétique devient négligeable.
Comment savoir si une substance est diamagnétique ou paramagnétique ?
La forme magnétique d’une substance peut être déterminée en examinant sa configuration électronique : si elle présente des électrons non appariés, la substance est paramagnétique ; si tous les électrons sont appariés, la substance est diamagnétique. Ce processus peut être décomposé en quatre étapes :
Trouvez la configuration des électrons
Dessinez les orbitales de valence
Rechercher des électrons non appariés
Déterminer si la substance est paramagnétique (un ou plusieurs électrons non appariés) ou diamagnétique (tous les électrons sont appariés).
Exemple 8.6.1 – Atomes de chlore
Les atomes de chlore sont-ils paramagnétiques ou diamagnétiques ?
Solution
Étape 1 : trouver la configuration des électrons
Pour les atomes de Cl, la configuration électronique est 3s23p5
Étape 2 : Dessiner les orbitales de valence
Ignorez les électrons de noyau et concentrez-vous uniquement sur les électrons de valence.
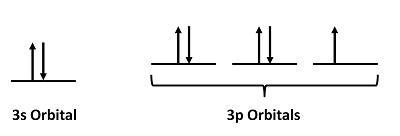
Étape 3 : Recherche d’électrons non appariés
Il y a un électron non apparié.
Étape 4 : Déterminer si la substance est paramagnétique ou diamagnétique.
Comme il y a un électron non apparié, les atomes de Cl sont paramagnétiques (mais faiblement puisqu’un seul électron est non apparié).
Vérifiez votre apprentissage 8.6.1- Atomes de chlore
Indiquez si les atomes de bore sont paramagnétiques ou diamagnétiques.
Réponse
L’atome B a pour configuration électronique 2s22p1. Comme il possède un électron non apparié, il est paramagnétique.
Exemple 8.6.2 – Atomes de zinc
Les atomes de zinc sont-ils paramagnétiques ou diamagnétiques ?
Solution
Étape 1 : trouver la configuration des électrons
Pour les atomes de Zn, la configuration électronique est 4s23d10
Étape 2 : Dessiner les orbitales de valence
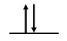
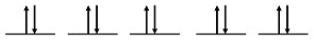
4s Orbital 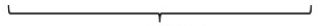
Orbitales 3d
Étape 3 : Recherche d’électrons non appariés
Il n’y a pas d’électrons non appariés.
Étape 4 : Déterminer si la substance est paramagnétique ou diamagnétique.
Comme il n’y a pas d’électrons non appariés, les atomes de Zn sont diamagnétiques.
Vérifiez votre apprentissage 8.6.2 – Atomes de zinc
Indiquez si les ions F– sont paramagnétiques ou diamagnétiques.
Réponse
L’ion F– a pour configuration électronique 2s22p6. Comme il n’a pas d’électrons non appariés, il est diamagnétique.
★ Questions
1. Une molécule ayant un nombre impair d’électrons peut-elle jamais être diamagnétique ? Expliquez pourquoi ou pourquoi pas.
2. Parmi les molécules diatomiques homonucléaires de la période 2, lesquelles sont censées être paramagnétiques ?
3. Combien d’électrons non appariés trouve-t-on dans les atomes d’oxygène ?
4. Combien d’électrons non appariés trouve-t-on dans les atomes de brome ?
5. Indiquez si les ions Fe2+ sont paramagnétiques ou diamagnétiques.
Réponses
1. Un nombre impair d’électrons ne peut jamais être apparié, quelle que soit la disposition des orbitales moléculaires. Il sera toujours paramagnétique.
2. Oxygène
3. La configuration électronique de l’atome de O est 2s22p4. Par conséquent, O possède 2 électrons non appariés.
4. L’atome Br a une configuration électronique de 4s23d104p5. Par conséquent, Br possède 1 électron non apparié.
5. La configuration électronique de l’ion Fe2+ est 3d6. Comme il possède 4 électrons non appariés, il est paramagnétique.
Mesure de la force et de la direction magnétiques d'un système ; une grandeur vectorielle
Mesure de la force et de la direction magnétiques d'un système ; une grandeur vectorielle
État magnétique des substances caractérisé par un ou plusieurs électrons non appariés ; les substances paramagnétiques sont attirées par un champ magnétique appliqué de l'extérieur
État magnétique des substances caractérisé par des paires d'électrons ; les substances diamagnétiques sont (faiblement) repoussées par un champ magnétique appliqué

