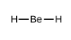9.5 – VESPR
Angles et distances de liaison
Jusqu’à présent, nous avons utilisé des structures de Lewis bidimensionnelles pour représenter les molécules. Cependant, la structure moléculaire est en fait tridimensionnelle et il est important de pouvoir décrire les liaisons moléculaires en termes de distances, d’angles et de dispositions relatives dans l’espace (figure 9.5.1). L’angle de liaison est l’angle entre deux liaisons qui comprennent un atome commun, généralement mesuré en degrés. La longueur d'une liaison (ou distance de liaison) est la distance entre les noyaux de deux atomes liés, le long de la ligne droite reliant les noyaux. Les longueurs de liaison sont mesurées en Ångstroms (1 Å = 10-10 m) ou en picomètres (1 pm = 10-12 m, 100 pm = 1 Å).
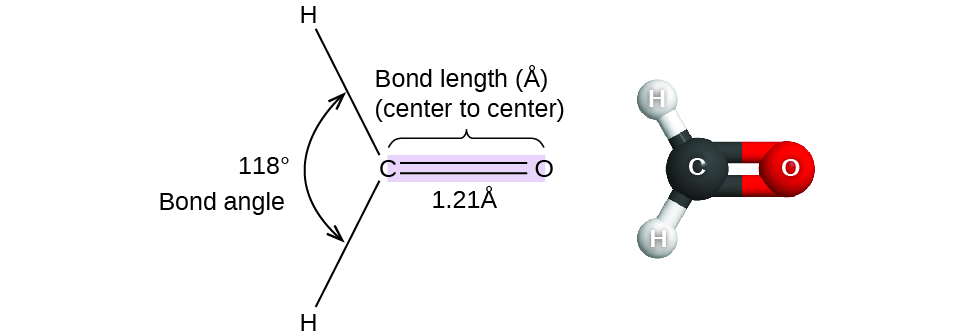
Figure 9.5.1. Les longueurs (distances) et les angles des liaisons sont indiqués pour la molécule de formaldéhyde, H2CO.
Théorie VSEPR
La théorie de la répulsion des paires d'électrons de la couche de valence (théorie VSEPR) nous permet de prédire la structure moléculaire, y compris les angles de liaison approximatifs autour d’un atome central, d’une molécule à partir d’un examen du nombre de liaisons et de paires d’électrons célibataires dans sa structure de Lewis. Le modèle VSEPR suppose que les paires d’électrons dans la couche de valence d’un atome central adopteront un arrangement qui minimise les répulsions entre ces paires d’électrons en maximisant la distance qui les sépare. Les électrons de la couche de valence d’un atome central forment soit des paires d’électrons de liaison, situées principalement entre des atomes liés, soit des paires célibataires. La répulsion électrostatique de ces électrons est réduite lorsque les différentes régions de haute densité électronique prennent des positions aussi éloignées que possible les unes des autres.
La théorie VSEPR prédit la disposition des paires d’électrons autour de chaque atome central et, généralement, la disposition correcte des atomes dans une molécule. Il faut toutefois comprendre que la théorie ne prend en compte que les répulsions des paires d’électrons. D’autres interactions, telles que les répulsions nucléaires-nucléaires et les attractions nucléaires-électroniques, sont également impliquées dans l’arrangement final que les atomes adoptent dans une structure moléculaire particulière.
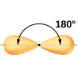
Dans un exemple simple de la théorie VSEPR, prédisons la structure d’une molécule de BeF2 gazeux. La structure de Lewis du BeF2 (Figure 9.5.2) ne montre que deux paires d’électrons autour de l’atome central de béryllium. Avec deux liaisons et aucune paire d’électrons célibataires sur l’atome central, les liaisons sont aussi éloignées que possible les unes des autres, et la répulsion électrostatique entre ces régions de haute densité électronique est réduite au minimum lorsqu’elles se trouvent sur les côtés opposés de l’atome central. L’angle de liaison est de 180° (Figure 9.5.2).
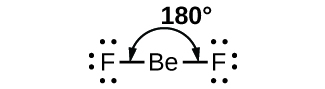
Figure 9.5.2. La molécule de BeF2 adopte une structure linéaire dans laquelle les deux liaisons sont aussi éloignées que possible, sur les côtés opposés de l’atome de Be.
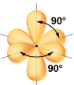
La Figure 9.5.3 illustre cette géométrie et d’autres géométries de paires d’électrons qui minimisent les répulsions entre les régions de haute densité électronique (liaisons et/ou paires célibataires). Deux régions de densité électronique autour d’un atome central dans une molécule forment une géométrie linéaire; trois régions forment une géométrie plane trigonale; quatre régions forment une géométrie tétraédrique; cinq régions forment une géométrie bipyramidale trigonale; et six régions forment une géométrie octaédrique.
|
Nombre de régions |
Deux régions de haute densité électronique (liaisons et/ou paires non partagées) |
Trois régions de haute densité électronique (liaisons et/ou paires non partagées) |
Quatre régions de haute densité électronique (liaisons et/ou paires non partagées) |
Cinq régions de haute densité électronique (liaisons et/ou paires non partagées) |
Six régions de haute densité électronique (liaisons et/ou paires non partagées) |
|
Arrangement spatiale |
|
|
|
|
|
|
Notation ligne–tiret-coin |
|
|
|
|
|
|
Géométrie des paires d’électrons |
Linéaire; Angle de 180° |
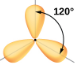
Planaire trigonale; tous les angles 120° |
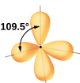
Tétraédrique; tous les angles 109.5° |
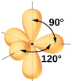
Bipyramidal trigonal; angles de 90° ou 120°. Un atome attaché peut être équatorial (dans le plan du triangle) ou axial (au-dessus ou au-dessous du plan du triangle). |
Octaédrique; tous les angles sont de 90° ou 180°. |
Figure 9.5.3. Les géométries de base des paires d’électrons prédites par la théorie VSEPR maximisent l’espace autour de toute région de densité électronique (liaisons ou paires célibatiares).
Géométrie des paires d’électrons et structure moléculaire
Il est important de noter que la géométrie des paires d’électrons autour d’un atome central n’est pas la même chose que sa structure moléculaire. Les géométries des paires d’électrons présentées à la Figure 9.5.3 décrivent toutes les régions où se trouvent les électrons, les liaisons comme les paires célibataires. La structure moléculaire décrit l’emplacement des atomes, pas celui des électrons.
Nous faisons la différence entre ces deux situations en appelant la géométrie qui inclut toutes les paires d’électrons la géométrie des paires d'électrons. La structure qui inclut uniquement le placement des atomes dans la molécule est appelée structure moléculaire. Les géométries des paires d’électrons seront les mêmes que les structures moléculaires lorsqu’il n’y a pas de paires d’électrons célibataires autour de l’atome central, mais elles seront différentes lorsque des paires célibataires sont présentes sur l’atome central.
Par exemple, la molécule de méthane, CH4, qui est le principal composant du gaz naturel, possède quatre paires d’électrons de liaison autour de l’atome de carbone central; la géométrie des paires d’électrons est tétraédrique, tout comme la structure moléculaire (Figure 9.5.4). D’autre part, la molécule d’ammoniac, NH3, possède également quatre paires d’électrons associées à l’atome d’azote, et présente donc une géométrie de paires d’électrons tétraédrique. Cependant, l’une de ces régions est un doublet célibataire, qui n’est pas inclus dans la structure moléculaire, et ce doublet célibataire influence la forme de la molécule (Figure 9.5.5).
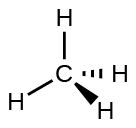
Figure 9.5.4. La structure moléculaire de la molécule de méthane, CH4, est représentée avec une disposition tétraédrique des atomes d’hydrogène. Les structures VSEPR comme celle-ci sont souvent dessinées à l’aide de la notation en coin et en tiret, dans laquelle les lignes pleines représentent les liaisons dans le plan de la page, les coins pleins représentent les liaisons qui sortent du plan et les lignes en tiret représentent les liaisons qui descendent dans le plan.
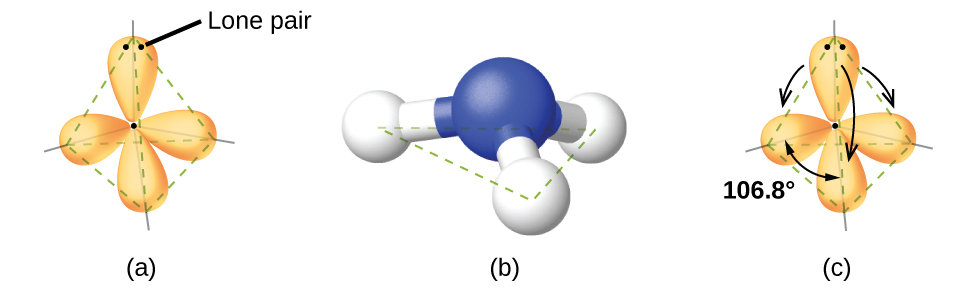
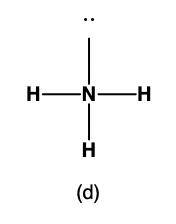
Figure 9.5.5. (a) La géométrie des paires d’électrons de la molécule d’ammoniac est tétraédrique avec une paire célibataire et trois liaisons simples. (b) La structure moléculaire pyramidale trigonale est déterminée à partir de la géométrie du couple d’électrons. (c) Les angles de liaison actuels s’écartent légèrement des angles idéalisés parce que la paire célibataire occupe une plus grande région de l’espace que les liaisons simples, ce qui fait que l’angle HNH est légèrement inférieur à 109,5°. (d) Structure de Lewis de NH3.
Comme le montre la Figure 9.5.5, de petites distorsions par rapport aux angles idéaux de la Figure 9.5.3 peuvent résulter de différences de répulsion entre diverses régions de la densité électronique. La théorie VSEPR prédit ces distorsions en établissant un ordre des répulsions et un ordre de la quantité d’espace occupé par les différents types de paires d’électrons. L’ordre des répulsions des paires d’électrons, de la plus grande à la plus faible, est le suivant:
paire célibataire – paire célibataire > paire célibataire – paire liante > paire liante – paire liante
Cet ordre de répulsion détermine la quantité d’espace occupée par les différentes régions d’électrons. Une paire d’électrons célibataires occupe une plus grande région d’espace que les électrons d’une triple liaison; à leur tour, les électrons d’une triple liaison occupent plus d’espace que ceux d’une double liaison, et ainsi de suite. L’ordre des tailles, de la plus grande à la plus petite, est le suivant:
paire célibataire > triple liaison > double liaison > liaison simple
Prenons l’exemple du formaldéhyde, H2CO, qui est utilisé comme conservateur pour les spécimens biologiques et anatomiques (Figure 9.5.1). Cette molécule possède des régions à forte densité électronique constituées de deux liaisons simples et d’une liaison double. La géométrie de base est un plan trigonal avec des angles de liaison de 120°, mais nous constatons que la double liaison provoque des angles légèrement plus grands (121°), et que l’angle entre les liaisons simples est légèrement plus petit (118°).
Dans la molécule d’ammoniac, les trois atomes d’hydrogène attachés à l’azote central ne sont pas disposés dans une structure moléculaire plane et trigonale, mais plutôt dans une pyramide trigonale tridimensionnelle (Figure 9.5.5) avec l’atome d’azote au sommet et les trois atomes d’hydrogène formant la base. Les angles de liaison idéaux dans une pyramide trigonale sont basés sur la géométrie des paires d’électrons tétraédriques. Là encore, il existe de légères déviations par rapport à l’idéal, car les paires solitaires occupent de plus grandes régions de l’espace que les électrons de liaison. Les angles de liaison H-N-H dans NH3 sont légèrement inférieurs à l’angle de 109,5° dans un tétraèdre régulier (Figure 9.5.3) parce que la répulsion entre paire célibataire et paire liante est plus grande que la répulsion entre paire liante et paire liante (Figure 9.5.5). La Figure 9.5.6 illustre les structures moléculaires idéales, qui sont prédites sur la base des géométries des paires d’électrons pour diverses combinaisons de paires célibataires et de paires liantes.
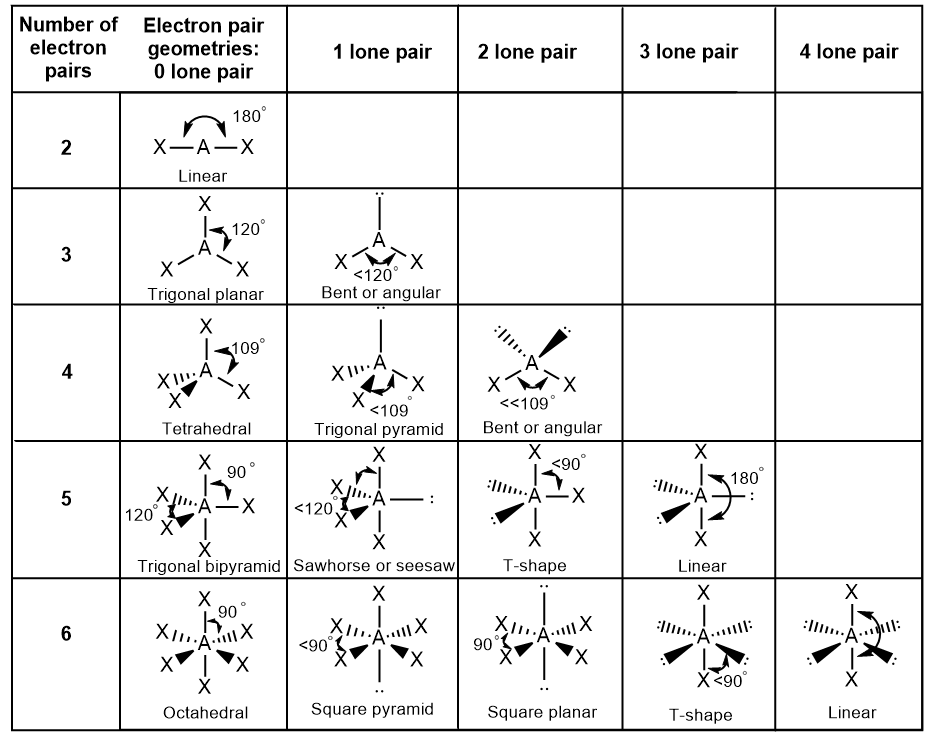
Figure 9.5.6. Les structures moléculaires sont identiques aux géométries des paires d’électrons lorsqu’il n’y a pas de paires célibataires (première colonne). Pour un nombre particulier de paires d’électrons (rangée), les structures moléculaires pour une ou plusieurs paires célibataires sont déterminées en fonction des modifications de la géométrie de la paire d’électrons correspondante.
Selon la théorie VSEPR, les emplacements des atomes terminaux (Xs dans la Figure 9.5.6) sont équivalents dans les géométries linéaire, planaire trigonal et tétraédrique des paires d’électrons (les trois premières lignes du tableau). Il importe peu de savoir quel X est remplacé par un doublet célibataire car les molécules peuvent être tournées pour convertir les positions. En revanche, pour les géométries à paire d’électrons bipyramidales trigonales, il existe deux positions X distinctes, comme le montre la Figure 9.5.8: une position axiale (si nous tenons un modèle de bipyramide trigonale par les deux positions axiales, nous avons un axe autour duquel nous pouvons faire tourner le modèle) et une position équatoriale (trois positions forment un équateur autour du milieu de la molécule). Comme le montre la Figure 9.5.6, la position axiale est entourée d’angles de liaison de 90°, tandis que la position équatoriale dispose de plus d’espace en raison des angles de liaison de 120°.
Paire célibataires axiale Paire célibataires Paire célibataires équatorialeaxiale et équatoriale
(a) (b) (c)
Interactions
90° LP-LP001
90° LP-BP643
Figure 9.5.7 Démonstration des interactions entre paires célibataires axiales et équatoriales.
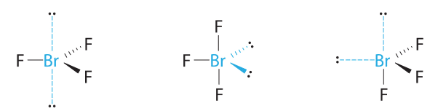
Dans une géométrie de paire d’électrons bipyramidale trigonale, les paires célibataires occupent toujours des positions équatoriales, car ces positions plus spacieuses peuvent plus facilement accueillir les paires célibataires plus grandes.
Théoriquement, nous pouvons imaginer trois arrangements possibles pour les trois liaisons et les deux paires célibataires de la molécule de ClF3 (Figure 9.5.8). La structure stable est celle qui place les paires célibataires en position équatoriale, ce qui donne une structure moléculaire en forme de T.
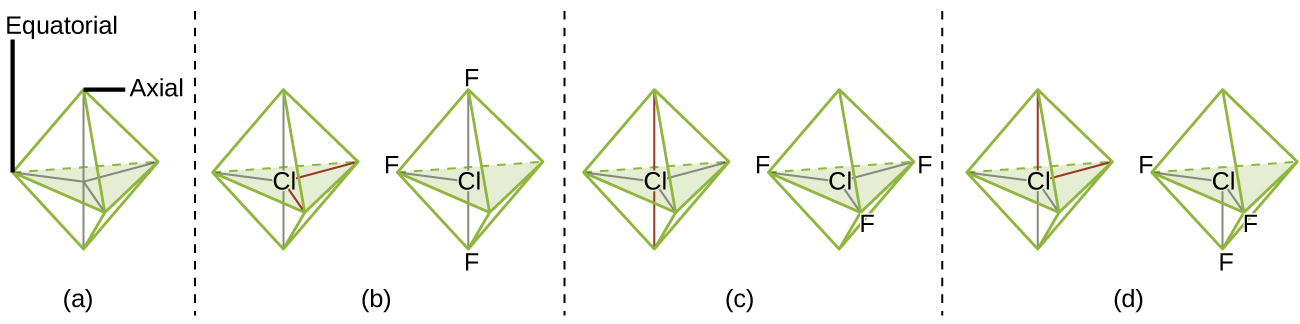
Figure 9.5.8. (a) Dans une bipyramide trigonale, les deux positions axiales sont situées directement en face l’une de l’autre, tandis que les trois positions équatoriales sont situées dans une disposition triangulaire. (b-d). Les deux paires célibataires (lignes rouges) dans ClF3 ont plusieurs dispositions possibles, mais la structure moléculaire en forme de T (b) est celle réellement observée, ce qui correspond au fait que les plus grandes paires célibataires occupent toutes deux des positions équatoriales.
Lorsqu’un atome central possède deux paires d’électrons célibataires et quatre régions de liaison, nous avons une géométrie de paires d’électrons octaédrique. Les deux paires célibataires se trouvent sur les côtés opposés de l’octaèdre (distants de 180°), ce qui donne une structure moléculaire plane carrée qui minimise les répulsions paires célibataire – paire célibataire (Figure 9.5.6).
Prévision de la géométrie des paires d’électrons et de la structure moléculaire
La procédure suivante utilise la théorie VSEPR pour déterminer les géométries des paires d’électrons et les structures moléculaires:
Dessinez la structure de Lewis de la molécule ou de l’ion polyatomique.
Comptez le nombre de régions de densité électronique (paires célibataires et liaisons) autour de l’atome central. Une liaison simple, double ou triple compte pour une région de densité électronique.
Identifiez la géométrie de la paire d’électrons en fonction du nombre de régions de densité électronique: linéaire, planaire trigonale, tétraédrique, bipyramidale trigonale ou octaédrique (Figure 9.5.6, première colonne).
Utilisez le nombre de paires célibataires pour déterminer la structure moléculaire (Figure 9.5.6). Si plusieurs dispositions de paires célibataires et de liaisons chimiques sont possibles, choisissez celle qui minimisera les répulsions, en vous rappelant que les paires célibataires occupent plus d’espace que les liaisons multiples, qui occupent plus d’espace que les liaisons simples. Dans un arrangement bipyramidal trigonal, la répulsion est minimisée lorsque chaque paire célibataire est en position équatoriale. Dans un arrangement octaédrique avec deux paires célibataires, la répulsion est minimisée lorsque les paires célibataires se trouvent sur les côtés opposés de l’atome central.
Les exemples suivants illustrent l’utilisation de la théorie VSEPR pour prédire la structure moléculaire de molécules ou d’ions qui ne possèdent pas de paires d’électrons célibataires. Dans ce cas, la structure moléculaire est identique à la géométrie des paires d’électrons.
Exemple 9.5.1 – Prévision de la géométrie des paires d’électrons et de la structure moléculaire: CO2 et BCl3
Prédisez la géométrie des paires d’électrons et la structure moléculaire pour chacun des éléments suivants:
(a) le dioxyde de carbone, CO2, une molécule produite par la combustion de combustibles fossiles
(b) le trichlorure de bore, BCl3, un produit chimique industriel important
Solution
(a) Nous dessinons la structure de Lewis du CO2 comme suit:
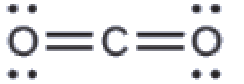
Cela nous montre deux régions de haute densité électronique autour de l’atome de carbone – chaque double liaison compte pour une région, et il n’y a pas de paires célibataires sur l’atome de carbone. En utilisant la théorie VSEPR, nous prédisons que les deux régions de densité électronique se placent sur les côtés opposés de l’atome central avec un angle de liaison de 180°. La géométrie des paires d’électrons et la structure moléculaire sont identiques, et les molécules de CO2 sont linéaires.
(b) Nous dessinons la structure de Lewis de BCl3 comme:
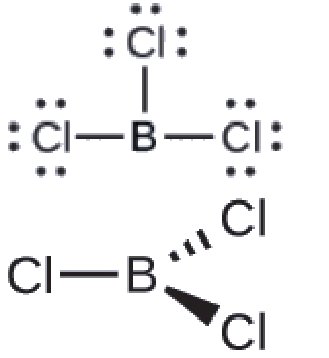
Nous voyons donc que BCl3 contient trois liaisons et qu’il n’y a pas de paires d’électrons célibataires sur le bore. La disposition de trois régions de haute densité électronique donne une géométrie de paire d’électrons planaire trigonale. Les liaisons B-Cl se trouvent dans un plan avec des angles de 120° entre elles. Le BCl3 présente également une structure moléculaire plane trigonale.
La géométrie des paires d’électrons et la structure moléculaire du BCl3 sont toutes deux trigones planes. Notez que la géométrie VSEPR indique les angles de liaison corrects (120°), contrairement à la structure de Lewis présentée ci-dessus.
Vérifiez votre apprentissage 9.5.1 – Prévision de la géométrie des paires d’électrons et de la structure moléculaire: CO2 et BCl3
Le carbonate, CO32-, est un ion polyatomique commun que l’on trouve dans divers matériaux, de la coquille d’œuf aux antiacides. Quelle est la géométrie des paires d’électrons et la structure moléculaire de cet ion polyatomique?
Réponse
La géométrie de la paire d’électrons est trigonale planaire et la structure moléculaire est trigonale planaire. En raison de la résonance, les trois liaisons C-O sont identiques. Qu’elles soient simples, doubles ou une moyenne des deux, chaque liaison compte pour une région de densité électronique.
Exemple 9.5.2 – Prévision de la géométrie des paires d’électrons et de la structure moléculaire: Ammonium
Deux des 50 principaux produits chimiques fabriqués aux États-Unis, le nitrate d’ammonium et le sulfate d’ammonium, tous deux utilisés comme engrais, contiennent l’ion ammonium. Prédisez la géométrie des paires d’électrons et la structure moléculaire du cation NH4+.
Solution
Nous dessinons la structure de Lewis de NH4+ comme:
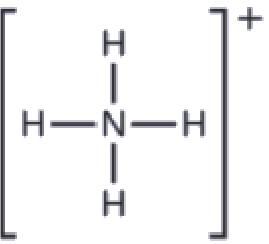
Nous pouvons voir que NH4+ contient quatre liaisons entre l’atome d’azote et les atomes d’hydrogène et aucune paire célibataire. Nous nous attendons à ce que les quatre régions à forte densité électronique soient disposées de façon à pointer vers les coins d’un tétraèdre avec l’atome d’azote central au milieu (Figure 9.5.6). Par conséquent, la géométrie des paires d’électrons de NH4+ est tétraédrique, et la structure moléculaire est également tétraédrique: (Figure 9.5.9).
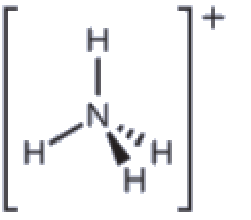
Figure 9.5.9. L’ion ammonium présente une géométrie tétraédrique des paires d’électrons ainsi qu’une structure moléculaire tétraédrique.
Vérifiez votre apprentissage 9.5.2 – Prévision de la géométrie des paires d’électrons et de la structure moléculaire: CO2 et BCl3
Identifiez une molécule ayant une structure moléculaire bipyramidale trigonale.
Réponse
Toute molécule comportant cinq paires d’électrons autour des atomes centraux, sans paires célibataires, sera trigonal bipyramidal. Le PF5 est un exemple courant.
Les quelques exemples suivants illustrent l’effet des paires d’électrons célibataires sur la structure moléculaire.
Exemple 9.5.3 – Prévision de la géométrie des paires d’électrons et de la structure moléculaire: Paires célibataires sur l’atome central
Prédire la géométrie des paires d’électrons et la structure moléculaire d’une molécule d’eau.
Solution
La structure de Lewis de H2O indique qu’il existe quatre régions de haute densité électronique autour de l’atome d’oxygène: deux paires célibataires et deux liaisons chimiques:
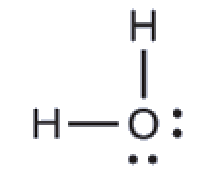
Nous prévoyons que ces quatre régions sont disposées de façon tétraédrique (Figure 9.5.10), comme l’indique la Figure 9.5.6. Ainsi, la géométrie des paires d’électrons est tétraédrique et la structure moléculaire est coudée avec un angle légèrement inférieur à 109,5°. En fait, l’angle de liaison est de 104,5°.

Figure 9.5.10. (a) H2O possède quatre régions de densité électronique autour de l’atome central (deux atomes et deux paires d’électrons), il présente donc une géométrie tétraédrique à paires d’électrons. Deux des régions électroniques sont des paires célibataires, la structure moléculaire est donc coudée.
Vérifiez votre apprentissage 9.5.3 – Prévision de la géométrie des paires d’électrons et de la structure moléculaire: Paires célibataires sur l’atome central
L’ion hydronium, H3O+, se forme lorsque des acides sont dissous dans l’eau. Prédisez la géométrie des paires d’électrons et la structure moléculaire de ce cation.
Réponse
géométrie de la paire d’électrons: tétraédrique; structure moléculaire: pyramide trigonale
Exemple 9.5.4 – Prédire la géométrie des paires d’électrons et la structure moléculaire: SF4
Le tétrafluorure de soufre, SF4, est extrêmement précieux pour la préparation de composés contenant du fluor utilisé comme herbicides (c’est-à-dire que le SF4 est utilisé comme agent de fluoration). Prédisez la géométrie des paires d’électrons et la structure moléculaire d’une molécule de SF4.
Solution
La structure de Lewis du SF4 indique cinq régions de densité électronique autour de l’atome de soufre: une paire célibataire et quatre paires liantes:
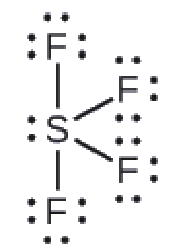
Nous nous attendons à ce que ces cinq régions adoptent une géométrie électron-paire bipyramidale trigonale. Pour minimiser les répulsions des paires célibataires, ces dernières occupent l’une des positions équatoriales. La structure moléculaire (Figure 9.5.11) est celle d’une bascule (Figure 9.5.6).
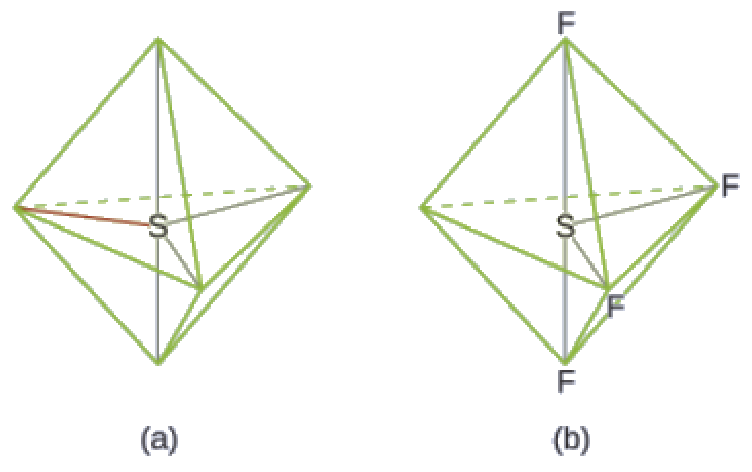
Figure 9.5.11. (a) Le SF4 présente un arrangement bipyramidal trigonal des cinq régions de densité électronique. (b) L’une des régions est une paire célibataire, ce qui donne une structure moléculaire en forme de bascule.
Vérifiez votre apprentissage 9.5.4 – Prédire la géométrie des paires d’électrons et la structure moléculaire: SF4
Prédire la géométrie des paires d’électrons et la structure moléculaire des molécules de XeF2.
Réponse
La géométrie des paires d’électrons est trigonal bipyramidal. La structure moléculaire est linéaire.
Exemple 9.5.5 – Prédiction de la géométrie des paires d’électrons et de la structure moléculaire : XeF4
De tous les gaz nobles, le xénon est le plus réactif, réagissant fréquemment avec des éléments tels que l’oxygène et le fluor. Prédisez la géométrie des paires d’électrons et la structure moléculaire de la molécule XeF4.
Solution
La structure de Lewis du XeF4 indique six régions de haute densité électronique autour de l’atome de xénon: deux paires célibataires et quatre liaisons:
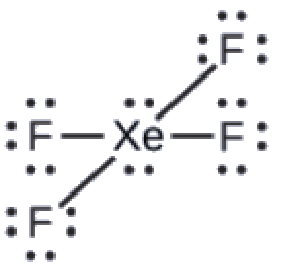
Ces six régions adoptent un arrangement octaédrique (Figure 9.5.6), qui est la géométrie des paires d’électrons. Pour minimiser les répulsions, les paires célibataires doivent se trouver sur les côtés opposés de l’atome central (Figure 9.5.12). Les cinq atomes sont tous dans le même plan et ont une structure moléculaire plane carrée.
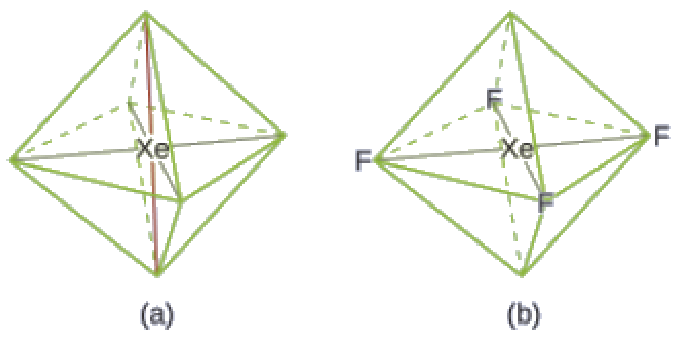
Figure 9.5.12. (a) XeF4 adopte un arrangement octaédrique avec deux paires célibataires (lignes rouges) et quatre liaisons dans la géométrie des paires d’électrons. (b) La structure moléculaire est plane et carrée avec les paires célibataires directement en face les unes des autres.
Vérifiez votre apprentissage 9.5.5 – Prédiction de la géométrie des paires d’électrons et de la structure moléculaire : XeF4
Dans une certaine molécule, l’atome central possède trois paires célibataires et deux liaisons. Quelle sera la géométrie des paires d’électrons et la structure moléculaire?
Réponse
géométrie des paires d’électrons: bipyramidal trigonal; structure moléculaire: linéaire
Exemple 9.5.6 – Prédire la structure moléculaire – Résumé VSEPR
En utilisant le modèle VSEPR, prédisez la géométrie moléculaire de chaque molécule ou ion.
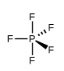
(a) PF5 (pentafluorure de phosphore, un catalyseur utilisé dans certaines réactions organiques)
(b) H3O+ (ion hydronium)
Solution
(a) L’atome central, P, a cinq électrons de valence et chaque fluor a sept électrons de valence, de sorte que la structure de Lewis de PF5 est la suivante
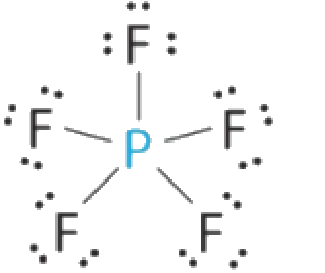
Il y a cinq groupes de liaison sur le phosphore. La structure qui minimise les répulsions est une bipyramide trigonale.
Tous les groupes d’électrons sont des paires liantes, donc PF5 est désigné comme AX5. Remarquez que cela donne un total de cinq paires d’électrons. En l’absence de répulsion des paires célibataires, nous ne nous attendons pas à ce que les angles de liaison s’écartent de l’idéal.
La molécule de PF5 possède cinq noyaux et aucune paire d’électrons célibataires, de sorte que sa géométrie moléculaire est bipyramidale trigonale.

(b) L’atome central, O, a six électrons de valence, et chaque atome H contribue un électron de valence. En soustrayant un électron pour la charge positive, on obtient un total de huit électrons de valence, de sorte que la structure électronique de Lewis est la suivante
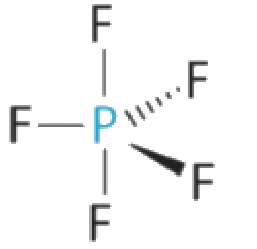
Il y a quatre groupes d’électrons autour de l’oxygène, trois paires liantes et une paire célibataire. Comme pour NH3, les répulsions sont minimisées en dirigeant chaque atome d’hydrogène et la paire célibataire vers les coins d’un tétraèdre.
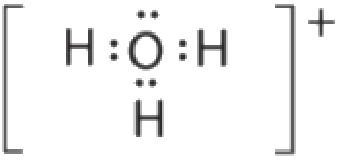
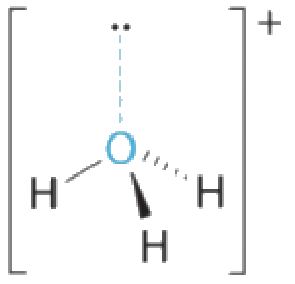
Avec trois paires liantes et une paire célibataire, nous nous attendons à ce que les interactions entre les paires d’électrons célibataires (non–liants) et liantes fassent que les angles des paires liantes s’écartent considérablement des angles d’un tétraèdre parfait.
Il y a trois noyaux et une paire célibataire, la géométrie moléculaire est donc une pyramide trigonale, en fait un tétraèdre auquel il manque un sommet. Cependant, les angles liantes H-O-H sont inférieurs à l’angle idéal de 109,5° en raison des répulsions entre les paires d’électrons célibataires (non–liants) et liantes:
Vérifiez votre apprentissage 9.5.6 – Prédire la structure moléculaire – Résumé VSEPR
En utilisant le modèle VSEPR, prédisez la géométrie moléculaire de chaque molécule ou ion.
(a) XeO3
(b) PF6–
(c) NO2+
Réponse
(a) pyramidal trigonal; (b) octaédrique; (c) linéaire
Structure moléculaire pour les molécules multicentriques
Lorsqu’une molécule ou un ion polyatomique ne possède qu’un seul atome central, la structure moléculaire décrit complètement la forme de la molécule. Les molécules plus grandes n’ont pas d’atome central unique, mais sont reliées par une chaîne d’atomes intérieurs qui possèdent chacun une géométrie “locale”. La façon dont ces structures locales sont orientées les unes par rapport aux autres influences également la forme de la molécule, mais ces considérations dépassent largement le cadre de cette introduction. Pour notre propos, nous nous concentrerons uniquement sur la détermination des structures locales.
Exemple 9.5.7 – Prédire la structure dans les molécules multicentriques
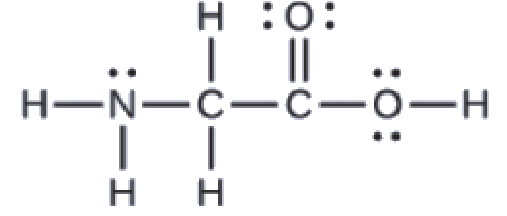
La structure de Lewis de l’acide aminé le plus simple, la glycine, H2NCH2CO2H, est présentée ici. Prédisez la géométrie locale de l’atome d’azote, des deux atomes de carbone et de l’atome d’oxygène avec un atome d’hydrogène attaché:
Solution
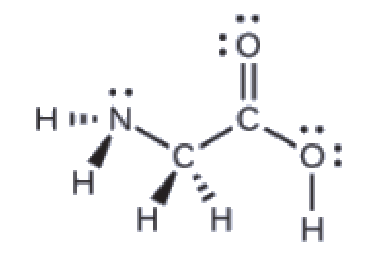
Considérez chaque atome central indépendamment. Les géométries des paires d’électrons:
azote–quatre régions de densité électronique; tétraédrique
carbone (CH2)–quatre régions de densité électronique; tétraédrique
carbone (CO2)-trois régions de densité électronique; plan trigonal
oxygène (OH)-quatre régions de densité électronique; tétraédrique
Les structures locales:
azote–trois liaisons, une paire célibataire; pyramide trigonale
carbone (CH2)-quatre liaisons, pas de paires célibataires; tétraédrique
carbone (CO2)-trois liaisons (la double liaison compte pour une liaison), pas de paires célibataires; plan trigonal.
oxygène (OH)-deux liaisons, deux paires célibataires; coudé (109°)
Vérifiez votre apprentissage 9.5.7 – Prédire la structure dans les molécules multicentriques
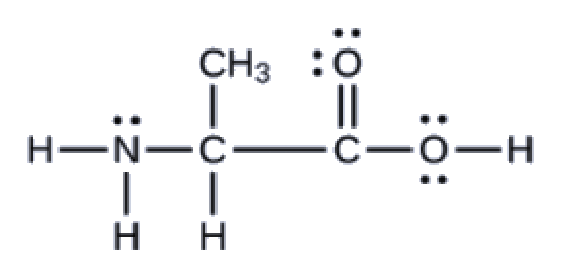
Un autre acide aminé est l’alanine, qui a la structure de Lewis présentée ici. Prédisez la géométrie des paires d’électrons et la structure locale de l’atome d’azote, des trois atomes de carbone et de l’atome d’oxygène avec l’hydrogène attaché:
Réponse
géométries des paires d’électrons: azote–tétraédrique; carbone (CH)-tétraédrique; carbone (CH3)-tétraédrique; carbone (CO2)-planaire trigonale; oxygène (OH)-tétraédrique; structures locales: azote-pyramidal trigonale; carbone (CH)-tétraédrique; carbone (CH3)-tétraédrique; carbone (CO2)-planaire trigonale; oxygène (OH)-coudé (109°)
|
VSEPR – Activité interactive |
|
Ce simulateur de forme moléculaire de PhET vous permet de construire diverses molécules et de vous entraîner à nommer leurs géométries de paires d’électrons et leurs structures moléculaires. |
Polarité moléculaire et moment dipolaire
Comme nous l’avons vu précédemment, les liaisons covalentes polaires relient deux atomes ayant des électronégativités différentes, laissant un atome avec une charge positive partielle (δ+) et l’autre atome avec une charge négative partielle (δ-), car les électrons sont tirés vers l’atome le plus électronégatif. Cette séparation des charges donne lieu à un moment dipolaire de liaison. La magnitude d’un moment dipolaire de liaison est représentée par la lettre grecque mu (µ) et est donnée par la formule suivante, où Q est la magnitude des charges partielles (déterminée par la différence d’électronégativité) et r est la distance entre les charges:
μ = Qr
Ce moment de liaison peut être représenté comme un vecteur, une quantité ayant à la fois une direction et une magnitude (Figure 9.5.13). Les vecteurs dipolaires sont représentés par des flèches pointant le long de la liaison, de l’atome le moins électronégatif vers l’atome le plus électronégatif. Un petit signe plus est dessiné sur l’extrémité la moins électronégative pour indiquer l’extrémité partiellement positive de la liaison. La longueur de la flèche est proportionnelle à l’ampleur de la différence d’électronégativité entre les deux atomes.
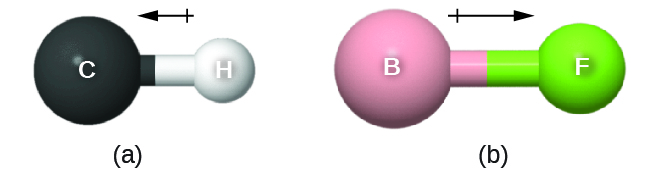
Figure 9.5.13. (a) Il existe une petite différence d’électronégativité entre C et H, représentée par un vecteur court. (b) La différence d’électronégativité entre B et F est beaucoup plus importante, le vecteur représentant le moment de la liaison est donc beaucoup plus long.
Une molécule entière peut également présenter une séparation de charge, en fonction de sa structure moléculaire et de la polarité de chacune de ses liaisons. Si une telle séparation de charge existe, la molécule est dite polaire (ou dipôle); sinon, la molécule est dite non–polaire. Le moment dipolaire mesure l’étendue de la séparation nette des charges dans la molécule dans son ensemble. On détermine le moment dipolaire en additionnant les moments de liaison dans l’espace tridimensionnel, en tenant compte de la structure moléculaire.
Pour les molécules diatomiques, il n’y a qu’une seule liaison, de sorte que le moment dipolaire de la liaison détermine la polarité moléculaire. Les molécules diatomiques homonucléaires telles que Br2 et N2 n’ont aucune différence d’électronégativité, leur moment dipolaire est donc nul. Pour les molécules hétéronucléaires telles que CO, il existe un petit moment dipolaire. Pour HF, le moment dipolaire est plus important car la différence d’électronégativité est plus grande.
Lorsqu’une molécule contient plus d’une liaison, la géométrie doit être prise en compte. Si les liaisons d’une molécule sont disposées de telle sorte que leurs moments de liaison s’annulent (la somme des vecteurs est égale à zéro), alors la molécule est non–polaire. C’est le cas du CO2 (Figure 9.5.14). Chacune des liaisons est polaire, mais la molécule dans son ensemble est non– polaire. À partir de la structure de Lewis, et en utilisant la théorie VSEPR, nous déterminons que la molécule de CO2 est linéaire avec des liaisons C=O polaires sur les côtés opposés de l’atome de carbone. Les moments de liaison s’annulent car ils sont orientés dans des directions opposées. Dans le cas de la molécule d’eau (Figure 9.5.14), la structure de Lewis montre à nouveau qu’il existe deux liaisons avec un atome central, et la différence d’électronégativité montre à nouveau que chacune de ces liaisons a un moment de liaison non nul. Dans ce cas, cependant, la structure moléculaire est courbée à cause des paires célibataires sur O, et les deux moments de liaison ne s’annulent pas. Par conséquent, l’eau a un moment dipolaire net et est une molécule polaire (dipôle).
Figure 9.5.14. Le moment dipolaire global d’une molécule dépend des moments dipolaires des liaisons individuelles et de la façon dont elles sont disposées. (a) Chaque liaison CO possède un moment dipolaire de liaison, mais ils sont orientés dans des directions opposées, de sorte que la molécule nette de CO2 est non-polaire. (b) En revanche, l’eau est polaire car les moments des liaisons OH ne s’annulent pas. 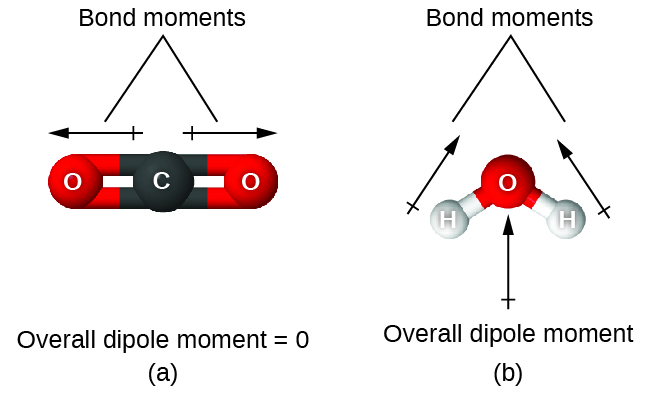
La molécule OCS a une structure similaire à celle du CO2, mais un atome de soufre a remplacé l’un des atomes d’oxygène. Pour déterminer si cette molécule est polaire, nous dessinons la structure moléculaire. La théorie VSEPR prédit une molécule linéaire:
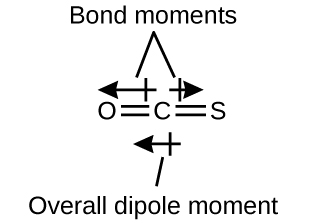
La liaison C-O est considérablement polaire. Bien que C et S aient des valeurs d’électronégativité très similaires, S est légèrement plus électronégatif que C, et donc la liaison C-S est juste légèrement polaire. L’oxygène étant plus électronégatif que le soufre, l’extrémité oxygène de la molécule est l’extrémité négative.
Le chlorométhane, CH3Cl, est un autre exemple de molécule polaire. Bien que les liaisons polaires C-Cl et C-H soient disposées selon une géométrie tétraédrique, les liaisons C-Cl ont un moment de liaison plus important que la liaison C-H, et les moments de liaison ne s’annulent pas complètement. Tous les dipôles ont une composante ascendante dans l’orientation indiquée, car le carbone est plus électronégatif que l’hydrogène et moins électronégatif que le chlore:
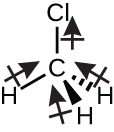
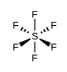
Lorsque nous examinons les molécules hautement symétriques BF3 (plan trigonale), CH4 (tétraédrique), PF5 (bipyramidal trigonale) et SF6 (octaédrique), dans lesquelles toutes les liaisons polaires sont identiques, ces molécules sont non–polaires. Les liaisons de ces molécules sont disposées de telle sorte que leurs dipôles s’annulent. Cependant, le fait qu’une molécule contienne des liaisons identiques ne signifie pas que les dipôles s’annuleront toujours. De nombreuses molécules qui ont des liaisons identiques et des paires célibataires sur les atomes centraux ont des dipôles de liaison qui ne s’annulent pas. C’est le cas par exemple de H2S et de NH3. Dans ces molécules, un atome d’hydrogène se trouve à l’extrémité positive et un atome d’azote ou de soufre à l’extrémité négative des liaisons polaires:
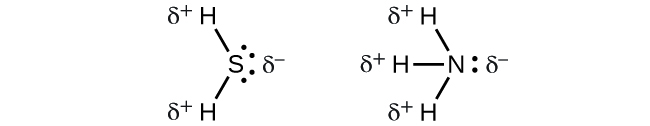
En résumé, pour être polaire, une molécule doit:
Contiennent au moins une liaison covalente polaire.
Avoir une structure moléculaire telle que la somme des vecteurs du moment dipolaire de chaque liaison ne s’annule pas.
Propriétés des molécules polaires
Les molécules polaires ont tendance à s’aligner lorsqu’elles sont placées dans un champ électrique, l’extrémité positive de la molécule étant orientée vers la plaque négative et l’extrémité négative vers la plaque positive (Figure 9.5.15). Nous pouvons utiliser un objet chargé électriquement pour attirer les molécules polaires, mais les molécules non–polaires ne sont pas attirées. De même, les solvants polaires sont plus efficaces pour dissoudre les substances polaires, et les solvants non–polaires sont plus efficaces pour dissoudre les substances non–polaires.
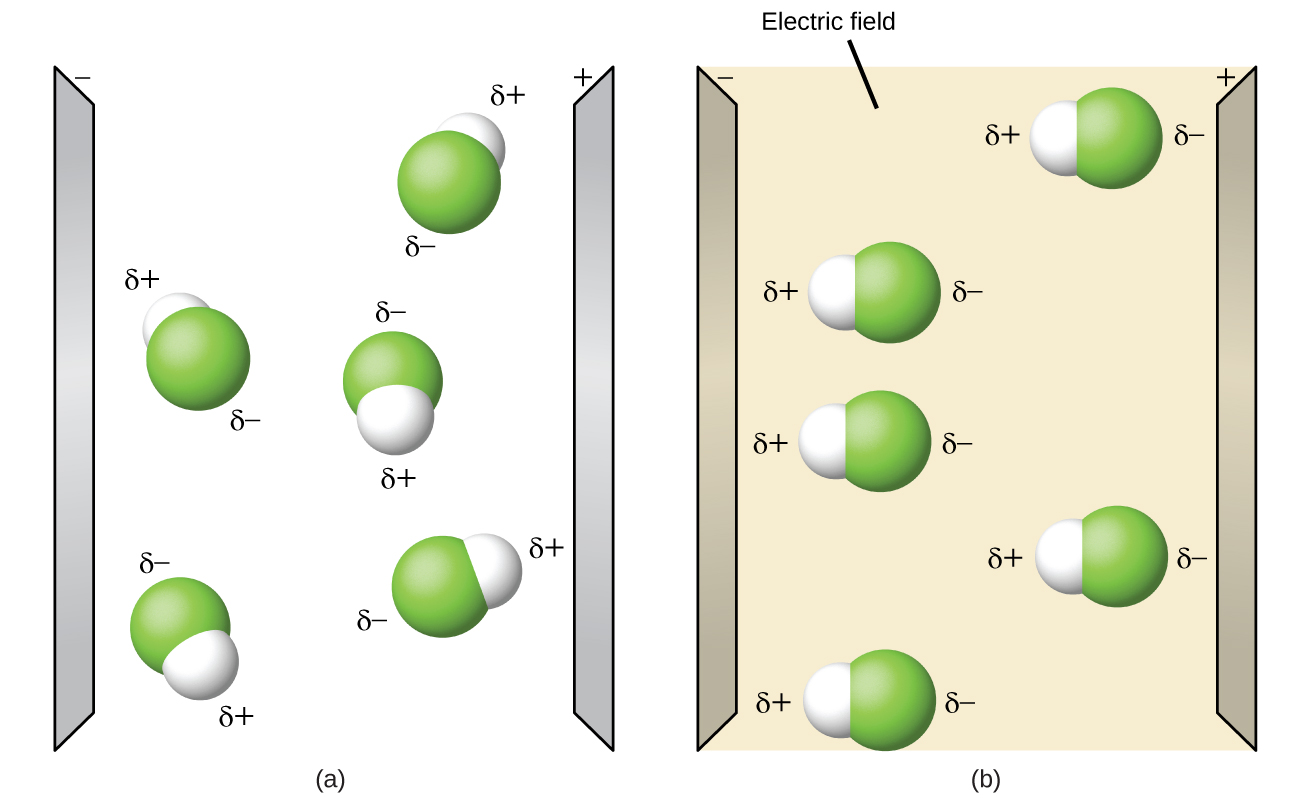
Figure 9.5.15. (a) Les molécules sont toujours distribuées au hasard à l’état liquide en l’absence de champ électrique. (b) Lorsqu’un champ électrique est appliqué, les molécules polaires comme HF s’alignent sur les dipôles dans la direction du champ.
|
Polarité moléculaire – Activité interactive |
|
Cette simulation de polarité de molécules de PhET offre de nombreuses possibilités d’explorer les moments dipolaires des liaisons et des molécules. |
★ Questions
1. Expliquez pourquoi la molécule de HOH est coudée, alors que la molécule de HBeH est linéaire.
2. Expliquez la différence entre la géométrie des paires d’électrons et la structure moléculaire.
3. Expliquez comment une molécule qui contient des liaisons polaires peut être non–polaire.
4. Prédisez la géométrie de la paire d’électrons et la structure moléculaire de chacune des molécules ou ions suivants:
a) SF6
b) PCl5
c) BeH2
d) CH3+
5. Quelle est la géométrie des paires d’électrons et la structure moléculaire de chacune des molécules ou ions suivants?
a) ClF5
b) ClO2−
c) TeCl42−
d) PCl3
e) SeF4
f) PH2−
6. Identifiez la géométrie de la paire d’électrons et la structure moléculaire de chacune des molécules suivantes:
a) ClNO (N is the central atom)
b) CS2
c) Cl2CO (C is the central atom)
d) Cl2SO (S is the central atom)
e) SO2F2 (S is the central atom)
f) XeO2F2 (Xe is the central atom)
g) ClOF2+ (Cl is the central atom)
7. Parmi les molécules et les ions suivants, lesquels contiennent des liaisons polaires? Lesquels de ces molécules et ions ont des moments dipolaires?
a) ClF5
b) ClO2−
c) TeCl42−
d) PCl3
e) SeF4
f) PH2−
g) XeF2
8. Lesquelles des molécules suivantes ont des moments dipolaires?
a) CS2
b) SeS2
c) CCl2F2
d) PCl3 (P is the central atom)
e) ClNO (N is the central atom)
9. La molécule XF3 a un moment dipolaire. X est-il du bore ou du phosphore?
10. La molécule Cl2BBCl2 est-elle polaire ou non–polaire?
11. Décrivez la structure moléculaire autour de l’atome ou des atomes indiqués:
a) L’atome de soufre dans l’acide sulfurique, H2SO4 [(HO)2SO2]
b) L’atome de chlore dans l’acide chlorique, HClO3 [HOClO2]
c) L’atome d’oxygène dans le peroxyde d’hydrogène, HOOH
d) L’atome d’azote dans l’acide nitrique, HNO3 [HONO2]
e) L’atome d’oxygène du groupe OH de l’acide nitrique, HNO3 [HONO2]
f) L’atome d’oxygène central de la molécule d’ozone, O3
g) Chacun des atomes de carbone dans le propyne, CH3CCH
h) L’atome de carbone dans le fréon, CCl2F2
i) Chacun des atomes de carbone de l’allène, H2CCCH2
★★ Questions
12. Une molécule de formule AB2, dans laquelle A et B représentent des atomes différents, pourrait avoir l’une de ces trois formes différentes. Dessinez et nommez les trois formes différentes que cette molécule pourrait avoir. Donnez un exemple de molécule ou d’ion pour chaque forme.
Réponses
1. L’emplacement des deux séries d’électrons non-liés dans l’eau oblige les liaisons à prendre une disposition tétraédrique, et la molécule HOH qui en résulte est coudée. La molécule HBeH (dans laquelle Be ne dispose que de deux électrons pour se lier aux deux électrons des hydrogènes) doit avoir les paires d’électrons aussi éloignées que possible les unes des autres et est donc linéaire.
2. Un espace doit être prévu pour chaque paire d’électrons, qu’ils soient dans une liaison ou qu’ils soient présents sous forme de paires célibataires. La géométrie des paires d’électrons prend en compte le placement de tous les électrons. La structure moléculaire ne prend en compte que la géométrie des paires de liaisons.
3. Tant que les liaisons polaires sont compensées (par exemple, deux atomes identiques se trouvent directement en face de l’atome central), la molécule peut être non–polaire.
4.
a) La géométrie des électrons et la structure moléculaire sont toutes deux octaédriques.
b) La géométrie des électrons et la structure moléculaire sont toutes deux des bipyramides trigonales.
c) La géométrie des électrons et la structure moléculaire sont toutes deux linéaires.
d) La géométrie des électrons et la structure moléculaire sont toutes deux planes et trigonales.
5.
a) géométrie des paires d’électrons: octaédrique, structure moléculaire: pyramidale carrée;
b) géométrie des paires d’électrons: tétraédrique, structure moléculaire: coudée;
c) géométrie des paires d’électrons: octaédrique, structure moléculaire: plane carrée;
d) géométrie des paires d’électrons: tétraédrique, structure moléculaire: pyramide trigonale;
e) géométrie des paires d’électrons: bipyramide trigonal, structure moléculaire: bascule;
f) géométrie des paires d’électrons: tétraédrique, structure moléculaire: coudée (109°)
6.
a) géométrie des paires d’électrons: plan trigonal, structure moléculaire: coudée (120°);
b) géométrie des paires d’électrons: linéaire, structure moléculaire: linéaire;
c) géométrie des paires d’électrons: planaire trigonale, structure moléculaire: planaire trigonale;
d) géométrie des paires d’électrons: tétraédrique, structure moléculaire: pyramide trigonale;
e) géométrie des paires d’électrons: tétraédrique, structure moléculaire: tétraédrique;
f) géométrie des paires d’électrons: bipyramide trigonale, structure moléculaire: bascule;
g) géométrie des paires d’électrons: tétraédrique, structure moléculaire: pyramide trigonale
7. Toutes ces molécules et tous ces ions contiennent des liaisons polaires. Seuls ClF5, ClO2–, PCl3, SeF4 et PH2– ont des moments dipolaires.
8. SeS2, CCl2F2, PCl3 et ClNO ont tous des moments dipolaires.
9. P
10. Non–polaire
11. (a) tétraédrique; (b) pyramidal trigonale; (c) coudé (109°); (d) plan trigonale; (e) coudé (109°); (f) coudé (109°); (g) CH3CCH tétraédrique, CH3CCH linéaire; (h) tétraédrique; (i) H2CCCH2 linéaire; H2CCCH2 plan trigonale
12.
a) CO2, linéaire
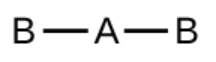
b) H2O, coudé avec un angle d’environ 109°
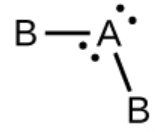
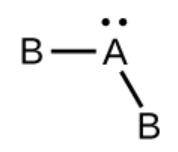
c) SO2, coudé avec un angle d’environ 120°
Angle entre deux liaisons covalentes quelconques qui partagent un atome commun
Distance entre les noyaux de deux atomes liés, à laquelle l'énergie potentielle la plus faible est atteinte
Distance entre les noyaux de deux atomes liés, à laquelle l'énergie potentielle la plus faible est atteinte
Théorie utilisée pour prédire les angles de liaison dans une molécule basée sur le positionnement de régions à haute densité d'électrons aussi éloignées que possible les unes des autres pour minimiser la répulsion électrostatique
Forme dans laquelle deux groupes extérieurs sont placés sur les côtés opposés d'un atome central
Forme dans laquelle trois groupes extérieurs sont placés dans un triangle plat autour d'un atome central avec des angles de 120° entre chaque paire et l'atome central
Forme dans laquelle quatre groupes extérieurs sont placés autour d'un atome central de telle sorte qu'une forme tridimensionnelle est générée avec quatre coins et des angles de 109,5° entre chaque paire et l'atome central
Forme dans laquelle cinq groupes extérieurs sont placés autour d'un atome central de telle sorte que trois forment un triangle plat avec des angles de 120° entre chaque paire et l'atome central, et les deux autres forment le sommet de deux pyramides, une au-dessus et une au-dessous du plan triangulaire
Forme dans laquelle six groupes extérieurs sont placés autour d'un atome central de telle sorte qu'une forme tridimensionnelle est générée avec quatre groupes formant un carré et les deux autres formant le sommet de deux pyramides, une au-dessus et une au-dessous du plan carré
Disposition autour d'un atome central de toutes les régions de densité électronique (liaisons, paires isolées ou électrons non appariés)
Arrangement des atomes dans une molécule ou un ion ; dans la théorie VSEPR, il s'agit d'une structure qui ne comprend que le placement des atomes dans la molécule
Localisation dans une géométrie bipyramidale trigonale dans laquelle un autre atome se trouve à un angle de 180° et les positions équatoriales à un angle de 90
Une des trois positions dans une géométrie bipyramidale trigonale avec des angles de 120° entre elles ; les positions axiales sont situées à un angle de 90
Séparation des charges dans une liaison qui dépend de la différence d'électronégativité et de la distance de liaison représentée par des charges partielles ou un vecteur
Quantité ayant une magnitude et une direction
Molécule avec un moment dipolaire global
Molécule avec un moment dipolaire global
Propriété d'une molécule qui décrit la séparation de charge déterminée par la somme des moments de liaison individuels sur la base de la structure moléculaire