9.2 – Les Liaisons Ioniques
Comme vous l’avez appris, les ions sont des atomes ou des molécules portant une charge électrique. Un cation (un ion positif) se forme lorsqu’un atome neutre perd un ou plusieurs électrons de sa couche de valence, et un anion (un ion négatif) se forme lorsqu’un atome neutre gagne un ou plusieurs électrons dans sa couche de valence.
Les composés formés d’ions sont appelés composés ioniques (ou sels), et leurs ions constitutifs sont maintenus ensemble par des liaisons ioniques : des forces électrostatiques d’attraction entre des cations et des anions de charge opposée. Les propriétés des composés ioniques nous éclairent sur la nature des liaisons ioniques. Les solides ioniques présentent une structure cristalline et ont tendance à être rigides et cassants ; ils ont également tendance à avoir des points de fusion et d’ébullition élevés, ce qui suggère que les liaisons ioniques sont très fortes. Les solides ioniques sont également de mauvais conducteurs d’électricité pour la même raison : la force des liaisons ioniques empêche les ions de se déplacer librement à l’état solide. Cependant, la plupart des solides ioniques se dissoudent facilement dans l’eau. Une fois dissous ou fondus, les composés ioniques sont d’excellents conducteurs d’électricité et de chaleur car les ions peuvent se déplacer librement.
Les atomes neutres et les ions qui leur sont associés ont des propriétés physiques et chimiques très différentes. Les atomes de sodium forment le sodium métallique, un métal mou, blanc argenté, qui brûle vigoureusement dans l’air et réagit de manière explosive avec l’eau. Les atomes de chlore forment du chlore gazeux, Cl2, un gaz jaune-vert qui est extrêmement corrosif pour la plupart des métaux et très toxique pour les animaux et les plantes. La réaction vigoureuse entre les éléments sodium et chlore forme le composé blanc et cristallin qu’est le chlorure de sodium, le sel de table commun, qui contient des cations sodium et des anions chlorure (Figure 9.2.1). Le composé constitué de ces ions présente des propriétés entièrement différentes de celles des éléments sodium et chlore. Le chlore est toxique, mais le chlorure de sodium est essentiel à la vie; les atomes de sodium réagissent vigoureusement avec l’eau, mais le chlorure de sodium se dissout simplement dans l’eau.

Figure 9.2.1. (a) Le sodium est un métal mou qui doit être stocké dans une huile minérale pour éviter toute réaction avec l’air ou l’eau. (b) Le chlore est un gaz jaune-vert pâle. (c) Lorsqu’ils sont combinés, ils forment des cristaux blancs de chlorure de sodium (sel de table). (Crédit a : modification de l’œuvre de “Jurii“/Wikimedia Commons)
Il est important de noter, cependant, que la formule d’un composé ionique ne représente pas l’arrangement physique de ses ions. Il est incorrect de parler de la “molécule” de chlorure de sodium (NaCl) car il n’existe pas de liaison ionique unique, en soi, entre une paire spécifique d’ions sodium et chlorure. Les forces d’attraction entre les ions sont isotropes, c’est-à-dire qu’elles sont les mêmes dans toutes les directions, ce qui signifie qu’un ion donné est également attiré par tous les ions voisins de charge opposée. Il en résulte que les ions s’arrangent pour former une structure tridimensionnelle en treillis étroitement liée. Le chlorure de sodium, par exemple, consiste en un arrangement régulier d’un nombre égal de cations Na+ et d’anions Cl– (Figure 9.2.2). Par conséquent, puisqu’il est impossible de définir une ” molécule ” d’un composé ionique, nous utilisons une formule empirique (par exemple: NaCl) au lieu d’une formule moléculaire pour représenter la cellule unitaire, et donc le rapport le plus simple en nombre entier des éléments présents dans le réseau cristallin.
Figure 9.2.2. Le composé ionique NaCl se forme lorsque les électrons des atomes de sodium sont transférés aux atomes de chlore. Les ions Na+ et Cl– qui en résultent forment un solide tridimensionnel maintenu par des interactions électrostatiques attractives.
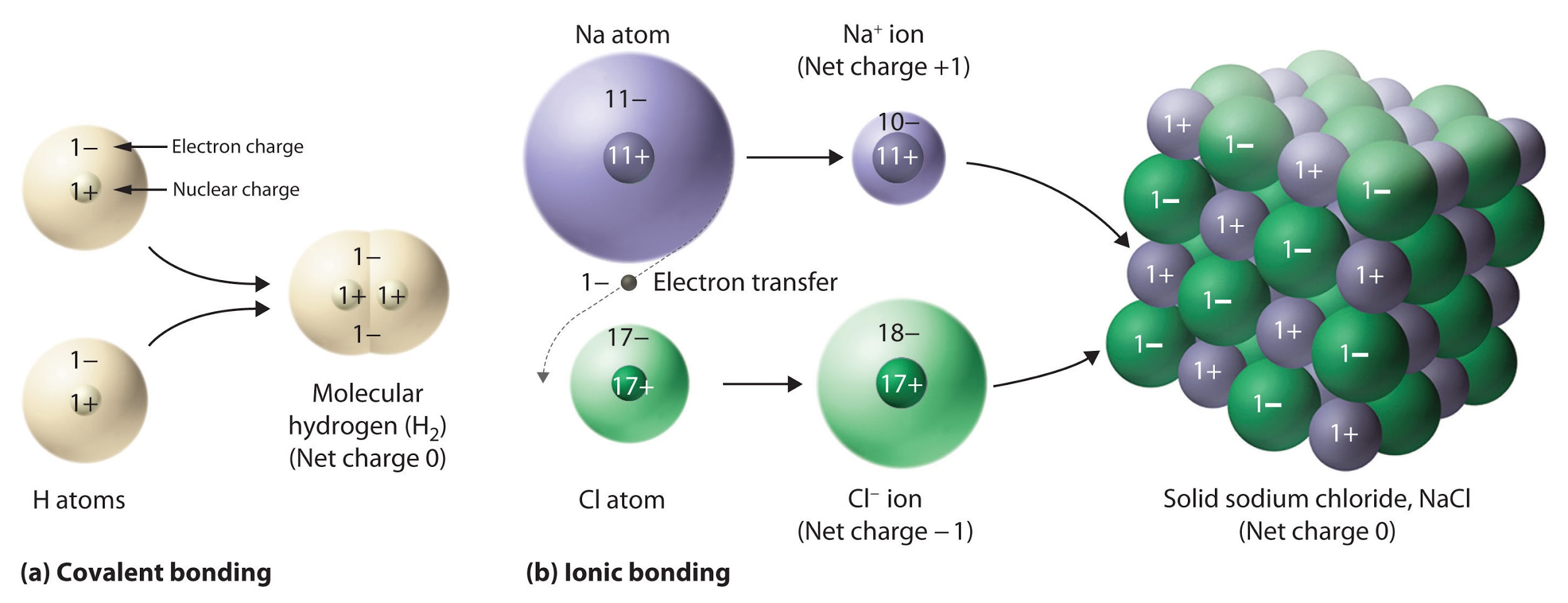
La forte attraction électrostatique entre les ions Na+ et Cl– les maintient fermement ensemble dans le NaCl solide. Dans la section suivante, nous examinerons cette force d’attraction en détail.
Force de la liaison ionique et énergie de réseau
Un composé ionique est stable en raison de l’attraction électrostatique entre ses ions positifs et négatifs. L’énergie de réseau d’un composé est une mesure de la force de cette attraction. L’énergie de réseau (ΔHréseau) d’un composé ionique est définie comme l’énergie requise pour séparer une mole du solide en ses ions gazeux constitutifs. Pour le solide ionique MX, l’énergie de réseau est le changement d’enthalpie du processus :
MX (s) → Mn+ (g) + Xn- (g) ΔHréseau
Notez que nous utilisons la convention où le solide ionique est séparé en ions, donc nos énergies de réseau seront endothermiques (valeurs positives). Certains textes utilisent une convention équivalente mais opposée, définissant l’énergie de réseau comme l’énergie libérée lorsque des ions séparés se combinent pour former un réseau et donnant des valeurs négatives (exothermiques). Par conséquent, si vous recherchez les énergies de réseau dans une autre référence, assurez-vous de vérifier quelle définition est utilisée. Dans les deux cas, une magnitude plus élevée pour l’énergie de réseau indique un composé ionique plus stable. Pour le chlorure de sodium, ΔHréseau = 769 kJ. Ainsi, il faut 769 kJ pour séparer une mole de NaCl solide en ions Na+ et Cl– gazeux. Lorsqu’une mole de chacun des ions Na+ et Cl– gazeux forme le NaCl solide, 769 kJ de chaleur sont libérés.
L’énergie de réseau ΔHréseau d’un cristal ionique peut être exprimée par l’équation suivante (dérivée de la loi de Coulomb, régissant les forces entre les charges électriques) :
ΔHréseau = C(Z+)(Z–)R0
Équation 9.2.1 Énergie de réseau d’un cristal ionique
dans laquelle C est une constante qui dépend du type de structure cristalline ; Z+ et Z– sont les charges des ions; et R0 est la distance interionique (la somme des rayons des ions positifs et négatifs). Ainsi, l’énergie de réseau d’un cristal ionique augmente rapidement lorsque les charges des ions augmentent et que la taille des ions diminue. Lorsque tous les autres paramètres sont maintenus constants, le fait de doubler la charge du cation et de l’anion quadruple l’énergie du réseau. Par exemple, l’énergie du réseau de LiF (Z+ et Z– = 1) est de 1023 kJ/mol, tandis que celle de MgO (Z+ et Z– = 2) est de 3900 kJ/mol (R0 est presque le même – environ 200 pm pour les deux composés).
Des distances interatomiques différentes produisent des énergies de réseau différentes. Par exemple, nous pouvons comparer l’énergie de réseau de MgF2 (2957 kJ/mol) à celle de MgI2 (2327 kJ/mol) pour observer l’effet sur l’énergie de réseau de la plus petite taille ionique de F– par rapport à I–.
Exemple 9.2.1 – Comparaisons d’énergie de réseau
Le rubis, pierre précieuse, est un oxyde d’aluminium, Al2O3, contenant des traces de Cr3+. Le composé Al2Se3 est utilisé dans la fabrication de certains dispositifs semi-conducteurs. Lequel a la plus grande énergie de réseau, Al2O3 ou Al2Se3?
Solution
Dans ces deux composés ioniques, les charges Z+ et Z– sont les mêmes, donc la différence d’énergie de réseau dépendra de R0. L’ion O2- est plus petit que l’ion Se2-. Ainsi, Al2O3 aurait une distance interionique plus courte que Al2Se3, et Al2O3 aurait une énergie de réseau plus grande.
Vérifiez votre apprentissage 9.2.1 – Comparaisons d’énergie de réseau
L’oxyde de zinc, ZnO, est une crème solaire très efficace. Comment l’énergie de réseau du ZnO se compare-t-elle à celle du NaCl ? Reportez-vous à la figure ci-dessous des rayons ioniques pour vous aider à répondre à cette question.
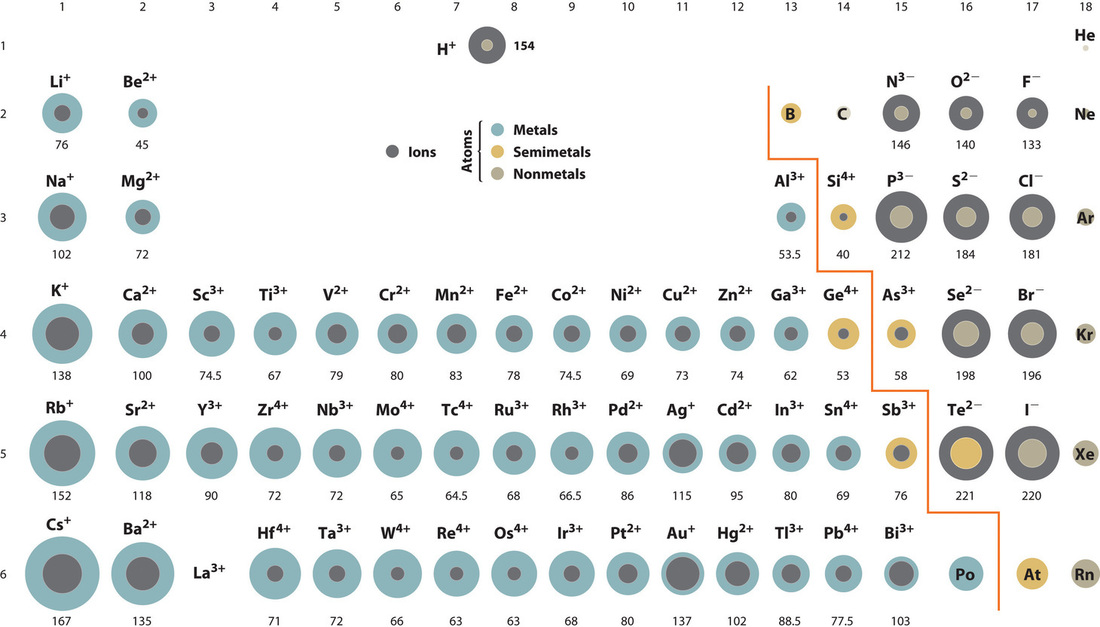
Figure 9.2.3. Tableau périodique avec les rayons ioniques des états ioniques les plus courants des éléments, les régions grises indiquant les rayons ioniques et les régions colorées les rayons neutres.
Réponse
Le ZnO aurait la plus grande énergie de réseau parce que les valeurs Z du cation et de l’anion dans le ZnO sont plus grandes, et la distance interionique du ZnO est plus petite que celle du NaCl.
★ Questions
1. Un cation gagne-t-il des protons pour former une charge positive ou perd-il des électrons ?
2. Parmi les atomes suivants, lesquels devraient former des ions négatifs dans des composés ioniques binaires et lesquels devraient former des ions positifs : P, I, Mg, Cl, In, Cs, O, Pb, Co ?
3. Prédisez la charge des ions monoatomiques formés à partir des atomes suivants dans des composés ioniques binaires :
a) P
b) Mg
c) Al
d) O
e) Cl
f) Cs
4. Écrivez la configuration électronique de chacun des ions suivants :
a) As3–
b) I–
c) Be2+
d) Cd2+
e) O2–
f) Ga3+
g) Li+
h) N3–
i) Sn2+
j) Co2+
k) Fe2+
l) As3+
5. Pourquoi est-il incorrect de parler d’une molécule de NaCl solide ?
6. Pour laquelle des substances suivantes faut-il le moins d’énergie pour convertir une mole du solide en ions séparés ?
a) MgO
b) SrO
c) KF
d) CsF
e) MgF2
★★ Questions
7. L’énergie de réseau du LiF est de 1023 kJ/mol, et la distance Li-F est de 201 pm. Le MgO se cristallise dans la même structure que le LiF mais avec une distance Mg-O de 205 pm. Laquelle des valeurs suivantes se rapproche le plus de l’énergie de réseau du MgO : 256 kJ/mol, 512 kJ/mol, 1023 kJ/mol, 2046 kJ/mol ou 4008 kJ/mol ? Expliquez votre choix.
8. Quel composé dans chacune des paires suivantes possède la plus grande énergie de réseau? Remarque : Ba2+ et K+ ont des rayons similaires; S2- et Cl– ont des rayons similaires. Expliquez vos choix.
a) K2O ou Na2O
b) K2S ou BaS
c) KCl ou BaS
d) BaS ou BaCl2
Réponses
1. Les protons du noyau ne changent pas au cours des réactions chimiques normales. Seuls les électrons extérieurs se déplacent. Des charges positives se forment lorsque des électrons sont perdus.
2. P, I, Cl et O formeraient des anions car ce sont des non-métaux. Mg, In, Cs, Pb et Co formeraient des cations parce qu’ils sont des métaux.
3. (a) P3-; (b) Mg2+; (c) Al3+; (d) O2-; (e) Cl–; (f) Cs+.
4. (a) [Ar]4s23d104p6; (b) [Kr]4d105s25p6 (c) 1s2 (d) [Kr]4d10; (e) [He]2s22p6; (f) [Ar]3d10; (g) 1s2 (h) [He]2s22p6 (i) [Kr]4d105s2 (j) [Ar]3d7 (k) [Ar]3d6, (l) [Ar]3d104s2
5. Le NaCl est constitué d’ions discrets disposés dans un réseau cristallin, et non de molécules liées de manière covalente.
6. d)
7. 4008 kJ/mol; les deux ions de MgO ont une charge deux fois plus élevée que celle des ions de LiF; la longueur des liaisons est très similaire et les deux ont la même structure; on s’attend à un quadruplement de l’énergie d’après l’équation de l’énergie de réseau
8. (a) Na2O; Na+ a un rayon plus petit que K+; (b) BaS; Ba a une charge plus grande que K; (c) BaS; Ba et S ont des charges plus grandes; (d) BaS; S a une charge plus grande.
Énergie nécessaire pour séparer une mole d'un solide ionique en ions gazeux qui le composent

