7.8 – Catalyse
Il a été présenté dans une section précédente que la vitesse de nombreuses réactions peut être accélérée par des catalyseurs. Un catalyseur accélère la vitesse d’une réaction en réduisant l’énergie d’activation; en outre, le catalyseur est régénéré au cours du processus. Plusieurs réactions qui sont thermodynamiquement favorables en l’absence de catalyseur ne se produisent à une vitesse raisonnable qu’en présence d’un catalyseur. L’une de ces réactions est l’hydrogénation catalytique, le processus par lequel l’hydrogène est ajouté à travers une liaison C=C d’un alcène pour donner le produit alcane saturé. La Figure 7.8.1 présente une comparaison des diagrammes de coordonnées de réaction (également appelés diagrammes énergétiques) pour l’hydrogénation catalytique et non catalytique des alcènes.
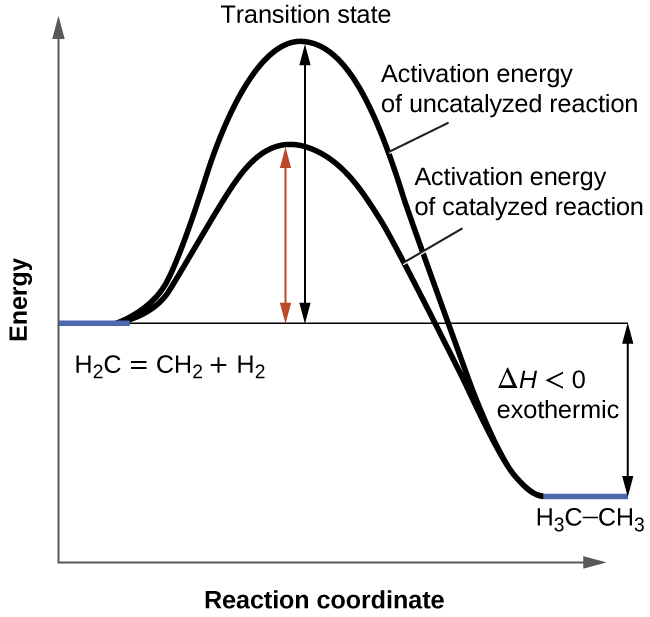
Figure 7.8.1. Ce graphique compare les coordonnées de réaction pour l’hydrogénation des alcènes catalysée et non catalysée.
Les diagrammes de coordonnées de réaction (également appelés profils de réaction) montrent comment une réaction progresse des réactifs aux produits en termes d’énergie. Ces diagrammes sont constitués des éléments suivants:
Coordonnée de réaction sur l’axe des X: la progression d’une réaction des réactifs (à gauche) vers les produits (à droite) pour la réaction directe, et vice-versa pour la réaction inverse.
Énergie sur l’axe des Y: quantité d’énergie potentielle présente au cours de la réaction; plus l’énergie potentielle est faible, plus l’espèce est stable.
Réactifs: indiqués par la ligne plate à l’extrême gauche.
Produits: indiqués comme la ligne plate à l’extrême droite
État de transition (complexe activé): représente le complexe trouvé au sommet de la courbe. Il s’agit d’une configuration particulière des réactifs au moment de la ou des collisions de réaction qui donne une “structure” d’énergie potentielle maximale et donc de plus grande instabilité. Notez que l’état de transition n’est pas une structure ou un intermédiaire défini.
Énergie d’activation: représentée par la différence et l’augmentation de l’énergie potentielle entre 1) les réactifs, les produits ou un intermédiaire, et 2) l’état de transition (réaction directe) ou entre les produits et l’état de transition (réaction inverse). Elle représente la barrière énergétique qui doit être franchie pour atteindre l’état de transition. Le système doit gagner de l’énergie et devenir de plus en plus instable pour adopter le complexe activé; une fois celui-ci atteint, un apport d’énergie n’est plus nécessaire, et le système diminue en énergie et devient plus stable au fur et à mesure de la réaction.
Intermédiaire (pas représenté sur la Figure 7.8.1 mais illustré dans la voie catalysée de la Figure 7.8.2): représente la structure que l’on trouve au creux d’une courbe. C’est une espèce qui existe temporairement en tant que produit pour une étape de la réaction et en tant que réactif pour l’étape suivante. Elle possède une structure chimique bien définie et est donc plus stable qu’un état de transition, mais elle ne persiste que momentanément et est donc moins stable et plus énergétique que les réactifs et les produits.
Les catalyseurs fonctionnent en fournissant un mécanisme de réaction alternatif qui présente une énergie d’activation inférieure à celle que l’on trouverait en l’absence du catalyseur. Dans certains cas, le mécanisme catalysé peut inclure des étapes supplémentaires, comme le montrent les diagrammes de réaction illustrés à la Figure 7.8.2. Cette énergie d’activation plus faible entraîne une augmentation de la vitesse, comme le décrit l’équation d’Arrhenius. Notez qu’un catalyseur diminue l’énergie d’activation pour les réactions avant et arrière et accélère donc les réactions directes et inverses. Par conséquent, la présence d’un catalyseur permet à un système d’atteindre l’équilibre plus rapidement, mais elle n’a aucun effet sur la position de l’équilibre telle qu’elle est reflétée par la valeur de sa constante d’équilibre (voir le sujet précédent sur l’équilibre chimique).
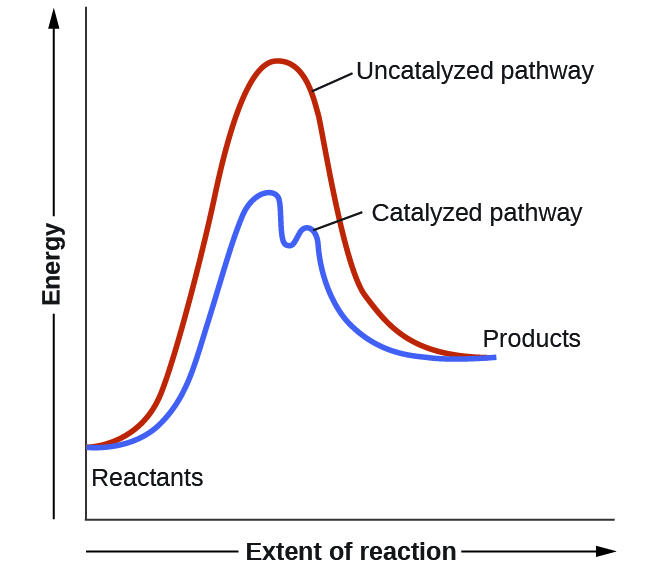
Figure 7.8.2. Ce diagramme d’énergie potentielle montre l’effet d’un catalyseur sur l’énergie d’activation. Le catalyseur fournit un chemin de réaction différent avec une énergie d’activation plus faible. Comme indiqué, la voie catalysée implique un mécanisme à deux étapes (notez la présence de deux états de transition) et une espèce intermédiaire (représentée par la vallée entre les deux états de transition).
Exemple 7.8.1 – Utilisation des diagrammes de réaction pour comparer les réactions catalysées
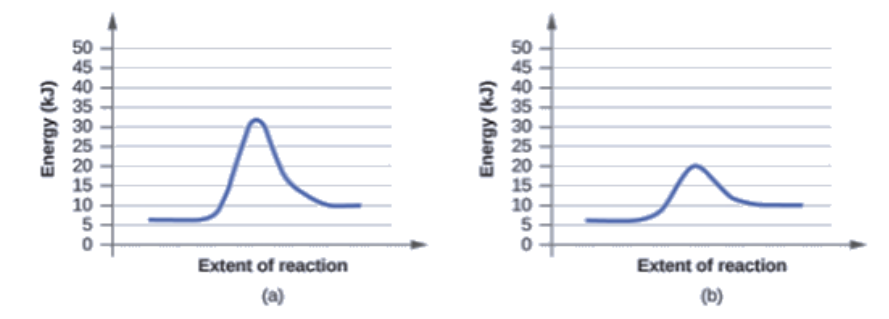
Les deux diagrammes de réaction ici représentent la même réaction: un sans catalyseur et un avec catalyseur. Identifiez le diagramme qui suggère la présence d’un catalyseur, et déterminez l’énergie d’activation de la réaction catalysée:
Solution
Un catalyseur n’affecte pas l’énergie du réactif ou du produit, donc ces aspects des diagrammes peuvent être ignorés; ils sont, comme on peut s’y attendre, identiques à cet égard. Il existe cependant une différence notable au niveau de l’état de transition, dont l’énergie est nettement plus faible dans le diagramme (b) que dans le diagramme (a). Cela indique l’utilisation d’un catalyseur dans le diagramme (b). L’énergie d’activation est la différence entre l’énergie des réactifs de départ et l’état de transition – un maximum sur le diagramme des coordonnées de réaction. Les réactifs sont à 6 kJ et l’état de transition est à 20 kJ, l’énergie d’activation peut donc être calculée comme suit:
Ea = 20 kJ – 6 kJ = 14 kJ
Vérifiez votre apprentissage 7.8.1
Déterminez lequel des deux diagrammes ici (tous deux pour la même réaction) implique un catalyseur, et identifiez l’énergie d’activation pour la réaction catalysée:
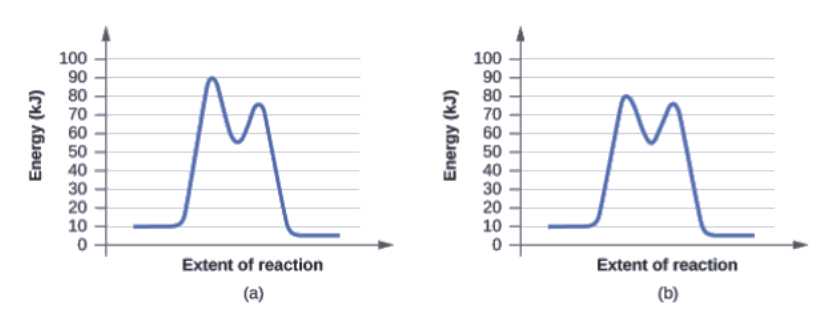
Réponse
Le schéma (b) représente une réaction catalysée avec une énergie d’activation d’environ 70 kJ.
Catalyseurs homogènes
Un catalyseur homogène est présent dans la même phase que les réactifs. Il interagit avec un réactif pour former une substance intermédiaire, qui se décompose ensuite ou réagit avec un autre réactif en une ou plusieurs étapes pour régénérer le catalyseur d’origine et former le produit.
Pour illustrer la catalyse homogène, prenons l’exemple de la couche d’ozone de la Terre. L’ozone dans la haute atmosphère, qui protège la terre du rayonnement ultraviolet, se forme lorsque les molécules d’oxygène absorbent la lumière ultraviolette et subissent la réaction:
3O2 (g) hv → 2O3 (g)
L’ozone est une molécule relativement instable qui se décompose pour donner de l’oxygène diatomique par l’inverse de cette équation. Cette réaction de décomposition est compatible avec le mécanisme suivant:
O3 → O2 + O
O + O3 → 2O2
La présence d’oxyde nitrique, NO, influence la vitesse de décomposition de l’ozone. L’oxyde nitrique agit comme un catalyseur selon le mécanisme suivant:
NO (g) + O3 (g) → NO2 (g) + O2 (g)
O3 (g) → O2 (g) + O (g)
NO2 (g) + O (g) → NO (g) + O2 (g)
Le changement chimique global pour le mécanisme catalysé est le même que:
2O3 (g) → 3O2 (g)
L’oxyde nitrique réagit et est régénéré dans ces réactions. Il n’est pas consommé de façon permanente; il agit donc comme un catalyseur. La vitesse de décomposition de l’ozone est plus élevée en présence d’oxyde nitrique en raison de l’activité catalytique du NO. Certains composés contenant du chlore catalysent également la décomposition de l’ozone.
|
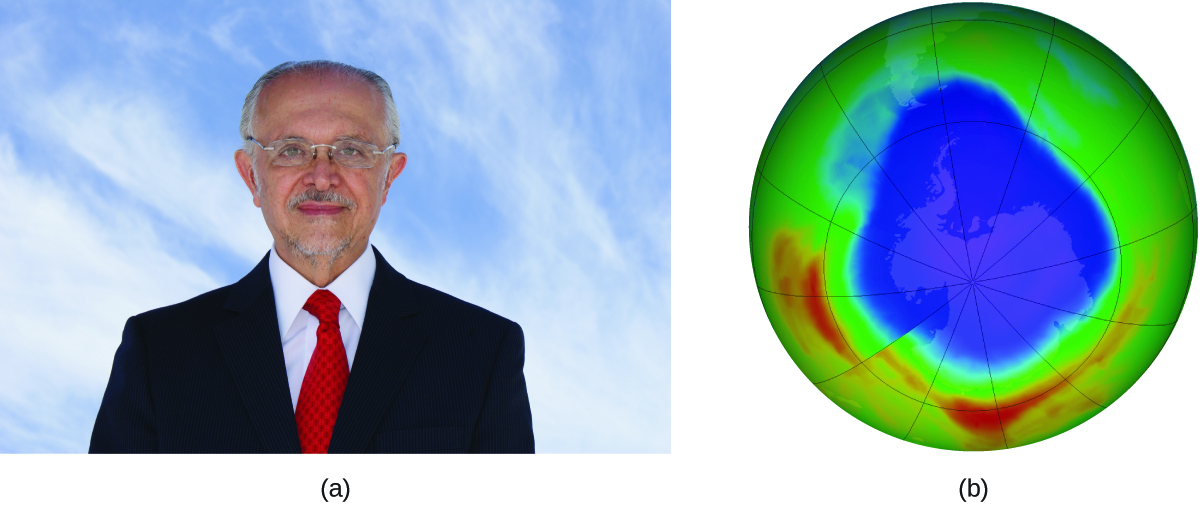
Mario J. Molina Le prix Nobel de chimie 1995 a été partagé entre Paul J. Crutzen, Mario J. Molina (Figure 7.8.3.) et F. Sherwood Rowland “pour leurs travaux dans le domaine de la chimie de l’atmosphère, notamment en ce qui concerne la formation et la décomposition de l’ozone. “1Molina, citoyen mexicain, a réalisé la majorité de ses travaux à l’Institut de Technologie de Massachusetts (MIT).
Figure 7.8.3. (a) Le chimiste mexicain Mario Molina (1943 -) a partagé le prix Nobel de chimie en 1995 pour ses recherches sur (b) le trou d’ozone en Antarctique. (crédit a: courtoisie de Mario Molina; crédit b: modification du travail par la NASA) En 1974, Molina et Rowland ont publié un article dans la revue Nature (l’une des principales publications scientifiques évaluées par des pairs) détaillant la menace que représentent les gaz chlorofluorocarbonés pour la stabilité de la couche d’ozone dans la haute atmosphère terrestre. La couche d’ozone protège la terre du rayonnement solaire en absorbant les rayons ultraviolets. Lorsque des réactions chimiques réduisent la quantité d’ozone dans la haute atmosphère, un “trou” mesurable se forme au-dessus de l’Antarctique et une augmentation de la quantité de rayonnement ultraviolet solaire – fortement liée à la prévalence des cancers de la peau – atteint la surface de la terre. Les travaux de Molina et Rowland ont joué un rôle déterminant dans l’adoption du protocole de Montréal, un traité international signé en 1987 qui a permis de commencer à éliminer progressivement la production de produits chimiques liés à la destruction de l’ozone. Molina et Rowland ont démontré que les atomes de chlore provenant de produits chimiques d’origine humaine peuvent catalyser la destruction de l’ozone selon un processus similaire à celui par lequel le NO accélère l’appauvrissement de l’ozone. Les atomes de chlore sont générés lorsque les chlorocarbones ou les chlorofluorocarbones – autrefois largement utilisés comme réfrigérants et propulseurs – sont décomposés photochimiquement par la lumière ultraviolette ou réagissent avec les radicaux hydroxyles. Un exemple de mécanisme est présenté ici en utilisant le chlorure de méthyle: CH3Cl + OH → Cl + autres produits Les radicaux de chlore décomposent l’ozone et sont régénérés par le cycle catalytique suivant: Cl + O3 → ClO + O2 ClO + O → Cl + O2 Réaction globale: O3 + O → 2O2 Un seul chlore monatomique peut décomposer des milliers de molécules d’ozone. Heureusement, la majorité du chlore atmosphérique existe sous les formes catalytiquement inactives Cl2 et ClONO2. Depuis qu’il a reçu sa part du prix Nobel, M. Molina a poursuivi ses travaux en chimie atmosphérique au MIT. 1 Le prix Nobel de chimie 1995. (s.d.). Récupéré sur https://www.nobelprize.org/prizes/chemistry/1995/summary/ |
|
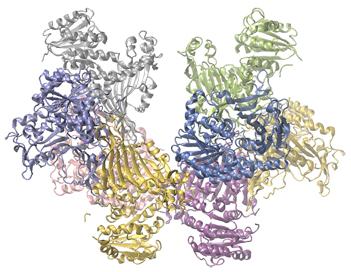
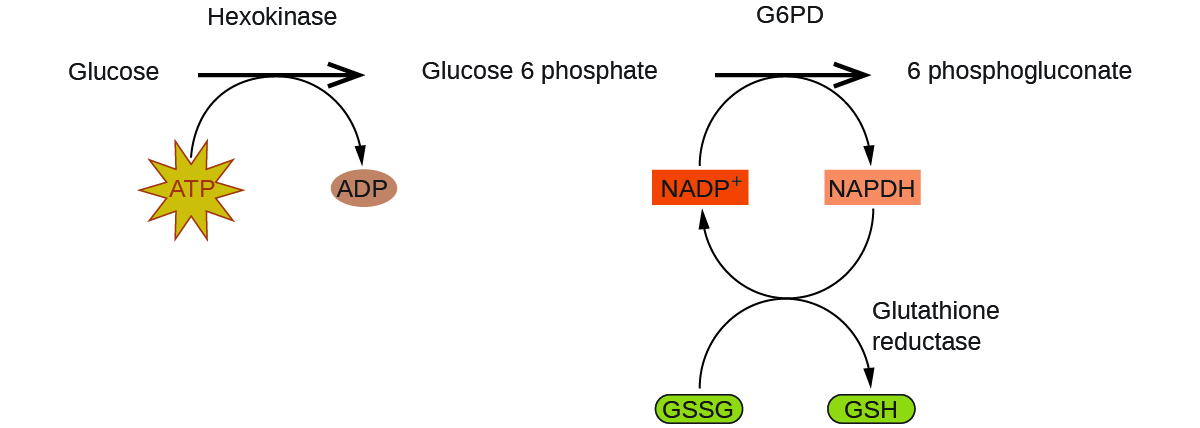
Déficit en glucose-6-phosphate déshydrogénase Les enzymes du corps humain servent de catalyseurs pour d’importantes réactions chimiques dans le métabolisme cellulaire. À ce titre, la déficience d’une enzyme particulière peut se traduire par une maladie potentiellement mortelle. Le déficit en G6PD (glucose-6-phosphate déshydrogénase), une maladie génétique qui se traduit par une insuffisance de l’enzyme glucose-6-phosphate déshydrogénase, est le déficit enzymatique le plus courant chez l’homme. Cette enzyme, représentée dans la Figure 7.8.4., est l’enzyme limitant la vitesse de la voie métabolique qui fournit le NADPH aux cellules (Figure 7.8.4.).
Figure 7.8.4. La glucose-6-phosphate déshydrogénase est une enzyme limitant la vitesse de la voie métabolique qui fournit du NADPH aux cellules. Une perturbation de cette voie peut entraîner une réduction du glutathion dans les globules rouges; une fois que tout le glutathion est consommé, les enzymes et d’autres protéines comme l’hémoglobine sont susceptibles d’être endommagées. Par exemple, l’hémoglobine peut être métabolisée en bilirubine, ce qui entraîne une jaunisse, un état qui peut devenir grave. Les personnes souffrant d’un déficit en G6PD doivent éviter certains aliments et médicaments contenant des produits chimiques susceptibles de provoquer des dommages à leurs globules rouges déficients en glutathion.
Figure 7.8.5. Dans le mécanisme de la voie des pentoses phosphates, la G6PD catalyse la réaction qui régule la NAPDH, une coenzyme qui régule le glutathion, un antioxydant qui protège les globules rouges et les autres cellules des dommages oxydatifs.
|
Catalyseurs hétérogènes
Un catalyseur hétérogène est un catalyseur qui est présent dans une phase différente (généralement un solide) de celle des réactifs. Ces catalyseurs fonctionnent généralement en fournissant une surface active sur laquelle une réaction peut se produire. Les réactions en phase gazeuse et liquide catalysées par les catalyseurs hétérogènes se produisent à la surface du catalyseur plutôt que dans la phase gazeuse ou liquide.
La catalyse hétérogène comporte au moins quatre étapes:
Adsorption du réactif sur la surface du catalyseur
Activation du réactif adsorbé
Réaction du réactif adsorbé
Diffusion du produit de la surface vers la phase gazeuse ou liquide (désorption).
L’une quelconque de ces étapes peut être lente et peut donc servir d’étape déterminant la vitesse. En général, cependant, en présence du catalyseur, la vitesse globale de la réaction est plus rapide qu’elle ne le serait si les réactifs étaient en phase gazeuse ou liquide.
La Figure 7.8.6. illustre les étapes qui, selon les chimistes, se produisent dans la réaction des composés contenant une double liaison carbone-carbone avec l’hydrogène sur un catalyseur au nickel. Le nickel est le catalyseur utilisé dans l’hydrogénation des graisses et huiles polyinsaturées (qui contiennent plusieurs doubles liaisons carbone-carbone) pour produire des graisses et huiles saturées (qui ne contiennent que des simples liaisons carbone-carbone).
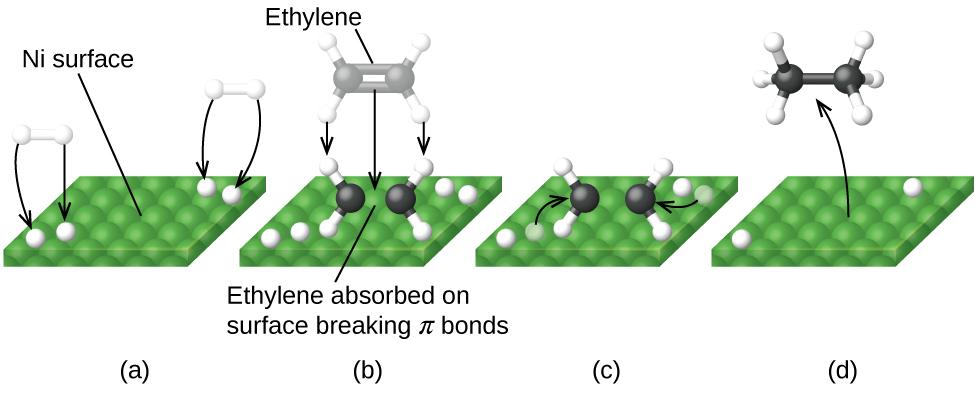
Figure 7.8.6. Il y a quatre étapes dans la catalyse de la réaction CdH4 + H2 ⟶ C2H6 par le nickel. (a) L’hydrogène est adsorbé sur la surface, brisant les liaisons H-H et formant des liaisons Ni-H. (b) L’éthylène est adsorbé à la surface, brisant la liaison π et formant des liaisons Ni-C. (c) Les atomes diffusent sur la surface et forment de nouvelles liaisons C-H lorsqu’ils entrent en collision. (d) Les molécules de C2H6 s’échappent de la surface du nickel, car elles ne sont pas fortement attirées par le nickel.
|
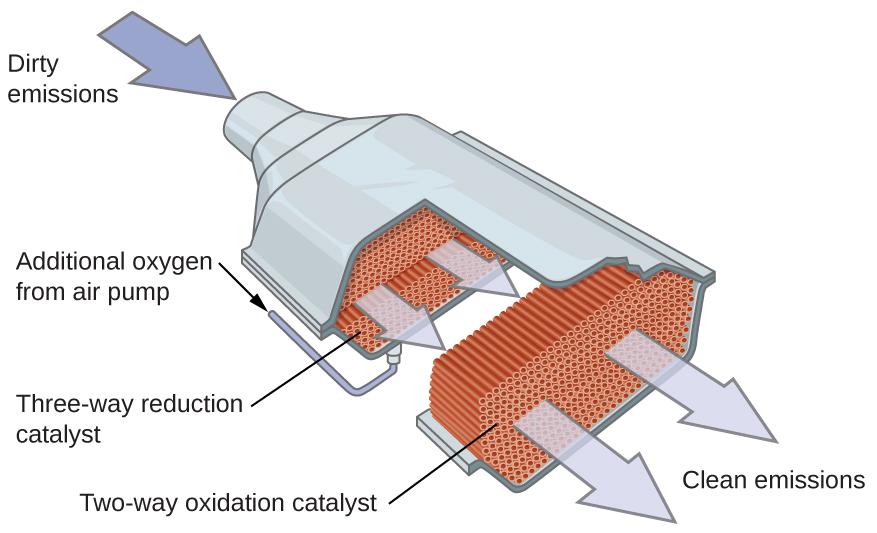
Convertisseurs catalytiques pour automobiles Les scientifiques ont mis au point des convertisseurs catalytiques pour réduire la quantité d’émissions toxiques produites par la combustion de l’essence dans les moteurs à combustion interne. Les convertisseurs catalytiques tirent parti des cinq facteurs qui influent la vitesse des réactions chimiques pour faire en sorte que les émissions d’échappement soient aussi sûres que possible. En utilisant un mélange soigneusement sélectionné de métaux catalytiquement actifs, il est possible d’effectuer une combustion complète de tous les composés contenant du carbone en dioxyde de carbone tout en réduisant la production d’oxydes d’azote. Ce résultat est particulièrement impressionnant si l’on considère qu’une étape consiste à ajouter de l’oxygène à la molécule et que l’autre consiste à éliminer l’oxygène (Figure 7.8.7.).
Figure 7.8.7. Un convertisseur catalytique permet la combustion de tous les composés contenant du carbone en dioxyde de carbone, tout en réduisant la production d’oxyde d’azote et d’autres polluants dans les émissions des moteurs à essence. La plupart des convertisseurs catalytiques modernes à trois voies possèdent une surface imprégnée d’un catalyseur platine-rhodium, qui catalyse la conversion de l’oxyde nitrique en azote et en oxygène ainsi que la conversion du monoxyde de carbone et des hydrocarbures tels que l’octane en dioxyde de carbone et en vapeur d’eau: 2NO2 (g) → N2 (g) + 2O2 (g) 2CO (g) + O2 (g) → 2CO2 (g) 2C8H18 (g) + 25 O2 (g) → 16CO2 (g) + 18H2O (g) Afin d’être aussi efficaces que possible, la plupart des convertisseurs catalytiques sont préchauffés par un chauffage électrique. Cela garantit que les métaux du catalyseur sont pleinement actifs avant même que les gaz d’échappement de l’automobile ne soient suffisamment chauds pour maintenir des températures de réaction appropriées. Le “ChemWiki” de l’Université de Californie à Davis fournit une explication détaillée dufonctionnement des convertisseurs catalytiques. |
|
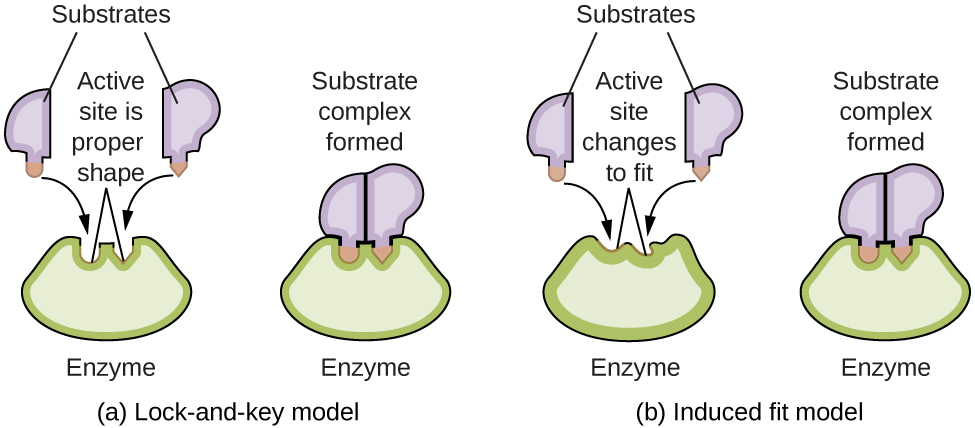
Structure et fonction des enzymes L’étude des enzymes est une interconnexion importante entre la biologie et la chimie. Les enzymes sont généralement des protéines (polypeptides) qui contribuent à contrôler la vitesse des réactions chimiques entre des composés biologiquement importants, notamment ceux qui interviennent dans le métabolisme cellulaire. Les différentes classes d’enzymes remplissent diverses fonctions, comme le montre le tableau ci-dessous. Classes d’enzymes et leurs fonctions Classe Fonctions oxydoréductases réactions redox transférases transfert de groupes fonctionnels hydrolases réactions d’hydrolyse lyse l’élimination des groupes pour former des doubles liaisons isomérases isomérisation ligases formation de liens avec l’hydrolyse de l’ATP Les molécules enzymatiques possèdent un site actif, une partie de la molécule dont la forme lui permet de se lier à un substrat spécifique (une molécule réactive), formant un complexe enzyme-substrat comme intermédiaire de réaction. Il existe deux modèles qui tentent d’expliquer le fonctionnement de ce site actif. Le modèle le plus simpliste est appelé l’hypothèse de la serrure-et-clé, qui suggère que les formes moléculaires du site actif et du substrat sont complémentaires, s’emboîtant comme une clé dans une serrure. L’hypothèse de l’ajustement induit, en revanche, suggère que la molécule d’enzyme est flexible et change de forme pour s’adapter à une liaison avec le substrat. Cela ne veut pas dire pour autant que le site actif d’une enzyme est complètement malléable. Le modèle serrure–et–clé et le modèle de l’ajustement induit tiennent tous deux compte du fait que les enzymes ne peuvent se lier qu’à des substrats spécifiques, puisqu’en général une enzyme particulière ne catalyse qu’une réaction particulière (Figure 7.8.8.).
Figure 7.8.8. (a) Selon le modèle “serrure-et-clé“, la forme du site actif d’une enzyme est parfaitement adaptée au substrat. (b) Selon le modèle de l’ajustement induit, le site actif est quelque peu flexible et peut changer de forme afin de se lier au substrat. |
La Royal Society of Chemistrypropose une excellente introduction aux enzymes pour les étudiants et les enseignants.
|
CHM1311 Laboratoire | Expérimente #5: Une étude cinétique: Catalase |
|
Objectif Cette expérience porte sur la cinétique des réactions dans le contexte des catalyseurs – des substances qui accélèrent la vitesse des réactions en réduisant l’énergie d’activation. Certains catalyseurs existent sous forme de composés, comme l’iodure de potassium (KI), tandis que d’autres sont des protéines biologiques que l’on trouve dans les organismes vivants – ces catalyseurs biologiques sont appelés enzymes. Dans la première partie de cette expérience, vous allez étudier la décomposition catalysée du peroxyde d’hydrogène par l’enzyme catalase dans la laitue. Votre travail consiste à concevoir et à réaliser des expériences pour déterminer l’ordre partiel par rapport au peroxyde d’hydrogène dans la loi de vitesse: vitesse = k [H2O2]x [catalase]y Dans la deuxième partie de votre expérience, vous devrez à nouveau concevoir et réaliser une procédure expérimentale pour déterminer et comparer les énergies d’activation de la décomposition du peroxyde d’hydrogène catalysée par une catalase et catalysée par un iodure (à partir d’iodure de potassium). Grâce à ces informations, vous pourrez déduire lequel des deux catalyseurs est le plus efficace pour accélérer la vitesse de la réaction. Principes Vitesse initiale de la réaction Ordre de la réaction Énergie d’activation Précautions de sécurité Portez en permanence l’équipement de protection individuelle (EPI) approprié dans le laboratoire, notamment votre sarrau et vos lunettes de sécurité. Assurez-vous de consulter la fiche signalétique de H2O2(aq), KI et catalase pour obtenir des informations pertinentes sur la santé et la sécurité, les premiers soins, la manipulation et l’élimination des déchets. Lorsque tu planifies ta procédure, assure-toi toujours que toutes les étapes sont sûres et respectent les directives de sécurité du laboratoire. Ton assistant technique vérifiera ta procédure avant que tu ne réalises ton expérience. Assurez-vous de ne pas confondre les réactifs – vérifiez l’étiquette de chaque réactif que vous ajoutez lorsque vous préparez le mélange. Points à considérer Assurez-vous de faire l’exercice préalable à l’expérience – il vous permettra de réviser vos connaissances en matière de cinétique chimique, de mieux comprendre votre tâche et vous donnera une bonne idée de la façon de planifier votre expérience. Dans votre rapport, veillez à bien détailler vos procédures expérimentales. Vous devrez fournir les données que vous avez recueillies, les analyser et discuter de vos résultats. Assurez-vous que vos conclusions répondent aux deux tâches qui vous ont été demandées. Les instructions expérimentales qui vous sont fournies sur Brightspace donnent une liste exhaustive de questions et d’éléments à prendre en compte lorsque vous planifiez votre expérience et avant de réaliser votre protocole de laboratoire. Assurez-vous de passer en revue et de couvrir ces points dans votre procédure expérimentale – cela vous aidera à mieux planifier votre expérience et vous permettra d’être bien préparé avant de venir au laboratoire. Référence Venkateswaran, R. Chimie générale – Manuel de laboratoire – CHM 1301/1311. |
Utilisé en cinétique chimique pour illustrer la progression et les diverses propriétés d'une réaction
Catalyseur présent dans la même phase que les réactifs
Catalyseur présent dans une phase différente de celle d'un ou de plusieurs réactifs (par exemple, en fournissant une surface sur laquelle une réaction peut se produire)