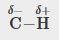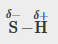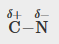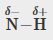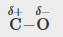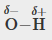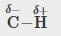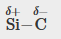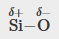9.3 – Les liaisons covalentes
La liaison ionique résulte de l’attraction électrostatique d’ions de charge opposée qui sont généralement produits par le transfert d’électrons entre des atomes métalliques et non–métalliques. Un autre type de liaison résulte de l’attraction mutuelle des atomes pour une paire « partagée » d’électrons. Ces liaisons sont appelées liaisons covalentes.
Les composés qui contiennent des liaisons covalentes présentent des propriétés physiques différentes de celles des composés ioniques. Comme l’attraction entre les molécules, qui sont électriquement neutres, est plus faible que celle entre les ions chargés électriquement, les composés covalents ont généralement des points de fusion et d’ébullition beaucoup plus bas que les composés ioniques. En fait, de nombreux composés covalents sont des liquides ou des gaz à température ambiante et, à l’état solide, ils sont généralement beaucoup plus mous que les solides ioniques. En outre, lorsque des composés ioniques sont dissous dans l’eau, ils produisent une solution aqueuse qui est un bon conducteur d’électricité (en raison de la dissociation des cations et des anions). En revanche, lorsque des composés covalents sont dissous dans l’eau, ils ont tendance à s’ioniser peu ou pas du tout, ce qui donne des solutions aqueuses de très faible conductivité. En tant que substances pures, étant donné qu’ils sont électriquement neutres, ils sont de mauvais conducteurs d’électricité, quel que soit leur état (liquide pur, solide ou gaz).
Formation des liaisons covalentes
Les atomes non–métalliques forment fréquemment des liaisons covalentes avec d’autres atomes non–métalliques. Par exemple, la molécule d’hydrogène, H2, contient une liaison covalente entre ses deux atomes d’hydrogène. La Figure 9.3.1 illustre la raison pour laquelle cette liaison est formée. En partant de l’extrême droite, nous avons deux atomes d’hydrogène distincts avec une énergie potentielle particulière, indiquée par la ligne rouge. L’axe des x représente la distance entre les deux atomes. Lorsque les deux atomes se rapprochent l’un de l’autre (en se déplaçant vers la gauche le long de l’axe des x), leurs orbitales atomiques commencent à se chevaucher. Les électrons célibataires de chaque atome d’hydrogène interagissent alors avec les deux noyaux atomiques, occupant l’espace autour des deux atomes. La forte attraction de chaque électron partagé vers les deux noyaux stabilise le système, et l’énergie potentielle diminue à mesure que la distance de liaison diminue. Si les atomes continuent à se rapprocher l’un de l’autre, les charges positives des deux noyaux commencent à se repousser, et l’énergie potentielle augmente. La longueur de la liaison est déterminée par la distance à laquelle l’énergie potentielle est la plus faible.
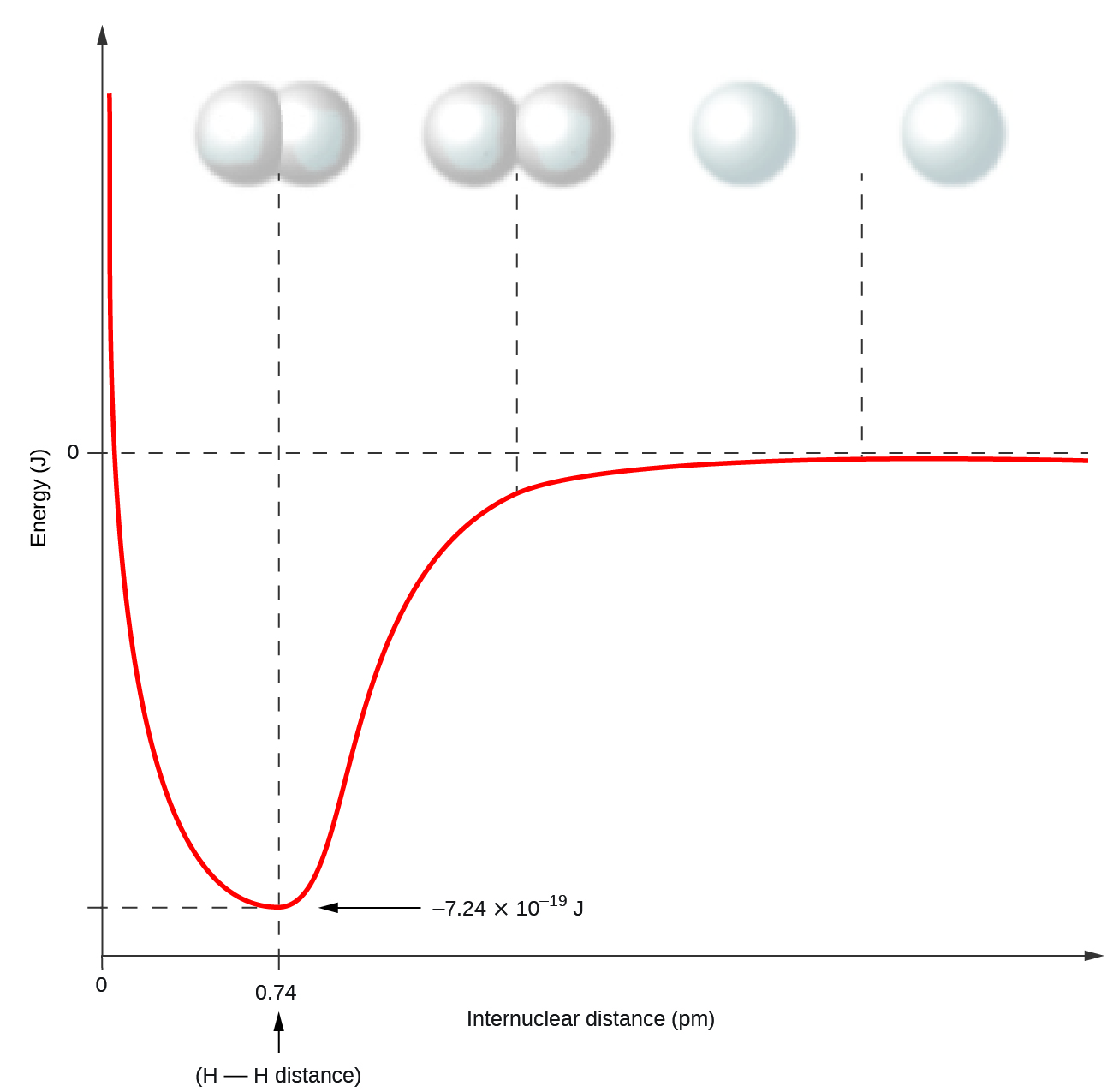
Figure 9.3.1. L’énergie potentielle de deux atomes d’hydrogène séparés (à droite) diminue lorsqu’ils se rapprochent l’un de l’autre, et les électrons uniques de chaque atome sont partagés pour former une liaison covalente. La longueur de la liaison est la distance internucléaire à laquelle l’énergie potentielle est la plus faible. Ces graphiques, où l’énergie potentielle est représentée en fonction de la distance internucléaire, sont connus sous le nom de courbes de Morse.
Il est essentiel de se rappeler qu’il faut ajouter de l’énergie pour briser les liaisons chimiques (processus endothermique), alors que la formation de liaisons chimiques libère de l’énergie (processus exothermique). Dans le cas de H2, la liaison covalente est très forte; une grande quantité d’énergie, 436 kJ, doit être ajoutée pour briser les liaisons dans une mole de molécules d’hydrogène et provoquer la séparation des atomes :
H2 (g) ⟶ 2H (g) ΔH = 436 kJ
Inversement, la même quantité d’énergie est libérée lorsqu’une mole de molécules de H2 se forme à partir de deux moles d’atomes de H :
2H (g) ⟶ H2 (g) ΔH = −436 kJ
Liaisons covalentes pures et polaires
Si les atomes qui forment une liaison covalente sont identiques, comme dans H2, Cl2 et d’autres molécules diatomiques, les électrons de la liaison doivent être partagés de manière égale. Nous appelons cela une liaison covalente pure (ou liaison covalente non-polaire). Les électrons partagés dans les liaisons covalentes pures ont une probabilité égale de se trouver près de chaque noyau.
Dans le cas de Cl2, chaque atome possède au départ sept électrons de valence, et chaque Cl partage un électron avec l’autre, formant ainsi une liaison covalente :
Cl + Cl → Cl2
Le nombre total d’électrons autour de chaque atome individuel se compose de six électrons non–liants et de deux électrons partagés (c’est-à-dire liants) pour un total de huit électrons, ce qui correspond au nombre d’électrons de valence du gaz noble argon. Comme les atomes de liaison sont identiques, Cl2 présente également une liaison covalente pure.
Lorsque les atomes liés par une liaison covalente sont d’éléments différents, les électrons de liaison peuvent encore être partagés, mais plus de manière égale. Au contraire, les électrons de liaison sont plus attirés par un atome que par l’autre, ce qui entraîne un déplacement de la densité électronique vers cet atome. Cette répartition inégale des électrons est connue sous le nom de liaison covalente polaire, caractérisée par une charge positive partielle sur un atome et une charge négative partielle sur l’autre. L’atome qui attire le plus fortement les électrons acquiert la charge négative partielle et vice versa. Par exemple, les électrons de la liaison H-Cl d’une molécule de chlorure d’hydrogène passent plus de temps près de l’atome de chlore que de l’atome d’hydrogène. Ainsi, dans une molécule de HCl, l’atome de chlore porte une charge négative partielle et l’atome d’hydrogène une charge positive partielle. La Figure 9.3.2 montre la distribution des électrons dans la liaison H-Cl. Notez que la zone ombragée autour de Cl est beaucoup plus grande que celle autour de H. Comparez ce résultat à celui de la Figure 9.3.1, qui montre la répartition uniforme des électrons dans la liaison non–polaire H2.
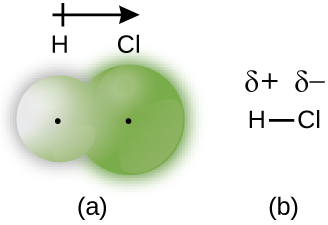
Figure 9.3.2. (a) La distribution de la densité électronique dans la molécule de HCl est inégale. La densité électronique est plus importante autour du noyau de chlore. Les petits points noirs indiquent l’emplacement des noyaux d’hydrogène et de chlore dans la molécule. (b) Les symboles δ+ et δ- indiquent la polarité de la liaison H-Cl.
Nous désignons parfois les atomes positifs et négatifs d’une liaison covalente polaire en utilisant la lettre grecque minuscule » delta « , δ, avec un signe plus ou moins pour indiquer si l’atome a une charge positive partielle (δ+) ou une charge négative partielle (δ-). Ce symbolisme est illustré pour la molécule H-Cl dans la Figure 9.3.2.
Électronégativité
Le caractère non–polaire ou polaire d’une liaison covalente est déterminé par une propriété des atomes liants appelée électronégativité. L’électronégativité (EN) est une mesure de la tendance d’un atome à attirer les électrons (ou densité électronique) vers lui. Elle détermine la façon dont les électrons partagés sont répartis entre les deux atomes d’une liaison. Plus un atome attire fortement les électrons dans ses liaisons, plus son électronégativité est grande. Les électrons d’une liaison covalente polaire sont déplacés vers l’atome le plus électronégatif; ainsi, l’atome le plus électronégatif est celui qui a la charge négative partielle. Plus la différence d’électronégativité est grande, plus la distribution des électrons est polarisée et plus les charges partielles des atomes sont importantes.
La Figure 9.3.4 montre les valeurs d’électronégativité des éléments telles que proposées par l’un des chimistes les plus célèbres du vingtième siècle: Linus Pauling (Figure 9.3.3). En général, l’électronégativité augmente de gauche à droite dans une période du tableau périodique et diminue dans un groupe. Ainsi, les non-métaux, qui se trouvent en haut à droite, ont tendance à avoir les électronégativités les plus élevées, le fluor étant l’élément le plus électronégatif de tous (EN = 4,0). Les métaux ont tendance à être des éléments moins électronégatifs, et les métaux du groupe 1 ont les électronégativités les plus faibles. Notez que les gaz nobles sont exclus de cette figure car ces atomes ne partagent généralement pas d’électrons avec d’autres atomes puisqu’ils ont une couche de valence rempli. (Bien que les composés de gaz nobles tels que XeO2 existent, ils ne peuvent être formés que dans des conditions extrêmes, et ne s’intègrent donc pas parfaitement au modèle général d’électronégativité).

Figure 9.3.3. Linus Pauling (1901-1994) a apporté de nombreuses contributions importantes au domaine de la chimie. Il était également un activiste de premier plan, faisant connaître les problèmes liés à la santé et aux armes nucléaires.
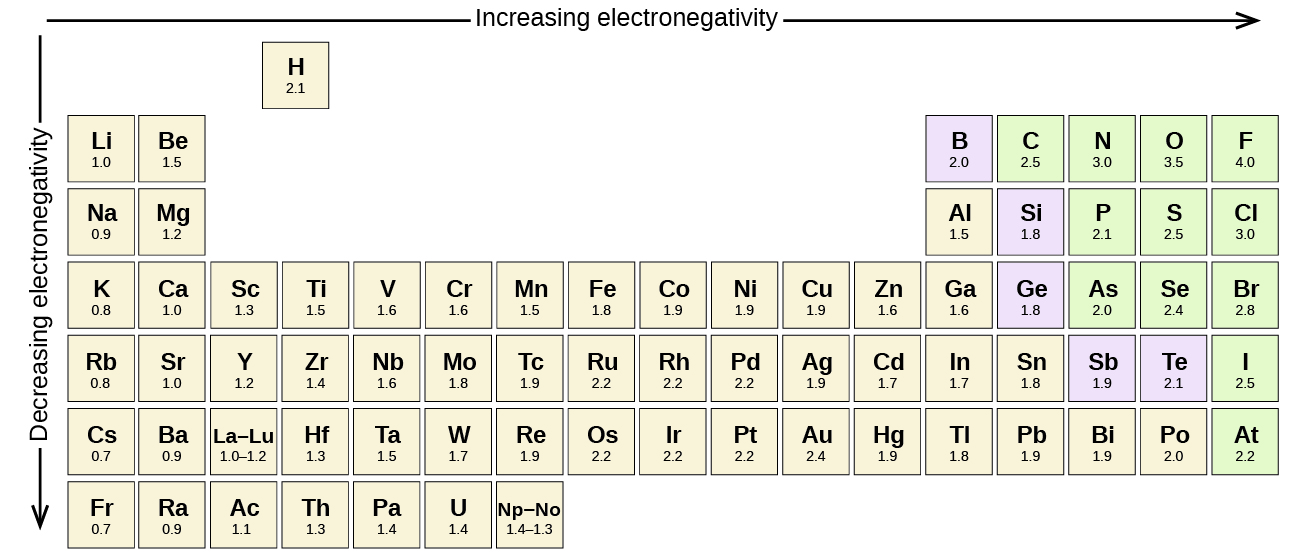
Figure 9.3.4. Les valeurs d’électronégativité dérivées par Pauling suivent des tendances périodiques prévisibles, les électronégativités les plus élevées se situant vers la partie supérieure droite du tableau périodique.
Électronégativité et affinité électronique
Il faut veiller à ne pas confondre électronégativité et affinité électronique. L’affinité électronique d’un élément est une quantité physique mesurable, à savoir l’énergie libérée ou absorbée lorsqu’un atome isolé en phase gazeuse acquiert un électron, mesurée en kJ/mol (ce point est abordé en détail dans la Section 8.7). L’électronégativité, quant à elle, décrit la force avec laquelle un atome attire les électrons dans une liaison. Il s’agit d’une quantité sans dimension qui est calculée et non mesurée. Pauling a obtenu les premières valeurs d’électronégativité en comparant les quantités d’énergie nécessaires pour rompre différents types de liaisons. Il a choisi une échelle relative arbitraire, avec des valeurs allant de 0 à 4. Vous pouvez rencontrer d’autres tableaux de valeurs d’électronégativité qui peuvent être légèrement différents de ceux dérivés par Pauling, en raison de différences dans la façon dont ces valeurs ont été déterminées. En général, cependant, les tendances périodiques décrites ci-dessus restent vraies, quelle que soit la façon dont les valeurs d’électronégativité sont définies.
Électronégativité et type de liaison
La valeur absolue de la différence d’électronégativité (ΔEN) de deux atomes liés donne une mesure approximative de la polarité à attendre dans la liaison et, par conséquent, du type de liaison. Lorsque la différence est très faible ou nulle, la liaison est covalente et non–polaire. Lorsqu’elle est importante, la liaison est polaire, covalente ou ionique. Les valeurs absolues des différences d’électronégativité entre les atomes dans les liaisons H-H, H-Cl et Na-Cl sont respectivement de 0 (non–polaire), 0,9 (covalente polaire) et 2,1 (ionique). Le degré de partage des électrons entre les atomes varie de complètement égal (liaison covalente pure) à pas du tout (liaison ionique). La Figure 9.3.5 montre la relation entre la différence d’électronégativité et le type de liaison.
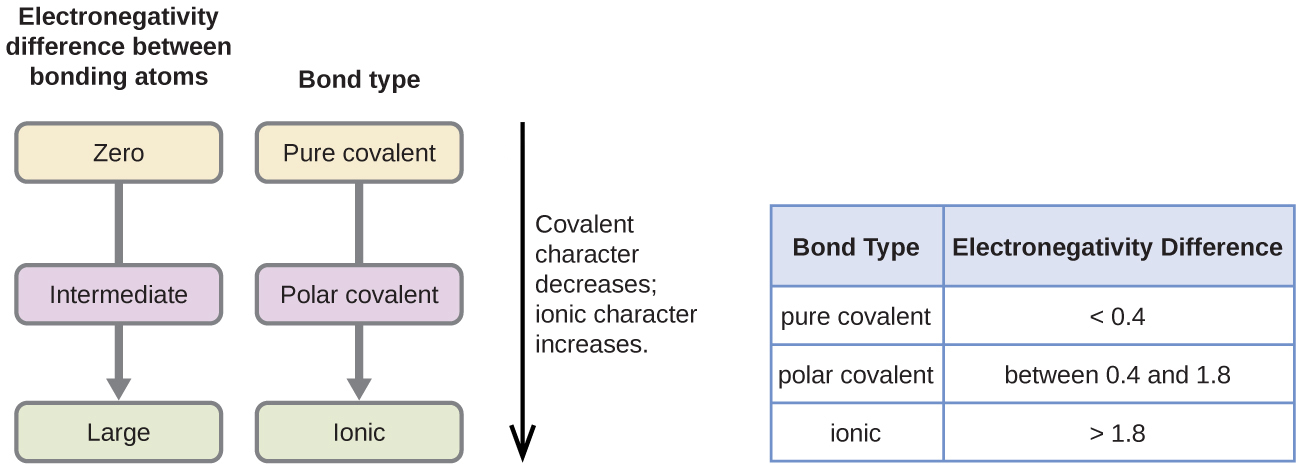
Figure 9.3.5. Lorsque la différence d’électronégativité augmente entre deux atomes, la liaison devient plus ionique.
La Figure 9.3.5 présente une approximation des différences d’électronégativité associées aux liaisons covalentes, covalentes polaires et ioniques. Il est important de noter que ce tableau n’est qu’un guide général pour déterminer le type de liaison entre les atomes – il existe de nombreuses exceptions. Par exemple, les atomes H et F de HF ont une différence d’électronégativité de 1,9, et les atomes N et H de NH3 une différence de 0,9, mais ces deux composés forment des liaisons considérées comme covalentes polaires. De même, les atomes Na et Cl de NaCl ont une différence d’électronégativité de 2,1, et les atomes Mn et I de MnI2 ont une différence de 1,0, mais ces deux substances forment des composés ioniques.
Par conséquent, gardez à l’esprit qu’en fin de compte, le meilleur guide pour déterminer le caractère covalent ou ionique d’une liaison est de considérer les types d’atomes impliqués et leurs positions relatives dans le tableau périodique. Les liaisons entre deux non-métaux sont généralement covalentes; les liaisons entre un métal et un non-métal sont souvent ioniques.
Exemple 9.3.1 – Électronégativité et polarité des liaisons
Les polarités des liaisons jouent un rôle important dans la détermination de la structure des protéines. À l’aide des valeurs d’électronégativité de la Figure 9.3.4, classez les liaisons covalentes suivantes – toutes couramment présentes dans les acides aminés – par ordre de polarité croissante. Désignez ensuite les atomes positifs et négatifs à l’aide des symboles δ+ et δ- :
C-H, C-N, C-O, N-H, O-H, S-H
Solution
La polarité de ces liaisons augmente à mesure que la valeur absolue de la différence d’électronégativité augmente. L’atome avec la désignation δ- est le plus électronégatif des deux. Le tableau ci-dessous présente ces liaisons par ordre de polarité croissante.
|
Différence de polarité et d’électronégativité des liaisons |
||
|
Liaison |
ΔEN |
Polarité |
|
C-H |
0,4 |
|
|
S-H |
0,4 |
|
|
C-N |
0,5 |
|
|
N-H |
0,9 |
|
|
C-O |
1,0 |
|
|
O-H |
1,4 |
|
Tableau 9.3.1 Différence de polarité et d’électronégativité des liaisons
Vérifiez votre apprentissage 8.3.1 – Électronégativité et polarité des liaisons
Les silicones sont des composés polymère contenant, entre autres, les types de liaisons covalentes suivants : Si-O, Si-C, C-H et C-C. En utilisant les valeurs d’électronégativité de la Figure 9.3.4, classez les liaisons par ordre de polarité croissante et désignez les atomes positifs et négatifs à l’aide des symboles δ+ et δ-.
Réponse :
|
Liaison |
Différence d’électronégativité |
Polarité |
|
C-C |
0,0 |
Non–polaire |
|
C-H |
0,4 |
|
|
Si-C |
0,7 |
|
|
Si-O |
1,7 |
|
La force des liaisons : Liaisons covalentes
Les molécules stables existent parce que des liaisons covalentes maintiennent les atomes ensemble. Nous mesurons la force d’une liaison covalente par l’énergie nécessaire pour la briser, c’est-à-dire l’énergie nécessaire pour séparer les atomes liés. La séparation de toute paire d’atomes liés nécessite de l’énergie (voir la discussion précédente sur la « Formation des liaisons covalentes »). Plus une liaison est forte, plus l’énergie nécessaire à sa rupture est importante.
L’énergie requise pour briser une liaison covalente spécifique dans une mole de molécules gazeuses est appelée énergie de liaison ou énergie de dissociation de liaison (EDL). L’énergie de liaison pour une molécule diatomique, DX-Y, est définie comme le changement d’enthalpie standard pour la réaction endothermique :
XY (g) → X (g) + Y (g) DX – y = ΔH∘
Par exemple, l’énergie de liaison de la liaison H-H covalente pure, DH-H, est de 436 kJ par mole de liaisons H-H brisées :
Les molécules comportant trois atomes ou plus ont deux liaisons ou plus. La somme de toutes les énergies de liaison dans une telle molécule est égale au changement d’enthalpie standard de la réaction endothermique qui brise toutes les liaisons de la molécule. Par exemple, la somme des énergies des quatre liaisons C-H dans CH4, 1660 kJ, est égale au changement d’enthalpie standard de la réaction :
CH4 (g) → C (g) + 4H (g) ΔH° = 1660kJ
L’énergie moyenne de la liaison C-H, DC-H, est de 1660/4 = 415 kJ/mol car il y a quatre moles de liaisons C-H brisées par mole de la réaction. Bien que les quatre liaisons C-H soient équivalentes dans la molécule d’origine, elles ne nécessitent pas toutes la même énergie pour être brisées; une fois la première liaison brisée (qui nécessite 439 kJ/mol), les autres liaisons sont plus faciles à briser. La valeur de 415 kJ/mol est l’énergie moyenne des liaisons, et non la valeur exacte requise pour briser une liaison donnée.
La force d’une liaison entre deux atomes augmente lorsque le nombre de paires d’électrons dans la liaison augmente. En général, lorsque la force de la liaison augmente, la longueur de la liaison diminue. Ainsi, on constate que les liaisons triples sont plus fortes et plus courtes que les liaisons doubles entre les deux mêmes atomes; de même, les liaisons doubles sont plus fortes et plus courtes que les liaisons simples entre les deux mêmes atomes. Les énergies de liaison moyennes pour certaines liaisons courantes, avec une comparaison des longueurs et des forces de liaison, figurent dans le tableau ci-dessous. Lorsqu’un atome se lie à plusieurs atomes d’un groupe, la force de la liaison diminue généralement à mesure que l’on descend dans le groupe. Par exemple, C-F est de 439 kJ/mol, C-Cl de 330 kJ/mol et C-Br de 275 kJ/mol.
|
Longueurs et énergies moyennes des liaisons pour certaines liaisons courantes |
||
|
Liaison |
Longueur de la liaison (Å) |
Énergie de liaison (kJ/mol) |
|
C-C |
1,54 |
345 |
|
C=C |
1,34 |
611 |
|
C≡C |
1,20 |
837 |
|
C-N |
1,43 |
290 |
|
C=N |
1,38 |
615 |
|
C≡N |
1,16 |
891 |
|
C-O |
1,43 |
350 |
|
C=O |
1,23 |
741 |
|
C≡O |
1,13 |
1080 |
Tableau 9.3.2 Longueurs et énergies de liaison moyennes pour certaines liaisons courantes
★ Questions
1. Quelles informations pouvez-vous utiliser pour prédire si une liaison entre deux atomes est covalente ou ionique?
2. Prédire lesquels des composés suivants sont ioniques et lesquels sont covalents, en fonction de l’emplacement de leurs atomes constitutifs dans le tableau périodique:
a) Cl2CO
b) MnO
c) NCl3
d) CoBr2
e) K2S
d) CO
f) CaF2
g) HI
h) CaO
i) IBr
j) CO2
3. D’après sa position dans le tableau périodique, déterminez quel atome de chaque paire est le plus électronégatif:
a) Br or Cl
b) N or O
c) S or O
d) P or S
e) Si or N
f) Ba or P
g) N or K
4. À partir de leur position dans le tableau périodique, classez les atomes de chacune des séries suivantes par ordre d’électronégativité croissante:
a) C, F, H, N, O
b) Br, Cl, F, H, I
c) F, H, O, P, S
d) Al, H, Na, O, P
e) Ba, H, N, O, As
5. Quels atomes peuvent se lier au soufre de manière à produire une charge partielle positive sur l’atome de soufre?
6. Identifiez la liaison la plus polaire dans chacune des paires de liaisons suivantes:
a) HF or HCl
b) NO or CO
c) SH or OH
d) PCl or SCl
e) CH or NH
f) SO or PO
g) CN or NN
7. Quelle est la liaison la plus forte dans chacune des paires de liaisons suivantes?
a) C–C or C=C
b) C–N or C≡N
c) C≡O or C=O
d) H–F or H–Cl
e) C–H or O–H
f) C–N or C–O
8. En utilisant les données d’enthalpie standard de formation de l’annexe, montrez comment l’enthalpie standard de formation de HCl(g) peut être utilisée pour déterminer l’énergie de liaison (en kJ).
9. En utilisant les données d’enthalpie standard de formation en annexe, déterminez quelle liaison est la plus forte : la liaison S-F dans SF4(g) ou dans SF6(g)?
10. Complétez la structure de Lewis suivante en ajoutant les liaisons (et non les atomes), puis indiquez la liaison la plus longue:

Réponses
1. Les indices qui peuvent être utilisés pour déterminer si une molécule est ionique ou covalente comprennent l’emplacement des éléments et la différence d’électronégativité. Plus les molécules sont éloignées les unes des autres, plus la différence d’électronégativité sera élevée, ce qui indique le caractère de la liaison. De même, le calcul de la différence d’électronégativité indique si le comportement de la molécule est ionique ou covalent. Plus la valeur est élevée, plus la liaison est ionique et plus les valeurs sont faibles, plus la liaison est covalente.
2. Ionique: (b), (d), (e), (g), et (i); covalent: (a), (c), (f), (h), (j) et (k).
3. (a) Cl; (b) O; (c) O; (d) S; (e) N; (f) P; (g) N
4. (a) H, C, N, O, F; (b) H, I, Br, Cl, F; (c) H, P, S, O, F; (d) Na, Al, H, P, O; (e) Ba, H, As, N, O
5. N, O, F et Cl
6. (a) HF; (b) CO; (c) OH; (d) PCl; (e) NH; (f) PO; (g) CN
7. (a) C=C; (b) C≡N; (c) C≡O; (d) H-F; (e) O-H; (f) C-O
8.
HCl (g) → 12H2 (g) +12Cl2 (g) ΔH1° = -ΔH° f[HCl(g)]
12H2 (g) → H (g) ΔH2° = ΔH° f[H(g)]
12Cl2 (g) → Cl (g) ΔH3° = -ΔH° 1[Cll(g)]
HCl (g) → H (g) + Cl (g) ΔH°298 = ΔH1° + ΔH2° + ΔH3°
DHCl = ΔH°298 = ΔH°f[HCl(g)] + ΔH°f[Cl(g)]
= -(-92.307 kJ) + 217.97 kJ + 121.3 kJ
= 431.6 kJ
9. La liaison S-F dans le SF4 est plus forte.
10. Les liaisons simples C-C sont les plus longues.
Liaison covalente entre des atomes d'électronégativités identiques
Liaison covalente entre des atomes d'électronégativités identiques
Liaison covalente entre différents atomes de différentes électronégativités, qui provoque un déséquilibre de la distribution des électrons ; une liaison covalente avec une extrémité partiellement positive et une extrémité partiellement négative
Tendance relative d'un atome à attirer les électrons dans une liaison avec lui-même
Énergie nécessaire pour rompre une liaison covalente dans une substance gazeuse
Énergie nécessaire pour rompre une liaison covalente dans une substance gazeuse