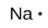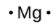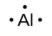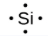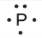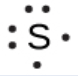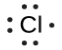9.1 – Propriétés atomiques des liaisons chimiques
Pourquoi certaines substances sont-elles des molécules chimiquement liées et d’autres une association d’ions ? La réponse à cette question dépend des structures électroniques des atomes et de la nature des forces chimiques au sein des composés – le sujet de discussion de ce chapitre.
Types de liaisons chimiques
Bien qu’il n’existe pas de frontières bien définies, les liaisons chimiques sont généralement classées en trois types principaux : les liaisons ioniques, les liaisons covalentes et les liaisons métalliques. Dans ce chapitre, chaque type de liaison sera abordé, ainsi que les propriétés générales que l’on retrouve dans les substances typiques dans lesquelles chaque type de liaison apparaît.
Les liaisons ioniques résultent des forces électrostatiques qui existent entre des ions de charge opposée. Ces liaisons impliquent généralement la liaison d’un atome métallique avec un atome non–métallique.
Les liaisons covalentes résultent du partage des électrons entre deux atomes. Ces liaisons impliquent généralement qu’un élément non–métallique se lie à un autre.
Les liaisons métalliques se trouvent dans les métaux solides (cuivre, fer, aluminium), où les atomes métalliques forment une structure en treillis et où les électrons de liaison sont libres de se déplacer dans la structure tridimensionnelle.
Dans ce texte, les liaisons ioniques sont traitées dans la Section 9.2 tandis que les liaisons covalentes sont expliquées dans la Section 9.3. Cependant, les liaisons métalliques seront abordées plus en détail dans vos futurs cours de chimie (tels que le cours CHM2353 : Chimie Inorganique Descriptive) et ne seront donc pas traitées dans ce livre.
Structures de Lewis
Au début du 20e siècle, le chimiste américain G. N. Lewis (1875-1946) a conçu un système de symboles – aujourd’hui appelés structures de points d'électrons de Lewis (souvent abrégés en structures de Lewis) – qui peut être utilisé pour prédire le nombre de liaisons formées par la plupart des éléments dans leurs composés. Chaque structure de Lewis est constituée du symbole chimique d’un élément entouré de points qui représentent ses électrons de valence.
Les structures de Lewis :
sont une représentation pratique des électrons de valence
vous permettent de suivre les électrons de valence pendant la formation des liaisons
sont constitués du symbole chimique de l’élément et un point pour chaque électron de valence
Pour écrire la structure de Lewis d’un élément, nous plaçons les points représentant ses électrons de valence, un par un, autour du symbole chimique de l’élément. Jusqu’à quatre points sont placés au-dessus, au-dessous, à gauche et à droite du symbole (dans n’importe quel ordre, à condition que les éléments ayant quatre électrons de valence ou moins n’aient pas plus d’un point dans chaque position). Les points suivants, pour les éléments ayant plus de quatre électrons de valence, sont également distribués un par un, chacun étant associé à l’un des quatre premiers. Par exemple, la configuration électronique du soufre atomique est [Ne]3s23p4, il y a donc six électrons de valence. Sa structure de Lewis serait donc :
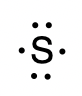
Le fluor, par exemple, avec la configuration électronique [He]2s22p5, possède sept électrons de valence, de sorte que sa structure de Lewis est construite comme suit :
Le nombre de points dans la structure de Lewis est le même que le nombre d’électrons de valence, qui est le même que le dernier chiffre du numéro de groupe de l’élément dans le tableau périodique. Les structures de Lewis des éléments de la période 3 sont donnés à la Figure 9.1.1. ![]()
Lewis a utilisé les points non-liants pour prédire le nombre de liaisons qu’un élément formera dans un composé. Considérez la structure du phosphore de la Figure 9.1.1. La structure de Lewis explique pourquoi le phosphore, qui possède trois électrons de valence non-liés, a tendance à former des composés dans lesquels il partage les électrons non-liés pour former trois liaisons. L’aluminium, dont la structure de Lewis comporte également trois électrons de valence non-liés, a également tendance à former des composés à trois liaisons, tandis que le silicium, dont la structure de Lewis comporte quatre électrons de valence non-liés, a tendance à partager tous ses électrons de valence non-liés en formant des composés à quatre liaisons.
|
Atomes |
Configuration des électrons |
Lewis Symbol |
|
sodium |
[Ne] 3s1 |
|
|
magnésium |
[Ne] 3s2 |
|
|
aluminium |
[Ne] 3s2 3p1 |
|
|
silicium |
[Ne] 3s2 3p2 |
|
|
phosphore |
[Ne] 3s2 3p3 |
|
|
soufre |
[Ne] 3s2 3p4 |
|
|
chlore |
[Ne] 3s2 3p5 |
|
|
argon |
[Ne] 3s2 3p6 |
|
Figure 9.1.1. Structures de Lewis illustrant le nombre d’électrons de valence pour chaque élément de la troisième période du tableau périodique.
Symbole d'un élément ou d'un ion monoatomique qui utilise un point pour représenter chaque électron de valence dans l'élément ou l'ion
Symbole d'un élément ou d'un ion monoatomique qui utilise un point pour représenter chaque électron de valence dans l'élément ou l'ion