5.6 – Acides et bases de Lewis
Remarque : la théorie de Brønsted-Lowry est suffisamment précise pour couvrir les concepts acide-base introduits dans le CHM1711. Cependant, dans le contexte de la chimie organique, la théorie de Lewis du comportement acido-basique est beaucoup plus appropriée, et sera donc examinée plus en détail dans le document CHM 1721. La description de la théorie est incluse ici pour être complétée, en tant que matériel supplémentaire.
En 1923, G. N. Lewis a proposé une définition généralisée du comportement acido-basique dans laquelle les acides et les bases sont identifiés par leur capacité à accepter ou à donner une paire d’électrons et à former une liaison covalente coordonnée.
Une liaison covalente coordonnée (ou liaison dative) se produit lorsque l’un des atomes de la liaison fournit les deux électrons de liaison. Par exemple, une liaison covalente coordonnée se produit lorsqu’une molécule d’eau se combine avec un proton pour former un ion hydronium. Une liaison covalente coordonnée se produit également lorsqu’une molécule d’ammoniac se combine avec un proton pour former un ion ammonium. Ces deux équations sont illustrées ici, les liaisons covalentes coordonnées étant constituées de deux électrons chacune indiquées en rouge.
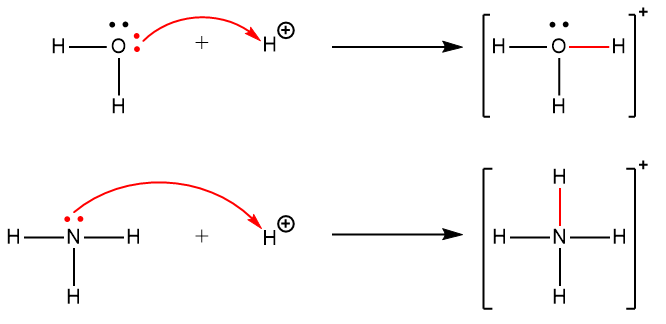
Les réactions impliquant la formation de liaisons covalentes coordonnées sont classées comme des réactions chimiques acide-base de Lewis.
Un acide de Lewis est toute espèce (molécule ou ion) qui peut accepter une paire d’électrons, et une base de Lewis est toute espèce (molécule ou ion) qui peut donner une paire d’électrons.
Une réaction de Lewis acide-base se produit lorsqu’une base donne une paire d’électrons à un acide. Dans de nombreuses réactions acide-base de Lewis, un adduit acide-base de Lewis, un composé qui contient une liaison covalente coordonnée entre l’acide de Lewis et la base de Lewis, est formé.
Exemple 5.6.1 – Identification des acides et bases de Lewis
Identifier l’acide et la base dans chaque réaction de Lewis acide-base.
(a) BH3 + (CH3)2S → H3B:S(CH3)2
(b) CaO + CO2 → CaCO3
(c) BeCl2 + 2 Cl− → BeCl42−
Solution
(a) Dans BH3, le bore ne possède que six électrons de valence. Il est donc déficient en électrons et peut accepter une seule paire. Comme l’oxygène, l’atome de soufre dans (CH3)2S a deux paires isolées. Ainsi, (CH3)2S donne une paire d’électrons sur le soufre à l’atome de bore de BH3. La base de Lewis est (CH3)2S, et l’acide de Lewis est BH3.
(b) L’oxygène du CaO est un donneur de paires d’électrons, le CaO est donc la base de Lewis. Le carbone accepte une paire d’électrons, donc le CO2 est l’acide de Lewis.
(c) L’ion chlorure contient quatre paires isolées. Dans cette réaction, chaque ion chlorure donne une paire isolée à BeCl2, qui ne possède que quatre électrons autour de Be. Ainsi, les ions chlorure sont des bases de Lewis, et BeCl2 est l’acide de Lewis.
Vérifiez votre apprentissage 5.6.1 – Identification des acides et bases de Lewis
Identifier l’acide et la base dans chaque réaction de Lewis acide-base.
(a) (CH3)2O + BF3 → (CH3)2O:BF3
(b) H2O + SO3 → H2SO4
Réponse
(a) Base de Lewis : (CH3)2O ; acide de Lewis : BF3 ; (b) Base de Lewis : H2O ; Acide de Lewis : SO3
Les équations suivantes illustrent l’application générale du concept de Lewis et des structures de Lewis. Les structures de Lewis sont couvertes en détail dans la section sur les liaisons moléculaires, section 9.1, mais pour l’instant, tout ce que vous devez savoir, c’est que les atomes sont indiqués par leur symbole élémentaire, les lignes les reliant au sein des molécules représentant des liaisons covalentes. Les points entourant les symboles élémentaires représentent des paires d’électrons isolés. Pour vous aider à comprendre, nous allons afficher visuellement les liaisons covalentes et les électrons qui les forment en rouge.
L’atome de bore dans le trifluorure de bore, BF3, ne possède que six électrons dans sa couche de valence. Comme l’atome de bore a un octet incomplet, il peut se comporter comme un accepteur de paires d’électrons. Par conséquent, le BF3 est un très bon acide de Lewis et réagit avec de nombreuses bases de Lewis ; un ion fluorure est la base de Lewis dans cette réaction, donnant une de ses paires isolées :
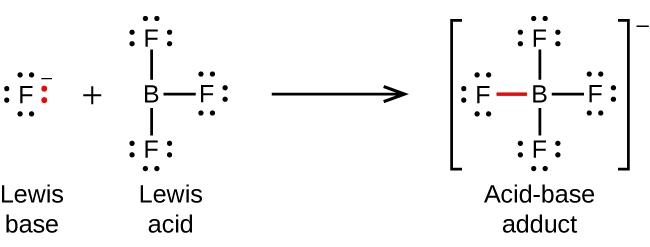
Notez la charge négative sur l’adduct – puisque la somme des charges du côté gauche de l’équation est -1, la somme des charges du côté droit doit également être -1.
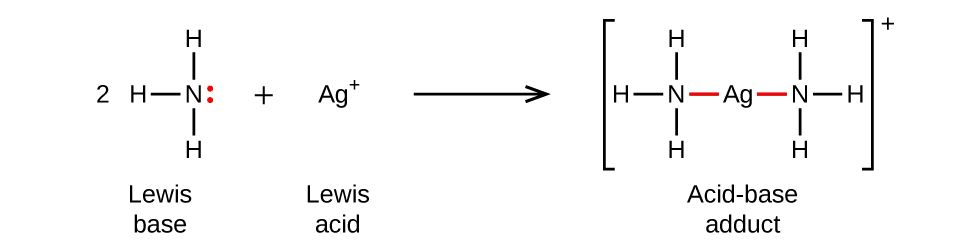
Dans la réaction suivante, chacune des deux molécules d’ammoniac, les bases de Lewis, donne une paire d’électrons à un ion d’argent chargé positivement, l’acide de Lewis. Notez une fois de plus que la somme des charges du côté gauche est de +1, donc l’adduit acide-base du côté droit doit porter une charge de +1 :
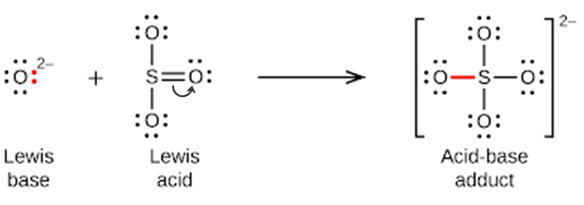
Les oxydes non métalliques agissent comme des acides de Lewis et réagissent avec des ions d’oxyde, les bases de Lewis, pour former des oxyanions :
De nombreuses réactions acide-base de Lewis sont des réactions de déplacement dans lesquelles une base de Lewis déplace une autre base de Lewis d’un produit d’addition acide-base, ou dans lesquelles un acide de Lewis déplace un autre acide de Lewis :
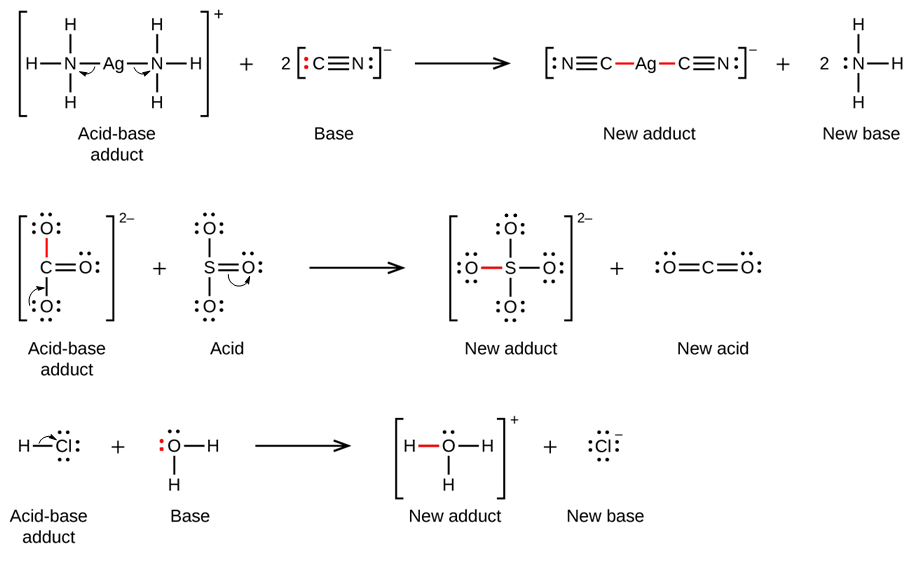
La dernière réaction de déplacement montre comment la réaction d’un acide de Brønsted-Lowry avec une base s’inscrit dans le concept de Lewis. Un acide de Brønsted-Lowry tel que le HCl est un produit d’addition acide-base selon le concept de Lewis, et le transfert de protons se produit parce qu’un produit d’addition acide-base plus stable est formé. Ainsi, bien que les définitions des acides et des bases dans les deux théories soient très différentes, les théories se chevauchent considérablement.
De nombreux solides ioniques légèrement solubles se dissolvent lorsque la concentration de l’ion métallique en solution est diminuée par la formation d’ions complexes (polyatomiques) dans une réaction de Lewis acide-base. Par exemple, le chlorure d’argent se dissout dans une solution d’ammoniac parce que l’ion argent réagit avec l’ammoniac pour former l’ion complexe Ag(NH3)2+. La structure de Lewis de l’ion Ag(NH3)2+ est la suivante
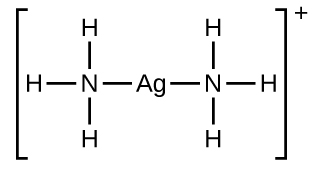
Les équations pour la dissolution de l’AgCl dans une solution de NH3 sont les suivantes :
AgCl (s) ⇌ Ag+ (aq) + Cl− (aq)
Ag+ (aq) + 2NH3 (aq) ⇌ Ag(NH3)2− (aq)
Net: AgCl (s) + Ag+ (aq) + 2NH3 (aq) ⇌ Ag(NH3)2+ (aq) + Ag+ (aq) + Cl− (aq)
Net: AgCl (s) + 2NH3 (aq) ⇌ Ag(NH3)2+ (aq) + Cl− (aq)
L’hydroxyde d’aluminium se dissout dans une solution d’hydroxyde de sodium ou d’une autre base forte en raison de la formation de l’ion complexe Al(OH)4-. La structure de Lewis de l’ion Al(OH)4- est la suivante
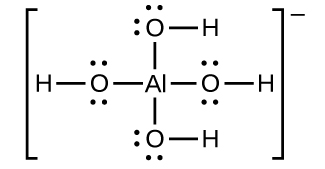
Les équations pour la dissolution sont :
Al(OH)3 (s) ⇌ Al3+ (aq) + 3OH– (aq)
Al3+ (aq) + 4OH– (aq) ⇌ Al(OH)4– (aq)
Net: Al(OH)3 (s) + Al3+ (aq) + 3OH– (aq) + OH– (aq) ⇌ Al(OH)4– (aq) + Al3+ (aq) + 3OH– (aq)
Net: Al(OH)3 (s) + OH– (aq) ⇌ Al(OH)4– (aq)
Le sulfure de mercure(II) se dissout dans une solution de sulfure de sodium parce que le HgS réagit avec l’ion S2- :
HgS (s) ⇌ Hg2+ (aq) + S2- (aq)
Hg2+ (aq) + 2S2- (aq) ⇌ HgS22- (aq)
Net: HgS (s) + S2- (aq) + S2- (aq) + Hg2+ ⇌ HgS22- (aq) + S2- (aq) + Hg2+
Net: HgS (s) + S2- (aq) ⇌ HgS22- (aq)
Un ion complexe est constitué d’un atome central, généralement un cation de métal de transition, entouré d’ions ou de molécules appelés ligands. Ces ligands peuvent être des molécules neutres comme H2O ou NH3, ou des ions comme CN- ou OH-. Habituellement, les ligands agissent comme des bases de Lewis, en donnant une paire d’électrons à l’atome central. Les ligands forment des liaisons avec l’atome ou l’ion central, créant ainsi un nouvel ion dont la charge est égale à la somme des charges des ligands et de l’atome ou de l’ion central. Cet arrangement plus complexe est la raison pour laquelle l’ion résultant est appelé un ion complexe. L’ion complexe formé lors de ces réactions ne peut être prédit ; il doit être déterminé expérimentalement. Les types de liaisons formées dans les ions complexes sont des liaisons covalentes coordonnées, car les électrons des ligands sont partagés avec l’atome central. C’est pourquoi les ions complexes sont parfois appelés complexes de coordination.
La constante d’équilibre pour la réaction des composants d’un ion complexe pour former l’ion complexe en solution est appelée constante de formation (Kf) (parfois appelée constante de stabilité). Par exemple, l’ion complexe Cu(CN)2- est représenté ici :
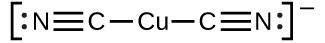
Elle se forme par la réaction :
Cu+ (aq) + 2 CN– (aq) ⇌ Cu(CN)2– (aq)
A l’équilibre :
Kf=[Cu(CN)2-]/([Cu+][CN–]2)
L’inverse de la constante de formation est la constante de dissociation (Kd), la constante d’équilibre pour la décomposition d’un ion complexe en ses composants en solution. L’annexe J et le tableau ci-dessous présentent une série de constantes de formation. En général, plus la constante de formation est grande, plus le complexe est stable.
|
Ions complexes communs par diminution des constantes de formation |
|
|
Substance |
Kf à 25°C |
|
AlF63- |
7 × 1019 |
|
Ag(NH3)2+ |
1.7 × 107 |
|
Cd(CN)42- |
3 × 1018 |
Comme exemple de dissolution par formation d’ions complexes, considérons ce qui se passe lorsque nous ajoutons de l’ammoniac aqueux à un mélange de chlorure d’argent et d’eau. Le chlorure d’argent se dissout légèrement dans l’eau, ce qui donne une petite concentration de Ag+ ([Ag+] = 1,3 × 10-5 M) :
AgCl (s) ⇌ Ag+ (aq) + Cl– (aq)
Cependant, si NH3 est présent dans l’eau, l’ion complexe, Ag(NH3)2+, peut se former selon l’équation :
Ag+ (aq) + 2NH3 (aq) ⇌ Ag(NH3)2+ (aq)
avec
Kf=[Ag(NH3)2+(aq)]/([Ag+][NH3]2)=1.7×107
La grande taille de cette constante de formation indique que la plupart des ions argent libres produits par la dissolution de AgCl se combinent avec NH3 pour former Ag(NH3)2+. En conséquence, la concentration des ions argent, [Ag+], est réduite, et le quotient de réaction pour la dissolution du chlorure d’argent, [Ag+][Cl–], tombe en dessous du produit de solubilité de AgCl :
Q=[Ag+][Cl–]<Ksp
Plus de chlorure d’argent se dissout alors. Si la concentration d’ammoniac est suffisamment élevée, tout le chlorure d’argent se dissout.
Exemple 5.6.2 – Dissociation d’un ion complexe
Calculer la concentration de l’ion argent dans une solution qui est initialement de 0,10 M Ag(NH3)2+.
Solution
Nous utilisons la voie habituelle pour résoudre ce problème :
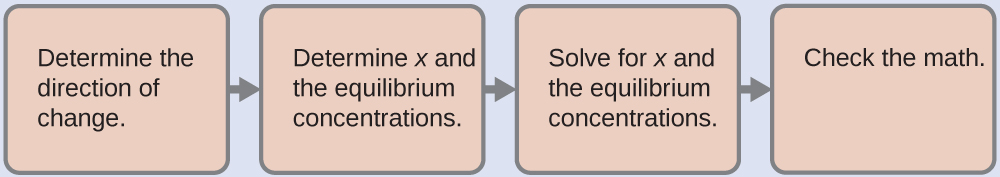
1. Déterminer la direction du changement. L’ion complexe Ag(NH3)2+ est en équilibre avec ses composants, tel que représenté par l’équation :
Ag+(aq) + 2NH3(aq) ⇌ Ag(NH3)2+(aq) Kf = 1.7 × 107
Nous écrivons l’équilibre comme une réaction de formation car l’annexe J énumère les constantes de formation pour les ions complexes. Au départ, seul l’ion complexe est présent ([Ag+] = 0 et [NH3] = 0), Q > Kf, et donc la réaction se déplace vers la gauche (vers les réactifs) pour atteindre l’équilibre.
2. Déterminer x et les concentrations d’équilibre. On laisse le changement de concentration de Ag+ être x. La dissociation de 1 mole de Ag(NH3)2+ donne 1 mole de Ag+ et 2 moles de NH3, donc le changement de [NH3] est 2x et celui de Ag(NH3)2+ est -x. En résumé :
Ag+ + 2NH3⇌ Ag(NH3)2+
|
Concentration initiale (M) |
0 |
0 |
0.10 |
|
Changement (M) |
+x |
+2x |
-x |
|
Concentration à l’équilibre (M) |
0 + x |
0 + 2x |
0.10 – x |
3. Rechercher x et les concentrations d’équilibre. A l’équilibre :
Kf=[Ag(NH3)2+(aq)]/([Ag+][NH3]2)
1.7×107 = (0.10-x)/((x)(2x)2)
Comme le Kf est très grand, nous savons qu’il s’agit d’une réaction fortement favorisée par le produit, et donc qu’une très petite partie du complexe se dissociera en ions séparés. Par conséquent, supposons que les changements de concentrations nécessaires pour atteindre l’équilibre sont faibles. Ainsi, 0,10 – x est approximé comme 0,10 pour simplifier nos calculs :
1.7×107= (0.10-x)/((x)(2x)2)
x3 = 0.104(1.7×107)=1.5×10-9
x3 * sqrt(1.5×10-9)=1.1×10-3
En vérifiant l’hypothèse que nous avons faite, nous constatons que seulement 1,1% de l’Ag(NH3)2+ se dissocie en Ag+ et NH3, et donc l’hypothèse que x est petit est justifiée.
Maintenant, nous déterminons les concentrations d’équilibre :
[Ag+]=0+x=1.1×10-3M
[NH3]=0+2x=2.2×10-3M
[Ag(NH3)2+]=0.10-x=0.10-0.0011=0.099
La concentration d’ions argent libres dans la solution est de 0,0011 M.
4. Vérifiez le travail. La valeur de Q calculée à l’aide des concentrations d’équilibre est égale à Kf dans les limites de l’erreur associée aux chiffres significatifs du calcul.
Vérifiez votre apprentissage 5.6.2 – Dissociation d’un ion complexe
Calculez la concentration en ions argent [Ag+] d’une solution préparée en dissolvant 1,00 g de AgNO3 et 10,0 g de KCN dans suffisamment d’eau pour obtenir 1,00 L de solution. (Conseil : Puisque Q < Kf, supposez que la réaction se termine puis calculez la concentration en [Ag+] produite par la dissociation du complexe).
Réponse
2.5 × 10–22 M
Questions
★ Questions
- Dans quelles circonstances, le cas échéant, un échantillon d’AgCl solide se dissout complètement dans l’eau pure ?
- Expliquez pourquoi l’ajout de NH3 ou de HNO3 à une solution saturée de Ag2CO3 en contact avec le solide Ag2CO3 augmente la solubilité du solide.
- Calculer la concentration en ions cadmium (g • mol-1), [Cd2+], dans une solution préparée en mélangeant 0,100 L de 0,0100 M Cd(NO3)2 avec 1,150 L de 0,100 NH3(aq).
- Expliquez pourquoi l’ajout de NH3 ou de HNO3 à une solution saturée de Cu(OH)2 en contact avec le Cu(OH)2 solide augmente la solubilité du solide.
- Parfois, les équilibres des ions complexes sont décrits en termes de constantes de dissociation, Kd. Pour l’ion complexe AlF63- la réaction de dissociation est :
AlF63- ⇌ Al3+ + 6F- et
Calculer la valeur de la constante de formation, Kf, pour AlF63-.
6. En utilisant la constante de dissociation, Kd = 7,8 × 10-18, calculer les concentrations d’équilibre (g • mol-1) de Cd2+ et CN– dans une solution de Cd(CN)42- à 0,250 M.
7. En utilisant la constante de dissociation, Kd = 2,2 × 10-34, calculer les concentrations d’équilibre (g • mol-1) de Co3+ et de NH3 dans une solution de Co(NH3)63+ à 0,500 M
8. Calculer la masse d’ion cyanure de potassium (en grammes) qui doit être ajoutée à 100 ml de solution pour dissoudre 2,0 × 10-2 mol de cyanure d’argent, AgCN.
★★ Questions
9. Un rouleau de film photographique noir et blanc de 35 mm contient environ 0,27 g d’AgBr non exposé avant le développement. Quelle masse (en grammes) de Na2S2O3·5H2O (thiosulfate de sodium pentahydraté ou hypo) dans 1,0 L de révélateur est nécessaire pour dissoudre l’AgBr sous forme d’Ag(S2O3)23- (Kf = 4,7 ×1013) ?
10. Nous avons vu une définition introductive d’un acide : Un acide est un composé qui réagit avec l’eau et augmente la quantité d’ions hydronium présents. Dans le chapitre sur les acides et les bases, nous avons vu deux autres définitions des acides : un composé qui donne un proton (un ion hydrogène, H+) à un autre composé est appelé un acide de Brønsted-Lowry, et un acide de Lewis est toute espèce qui peut accepter une paire d’électrons. Expliquez pourquoi la définition d’introduction est une définition macroscopique, alors que la définition de Brønsted-Lowry et la définition de Lewis sont des définitions microscopiques.
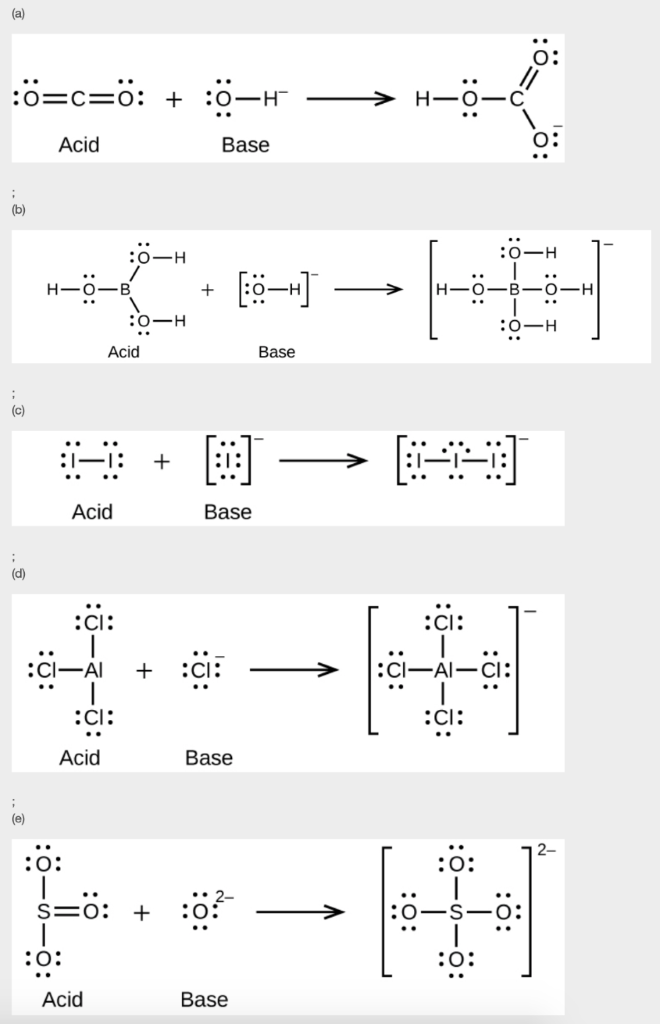
11. Ecrivez les structures de Lewis des réactifs et le produit de chacune des équations suivantes, et identifiez l’acide de Lewis et la base de Lewis dans chacune d’elles :
(a) CO2 + OH– → HCO3–
(b) B(OH)3 + OH– → B(OH)4–
(c) I– + I2 → I3–
(d) AlCl3 + Cl– → AlCl4– – (utiliser les obligations simples Al – Cl)
(e) O2- + SO3 → SO42-
12. Ecrivez les structures de Lewis des réactifs et le produit de chacune des équations suivantes, et identifiez l’acide de Lewis et la base de Lewis dans chacune d’elles :
(a) CS2 + SH– → HCS3–
(b) BF3 + F– → BF4–
(c) I– + SnI2 → SnI3–
(d) Al(OH)3 + OH– → Al(OH)4–
(e) F– + SO3 → SFO3–
13. En utilisant les structures de Lewis, écrivez des équations équilibrées pour les réactions suivantes :
(a) HCl (g) + PH3 (g) →
(b) H3O+ + CH3– →
(c) CaO + SO3 →
(d) NH4+ + C2H5O– →
14. Dans un titrage de l’ion cyanure, 28,72 ml de 0,0100 M AgNO3 sont ajoutés avant le début de la précipitation. [La réaction de Ag+ avec CN– s’achève, produisant le complexe Ag(CN)2–]. La précipitation de AgCN solide a lieu lorsque l’excès de Ag+ est ajouté à la solution, au-delà de la quantité nécessaire pour compléter la formation de Ag(CN)2–. Combien de grammes (masse) de NaCN se trouvaient dans l’échantillon initial ?
15. En solution aqueuse diluée, le HF agit comme un acide faible. Cependant, l’HF liquide pur (point d’ébullition = 19,5 °C) est un acide fort. Dans l’HF liquide, le HNO3 agit comme une base et accepte les protons. L’acidité de l’HF liquide peut être augmentée en ajoutant un des nombreux fluorures inorganiques qui sont des acides de Lewis et acceptent l’ion F– (par exemple, BF3 ou SbF5). Écrivez des équations chimiques équilibrées pour la réaction du HNO3 pur avec le HF pur et du HF pur avec le BF3.
16. L’acide borique, H3BO3, n’est pas un acide de Brønsted-Lowry mais un acide de Lewis.
(a) Ecrivez une équation pour sa réaction avec l’eau.
(b) Prévoir la forme de l’anion ainsi formé.
(c) Quelle est l’hybridation sur le bore qui correspond à la forme que vous avez prédite ?
Réponses
- Lorsque la quantité de solide est si faible qu’elle ne permet pas de produire une solution saturée
- Le CO3 est une base conjuguée d’un acide faible, ce qui signifie qu’il s’hydrolyse en poussant l’équilibre vers la droite, augmentant ainsi la solubilité.
- 8 × 10–5 M
- OH- est retiré de la solution en réagissant avec le NH3 ou le HNO3, ce qui pousse l’équilibre vers la droite et augmente donc la solubilité.
- 5 ×1023
6. [Cd(CN)42-] + [CN–]⇌ [Cd2+]
|
Concentration initiale (M) |
0.250 |
0 |
0 |
|
Concentration d’équilibre (M) |
0.250 – x |
4x |
x |
7. [Co3+] = 3,0 × 10-6 M ; [NH3] = 1,8 × 10-5 M
8. 1.3 g
9. 0.79 g
10. Comme presque tous les acides (qu’ils soient de Lewis ou de Brønsted-Lowry) augmentent la concentration d’hydronium dans la solution en réagissant avec l’eau, la définition d’introduction des acides englobe le comportement de ces composés, et constitue donc une définition macroscopique d’un acide. Comme les définitions de Lewis ou de Brønsted-Lowry expliquent les mécanismes à l’origine de l’augmentation de la concentration en ions hydronium (c’est-à-dire que les acides de Brønsted-Lowry libèrent du H+), elles sont considérées comme une définition microscopique.
11.
12.
(a)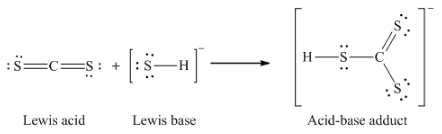
(b)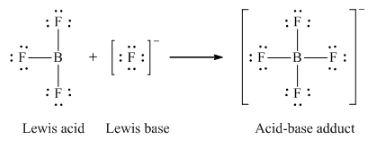
(c)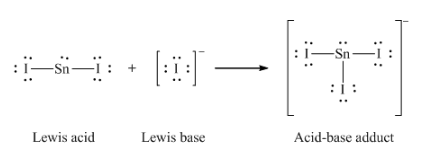
(d)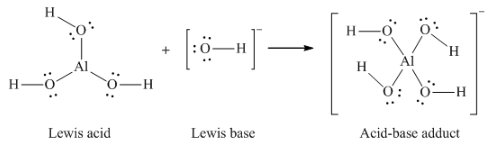
(e)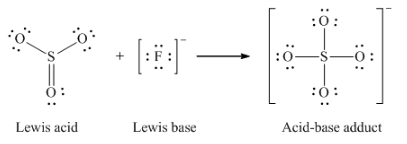
13.
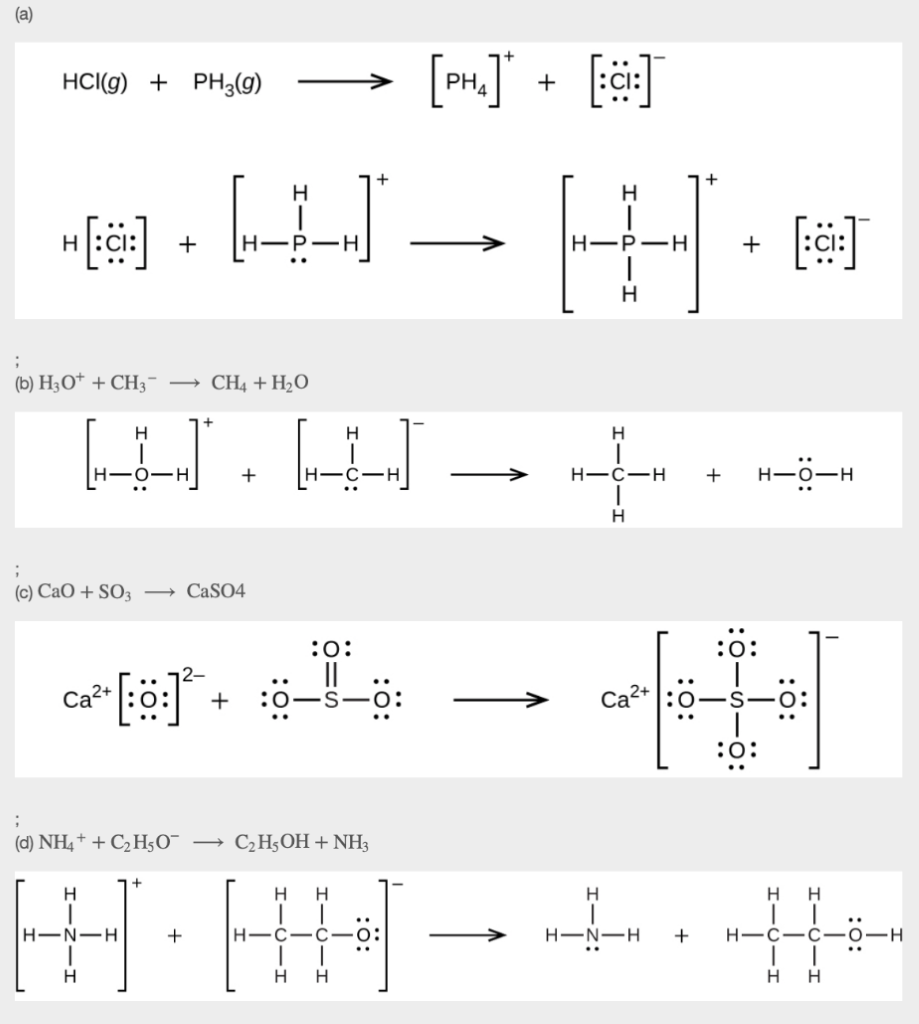
14. 0.0281 g
15. HNO3 (l) + HF (l) → H2NO3+ + F– ; HF (l) + BF3 (g) → H+ + BF4
16. (a) H3BO3 + H2O → H4BO4– + H+ ; (b) Les formes électronique et moléculaire sont les mêmes – toutes deux tétraédriques. (c) La structure tétraédrique est cohérente avec sp3 l’hybridation.
Liaison covalente dans laquelle les deux électrons proviennent du même atome
Réactions impliquant la formation de liaisons covalentes coordonnées
Toute espèce capable d'accepter une paire d'électrons et de former une liaison covalente coordonnée
Toute espèce capable de donner une paire d'électrons et de former une liaison covalente coordonnée
Composé ou ion qui contient une liaison covalente coordonnée entre un acide de Lewis et une base de Lewis
Molécule ou ion agissant comme une base de Lewis dans la formation d'un ion complexe ; liaisons avec l'atome central du complexe
Constante d'équilibre pour la formation d'un ion complexe à partir de ses composants
Constante d'équilibre pour la décomposition d'un ion complexe en ses composants

