2.5 – Mélanges gazeux et pressions partielles
Jusqu’à présent, dans notre utilisation de la loi du gaz idéal, nous nous sommes entièrement concentrés sur les propriétés des gaz purs avec une seule espèce chimique. Mais que se passe-t-il lorsque deux ou plusieurs gaz sont mélangés ? Dans cette section, nous décrivons comment déterminer la contribution de chaque gaz présent à la pression totale du mélange.
La pression d’un mélange de gaz : La loi de Dalton
Dans les mélanges gazeux, chaque composant de la phase gazeuse peut être traité séparément. Chaque composant du mélange partage la même température et le même volume. (N’oubliez pas que les gaz se dilatent pour remplir le volume de leur récipient ; les gaz dans un mélange le font également). Cependant, chaque gaz a sa propre pression. À moins qu’ils ne réagissent chimiquement les uns avec les autres, les différents gaz d’un mélange de gaz n’affectent pas la pression des autres. Chaque gaz individuel d’un mélange exerce la même pression que celle qu’il exercerait s’il était présent seul dans le récipient (figure 2.5.1). La pression exercée par chaque gaz individuel dans un mélange est appelée sa pression partielle, dénommée Pi. Cette observation est résumée par la loi des pressions partielles de Dalton : La pression totale d’un mélange de gaz idéaux est égale à la somme des pressions partielles des gaz qui le composent :
PTotal = PA + PB + PC + … = ΣiPi
Equation 2.5.1 La loi de Dalton sur les pressions partielles
Dans l’équation PTotal est la pression totale d’un mélange de gaz, PA est la pression partielle du gaz A ; PB est la pression partielle du gaz B ; PC est la pression partielle du gaz C ; et ainsi de suite.
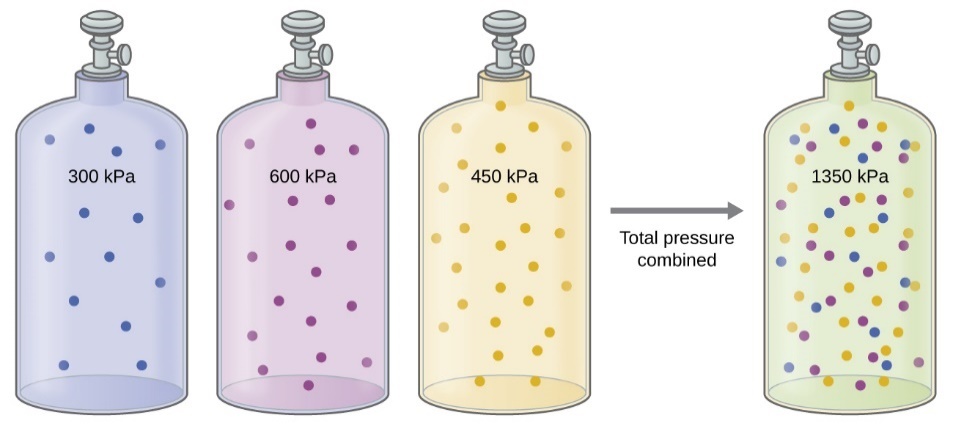
Figure 2.5.1. Si des bouteilles de même volume contenant du gaz A à une pression de 300 kPa, du gaz B à une pression de 600 kPa et du gaz C à une pression de 450 kPa sont toutes combinées dans une bouteille de même taille, la pression totale du mélange est de 1350 kPa.
Dans ce scénario de mélanges de gaz, le volume et la température sont maintenus constants parce que les gaz sont mélangés dans un même récipient (même volume fixe) dans le même environnement (même température). Dans ce cas, l’équation du gaz idéal peut être réarrangée pour montrer que la pression d’un échantillon de gaz est directement proportionnelle au nombre de moles de gaz présentes :
![]()
Rien dans l’équation ne dépend de la nature du gaz – seulement la quantité.
Ainsi, si nous avons, par exemple, un mélange de deux gaz idéaux, A et B, nous pouvons écrire une expression pour la pression totale comme :
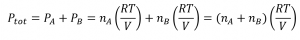
Plus généralement, pour un mélange de n gaz composants, la pression totale est donnée par
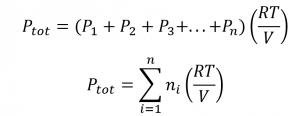
Fractions molaires des mélanges gazeux
La pression partielle du gaz A est liée à la pression totale du mélange gazeux via sa fraction molaire (X), une unité de concentration définie comme le nombre de moles d’un composant d’une solution divisé par le nombre total de moles de tous les composants :
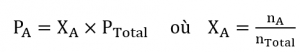
où PA, XA et nA sont respectivement la pression partielle, la fraction molaire et le nombre de moles de gaz A, et nTotal est le nombre de moles de tous les composants du mélange.
Exemple 2.5.1 – La pression d’un mélange de gaz
Un récipient de 10,0 L contient 2,50 × 10-3 mol de H2, 1,00 × 10-3 mol de He et 3,00 × 10-4 mol de Ne à 35 °C.
a) Quelles sont les pressions partielles de chacun des gaz ?
(b) Quelle est la pression totale dans les atmosphères ?
Solution
Les gaz se comportent de manière indépendante, de sorte que la pression partielle de chaque gaz peut être déterminée à partir de l’équation du gaz idéal, en utilisant P = nRT/V :

La pression totale est donnée par la somme des pressions partielles :
![]()
Vérifiez votre apprentissage 2.5.1 – La pression d’un mélange de gaz
Un ballon de 5,73 litres à 25°C contient 0,0388 mol de N2, 0,147 mol de CO et 0,0803 mol de H2. Quelle est la pression totale dans le ballon en atmosphères ?
Réponse
1,14 atm
Voici un autre exemple de ce concept, mais portant sur le calcul des fractions molaires.
Exemple 2.5.2 – La pression d’un mélange de gaz
Un mélange gazeux utilisé pour l’anesthésie contient 2,83 moles d’oxygène, O2, et 8,41 moles d’oxyde nitreux, N2O. La pression totale du mélange est de 192 kPa.
(a) Quelles sont les fractions molaires de O2 et de N2O ?
(b) Quelles sont les pressions partielles de l’O2 et du N2O ?
Solution
La fraction molaire est donnée par
et la pression partielle est PA = XA × PTotal.
Pour l’O2,
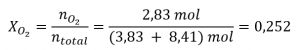
et
![]()
Pour le N2O,
![]()
et
Vérifiez votre apprentissage 2.5.2 – La pression d’un mélange de gaz
Quelle est la pression d’un mélange de 0,200 g de H2, 1,00 g de N2 et 0,820 g de Ar dans un récipient d’un volume de 2,00 L à 20°C ?
Répondez :
1,87 atm
Collecte de gaz sur l’eau
L’accumulation de gaz sur l’eau par le biais de bulles est l’une des principales raisons pour lesquelles nous devons apprendre et comprendre la loi des pressions partielles de Dalton. Cette méthode simple de collecte des gaz qui ne réagissent pas avec l’eau consiste à les capturer dans une bouteille remplie d’eau et à les inverser dans un plat rempli d’eau. La pression du gaz à l’intérieur de la bouteille peut être rendue égale à la pression de l’air à l’extérieur en soulevant ou en abaissant la bouteille. Lorsque le niveau d’eau est le même à l’intérieur et à l’extérieur de la bouteille (figure 2.5.2), la pression du gaz est égale à la pression atmosphérique, qui peut être mesurée à l’aide d’un baromètre.
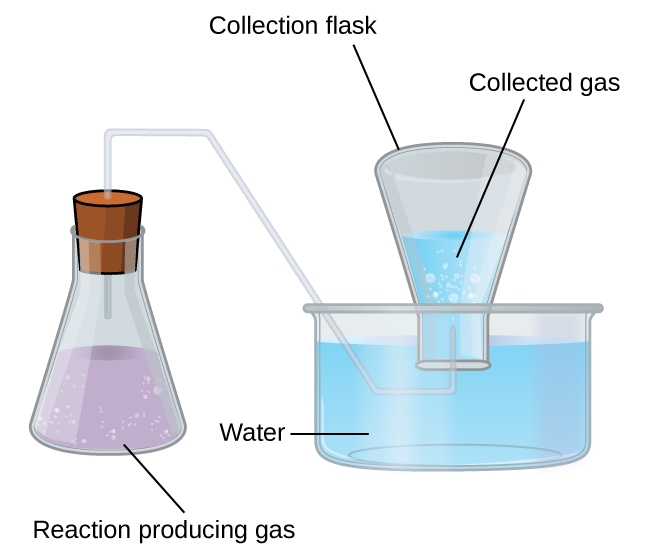
Figure 2.5.2. Lorsqu’une réaction produit un gaz qui est recueilli au-dessus de l’eau, le gaz piégé est un mélange du gaz produit par la réaction et de la vapeur d’eau. Si le flacon de collecte est correctement positionné pour égaliser les niveaux d’eau à l’intérieur et à l’extérieur du flacon, la pression du mélange de gaz piégé sera égale à la pression atmosphérique à l’extérieur du flacon (voir la discussion précédente sur les manomètres).
Cependant, il y a un autre facteur dont nous devons tenir compte lorsque nous mesurons la pression du gaz par cette méthode. Les liquides, y compris l’eau, ont la propriété de s’évaporer constamment en une vapeur jusqu’à ce que celle-ci atteigne une pression partielle caractéristique de la substance et de la température. Cette pression partielle est appelée pression de vapeur. L’eau s’évapore et il y a toujours de l’eau gazeuse (vapeur d’eau) au-dessus d’un échantillon d’eau liquide. Lorsqu’un gaz est recueilli au-dessus de l’eau, il devient saturé de vapeur d’eau et la pression totale du mélange est égale à la pression partielle du gaz plus la pression partielle de la vapeur d’eau. La pression du gaz pur est donc égale à la pression totale moins la pression de la vapeur d’eau – c’est ce que l’on appelle la pression du gaz « sec », c’est-à-dire la pression du gaz seul, sans vapeur d’eau. La pression de vapeur de l'eau, qui est la pression exercée par la vapeur d’eau en équilibre avec l’eau liquide dans un récipient fermé, dépend de la température (figure 2.5.3) ; des informations plus détaillées sur la dépendance de la vapeur d’eau à la température figurent dans le tableau 2.5.1 ci-dessous la figure 2.5.3.
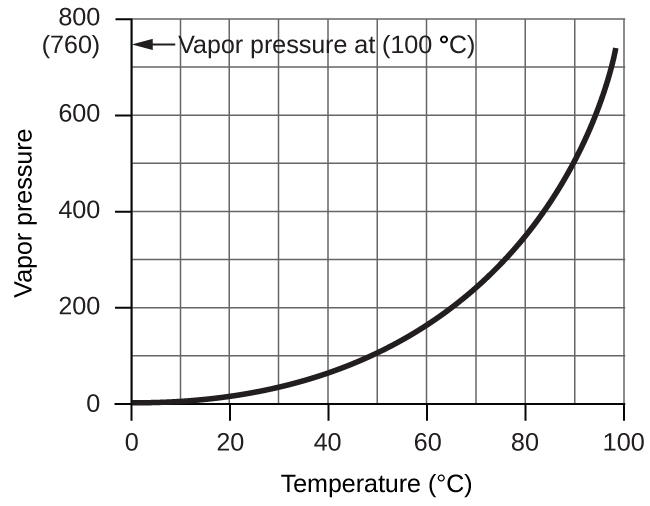
Figure 2.5.3. Ce graphique montre la pression de vapeur de l’eau au niveau de la mer en fonction de la température.
Tableau 2.5.1. Pression de vapeur de la glace et de l’eau à diverses températures au niveau de la mer
|
Pression de vapeur de la glace et de l’eau à différentes températures au niveau de la mer*. |
|||||
|
Température (°C) |
Pression (Torr) |
Température (°C) |
Pression (Torr) |
Température (°C) |
Pression (Torr) |
|
-10 |
1.95 |
18 |
15.48 |
30 |
31.82 |
|
-5 |
3.01 |
19 |
16.48 |
35 |
41.18 |
|
-2 |
3.88 |
20 |
17.54 |
40 |
55.32 |
|
0 |
4.58 |
21 |
18.65 |
50 |
92.51 |
|
2 |
5.29 |
22 |
19.83 |
60 |
149.38 |
|
4 |
6.10 |
23 |
21.07 |
70 |
233.7 |
|
6 |
7.01 |
24 |
22.38 |
80 |
355.1 |
|
8 |
8.04 |
25 |
23.76 |
90 |
525.76 |
|
10 |
9.21 |
26 |
25.21 |
95 |
633.90 |
|
12 |
10.52 |
27 |
26.74 |
99 |
733.24 |
|
14 |
11.99 |
28 |
28.35 |
100.0 |
760.00 |
|
16 |
13.63 |
29 |
30.04 |
101.0 |
787.57 |
| * Manuel de chimie et de physique du CRC, 65e édition. Cleveland, Ohio : CRC Press, 1984. | |||||
Exemple 2.5.3 – Pression d’un gaz recueilli au-dessus de l’eau
Si l’on recueille 0,200 L d’argon sur de l’eau à une température de 26 °C et à une pression de 750 Torr dans un système comme celui illustré à la figure 2.5.3, quelle est la pression partielle de l’argon ?
Solution
Selon la loi de Dalton, la pression totale dans la bouteille (750 Torr) est la somme de la pression partielle de l’argon et de la pression partielle de l’eau gazeuse :
PT = PAr + PH2O
Réorganiser cette équation pour résoudre la pression de l’argon donne :
PAr = PT – PH2O
La pression de la vapeur d’eau au-dessus d’un échantillon d’eau liquide à 26 °C est d’environ 25,2 Torr (Annexe F), donc :
PAr = 750 Torr – 25,2 Torr = 725 Torr
Vérifiez votre apprentissage 2.5.3 – Pression d’un gaz recueilli au-dessus de l’eau
Un échantillon d’oxygène prélevé sur de l’eau à une température de 29,0 °C et à une pression de 764 Torr a un volume de 0,560 L. Quel volume l’oxygène sec aurait-il dans les mêmes conditions de température et de pression ?
Répondez :
0,583 L
|
Demande d’autorisation pour les aliments et boissons – boissons gazeuses |
|
Les boissons gazeuses – sodas, bière, vins mousseux – ont un point commun : elles contiennent du gaz CO2 dissous en quantité telle qu’il affecte l’expérience de la boisson. La plupart des gens trouvent l’expérience de la boisson agréable – en fait, rien qu’au Canada, en 2016, environ 1/4 des personnes âgées de 5 à 19 ans ont déclaré avoir consommé quotidiennement des boissons sucrées. Les recherches montrent que les sodas, les boissons énergétiques et les boissons pour sportifs sont la principale source de calories chez les Nord-Américains âgés de 12 à 50 ans.
Toutes les boissons gazeuses sont fabriquées de deux manières. Premièrement, la boisson plate est soumise à une pression élevée de CO2 gazeux, qui force le gaz en solution. La boisson gazeuse est ensuite conditionnée dans un emballage hermétique (généralement une bouteille ou une canette) et vendue. Lorsque le récipient est ouvert, la pression de CO2 est libérée, ce qui provoque le fameux sifflement, et des bulles de CO2 sortent de la solution (figure 2.5.4). Cela doit être fait avec précaution : si le CO2 sort trop violemment, un gâchis peut se produire ! Figure 2.5.4. Si vous ne faites pas attention en ouvrant un récipient de boisson gazeuse, vous pouvez faire un gâchis car le CO2 sort soudainement de la solution. Source : « Champagne uncorking » par Niels Noordhoek est sous licence Creative Commons Attribution-Share Alike 3.0 Unported license. La deuxième façon dont une boisson peut devenir gazeuse est par l’ingestion de sucre par la levure, qui génère alors du CO2 comme produit de digestion. Ce processus s’appelle la fermentation. La réaction globale est C6H12O6 (aq) → 2 C2H5OH (aq) + 2 CO2 (aq) Lorsque ce processus se produit dans un récipient fermé, le CO2 produit se dissout dans le liquide, pour être libéré de la solution lorsque le récipient est ouvert. La plupart des vins mousseux et champagnes fins sont transformés en boissons gazeuses de cette manière. Les vins mousseux moins chers sont fabriqués comme les sodas et la bière, avec une exposition à des pressions élevées de gaz CO2. * Source : Fondation des maladies du cœur. |
Questions
★ Questions
1. Une bouteille d’O2 (g) utilisée pour la respiration des patients souffrant d’emphysème a un volume de 3,00 L à une pression de 10,0 atm. Si la température de la bouteille est de 28,0 °C, quelle est la masse (en grammes) d’oxygène dans la bouteille ?
2. Quelle est la masse molaire (en g⋅mol-1) d’un gaz si 0,0494 g de ce gaz occupe un volume de 0,100 L à une température de 26 °C et à une pression de 307 Torr ?
3. Comment pourriez-vous démontrer expérimentalement que la formule moléculaire du propène est C3H6 et non CH2?
4. La densité d’un certain fluorure gazeux de phosphore est de 3,93 g/L à la STP (où P = 1,00 bar, T = 273,15 K, 1 mole = 22,7 L). Calculer la masse molaire (en g⋅mol-1) de ce fluorure et de déterminer sa formule moléculaire.
5. Quelle est la formule moléculaire d’un composé qui contient 39% de C, 45% de N et 16% de H si 0,157 g du composé occupe 125 ml avec une pression de 99,5 kPa à 22 °C ?
6. Une bouteille d’un mélange de gaz utilisée pour l’étalonnage des analyseurs de gaz du sang dans les laboratoires médicaux contient 5,0 % de CO2, 12,0 % d’O2 et le reste de N2 à une pression totale de 146 atm. Quelle est la pression partielle (en bars) de chaque composant de ce gaz (les pourcentages donnés indiquent le pourcentage de la pression totale qui est due à chaque composant) ?
7. Un échantillon de gaz isolé à partir de pétrole non raffiné contient 90,0 % de CH4, 8,9 % de C2H6 et 1,1 % de C3H8 à une pression totale de 307,2 kPa. Quelle est la pression partielle (en bars) de chaque composant de ce gaz (les pourcentages donnés indiquent le pourcentage de la pression totale qui est due à chaque composant) ?
8. Un mélange de 0,200 g de H2, 1,00 g de N2 et 0,820 g de Ar est stocké dans un récipient fermé à la STP (où P = 1,00 bar, T = 273,15 K, 1 mole = 22,7 L). Trouvez le volume du conteneur (en litres), en supposant que les gaz présentent un comportement idéal.
9. Calculer le volume (en litres) d’oxygène nécessaire pour brûler 12,00 L de gaz éthane, C2H6, pour produire du dioxyde de carbone et de l’eau, si les volumes de C2H6 et d’O2 sont mesurés dans les mêmes conditions de température et de pression.
10. Le méthanol, CH3OH, est produit industriellement par la réaction suivante :
CO (g) + 2H2 (g) → CH3OH (g) (en utilisant un catalyseur au cuivre à 300 °C, 300 atm)
En supposant que les gaz se comportent comme des gaz idéaux, trouvez le rapport entre le volume total des réactifs et le volume final.
11. Un échantillon de 2,50 L d’un gaz incolore à la STP s’est décomposé pour donner 2,50 L de N2 et 1,25 L d’O2 à la STP. Qu’est-ce que le gaz incolore ?
★★ Questions
12. L’éthanol, C2H5OH, est produit industriellement à partir de l’éthylène, C2H4, par la séquence de réactions suivante :
3 C2H4 + 2 H2SO4 → C2H5HSO4 + (C2H5)2SO4
C2H5HSO4 + (C2H5)2SO4 + 3 H2O → 3 C2H5OH + 2 H2SO4
Quel volume (en litres) d’éthylène à la STP (où P = 1,00 bar, T = 273,15 K, 1 mole = 22,7 L) est nécessaire pour produire 1 000 tonnes métriques (1000 kg) d’éthanol si le rendement global de l’éthanol est de 90,1% ?
★★★ Questions
13. Un échantillon d’un composé de xénon et de fluor a été confiné dans une ampoule avec une pression de 18 Torr. De l’hydrogène a été ajouté à l’ampoule jusqu’à ce que la pression soit de 72 Torr. Le passage d’une étincelle électrique à travers le mélange a produit du Xe et du HF. Après que le HF ait été éliminé par réaction avec du KOH solide, la pression finale du xénon et de l’hydrogène n’ayant pas réagi dans l’ampoule était de 36 Torr. Quelle est la formule empirique du fluorure de xénon dans l’échantillon original ? (Note : les fluorures de xénon ne contiennent qu’un seul atome de xénon par molécule).
Réponses
1. 38.8 g
2. 30,0 g mol-1
3. En faisant une élévation du point d’ébullition et une dépression du point de congélation à titre expérimental, on peut trouver la masse moléculaire exacte. On peut ainsi déterminer la différence entre le propène et le CH2.
4. 88,1 g mol-1 ; PF3
5. (a) Avec les compositions données en pourcentage, on peut supposer une masse de 40 g de C, 45 g de N et 16 g de H. En utilisant ces informations, la formule empirique peut être obtenue en trouvant les moles de chaque atome composant le composé. A partir de là, il faut diviser chaque valeur molaire par la plus petite quantité de moles pour obtenir la composition de la formule empirique. Calculer la masse moléculaire de la formule empirique en fonction de sa composition ainsi que la masse moléculaire de la formule moléculaire avec les valeurs données dans la question. Divisez la masse moléculaire de la formule moléculaire par celle de la formule empirique. Ce rapport déterminera si la composition doit être multipliée par ce facteur afin de déterminer la formule moléculaire ; b) CNH5
6. CO2 = 7 atm, O2 = 18 atm, N2 = 120 atm
7. CH4 : 276 kPa ; C2H6 : 27 kPa ; C3H8 : 3,4 kPa
8. 1,87 atm
9. 42,00 L
10. 3:1, si des quantités stœchiométriques sont utilisées
11. N2O
12. 5.40 × 105 L
13. XeF2
Pression exercée par un gaz individuel dans un mélange
La pression totale d'un mélange de gaz idéaux est égale à la somme des pressions partielles des gaz composants
Rapport entre la quantité molaire d'un composant du mélange et le nombre total de moles de tous les composants du mélange
Pression exercée par la vapeur d'eau en équilibre avec l'eau liquide dans un récipient fermé à une température déterminée


