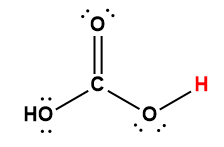
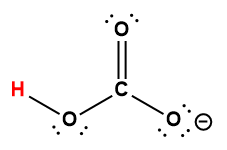
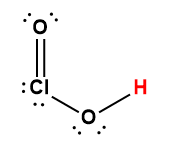
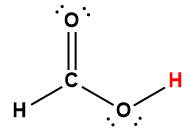
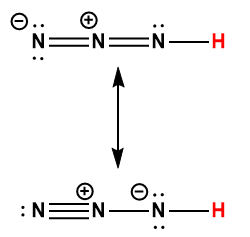
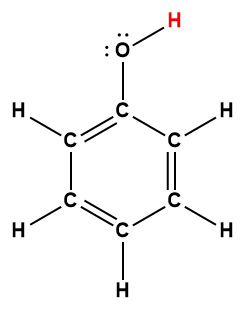
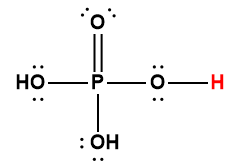
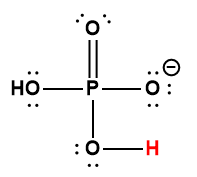
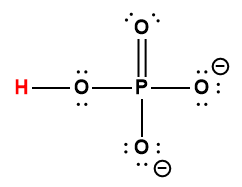
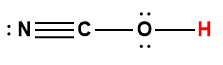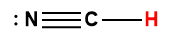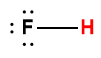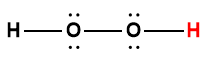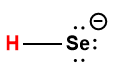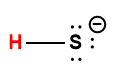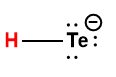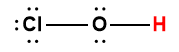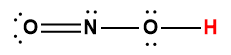Annexe H | Constantes d’ionisation des acides faibles
|
Acide |
Formule |
Ka à 25 °C |
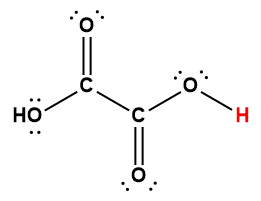
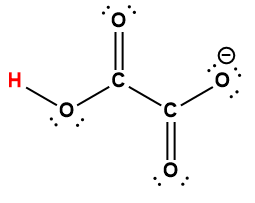
Structure de Lewis1 |
|
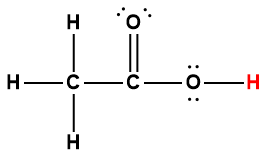
acétique |
CH3COOH |
1,75 × 10-5 |
|
|
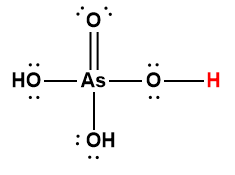
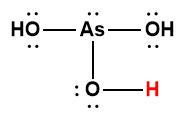
arsénique |
H3AsO4 |
5,5 × 10-3 |
|
|
|
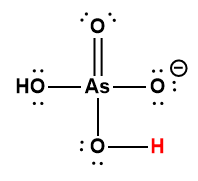
H2AsO4– |
1,7 × 10-7 |
|
|
|
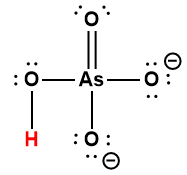
HAsO42- |
5,1 × 10-12 |
|
|
orthoarsénieux |
H3AsO3 |
5,1 × 10-10 |
|
|
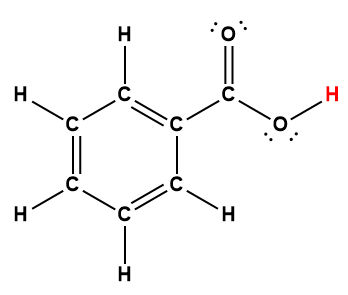
benzoïque |
C6H5COOH |
6,25 × 10-5 |
|
|
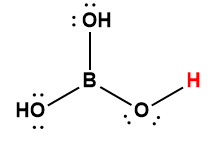
borique |
H3BO3 |
5,4 × 10-10 |
|
|
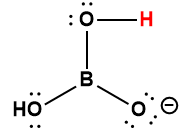
|
H2BO3– |
1 × 10-14 * |
|
|
carbonique |
H2CO3 |
4,5 × 10-7 |
|
|
|
HCO3– |
4,7 × 10-11 |
|
|
chloreux |
HClO2 |
1,1 × 10-2 |
|
|
cyanique |
HOCN |
3,5 × 10-4 |
|
|
formique |
HCOOH |
1,8 × 10-4 |
|
|
hydrazoïque |
HN3 |
2 × 10-5 |
|
|
hydrocyanique |
HCN |
6,2 × 10-10 |
|
|
hydrofluorique |
HF |
6,3 × 10-4 |
|
|
peroxyde d’hydrogène |
H2O2 |
2,4 × 10-12 |
|
|
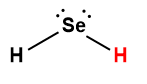
séléniure d’hydrogène |
H2Se |
1,3 × 10-4 |
|
|
|
HSe– |
1,0 × 10-11 |
|
|
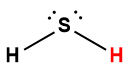
sulfure d’hydrogène |
H2S |
8,9 × 10-8 |
|
|
|
HS– |
1 × 10-19 |
|
|
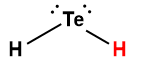
tellurure d’hydrogène |
H2Te |
2 × 10-3 |
|
|
|
HTe– |
1 × 10-11 |
|
|
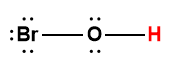
hypobromeux |
HOBr |
2,8 × 10-9 |
|
|
hypochloreux |
HOCl |
4,0 × 10-8 |
|
|
nitreux |
HNO2 |
5,6 × 10-4 |
|
|
oxalique |
H2C2O4 |
5,6 × 10-2 |
|
|
|
HC2O4– |
1,5 × 10-4 |
|
|
phénol |
C5H5OH |
1,0 × 10-10 |
|
|
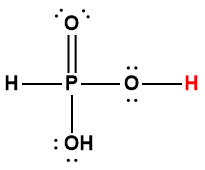
phosphorique |
H3PO4 |
6,9 × 10-3 |
|
|
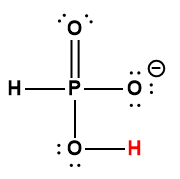
|
H2PO4– |
6,2× 10-8 |
|
|
|
HPO42- |
4,8 × 10-13 |
|
|
phosphore |
H3PO3 |
5 × 10-2 |
|
|
|
H2PO3– |
2,0 × 10-7 |
|
|
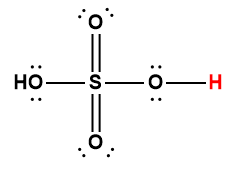
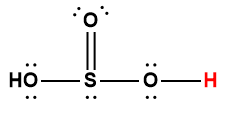
sulfurique |
H2SO4 |
acide fort |
|
|
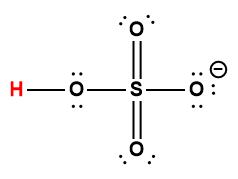
|
HSO4– |
1,0 × 10-2 |
|
|
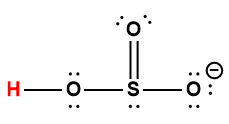
sulfureuse |
H2SO3 |
1,4 × 10-2 |
|
|
|
HSO3– |
6 × 10-8 |
|
1 L’atome d’hydrogène indiqué en rouge représente le proton donné dans une réaction acide-base.
* Représente la valeur limite inférieure.
RÉFÉRENCES
1) « Dissociation Constants of Inorganic Acids and Bases » in CRC Handbook of Chemistry and Physics, 100e édition (version Internet 2019), John R. Rumble, ed., CRC Press/Taylor & Francis, Boca Raton, FL.
2) « Dissociation Constants of Organic Acids and Bases » in CRC Handbook of Chemistry and Physics, 100e édition (version Internet 2019), John R. Rumble, ed., CRC Press/Taylor & Francis, Boca Raton, FL.