9.1 Molécules de signalisation et récepteurs cellulaires
Objectifs d’apprentissage
À la fin de cette section, vous serez en mesure de faire ce qui suit :
- Décrire quatre types de mécanismes de signalisation présents dans les organismes multicellulaires
- Comparer les récepteurs internes avec les récepteurs transmembranaires
- Reconnaître la relation entre la structure d’un ligand et son mécanisme d’action
Il existe deux types de communication dans le monde des cellules vivantes. La communication entre les cellules est appelée signalisation intercellulaire et la communication à l’intérieur d’une cellule est appelée signalisation intracellulaire. Pour se souvenir de cette distinction, il suffit de comprendre l’origine latine des préfixes : inter- signifie « entre » (par exemple, les lignes qui se croisent sont celles qui s’entrecroisent) et intra- signifie « à l’intérieur » (comme dans l’intraveineuse).
Les signaux chimiques sont émis par les cellules de signalisation sous la forme de petites molécules, généralement volatiles ou solubles, appelées ligands. Un ligand est une molécule qui se lie à une autre molécule spécifique et qui, dans certains cas, délivre un signal au cours du processus. Les ligands peuvent donc être considérés comme des molécules de signalisation. Les ligands interagissent avec les protéines des cellules cibles, qui sont des cellules affectées par les signaux chimiques ; ces protéines sont également appelées récepteurs. Les ligands et les récepteurs existent en plusieurs variétés ; cependant, un ligand spécifique a un récepteur spécifique qui ne lie généralement que ce ligand. Il est par contre possible que des ligands de structures semblables puissent liés le même récepteur. Pensez par exemple à la caféine, dont la structure chimique ressemble à celle de l’adénosine. Dans notre cerveau, la caféine se lie au récepteur de l’adénosine et lui fait compétition, prévenant par le fait même le signal de l’adénosine, ce qui favorise un état d’éveil.
Voies de communication
Il existe quatre voies de communication (ou signalisation) chimique dans les organismes multicellulaires : la signalisation paracrine, la signalisation endocrinienne, la signalisation autocrine et la signalisation directe à travers les jonctions communicantes (figure 9.2). La principale différence entre les différentes voies de communication est la distance parcourue par le signal dans l’organisme pour atteindre la cellule cible. Il convient de noter que toutes les cellules ne sont pas affectées par les mêmes signaux.
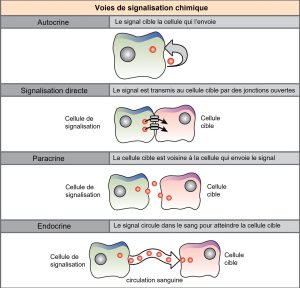
Signalisation paracrine
Les signaux qui agissent localement entre des cellules proches les unes des autres sont appelés signaux paracrines. Les signaux paracrines se déplacent par diffusion à travers la matrice extracellulaire. Ces types de signaux suscitent généralement des réponses rapides qui ne durent qu’un court laps de temps. Afin de maintenir la réponse localisée, les molécules de ligand paracrine sont normalement rapidement dégradées par des enzymes ou éliminées par les cellules voisines. L’élimination des signaux rétablit le gradient de concentration pour le signal, ce qui leur permet de diffuser rapidement dans l’espace intracellulaire s’ils sont libérés à nouveau.
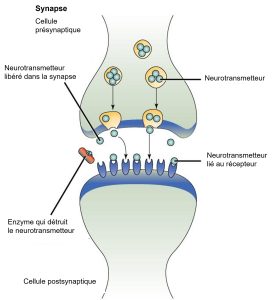
Un exemple de signalisation paracrine est le transfert de signaux à travers les synapses entre les cellules nerveuses. Une cellule nerveuse se compose d’un corps cellulaire, de plusieurs prolongements courts et ramifiés appelés dendrites qui reçoivent les stimuli, et d’un long prolongement appelé axone, qui transmet les signaux à d’autres cellules nerveuses ou à des cellules musculaires. La jonction entre les cellules nerveuses où se produit la transmission des signaux est appelée synapse. Un signal synaptique est un signal chimique qui circule entre les cellules nerveuses. Les signaux à l’intérieur des cellules nerveuses sont propagés par des impulsions électriques rapides. Lorsque ces impulsions atteignent l’extrémité de l’axone, le signal se poursuit jusqu’à la dendrite de la cellule suivante grâce à la libération de ligands chimiques appelés neurotransmetteurs par la cellule présynaptique (la cellule émettrice du signal). Les neurotransmetteurs sont transportés sur de très petites distances (20-40 nanomètres) entre les cellules nerveuses, appelées synapses chimiques (figure 9.3). La faible distance entre les cellules nerveuses permet au signal de voyager rapidement, ce qui permet une réponse immédiate, telle que « Enlève ta main de la cuisinière ».
Lorsque le neurotransmetteur se lie au récepteur à la surface de la cellule postsynaptique (cellule qui reçoit le message), le potentiel électrochimique de la cellule cible change et l’impulsion électrique suivante est lancée. Les neurotransmetteurs libérés dans la synapse chimique sont rapidement dégradés ou réabsorbés par la cellule présynaptique, de sorte que la cellule nerveuse réceptrice peut se rétablir rapidement et être prête à répondre rapidement au prochain signal synaptique.
Signalisation endocrinienne
Les signaux provenant de cellules éloignées sont appelés signaux endocriniens et proviennent des cellules endocrines. (Dans l’organisme, de nombreuses cellules endocrines sont situées dans les glandes endocrines, telles que la glande thyroïde, l’hypothalamus et l’hypophyse). Ces types de signaux produisent généralement une réponse plus lente, mais ont un effet plus durable. Les ligands libérés dans le cadre de la signalisation endocrinienne sont appelés hormones, des molécules de signalisation qui sont produites dans une partie du corps, mais qui affectent d’autres régions du corps à une certaine distance.
Les hormones parcourent les grandes distances entre les cellules endocrines et leurs cellules cibles par l’intermédiaire de la circulation sanguine, qui est un moyen relativement lent de se déplacer dans le corps. En raison de leur mode de transport, les hormones se diluent et sont présentes en faibles concentrations lorsqu’elles agissent sur leurs cellules cibles. Cela diffère de la signalisation paracrine, dans laquelle les concentrations locales de ligands peuvent être très élevées.
Signalisation autocrine
Les signaux autocrines sont produits par des cellules de signalisation qui peuvent également se lier au ligand libéré. Cela signifie que la cellule de signalisation et la cellule cible peuvent être la même cellule ou une cellule similaire (le préfixe auto- signifie autonome, ce qui rappelle que la cellule de signalisation s’envoie un signal à elle-même). Ce type de signalisation se produit souvent au cours du développement précoce d’un organisme afin de s’assurer que les cellules se développent dans les tissus appropriés et assument les fonctions adéquates. La signalisation autocrine régule également la sensation de douleur et les réponses inflammatoires. En outre, si une cellule est infectée par un virus, elle peut se signaler pour subir une mort cellulaire programmée, tuant ainsi le virus. Dans certains cas, les cellules voisines du même type sont également influencées par le ligand libéré. Dans le développement embryonnaire, ce processus de stimulation d’un groupe de cellules voisines peut contribuer à orienter la différenciation de cellules identiques vers le même type de cellules, garantissant ainsi un développement adéquat.
Signalisation directe à travers les jonctions communicantes (ou jonctions ouvertes)
Les jonctions communicantes (ou jonctions ouvertes) chez les animaux et les plasmodesmes chez les plantes sont des connexions entre les membranes plasmiques de cellules voisines. Ces canaux remplis de liquide permettent à de petites molécules de signalisation, appelées médiateurs intracellulaires, de se répandre entre les deux cellules. Les petites molécules ou les ions, tels que les ions calcium (Ca2+), peuvent se déplacer entre les cellules, mais les grosses molécules, telles que les protéines et l’ADN, ne peuvent pas passer par les canaux. La spécificité des canaux permet aux cellules de rester indépendantes, mais de transmettre rapidement et facilement des signaux. Le transfert de molécules de signalisation communique l’état actuel de la cellule qui se trouve juste à côté de la cellule cible ; cela permet à un groupe de cellules de coordonner leur réponse à un signal qu’une seule d’entre elles peut avoir reçu. Chez les plantes, les plasmodesmes sont omniprésents, faisant de la plante entière un gigantesque réseau de communication.
Types de récepteurs
Les récepteurs sont des protéines situées dans la cellule cible ou à sa surface qui lient le ligand. Il existe deux types de récepteurs : les récepteurs internes et les récepteurs transmembranaires (à la surface des cellules).
Récepteurs internes
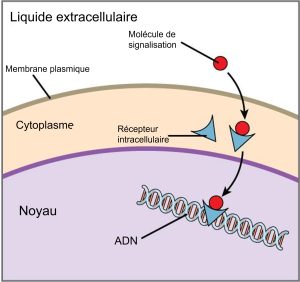
Les récepteurs internes, également appelés récepteurs intracellulaires ou cytoplasmiques, se trouvent dans le cytoplasme de la cellule et répondent à des molécules ligands hydrophobes capables de traverser la membrane plasmique. Une fois à l’intérieur de la cellule, nombre de ces molécules se lient à des protéines qui agissent comme des régulateurs de la synthèse de l’ARNm (transcription) pour médier l’expression des gènes. L’expression des gènes est le processus cellulaire qui transforme l’information contenue dans l’ADN d’une cellule en une séquence d’acides aminés, qui forme finalement une protéine. Lorsque le ligand se lie au récepteur interne, un changement de conformation est déclenché qui expose un site de liaison à l’ADN sur la protéine. Le complexe ligand-récepteur se déplace dans le noyau, puis se lie à des régions régulatrices spécifiques de l’ADN chromosomique et favorise l’initiation de la transcription (figure 9.4). La transcription est le processus qui consiste à copier l’information contenue dans l’ADN d’une cellule dans une forme spéciale d’ARN appelée ARN messager (ARNm) ; la cellule utilise l’information contenue dans l’ARNm (qui se déplace dans le cytoplasme et s’associe aux ribosomes) pour relier des acides aminés spécifiques dans le bon ordre, produisant ainsi une protéine. Les récepteurs internes peuvent influencer directement l’expression des gènes sans devoir transmettre le signal à d’autres récepteurs ou messagers.
Récepteurs transmembranaires
Les récepteurs transmembranaires (ou simplement membranaires), sont des protéines ancrées dans la membrane cytoplasmique qui se lient à des molécules ligands extracellulaires (situées à l’extérieur de la cellule). Ce type de récepteur traverse la membrane plasmique et assure la transduction du signal, par laquelle un signal extracellulaire est converti en un signal intracellulaire. Les ligands qui interagissent avec les récepteurs de la surface cellulaire n’entrent pas dans la cellule qu’ils affectent. Les récepteurs de la surface cellulaire sont également appelés protéines ou marqueurs spécifiques des cellules, car ils sont propres à chaque type de cellule.
Les protéines réceptrices de la surface cellulaire étant essentielles au fonctionnement normal des cellules, il n’est pas surprenant qu’un dysfonctionnement de l’une d’entre elles puisse avoir de graves conséquences. Il a été démontré que des erreurs dans les structures protéiques de certaines molécules réceptrices jouent un rôle dans l’hypertension, l’asthme, les maladies cardiaques et le cancer.
Chaque récepteur de la surface cellulaire possède trois composants principaux : un domaine externe de liaison au ligand appelé domaine extracellulaire, une région hydrophobe traversant la membrane appelée domaine transmembranaire et un domaine intracellulaire à l’intérieur de la cellule. La taille et l’étendue de chacun de ces domaines varient considérablement en fonction du type de récepteur.
LIEN AVEC L’ÉVOLUTION
Comment les virus reconnaissent un hôte
Contrairement aux cellules vivantes, de nombreux virus n’ont pas de membrane plasmique ni aucune des structures nécessaires au maintien d’une vie métabolique. Certains virus sont simplement composés d’une enveloppe protéique inerte renfermant de l’ADN ou de l’ARN. Pour se reproduire, les virus doivent envahir une cellule vivante, qui sert d’hôte, et prendre le contrôle de l’appareil cellulaire de l’hôte. Mais comment un virus reconnaît-il son hôte?
Les virus se lient souvent aux récepteurs de la surface cellulaire de la cellule hôte. Par exemple, le virus de la grippe humaine se lie spécifiquement à des récepteurs situés sur les membranes des cellules du système respiratoire. Les différences chimiques entre les récepteurs de la surface cellulaire des différents hôtes font qu’un virus qui infecte une espèce spécifique (par exemple, l’humain) ne peut souvent pas infecter une autre espèce (par exemple, les poulets).
Cependant, les virus ont de très petites quantités d’ADN ou d’ARN par rapport à l’humain et, par conséquent, la reproduction virale peut se produire rapidement. La reproduction virale produit invariablement des erreurs qui peuvent entraîner des changements dans les virus nouvellement produits ; ces changements signifient que les protéines virales qui interagissent avec les récepteurs de la surface cellulaire peuvent évoluer de manière à se lier aux récepteurs d’un nouvel hôte. Ces changements se produisent de manière aléatoire et assez souvent au cours du cycle de reproduction d’un virus, mais ils n’ont d’importance que si un virus doté de nouvelles propriétés de liaison entre en contact avec un hôte approprié. Dans le cas de la grippe, cette situation peut se produire dans des environnements où les animaux et les personnes sont en contact étroit, comme les élevages de volailles et de porcs.1 Une fois qu’un virus franchit l’ancienne « barrière des espèces » pour atteindre un nouvel hôte, il peut se propager rapidement. Les scientifiques surveillent de près les virus nouvellement apparus (appelés virus émergents) dans l’espoir que cette surveillance puisse réduire la probabilité d’épidémies virales à l’échelle mondiale.
Les récepteurs à la surface des cellules (ou transmembranaires), sont impliqués dans la plupart des signaux des organismes multicellulaires. Il existe trois catégories générales de récepteurs transmembranaires : les récepteurs couplés aux canaux ioniques, les récepteurs couplés aux protéines G et les récepteurs enzymes.
Les récepteurs couplés aux canaux ioniques sont des complexes protéiques, c’est-à-dire qu’ils sont formés de plusieurs protéines qui s’assemblent en un seul complexe, qui traverse la membrane plasmique plusieurs fois pour former une sorte de canal à travers lequel peut passer des ions. Les acides aminés en contact avec les phospholipides de la membrane plasmique sont souvent des acides aminés hydrophobes. À l’inverse, les acides aminés qui tapissent l’intérieur du canal sont hydrophiles pour permettre le passage de l’eau ou des ions. Lorsqu’un ligand se lie à la région extracellulaire du canal, il se produit un changement de conformation dans la structure de la protéine qui permet le passage d’ions tels que le sodium, le calcium, le magnésium et l’hydrogène (Figure 9.5).
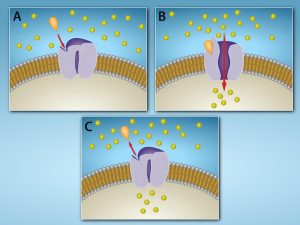
Les récepteurs couplés aux protéines G lient un ligand et activent une protéine membranaire appelée protéine G. La protéine G activée interagit alors avec un canal ionique ou une enzyme dans la membrane (figure 9.6). Tous les récepteurs couplés aux protéines G possèdent sept domaines transmembranaires, mais chaque récepteur possède son propre domaine extracellulaire et son propre site de liaison à la protéine G.
La signalisation cellulaire à l’aide de récepteurs couplés aux protéines G se produit sous la forme d’une série d’événements cycliques. Avant que le ligand ne se lie, la protéine G inactive peut se lier à un site nouvellement révélé sur le récepteur, spécifique à sa liaison. Lorsque le ligand se lie au récepteur, le changement de forme qui en résulte active la protéine G, qui libère la guanosine diphosphate (GDP) et capte la guanosine 3-phosphate (GTP). Les sous-unités de la protéine G se divisent ensuite en sous-unité α et sous-unité βγ. L’un ou les deux fragments de ces protéines G peuvent alors activer d’autres protéines. Après un certain temps, la sous-unité α de la protéine G hydrolyse le GTP en GDP, s’auto-inactivant par le fait même, et la sous-unité βγ est inactivée. Les sous-unités se réassocient pour former la protéine G inactive et le cycle recommence.
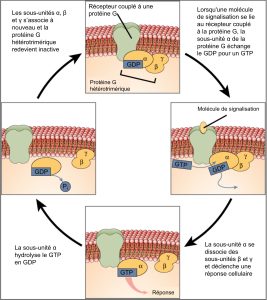
Les récepteurs couplés aux protéines G ont fait l’objet d’études approfondies et nous avons beaucoup appris sur leur rôle dans le maintien de la santé. Les bactéries pathogènes pour l’homme peuvent libérer des poisons qui interrompent la fonction de récepteurs spécifiques couplés aux protéines G, ce qui entraîne des maladies telles que la coqueluche, le botulisme et le choléra. Dans le cas du choléra (Figure 9.7), par exemple, la bactérie Vibrio cholerae, présente dans l’eau, produit une toxine, la toxine cholérique, qui se lie aux cellules de l’intestin grêle. La toxine pénètre ensuite dans les cellules intestinales, où elle modifie une protéine G qui contrôle l’ouverture d’un canal de chlorure et le rend continuellement actif, ce qui entraîne d’importantes pertes de fluides dans l’organisme et une déshydratation potentiellement mortelle.

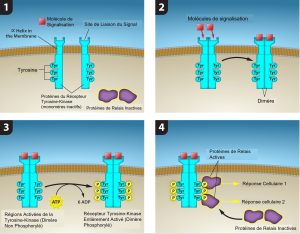
Les récepteurs enzymes sont des récepteurs de la surface cellulaire avec des domaines intracellulaires qui possèdent eux-même un domaine enzymatique ou sont associés à une enzyme. Les récepteurs enzymes ont normalement de grands domaines extracellulaires et intracellulaires, mais la région qui traverse la membrane est constituée d’une seule région peptidique en forme d’hélice α. Lorsqu’un ligand se lie au domaine extracellulaire, la conformation du récepteur change, activant l’enzyme. L’activation de l’enzyme déclenche une chaîne d’événements au sein de la cellule qui aboutit finalement à une réponse. Un exemple de ce type de récepteur enzymatique est le récepteur de la tyrosine kinase (figure 9.8). Une kinase est une enzyme qui transfère les groupes phosphates de l’ATP à une autre protéine. Le récepteur de la tyrosine kinase transfère des groupes phosphates aux molécules de tyrosine (résidus de tyrosine). Tout d’abord, les molécules de signalisation se lient au domaine extracellulaire de deux récepteurs de tyrosine kinase situés à proximité. Les deux récepteurs voisins se lient alors, ou se dimérisent. Des phosphates sont ensuite ajoutés aux résidus de tyrosine dans le domaine intracellulaire des récepteurs (par autophosphorylation des récepteurs). Les résidus phosphorylés peuvent alors transmettre le signal au messager suivant dans le cytoplasme.
Molécules de signalisation
Produits par les cellules de signalisation et se liant ensuite aux récepteurs des cellules cibles, les ligands agissent comme des signaux chimiques qui se déplacent vers les cellules cibles pour coordonner les réponses. Les types de molécules qui servent de ligands sont incroyablement variés et vont des petites protéines aux petits ions comme le calcium (Ca2+).
Petits ligands hydrophobes
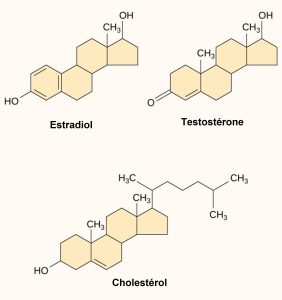
Les petits ligands hydrophobes peuvent diffuser directement à travers la membrane plasmique et interagir avec les récepteurs internes. Les hormones stéroïdiennes sont des membres importants de cette classe de ligands. Les stéroïdes sont des lipides dont le squelette hydrocarboné comporte quatre anneaux fusionnés ; différents stéroïdes ont différents groupes fonctionnels attachés au squelette carboné. Les hormones stéroïdiennes comprennent l’hormone sexuelle féminine, l’estradiol, qui est un type d’œstrogène, l’hormone sexuelle masculine, la testostérone, et le cholestérol, qui est un composant structurel important des membranes biologiques et un précurseur des hormones stéroïdiennes (figure 9.9). Les hormones thyroïdiennes et la vitamine D sont d’autres hormones hydrophobes. Pour être solubles dans le sang, les ligands hydrophobes doivent se lier à des protéines porteuses pendant qu’ils sont transportés dans la circulation sanguine.
Ligands solubles dans l’eau
Les ligands hydrosolubles sont polaires et ne peuvent donc pas traverser la membrane plasmique sans aide ; parfois, ils sont trop gros pour traverser la membrane. Au lieu de cela, la plupart des ligands hydrosolubles se lient au domaine extracellulaire des récepteurs de la surface cellulaire. Ce groupe de ligands est très diversifié et comprend des petites molécules, des peptides et des protéines.
Autres ligands
Le monoxyde d’azote (NO) est un gaz qui agit également comme un ligand. Il est capable de se diffuser directement à travers la membrane plasmique et l’un de ses rôles est d’interagir avec les récepteurs des muscles lisses et d’induire une relaxation du tissu. Le NO a une demi-vie très courte et ne fonctionne donc que sur de courtes distances. La nitroglycérine, un traitement des maladies cardiaques, agit en déclenchant la libération de NO, qui provoque la dilatation des vaisseaux sanguins, rétablissant ainsi le flux sanguin vers le cœur. Le NO est mieux connu depuis peu, car la voie qu’il affecte est ciblée par des médicaments prescrits pour la dysfonction érectile, tels que le Viagra (l’érection implique une dilatation des vaisseaux sanguins).
Notes de bas de page
1 A. B. Sigalov, The School of Nature. IV. Learning from Viruses, Self/Nonself 1, no. 4 (2010): 282-298. Y. Cao, X. Koh, L. Dong, X. Du, A. Wu, X. Ding, H. Deng, Y. Shu, J. Chen, T. Jiang, Rapid Estimation of Binding Activity of Influenza Virus Hemagglutinin to Human and Avian Receptors, PLoS One 6, no. 4 (2011): e18664.

