7.4 Phosphorylation oxydative
Objectifs d’apprentissage
À la fin de cette section, vous serez en mesure de faire ce qui suit :
- Décrivez comment les électrons se déplacent dans la chaîne de transport des électrons et expliquez ce qui arrive à leurs niveaux d’énergie pendant ce processus
- Expliquer comment un gradient de protons (H+) est établi et maintenu par la chaîne de transport des électrons
Vous venez de lire sur deux voies du catabolisme du glucose — la glycolyse et le cycle de l’acide citrique — qui génèrent l’ATP. Cependant, la majeure partie de l’ATP produite pendant le catabolisme aérobie du glucose ne provient pas directement de ces voies. Elle est plutôt dérivée d’un processus qui commence par déplacer les électrons dans une série de porteurs d’électrons qui subissent des réactions d’oxydoréduction. Ce processus amène les ions hydrogène à s’accumuler dans l’espace intermembranaire. Par conséquent, un gradient de concentration se forme dans lequel les ions hydrogène se diffusent hors de l’espace intermembranaire dans la matrice mitochondriale en passant par l’ATP synthase. Le courant des ions hydrogène alimente l’action catalytique de l’ATP synthase, qui phosphoryle l’ADP et produit de l’ATP.
Chaîne de transport d’électrons
La chaîne de transport des électrons (Figure 7.12) est la dernière composante de la respiration aérobie et est la seule partie du métabolisme du glucose qui utilise l’oxygène atmosphérique. L’oxygène se diffuse continuellement dans les tissus végétaux (généralement par les stomates), ainsi que dans les champignons et les bactéries ; toutefois, chez les animaux, l’oxygène pénètre dans l’organisme par divers systèmes respiratoires. Le transport d’électrons est une série de réactions d’oxydoréduction qui ressemble à une course de relais ou à une chaîne de seaux en ce sens que les électrons passent rapidement d’un composant à l’autre, jusqu’au point final de la chaîne où les électrons réduisent l’oxygène moléculaire et, avec les protons associés, produisent de l’eau. Il y a quatre complexes composés de protéines, marqués I à IV dans la Figure 7.12, et l’agrégation de ces quatre complexes, ainsi que des porte-électrons accessoires mobiles associés, est appelée chaîne de transport des électrons. La chaîne de transport des électrons est présente avec de multiples copies dans la membrane mitochondriale interne des eucaryotes et dans la membrane plasmatique des procaryotes.
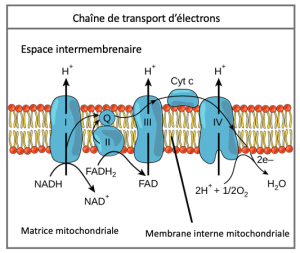
Complexe I
Premièrement, deux électrons sont transportés vers le premier complexe via le NADH. Ce complexe, marqué I, est composé de flavine mononucléotide (FMN) et d’une protéine contenant du fer et du soufre (Fe-S). La FMN, qui est dérivée de la vitamine B2 (aussi appelée riboflavine), est l’un des nombreux groupement prosthétiques ou cofacteurs de la chaîne de transport des électrons. Un groupement prosthétique est une molécule non protéique nécessaire à l’activité d’une protéine. Les groupements prosthétiques sont des molécules non peptidiques organiques ou inorganiques liées à une protéine qui facilite sa fonction. Les groupements prosthétiques comprennent les coenzymes, qui sont une famille d’enzymes prosthétiques. L’enzyme du complexe I est la NADH déshydrogénase et est composée de 44 chaînes polypeptidiques distinctes. Le complexe I peut pomper quatre ions hydrogène à travers la membrane à partir de la matrice dans l’espace intermembranaire, et c’est de cette façon que le gradient d’ions hydrogène est établi et maintenu entre les deux compartiments séparés par la membrane mitochondriale interne.
Q et complexe II
Le complexe II reçoit directement le FADH2, qui ne passe pas par le complexe I. Le composé reliant le premier et le deuxième complexe au troisième est l’ubiquinone B. La molécule Q est soluble dans les lipides et se déplace librement dans le noyau hydrophobe de la membrane. Une fois réduite (QH2), l’ubiquinone achemine ses électrons au complexe suivant de la chaîne de transport des électrons. Q reçoit les électrons dérivés du NADH du complexe I et les électrons dérivés du FADH2 du complexe II. Cette enzyme et le FADH2 forment un petit complexe qui achemine les électrons directement dans la chaîne de transport des électrons, en contournant le premier complexe. Étant donné que ces électrons contournent et n’activent donc pas la pompe à protons dans le premier complexe, moins de molécules d’ATP sont fabriquées à partir des électrons FADH2. Le nombre de molécules d’ATP finalement obtenues est directement proportionnel au nombre de protons pompés à travers la membrane mitochondriale interne.
Complexe III
Le troisième complexe est composé du cytochrome b – une autre protéine Fe-S, composée d’un centre Rieske (centre 2Fe-2S) et de protéines du cytochrome c. Ce complexe est aussi appelé cytochrome oxidoréductase. Les protéines cytochromes ont un groupement prosthétique d’hèmes. La molécule hémique est semblable à celle de l’hémoglobine, mais elle transporte des électrons et non de l’oxygène. Par conséquent, l’ion fer à son cœur est réduit et oxydé au fur et à mesure qu’il passe les électrons, fluctuant entre différents états d’oxydation : Fe2+ (réduit) et Fe3+ (oxydé). Les molécules hémiques dans les cytochromes ont des caractéristiques légèrement différentes en raison des effets des différentes protéines qui les lient, ce qui donne des caractéristiques légèrement différentes à chaque complexe. Le complexe III pompe les protons à travers la membrane et fait passer ses électrons au cytochrome c pour le transport vers le quatrième complexe de protéines et d’enzymes. (Le cytochrome c reçoit des électrons de Q ; toutefois, alors que Q transporte des paires d’électrons, le cytochrome c ne peut en accepter qu’un à la fois.)
Complexe IV
Le quatrième complexe est composé des protéines du cytochrome c, a et a3. Ce complexe contient deux groupements hémiques (un dans chacun des deux cytochromes, a et a3) et trois ions cuivre (une paire de Cu A et un Cu B dans le cytochrome a3). Les cytochromes maintiennent une molécule d’oxygène très serrée entre les ions fer et cuivre jusqu’à ce que l’oxygène soit complètement réduit par le gain de deux électrons. L’oxygène réduit prélève ensuite deux ions hydrogène du milieu environnant pour produire de l’eau (H2O). L’élimination des ions hydrogène du système contribue au gradient ionique qui constitue le fondement du processus de chimiosmose.
Chimiosmose
Dans la chimiosmose, l’énergie libre provenant de la série de réactions d’oxydoréduction décrite est utilisée pour pomper les ions hydrogène (protons) à travers la membrane mitochondriale. La distribution inégale des ions H+ à travers la membrane établit à la fois des gradients de concentration et des gradients électriques (donc un gradient électrochimique), en raison de la charge positive des ions hydrogène et de leur agrégation sur un côté de la membrane.
Si la membrane était continuellement ouverte à une simple diffusion par les ions hydrogène, les ions auraient tendance à se répandre dans la matrice, sous l’effet des concentrations produisant leur gradient électrochimique. Rappelons que de nombreux ions ne peuvent pas se diffuser à travers les régions non polaires des membranes phospholipides sans l’aide des canaux ioniques. De même, les ions hydrogène dans l’espace matriciel ne peuvent traverser la membrane mitochondriale interne que par une protéine membranaire intégrale appelée ATP synthase (Figure 7.13). Cette protéine complexe agit comme une minuscule génératrice, tourné par la force des ions hydrogène qui la diffusent, vers le bas de leur gradient électrochimique. Le tournage de parties de cette machine moléculaire facilite l’ajout d’un phosphate à l’ADP, formant de l’ATP, en utilisant l’énergie potentielle du gradient ionique hydrogène.
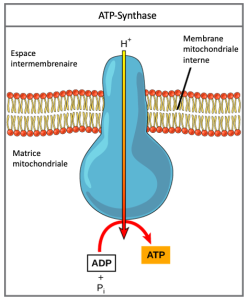
La chimiosmose (Figure 7.14) est utilisée pour produire 90 % de l’ATP produite pendant le catabolisme aérobie du glucose ; c’est aussi la méthode utilisée dans les réactions lumineuses de la photosynthèse pour exploiter l’énergie de la lumière solaire dans le processus de photophosphorylation. Rappelons que la production d’ATP par chimiosmose dans les mitochondries est appelée phosphorylation oxydative. Le résultat global de ces réactions est la production d’ATP à partir de l’énergie des électrons retirés des atomes d’hydrogène. À l’origine, ces atomes faisaient partie d’une molécule de glucose. À la fin de la voie, les électrons sont utilisés pour réduire une molécule d’oxygène en ions oxygène. Les électrons supplémentaires sur l’oxygène attirent les ions hydrogène (protons) du milieu environnant, et de l’eau se forme. Ainsi, l’oxygène est le dernier accepteur d’électrons dans la chaîne de transport des électrons.
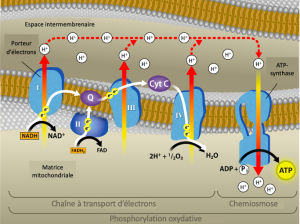
Le cyanure inhibe la cytochrome c oxydase, un composant de la chaîne de transport d’électrons. En cas d’empoisonnement au cyanure, le pH de l’espace intermembranaire devrait-il augmenter ou diminuer ? Quel serait l’effet du cyanure sur la synthèse de l’ATP ?
Rendement de l’ATP
Le nombre de molécules d’ATP générées par le catabolisme du glucose varie. Par exemple, le nombre d’ions hydrogène que les complexes de chaînes de transport d’électrons peuvent pomper à travers la membrane varie d’une espèce à l’autre. Une autre source de variance provient de la navette d’électrons à travers les membranes des mitochondries. (Le NADH généré par la glycolyse ne peut pas facilement pénétrer dans les mitochondries.) Ainsi, les électrons sont captés à l’intérieur des mitochondries par NAD+ ou FAD+. Comme vous l’avez appris plus tôt, ces molécules FAD+ peuvent transporter moins d’ions ; par conséquent, moins de molécules d’ATP sont générées lorsque le FAD+ agit comme vecteur. Le NAD+ est utilisé comme transporteur d’électrons dans le foie et le FAD+ agit dans le cerveau.
Un autre facteur qui influe sur le rendement des molécules d’ATP générées par le glucose est le fait que les composés intermédiaires dans ces voies sont également utilisés à d’autres fins. Le catabolisme du glucose est lié aux voies qui construisent ou décomposent tous les autres composés biochimiques dans les cellules, et le résultat est quelque peu plus difficile que les situations idéales décrites jusqu’à présent. Par exemple, des sucres autres que le glucose sont introduits dans la voie glycolytique pour l’extraction d’énergie. De plus, les sucres à cinq carbones qui forment les acides nucléiques sont fabriqués à partir d’intermédiaires de la glycolyse. Certains acides aminés non essentiels peuvent être fabriqués à partir d’intermédiaires de la glycolyse et du cycle de l’acide citrique. Les lipides, comme le cholestérol et les triglycérides, sont également fabriqués à partir d’intermédiaires dans ces voies, et les acides aminés et les triglycérides sont décomposés en énergie par ces voies. Dans l’ensemble, dans les systèmes vivants, ces voies de catabolisme du glucose extraient environ 34 % de l’énergie contenue dans le glucose, le reste étant libéré sous forme de chaleur.

