2.2 Eau
Objectifs d’apprentissage
À la fin de cette section, vous serez en mesure de faire ce qui suit :
- Décrire les propriétés de l’eau essentielles au maintien de la vie utile
- Expliquer pourquoi l’eau est un excellent solvant
- Fournir des exemples des propriétés cohésives et adhésives de l’eau
- Discuter du rôle des acides, des bases et des tampons dans l’homéostasie
Pourquoi les scientifiques consacrent-ils du temps à chercher de l’eau sur d’autres planètes ? Pourquoi l’eau est-elle si importante ? C’est parce que l’eau est essentielle à la vie telle que nous la connaissons. L’eau est l’une des molécules les plus abondantes et la plus essentielle à la vie sur Terre. L’eau représente environ 60 à 70 % du corps humain. Sans elle, la vie telle que nous la connaissons n’existerait tout simplement pas.
La polarité de la molécule d’eau et la liaison hydrogène qui en résulte font de l’eau une substance unique aux propriétés spéciales qui sont intimement liées aux processus de la vie. À l’origine, la vie a évolué dans un environnement aqueux, et la plus grande partie de la chimie cellulaire et du métabolisme d’un organisme se produisent à l’intérieur du contenu aqueux du cytoplasme de la cellule. Les propriétés spéciales de l’eau sont sa capacité calorifique élevée et sa chaleur latente de vaporisation, sa capacité à dissoudre les molécules polaires, ses propriétés cohésives et adhésives, et sa dissociation en ions qui entraîne la production de pH. La compréhension de ces caractéristiques de l’eau aide à élucider son importance pour le maintien de la vie.
Polarité de l’eau
L’une des propriétés importantes de l’eau est qu’elle est composée de molécules polaires : l’hydrogène et l’oxygène des molécules d’eau (H2O) forment des liaisons covalentes polaires. Bien qu’il n’y ait pas de charge nette dans une molécule d’eau, la polarité de l’eau crée une charge légèrement positive sur l’hydrogène et une charge légèrement négative sur l’oxygène, ce qui contribue aux propriétés d’attraction de l’eau. L’eau génère des charges parce que l’oxygène est plus électronégatif que l’hydrogène, ce qui rend plus probable qu’un électron partagé soit près du noyau d’oxygène que le noyau hydrogène, générant ainsi la charge négative partielle près de l’oxygène.
En raison de la polarité de l’eau, chaque molécule d’eau attire d’autres molécules d’eau en raison des charges opposées entre les molécules d’eau, formant des liaisons hydrogène. L’eau attire ou est attirée par d’autres molécules et ions polaires. Nous appelons une substance polaire qui interagit facilement avec l’eau ou qui se dissout dans l’eau hydrophile (hydro = « eau » ; -phile = « amour »). En revanche, les molécules non polaires comme les huiles et les graisses n’interagissent pas bien avec l’eau, comme le montre la Figure 2.13. La vinaigrette au vinaigre et à l’huile (une solution aqueuse acide) en est un bon exemple. Nous appelons de tels composés non polaires hydrophobes (hydro- = « eau » ; -phobe = « peur »).

États de l’eau : Gaz, liquide et solide
La formation de liaisons hydrogène est une qualité importante de l’eau liquide qui est essentielle à la vie telle que nous la connaissons. Comme les molécules d’eau établissent des liaisons hydrogène les unes avec les autres, l’eau adopte des caractéristiques chimiques uniques par rapport à d’autres liquides et, comme les êtres vivants ont une teneur élevée en eau, il est essentiel de comprendre ces caractéristiques chimiques pour comprendre la vie. Dans l’eau liquide, les liaisons hydrogène se forment et se rompent constamment lorsque les molécules d’eau glissent les unes sur les autres. Le mouvement des molécules d’eau (énergie cinétique) provoque la rupture des liaisons en raison de la chaleur contenue dans le système. Lorsque la chaleur monte à mesure que l’eau bout, l’énergie cinétique plus élevée des molécules d’eau provoque la rupture complète des liaisons hydrogène et permet aux molécules d’eau de s’échapper dans l’air sous forme de gaz (vapeur ou vapeur d’eau). Sinon, lorsque la température de l’eau diminue et que l’eau gèle, les molécules d’eau forment une structure cristalline maintenue par liaison hydrogène (il n’y a pas assez d’énergie pour rompre les liaisons hydrogène) qui rend la glace moins dense que l’eau liquide, phénomène que l’on ne voit pas lorsque d’autres liquides se solidifient.
La densité plus faible de l’eau sous sa forme solide est due à la façon dont les liaisons hydrogène s’orientent lorsqu’elles gèlent : les molécules d’eau s’écartent plus loin par rapport à l’eau liquide. Chez la plupart des autres liquides, la solidification occasionnée par une chute de température comprend la diminution de l’énergie cinétique entre les molécules, ce qui leur permet de se comprimer encore plus étroitement que sous forme liquide et de donner au solide une densité plus élevée que le liquide.
La densité plus faible de glace, comme le montre la Figure 2.14, est une anomalie qui la fait flotter à la surface de l’eau liquide, comme dans un iceberg ou des glaçons dans un verre d’eau. Dans les lacs et les étangs, de la glace se forme à la surface de l’eau, créant une barrière isolante qui protège les animaux et la flore de l’étang contre le gel. Sans cette couche de glace isolante, les plantes et les animaux vivant dans l’étang gèleraient dans le bloc de glace solide et ne pourraient pas survivre. L’expansion de la glace par rapport à l’eau liquide cause l’effet néfaste de la congélation sur les organismes vivants. Les cristaux de glace qui se forment lors de la congélation rompent les membranes délicates essentielles au fonctionnement des cellules vivantes, les endommageant irréversiblement. Les cellules ne peuvent survivre à la congélation que si un autre liquide comme le glycérol remplace temporairement l’eau qu’elles contiennent.

Capacité calorifique élevée de l’eau
La capacité calorifique élevée de l’eau est une propriété causée par la liaison hydrogène entre les molécules d’eau. L’eau a la chaleur spécifique la plus élevée de tous les liquides. Nous définissons la chaleur spécifique comme la quantité de chaleur qu’un gramme d’une substance doit absorber ou perdre pour changer sa température d’un degré Celsius. Pour l’eau, cette quantité est d’une calorie. Il faut donc beaucoup de temps à chauffer l’eau et beaucoup de temps à refroidir. En fait, la chaleur spécifique de l’eau est environ cinq fois plus élevée que celle du sable. Cela explique pourquoi la terre se rafraîchit plus rapidement que la mer. En raison de sa capacité thermique élevée, les animaux à sang chaud utilisent de l’eau pour disperser plus uniformément la chaleur dans leur corps : elle agit de la même manière que le système de refroidissement d’une voiture, transportant la chaleur des endroits chauds aux endroits froids, ce qui fait que le corps maintient une température plus uniforme.
Chaleur latente de vaporisation de l’eau
L’eau a également une chaleur latente de vaporisation élevée, soit la quantité d’énergie nécessaire pour transformer un gramme d’une substance liquide en gaz. Une quantité considérable d’énergie thermique (586 cal) est nécessaire pour accomplir ce changement dans l’eau. Ce processus se produit à la surface de l’eau. À mesure que l’eau liquide se réchauffe, la liaison hydrogène rend difficile la séparation des molécules d’eau liquide, ce qui est nécessaire pour qu’elle pénètre dans sa phase gazeuse (vapeur). Par conséquent, l’eau agit comme un dissipateur thermique ou un réservoir de chaleur et nécessite beaucoup plus de chaleur pour bouillir qu’un liquide comme l’éthanol (alcool de grain), dont la liaison hydrogène avec d’autres molécules d’éthanol est plus faible que la liaison hydrogène de l’eau. Finalement, lorsque l’eau atteint son point d’ébullition de 100° Celsius (212° Fahrenheit), la chaleur peut rompre les liaisons hydrogène entre les molécules d’eau, et l’énergie cinétique (mouvement) entre les molécules d’eau leur permet de s’échapper du liquide sous forme de gaz. Même en dessous de son point d’ébullition, les molécules individuelles de l’eau acquièrent suffisamment d’énergie des autres molécules d’eau pour que certaines molécules d’eau de surface puissent s’échapper et se vaporiser : nous appelons ce processus évaporation.
Le fait que les liaisons hydrogène doivent être rompues pour que l’eau s’évapore signifie que les liaisons utilisent une quantité importante d’énergie dans le processus. Au fur et à mesure que l’eau s’évapore, l’énergie est absorbée par le procédé, ce qui permet de refroidir l’environnement où l’évaporation a lieu. Dans de nombreux organismes vivants, y compris chez les humains, l’évaporation de la sueur, qui est à 90 % d’eau, permet à l’organisme de se refroidir afin de maintenir l’homéostasie de la température corporelle.
Propriétés du solvant de l’eau
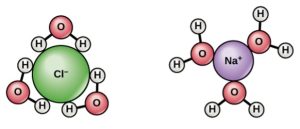
Comme l’eau est une molécule polaire avec des charges légèrement positives et légèrement négatives, les ions et les molécules polaires peuvent facilement se dissoudre dans cette molécule. Par conséquent, nous considérons l’eau comme étant un solvant, une substance capable de dissoudre d’autres molécules polaires et composés ioniques. Les charges associées à ces molécules formeront des liaisons hydrogène avec l’eau, entourant la particule avec des molécules d’eau. Nous appelons cela une sphère d’hydratation, ou une couche d’hydratation, comme l’illustre la Figure 2.15 et sert à garder les particules séparées ou dispersées dans l’eau.
Lorsque nous ajoutons des composés ioniques à l’eau, les ions individuels réagissent avec les régions polaires des molécules d’eau et leurs liaisons ioniques sont perturbées dans le processus de dissociation. La dissociation se produit lorsque des atomes ou des groupes d’atomes se détachent des molécules et forment des ions. Considérons le sel de table (NaCl ou chlorure de sodium) : lorsque nous ajoutons des cristaux de NaCl à l’eau, les molécules de NaCl se dissocient en ions Na+ et Cl– , et des sphères d’hydratation se forment autour des ions, comme l’illustre la Figure 2.15. La charge partiellement négative de l’oxygène de la molécule d’eau entoure l’ion sodium chargé positivement. La charge partiellement positive de l’hydrogène sur la molécule d’eau entoure l’ion chlorure chargé négativement.
Propriétés cohésives et adhésives de l’eau
Avez-vous déjà rempli un verre d’eau, puis ajouté lentement quelques gouttes de plus ? Avant qu’elle ne déborde, l’eau forme un dôme au-dessus du rebord du verre. Cette eau peut rester au-dessus du verre en raison de sa propriété de cohésion. En cas de cohésion, les molécules d’eau sont attirées les unes vers les autres (en raison de la liaison hydrogène), ce qui maintient les molécules ensemble à l’interface liquide-gaz (eau-air), bien qu’il n’y ait plus de place dans le verre.
La cohésion permet la tension superficielle, la capacité d’une substance à résister à la rupture lorsqu’elle est placée sous tension ou contrainte. C’est aussi pourquoi l’eau forme des gouttelettes sur une surface sèche plutôt que de s’aplatir par gravité. Lorsque nous plaçons un petit morceau de papier sur une gouttelette d’eau, le papier flotte sur le dessus même si le papier est plus dense (plus lourd) que l’eau. La cohésion et la tension superficielle maintiennent intactes les liaisons hydrogène des molécules d’eau et soutiennent l’élément flottant sur le dessus. Il est même possible de « faire flotter » une aiguille sur un verre d’eau si vous la placez doucement sans rompre la tension superficielle, comme le montre la Figure 2.16.

Ces forces cohésives sont liées à la propriété d’adhésion de l’eau ou à l’attraction entre les molécules d’eau et d’autres molécules. Cette attraction est parfois plus forte que les forces cohésives de l’eau, surtout lorsque l’eau est exposée à des surfaces chargées comme celles à l’intérieur de minces tubes de verre appelés tubes capillaires. On observe une adhérence lorsque l’eau « monte » sur le tube placé dans un verre d’eau : remarquez que l’eau semble plus haute sur les côtés du tube qu’au milieu. En effet, les molécules d’eau sont attirées par les parois de verre chargées du capillaire plus qu’elles ne le sont les unes aux autres et y adhèrent donc. Nous appelons ce type d’adhésion action capillaire, comme l’illustre la Figure 2.17.

Pourquoi les forces cohésives et adhésives sont-elles importantes à vie ? Les forces cohésives et adhésives sont importantes pour transporter l’eau des racines aux feuilles des plantes. Ces forces créent une « traction » sur la colonne d’eau. Cette attraction résulte de la tendance des molécules d’eau qui s’évaporent à la surface de la plante à rester reliées aux molécules d’eau en dessous d’elles, et donc elles sont traînées. Les plantes utilisent ce phénomène naturel pour aider à transporter l’eau de leurs racines à leurs feuilles. Sans ces propriétés de l’eau, les plantes seraient incapables de recevoir l’eau et les minéraux dissous dont elles ont besoin. Dans un autre exemple, des insectes comme le percuteur d’eau, comme le montre la Figure 2.18, utilisent la tension superficielle de l’eau pour rester à flot sur la couche superficielle de l’eau et même s’y accoupler.

pH, tampons, acides et bases
Le pH d’une solution indique son acidité ou sa basicité.
H2O(I) ↔ H+(aq) + OH−(aq)
Vous avez peut-être utilisé du papier tournesol ou du papier filtre à pH traité avec un colorant naturel soluble dans l’eau comme indicateur de pH. Il évalue la quantité d’acide (acidité) ou de base (basicité) dans une solution. Vous en avez peut-être même utilisé pour vérifier si l’eau d’une piscine est bien traitée. Dans les deux cas, le test de pH mesure la concentration des ions hydrogène dans une solution donnée.
Les ions hydrogène se génèrent spontanément dans l’eau pure par la dissociation (ionisation) d’un faible pourcentage de molécules d’eau en un nombre égal d’ions hydrogène (H+) et d’ions hydroxyde (OH–). Alors que les ions hydroxyde sont maintenus en solution par leur liaison hydrogène avec d’autres molécules d’eau, les ions hydrogène, constitués de protons nus, sont immédiatement attirés vers des molécules d’eau non ionisées, formant des ions hydronium (H3O+). Pourtant, par convention, les scientifiques font référence aux ions hydrogène et à leur concentration comme s’ils étaient libres dans cet état dans l’eau liquide.
La concentration d’ions hydrogène se dissociant de l’eau pure est de 1 × 10-7 moles d’ions H+ par litre d’eau. Les moles (mol) sont un moyen d’exprimer la quantité d’une substance (qui peut être des atomes, des molécules, des ions, etc.). Une mole représente le poids atomique d’une substance, exprimé en grammes, qui correspond à la quantité de la substance contenant autant d’unités qu’il y a d’atomes dans 12 grammes de 12C. Mathématiquement, une mole équivaut à 6,02 × 1023 particules de la substance. Par conséquent, 1 mole d’eau équivaut à 6,02 × 1023 molécules d’eau. Nous calculons le pH comme étant la valeur négative du logarithme de base 10 de cette concentration. Le log10 de 1 × 10-7 est -7,0, et la valeur négative de ce chiffre (indiqué par le « p » de « pH ») donne un pH de 7,0, qui est également un pH neutre. Le pH à l’intérieur des cellules humaines et du sang est un exemple de deux zones du corps où le pH presque neutre est maintenu.
Les lectures de pH non neutres résultent de la dissolution d’acides ou de bases dans l’eau. En utilisant le logarithme négatif pour générer des nombres entiers positifs, des concentrations élevées d’ions hydrogène produisent un faible indice de pH, tandis que de faibles niveaux d’ions hydrogène entraînent un pH élevé. Un acide est une substance qui augmente la concentration des ions hydrogène (H+ ) dans une solution, habituellement en faisant dissocier l’un de ses atomes d’hydrogène. Une base fournit des ions hydroxydes (OH–) ou d’autres ions chargés négativement qui se combinent avec des ions hydrogène, réduisant ainsi leur concentration dans la solution et augmentant ainsi le pH. Dans les cas où la base libère des ions hydroxyde, ces ions se lient aux ions hydrogène libres, générant de nouvelles molécules d’eau.
Plus l’acide est fort, plus il donne de H+ facilement. Par exemple, l’acide chlorhydrique (HCl) se dissocie complètement en ions hydrogène et chlorure et est très acide, tandis que les acides contenus dans le jus de tomate ou le vinaigre ne se dissocient pas complètement et sont des acides faibles. À l’inverse, les bases fortes sont les substances qui donnent facilement de l’OH ou qui prennent des ions hydrogène. L’hydroxyde de sodium (NaOH) et de nombreux nettoyants ménagers sont très alcalins et libère l’OH– rapidement lorsque nous les plaçons dans l’eau, augmentant ainsi le pH. Un exemple de solution basique faible est l’eau de mer, dont le pH est proche de 8,0. Ce pH est suffisamment proche d’un pH neutre que les organismes marins se sont adaptés pour vivre et prospérer dans un environnement salin.
Comme nous l’avons mentionné précédemment, l’échelle de pH est un logarithme inverse et varie de 0 à 14 (Figure 2.19). Tout ce qui est inférieur à 7,0 (allant de 0,0 à 6,9) est acide, et tout ce qui est supérieur à 7,0 (de 7,1 à 14,0) est alcalin. Les pH extrêmes de 7,0 dans les deux sens sont habituellement inhospitaliers pour la vie. Le pH à l’intérieur des cellules (6,8) et le pH dans le sang (7,4) sont tous deux très proches du neutre. Cependant, l’environnement dans l’estomac est très acide, avec un pH de 1 à 2. Par conséquent, comment les cellules de l’estomac survivent-elles dans un environnement aussi acide ? Comment maintiennent-elles de façon homéostatique le pH quasi neutre à l’intérieur ? La réponse est qu’elles ne peuvent pas le faire et qu’elles meurent constamment. L’estomac produit constamment de nouvelles cellules pour remplacer les cellules mortes, que les acides gastriques digèrent. Les scientifiques estiment que le corps humain remplace complètement la muqueuse de l’estomac tous les sept à dix jours.

Comment les organismes dont le corps a besoin d’un pH quasi neutre peuvent-ils ingérer des substances acides et basiques (un humain qui boit du jus d’orange, par exemple) et survivre ? Les tampons sont la clé. Les tampons absorbent facilement l’excès de H+ ou d’OH–, maintenant le pH du corps soigneusement dans la plage étroite requise pour la survie. Le maintien d’un pH sanguin constant est essentiel au bien-être d’une personne. Le tampon qui maintient le pH du sang humain comprend l’acide carbonique (H2CO3), l’ion bicarbonate (HCO3–) et le dioxyde de carbone (CO2). Lorsque les ions bicarbonate se combinent avec les ions hydrogène libres et deviennent de l’acide carbonique, ils éliminent les ions hydrogène et atténuent les changements de pH. De même, comme le montre la Figure 2.20, l’excès d’acide carbonique peut se transformer en gaz carbonique que nous expirons par les poumons. Cela empêche un trop grand nombre d’ions hydrogène libres de s’accumuler dans le sang et de réduire dangereusement le pH du sang. De même, si trop d’OH pénètre dans le système, l’acide carbonique se combinera avec lui pour créer du bicarbonate, ce qui abaisse le pH. Sans ce système tampon, le pH de l’organisme fluctuerait suffisamment pour mettre en péril la survie.

D’autres exemples de tampons sont les antiacides que certaines personnes utilisent pour traiter un excès d’acide gastrique. Bon nombre de ces médicaments en vente libre fonctionnent de la même manière que les tampons sanguins, habituellement avec au moins un ion capable d’absorber l’hydrogène et de modérer le pH, apportant un soulagement à ceux qui souffrent de « brûlures d’estomac » après avoir mangé. Les propriétés uniques de l’eau qui contribuent à cette capacité d’équilibrer le pH, ainsi que les autres caractéristiques de l’eau, sont essentielles au maintien de la vie sur Terre.

