2.1 Atomes, isotopes, ions et molécules : Les éléments constitutifs
Objectifs d’apprentissage
À la fin de cette section, vous serez en mesure de faire ce qui suit :
- Définir la matière et les éléments
- Décrire l’interrelation entre les protons, les neutrons et les électrons
- Comparer les façons dont les électrons peuvent être donnés ou partagés entre les atomes
- Expliquer comment les éléments naturels se combinent pour créer des molécules, des cellules, des tissus, des systèmes d’organes et des organismes
À son niveau le plus fondamental, la vie est composée de matière. La matière est toute substance qui occupe l’espace et qui a une masse. Les éléments sont des formes uniques de matière ayant des propriétés chimiques et physiques particulières qui ne peuvent pas se décomposer en substances plus petites par des réactions chimiques ordinaires. Il y a 118 éléments, mais seulement 98 sont présents à l’état naturel. Les autres éléments sont instables et obligent les scientifiques à les synthétiser en laboratoire.
Chaque élément est désigné par son symbole chimique, qui est une seule lettre majuscule ou, lorsque la première lettre est déjà « prise » par un autre élément, une combinaison de deux lettres. Certains éléments suivent le terme anglais pour l’élément, comme C pour le carbone et Ca pour le calcium. Les symboles chimiques d’autres éléments proviennent de leurs noms latins. Par exemple, le symbole du sodium est Na, faisant référence au natrium, le mot latin pour sodium.
Les quatre éléments communs à tous les organismes vivants sont l’oxygène (O), le carbone (C), l’hydrogène (H) et l’azote (N). Dans le monde non vivant, les éléments se trouvent dans des proportions différentes, et certains éléments communs aux organismes vivants sont relativement rares sur la terre, comme le montre le Tableau 2.1. Par exemple, l’atmosphère est riche en azote et en oxygène, mais contient peu de carbone et d’hydrogène, tandis que la croûte terrestre, bien qu’elle contienne de l’oxygène et une petite quantité d’hydrogène, contient peu d’azote et de carbone. Malgré leurs différences d’abondance, tous les éléments et les réactions chimiques entre eux obéissent aux mêmes lois chimiques et physiques, qu’ils fassent partie du monde vivant ou non vivant.
Tableau 2.1 Pourcentage approximative des éléments dans des organismes vivants (humains) comparé au monde non-vivant
| Élément | Vie (Humains) | Atmosphère | Croûte de la Terre |
| Oxygène (O) | 65% | 21% | 46% |
| Carbone (C) | 18% | traces | traces |
| Hydrogène (H) | 10% | traces | 0.1% |
| Azote (N) | 3% | 78% | traces |
La structure de l’atome
Pour comprendre comment les éléments se réunissent, nous devons d’abord discuter du plus petit composant ou élément de construction de l’élément, l’atome. Un atome est la plus petite unité de matière qui conserve toutes les propriétés chimiques de l’élément. Par exemple, un atome d’or possède toutes les propriétés de l’or, comme sa réactivité chimique. Une pièce d’or est simplement un très grand nombre d’atomes d’or moulés en forme de pièce de monnaie et contient de petites quantités d’autres éléments connus sous le nom d’impuretés. Nous ne pouvons pas décomposer les atomes d’or en quelque chose de plus petit tout en conservant les propriétés de l’or.
Un atome est composé de deux zones : le noyau, qui est au centre de l’atome et contient des protons et des neutrons. La zone la plus externe de l’atome maintient ses électrons en orbite autour du noyau, comme l’illustre la Figure 2.2. Les atomes contiennent des protons, des électrons et des neutrons, entre autres particules subatomiques. L’isotope le plus courant de l’hydrogène (H) est la seule exception et est composé d’un proton et d’un électron sans neutrons.

Les protons et les neutrons ont à peu près la même masse, soit environ 1,67 x 10-24 grammes. Les scientifiques définissent arbitrairement cette quantité de masse comme une unité de masse atomique (uma) ou un Dalton, comme le montre le Tableau 2.2. Bien que leur masse soit semblable, les protons et les neutrons diffèrent par leur charge électrique. Un proton est chargé positivement, tandis qu’un neutron n’est pas chargé. Par conséquent, le nombre de neutrons dans un atome contribue de façon significative à sa masse, mais pas à sa charge. Les électrons ont une masse beaucoup plus petite que les protons, pesant seulement 9,11 x 10-28 grammes, soit environ 1/1800 d’une unité de masse atomique. Par conséquent, ils ne contribuent pas beaucoup à la masse atomique globale d’un élément. Par conséquent, lorsqu’on considère la masse atomique, il est habituel d’ignorer la masse des électrons et de calculer la masse de l’atome en fonction du nombre de protons et de neutrons seulement. Bien qu’ils ne contribuent pas de façon significative à la masse, les électrons contribuent grandement à la charge de l’atome, car chaque électron a une charge négative égale à la charge positive du proton. Dans les atomes neutres non chargés, le nombre d’électrons qui orbitent le noyau est égal au nombre de protons à l’intérieur du noyau. Dans ces atomes, les charges positives et négatives s’annulent mutuellement, conduisant à un atome sans charge nette.
En tenant compte de la taille des protons, des neutrons et des électrons, la majeure partie du volume de l’atome — plus de 99 % — est l’espace vide. Avec tout cet espace vide, on peut se demander pourquoi les objets dits solides ne se traversent pas. La raison pour laquelle ils ne le font pas est que les électrons qui entourent tous les atomes sont chargés négativement et que les charges négatives se repoussent mutuellement.
Tableau 2.2. Protons, Neutrons et Électrons
| Charge | Mass (uma) | Localisation | |
| Proton | +1 | 1 | noyau |
| Neutron | 0 | 1 | noyau |
| Électron | –1 | 0 | orbitales |
Numéro atomique et masse
Les atomes de chaque élément contiennent un nombre caractéristique de protons et d’électrons. Le nombre de protons détermine le numéro atomique d’un élément, que les scientifiques utilisent pour distinguer un élément d’un autre. Le nombre de neutrons est variable, ce qui donne des isotopes, qui sont des formes différentes d’un même atome qui ne varient que par le nombre de neutrons qu’ils possèdent. Ensemble, le nombre de protons et de neutrons détermine le nombre de masse d’un élément, comme l’illustre la Figure 2.3 [lien vers Biology 2e]. Notez que nous ne tenons pas compte de la faible contribution de la masse des électrons dans le calcul du nombre de masse. Nous pouvons utiliser cette approximation de la masse pour calculer facilement le nombre de neutrons d’un élément en soustrayant simplement le nombre de protons du nombre de masse. Comme les isotopes d’un élément auront des nombres de masse légèrement différents, les scientifiques déterminent également la masse atomique, qui est la moyenne calculée du nombre de masse pour ses isotopes naturels. Souvent, le nombre obtenu contient une fraction. Par exemple, la masse atomique du chlore (Cl) est de 35,45 parce que le chlore est composé de plusieurs isotopes, certains (la majorité) ayant une masse atomique 35 (17 protons et 18 neutrons) et d’autres ayant une masse atomique 37 (17 protons et 20 neutrons).
Isotopes
Les isotopes sont des formes différentes d’un élément qui a le même nombre de protons, mais un nombre différent de neutrons. Certains éléments, comme le carbone, le potassium et l’uranium, ont des isotopes naturels. Le carbone 12 contient six protons, six neutrons et six électrons ; par conséquent, il a un nombre de masse de 12 (six protons et six neutrons). Le carbone 14 contient six protons, huit neutrons et six électrons ; sa masse atomique est de 14 (six protons et huit neutrons). Ces deux formes alternatives de carbone sont des isotopes. Certains isotopes peuvent émettre des neutrons, des protons et des électrons, et atteindre une configuration atomique plus stable (niveau d’énergie potentielle plus faible) ; il s’agit d’isotopes radioactifs ou de radio-isotopes. La désintégration radioactive (le carbone 14 se désintègre pour devenir éventuellement de l’azote 14) décrit la perte d’énergie qui se produit lorsque le noyau d’un atome instable libère un rayonnement.
Lien avec l’évolution
Datation au carbone
Le carbone est normalement présent dans l’atmosphère sous forme de composés gazeux comme le dioxyde de carbone et le méthane. Le carbone 14 (14C) est un radio-isotope naturel qui est créé dans l’atmosphère à partir du 14N (azote) atmosphérique par l’ajout d’un neutron et la perte d’un proton à cause des rayons cosmiques. Il s’agit d’un processus continu, donc plus de 14C sont toujours créés. Comme un organisme vivant incorpore le 14C initialement sous forme de dioxyde de carbone fixé dans le processus de photosynthèse, la quantité relative de 14C dans son corps est égale à la concentration de 14C dans l’atmosphère. Lorsqu’un organisme meurt, il n’ingère plus 14C, de sorte que le rapport entre 14C et 12C diminuera à mesure que le 14C se désintègre graduellement à 14N par un processus appelé désintégration bêta — émission d’électrons ou de positrons. Cette désintégration émet de l’énergie dans un processus lent.
Après environ 5 730 ans, la moitié de la concentration initiale de 14C reconvertira à 14N. Nous appelons le temps qu’il faut à la moitié de la concentration initiale d’un isotope pour se désintégrer à sa forme plus stable sa demi-vie. Parce que la demi-vie du 14C est longue, les scientifiques l’utilisent pour dater des objets autrefois vivants tels que les vieux os ou le bois. En comparant le rapport entre la concentration de 14C dans un objet et la quantité de 14C dans l’atmosphère, les scientifiques peuvent déterminer la quantité d’isotope qui ne s’est pas encore décomposée. Sur la base de ce montant, la Figure 2.4 montre que nous pouvons calculer l’âge du matériel, comme le mammouth nain, avec précision s’il n’est pas beaucoup plus vieux qu’environ 50 000 ans. D’autres éléments ont des isotopes dont les demi-vies sont différentes. Par exemple, le 40K (potassium 40) a une demi-vie de 1,25 milliard d’années et 235U (uranium 235) a une demi-vie d’environ 700 millions d’années. Grâce à la datation radiométrique, les scientifiques peuvent étudier l’âge des fossiles ou d’autres restes d’organismes disparus afin de comprendre comment les organismes ont évolué à partir d’espèces antérieures.
-

Figure 2.4 Des scientifiques peuvent déterminer l’âge des restants contenant du carbone qui sont âgées de moins d’environ 50 000 ans, comme ce mammouth, en utilisant la datation par le carbone. (crédit : Bill Faulkner, NPS)
Le tableau périodique
Le tableau périodique organise et affiche différents éléments. Conçu par le chimiste russe Dmitri Mendeleev (1834—1907) en 1869, le tableau regroupe des éléments qui, bien qu’uniques, partagent certaines propriétés chimiques avec d’autres éléments. Les propriétés des éléments sont responsables de leur état physique à température ambiante : il peut s’agir de gaz, de solides ou de liquides. Les éléments ont également une réactivité chimique spécifique, la capacité de se combiner et de se lier chimiquement les uns aux autres.
Dans le tableau périodique de la Figure 2.5, les éléments sont organisés et affichés en fonction de leur numéro atomique et sont disposés en une série de rangées et de colonnes basées sur des propriétés chimiques et physiques communes. En plus de fournir le numéro atomique de chaque élément, le tableau périodique affiche également la masse atomique de l’élément. En regardant le carbone, par exemple, son symbole (C) et son nom apparaissent, ainsi que son numéro atomique de six (dans le coin supérieur gauche) et sa masse atomique de 12,01.

Le tableau périodique regroupe les éléments en fonction des propriétés chimiques. Les scientifiques fondent les différences de réactivité chimique entre les éléments sur le nombre et la distribution spatiale des électrons d’un atome. Les atomes qui réagissent chimiquement et se lient les uns aux autres forment des molécules. Les molécules sont simplement deux atomes ou plus chimiquement liés. Logiquement, lorsque deux atomes se lient chimiquement pour former une molécule, leurs électrons, qui forment la zone la plus externe de chaque atome, se réunissent d’abord au fur et à mesure que les atomes forment une liaison chimique.
Les couches électroniques et le modèle Bohr
Il est à noter qu’il existe un lien entre le nombre de protons dans un élément, le numéro atomique qui distingue un élément d’un autre et le nombre d’électrons qu’il possède. Dans tous les atomes électriquement neutres, le nombre d’électrons est le même que le nombre de protons. Ainsi, chaque élément, au moins lorsqu’il est électriquement neutre, a un nombre caractéristique d’électrons égal à son numéro atomique.
En 1913, le scientifique danois Niels Bohr (1885—1962) a mis au point un premier modèle de l’atome. Le modèle de Bohr montre que l’atome est un noyau central contenant des protons et des neutrons, les électrons étant en orbitales circulaires à des distances spécifiques du noyau, comme l’illustre la Figure 2.6. Ces orbites forment des couches électroniques ou des niveaux d’énergie, ce qui permet de visualiser le nombre d’électrons dans les couches les plus extérieures. Ces niveaux d’énergie sont désignés par un chiffre et le symbole « n ». Par exemple, 1n représente le premier niveau d’énergie situé le plus près du noyau.
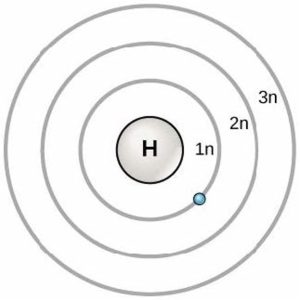
Les électrons remplissent les orbitales dans un ordre cohérent : ils remplissent d’abord les orbitales les plus proches du noyau, puis ils continuent à remplir les orbitales d’énergie croissante plus loin du noyau. S’il y a plusieurs orbitales d’énergie égale, elles se remplissent d’un électron dans chaque niveau d’énergie avant d’ajouter un deuxième électron. Les électrons du niveau d’énergie le plus externe déterminent la stabilité énergétique de l’atome et sa tendance à former des liaisons chimiques avec d’autres atomes pour former des molécules.
Dans des conditions normalisées, les atomes remplissent d’abord les enveloppes internes, ce qui entraîne souvent un nombre variable d’électrons dans la couche la plus externe. La couche la plus à l’intérieur comporte un maximum de deux électrons, mais les deux enveloppes d’électrons suivantes peuvent chacune avoir un maximum de huit électrons. C’est ce qu’on appelle la règle de l’octet, qui stipule, à l’exception de la couche la plus interne, que les atomes sont plus stables sur le plan énergétique lorsqu’ils ont huit électrons dans leur couche de valence, la couche électronique la plus externe. La Figure 2.7 [lien vers Biology 2e] montre des exemples de certains atomes neutres et de leurs configurations électroniques. Notez que dans la Figure 2.7 [lien vers Biology 2e], l’hélium a une enveloppe électronique extérieure complète, et que deux électrons remplissent sa première et seule couche. De même, le néon a une enveloppe extérieure complète de 2n contenant huit électrons. En revanche, le chlore et le sodium ont respectivement sept électrons et un électron dans leur couche extérieure, mais théoriquement, ils seraient plus stables sur le plan énergétique s’ils suivaient la règle de l’octet et en avaient huit.
Comprendre que l’organisation du tableau périodique est basée sur le nombre total de protons (et d’électrons) nous aide à savoir comment les électrons se répartissent entre les couches. Le tableau périodique est divisé en colonnes et en rangées en fonction du nombre d’électrons et de leur emplacement. Examinez de plus près certains des éléments de la colonne d’extrême droite du tableau de la Figure 2.5. Les atomes d’hélium (He), de néon (Ne) et d’argon (Ar) du groupe 18 ont tous des couches d’électrons extérieures remplies, ce qui rend inutile de partager des électrons avec d’autres atomes pour atteindre la stabilité. Ils sont très stables en tant qu’atomes uniques. Parce qu’ils ne sont pas réactifs, les scientifiques les appellent gaz inertes (ou gaz rares). Comparons cela aux éléments du groupe 1 de la colonne de gauche. Ces éléments, y compris l’hydrogène (H), le lithium (Li) et le sodium (Na), ont tous un électron dans leur couche extérieure. Cela signifie qu’ils peuvent obtenir une configuration stable et une couche extérieure remplie en donnant ou en partageant un électron avec un autre atome ou une molécule comme l’eau. L’hydrogène donnera ou partagera son électron pour atteindre cette configuration, tandis que le lithium et le sodium donneront leur électron pour devenir stables. À la suite de la perte d’un électron chargé négativement, ils deviennent des ions chargés positivement. Les éléments du groupe 17, y compris le fluor et le chlore, ont sept électrons dans leur couche extérieure, de sorte qu’ils ont tendance à remplir cette couche d’un électron provenant d’autres atomes ou molécules, ce qui en fait des ions chargés négativement. Les éléments du groupe 14, dont le carbone est le plus important pour les systèmes vivants, ont quatre électrons dans leur enveloppe extérieure, ce qui leur permet d’établir plusieurs liaisons covalentes (voir ci-dessous) avec d’autres atomes. Ainsi, les colonnes du tableau périodique représentent l’état partagé potentiel des couches d’électrons externes de ces éléments, qui est responsable de leurs caractéristiques chimiques similaires.
Orbitales d’électrons
Bien qu’utile pour expliquer la réactivité et la liaison chimique de certains éléments, le modèle de Bohr ne reflète pas exactement la façon dont les électrons se répartissent spatialement autour du noyau. Ils n’encerclent pas le noyau comme la terre tourne autour du soleil, mais nous les trouvons dans des orbitales d’électrons. Ces formes relativement complexes résultent du fait que les électrons se comportent non seulement comme des particules, mais aussi comme des ondes. Les équations mathématiques de la mécanique quantique, que les scientifiques appellent des fonctions d’onde, peuvent prédire avec un niveau défini de probabilité où un électron peut se trouver à un moment donné. Les scientifiques appellent la zone où un électron est le plus susceptible de se trouver son orbitale.
Rappelons que le modèle de Bohr illustre la configuration de la couche électronique d’un atome. À l’intérieur de chaque couche électronique se trouvent des sous-couches, et chaque sous-couche comporte un nombre déterminé d’orbitales contenant des électrons. Bien qu’il soit impossible de calculer exactement l’emplacement d’un électron, les scientifiques savent qu’il est très probablement situé à l’intérieur de sa trajectoire orbitale. Les lettres s, p, d et f désignent les sous-couches. La sous-couche s est de forme sphérique et a une orbitale. La couche principale 1n n’a qu’une seule orbitale s , qui peut contenir deux électrons. La couche principale 2n comporte une sous-couche s et une sous-couche p , et peut contenir un total de huit électrons. La sous-couche p comporte trois orbitales en forme d’haltères, comme l’illustre la Figure 2.8. Les sous-couches d et f ont des formes plus complexes et contiennent respectivement cinq et sept orbitales. Nous ne les montrons pas dans l’illustration. La couches principale 3n a des sous-couches s, p et d et peut contenir 18 électrons. La couche principale 4n a des orbitales s, p, d et f et peut contenir 32 électrons. En s’éloignant du noyau, le nombre d’électrons et d’orbitales dans les niveaux d’énergie augmente. En progressant d’un atome à l’autre dans le tableau périodique, nous pouvons déterminer la structure des électrons en ajoutant un électron supplémentaire dans la prochaine orbitale disponible.
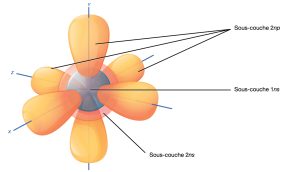
L’orbitale la plus proche du noyau, l’orbitale 1s, peut contenir jusqu’à deux électrons. Cette orbitale est équivalente à la couche électronique la plus interne du modèle de Bohr. Les scientifiques l’appellent l’orbitale 1s parce qu’elle est sphérique autour du noyau. L’orbitale 1s est l’orbitale la plus proche du noyau, et elle est toujours remplie en premier, avant tout autre remplissage orbital. L’hydrogène a un électron ; par conséquent, il n’occupe qu’un seul point à l’intérieur de l’orbitale de 1s. Nous désignons cela comme 1s1, où le 1 en exposant fait référence à l’électron à l’intérieur de l’orbitale 1s. L’hélium a deux électrons ; par conséquent, il peut remplir complètement l’orbitale 1s avec ses deux électrons. Nous désignons cela comme 1s2, en référence aux deux électrons de l’hélium dans l’orbitale de 1s. Sur la Figure 2.5 du tableau périodique, l’hydrogène et l’hélium sont les deux seuls éléments de la première rangée (période). C’est parce qu’ils n’ont que des électrons dans leur première couche, l’orbitale 1s. L’hydrogène et l’hélium sont les deux seuls éléments qui ont le 1s et aucune autre orbitale électronique à l’état neutre.
La deuxième couche électronique peut contenir huit électrons. Cette couche contient une autre orbitale sphérique et trois orbitales p en forme d’haltères, chacune pouvant contenir deux électrons, comme le montre la Figure 2.8. Après le remplissage orbital de 1s, la seconde couche électronique se remplit, remplissant d’abord son orbitale de 2s, puis ses trois orbitales p. Chaque orbitales p se remplit avec un seul électron. Une fois que chaque orbitale p a un électron, elle peut en ajouter un deuxième. Le lithium (Li) contient trois électrons qui occupent la première et la deuxième couche. Deux électrons remplissent l’orbitale 1s, et le troisième électron remplit ensuite l’orbitale 2s. Sa configuration électronique est de 1s2 2s1. Par ailleurs, le néon (Ne) a un total de dix électrons : deux sont dans son orbitale la plus interne de 1s et huit remplissent sa deuxième couches (deux dans la 2s et trois orbitales p). Il s’agit donc d’un gaz inerte et énergiquement stable sous forme d’un seul atome qui forme rarement une liaison chimique avec d’autres atomes. Les éléments plus gros ont des orbitales supplémentaires, comprenant la troisième couche d’électrons. Bien que les concepts de couches électroniques et d’orbitales soient étroitement liés, les orbitales fournissent une représentation plus précise de la configuration électronique d’un atome parce que le modèle orbital spécifie les différentes formes et orientations spéciales de toutes les zones que les électrons peuvent occuper.
Réactions chimiques et molécules
Tous les éléments sont plus stables lorsque leur couche extérieure est remplie d’électrons selon la règle de l’octet. En effet, il est énergiquement favorable pour les atomes d’être dans cette configuration et cela les rend stables. Cependant, comme tous les éléments n’ont pas assez d’électrons pour remplir leurs couches les plus extérieures, les atomes forment des liaisons chimiques avec d’autres atomes, obtenant ainsi les électrons dont ils ont besoin pour atteindre une configuration électronique stable. Lorsque deux atomes ou plus se lient chimiquement l’un à l’autre, la structure chimique résultante est une molécule. La molécule d’eau familière, H2O, est composée de deux atomes d’hydrogène et d’un atome d’oxygène. Ceux-ci se lient ensemble pour former de l’eau, comme l’illustre la Figure 2.9. Les atomes peuvent former des molécules en donnant, en acceptant ou en partageant des électrons pour remplir leurs couches extérieures.
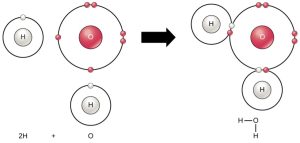
Des réactions chimiques se produisent lorsque deux atomes ou plus se lient ensemble pour former des molécules ou lorsque les atomes liés se séparent. Les scientifiques appellent les substances utilisées au début d’une réaction chimique des réactifs (habituellement sur le côté gauche d’une équation chimique), et nous appelons les substances à la fin produits de réaction (habituellement sur le côté droit d’une équation chimique). Nous dessinons habituellement une flèche entre les réactifs et les produits pour indiquer la direction de la réaction chimique. Cette direction n’est pas toujours une « voie à sens unique ». Pour créer la molécule d’eau ci-dessus, l’équation chimique serait la suivante :
2H + O → H2O
Un exemple de réaction chimique simple est la décomposition des molécules de peroxyde d’hydrogène, chacune étant constituée de deux atomes d’hydrogène liés à deux atomes d’oxygène (H2O2). Le peroxyde d’hydrogène réactif se décompose en eau, contenant un atome d’oxygène lié à deux atomes d’hydrogène (H2O), et en oxygène, qui est composé de deux atomes d’oxygène liés (O2). Dans l’équation ci-dessous, la réaction comprend deux molécules de peroxyde d’hydrogène et deux molécules d’eau. Il s’agit d’un exemple d’équation chimique équilibrée, où le nombre d’atomes de chaque élément est le même de chaque côté de l’équation. Selon la loi de conservation de la matière, le nombre d’atomes avant et après une réaction chimique doit être égal, de sorte qu’aucun atome ne soit, dans des circonstances normales, créé ou détruit.
2H2O2 (peroxyde d’hydrogène) → 2H2O (eau) + O2 (oxygène)
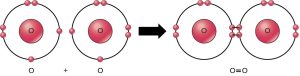
Même si tous les réactifs et produits de cette réaction sont des molécules (chaque atome reste lié à au moins un autre atome), seuls le peroxyde d’hydrogène et l’eau sont représentatifs des composés : ils contiennent des atomes de plus d’un type d’élément. Comme le montre la Figure 2.10, l’oxygène moléculaire se compose de deux atomes d’oxygène doublement liés et n’est pas classé comme composé, mais comme molécule homonucléaire.
Certaines réactions chimiques, comme celle ci-dessus, peuvent se dérouler dans une direction jusqu’à ce qu’elles perdent tous les réactifs. Les équations qui décrivent ces réactions contiennent une flèche unidirectionnelle et sont irréversibles. Les réactions réversibles sont celles qui peuvent aller dans les deux sens. Dans les réactions réversibles, les réactifs se transforment en produits, mais lorsque la concentration du produit dépasse un certain seuil (caractéristique de la réaction particulière), certains de ces produits se reconvertissent en réactifs. À ce stade, les désignations de produit et de réactif s’inversent. Ces allers-retours se poursuivent jusqu’à ce qu’un certain équilibre relatif entre les réactifs et les produits se produise — un état appelé équilibre. Une équation chimique avec une flèche à double pointes pointant vers les réactifs et les produits indique souvent ces situations réversibles.
Par exemple, dans le sang humain, les ions d’hydrogène en excès (H+) se lient aux ions bicarbonate (HCO3–) formant un état d’équilibre avec l’acide carbonique (H2CO3). Si nous ajoutons de l’acide carbonique à ce système, une partie de celui-ci se convertirait en ions bicarbonate et hydrogène.
HCO3– + H+ ↔ H2CO3
Cependant, les réactions biologiques atteignent rarement un équilibre parce que les concentrations des réactifs ou des produits, ou les deux, changent constamment, souvent lorsque le produit d’une réaction est un réactif pour un autre. Pour revenir à l’exemple de l’excès d’ions hydrogène dans le sang, la formation d’acide carbonique sera la principale direction de la réaction. Cependant, l’acide carbonique peut également quitter le corps sous forme de gaz carbonique (par exhalation) au lieu de se reconvertir en ion bicarbonate, ce qui entraîne la réaction vers la droite par la loi de l’action de masse. Ces réactions sont importantes pour maintenir l’homéostasie dans notre sang.
HCO3– + H+ ↔ H2CO3 ↔ CO2 + H2O
Ions et liaisons ioniques
Certains atomes sont plus stables lorsqu’ils gagnent ou perdent un électron (ou peut-être deux) et forment des ions. Cela remplit leur enveloppe électronique la plus externe et les rend plus stables sur le plan énergétique. Comme le nombre d’électrons n’est pas égal au nombre de protons, chaque ion a une charge nette. Les cations sont des ions positifs qui se forment en perdant des électrons. Les ions négatifs se forment en acquérant des électrons, que nous appelons des anions. Nous désignons les anions par leur nom élémentaire et changeons la fin par « -ure », de sorte que l’anion du chlore est le chlorure et l’anion du soufre est le sulfure.
Les scientifiques qualifient ce mouvement d’électrons d’un élément à un autre comme un transfert d’électrons. Comme l’illustre la Figure 2.11, le sodium (Na) ne contient qu’un électron dans son enveloppe externe. Il faut moins d’énergie pour que le sodium donne cet électron que pour accepter sept électrons de plus pour remplir la couche extérieure. Si le sodium perd un électron, il a maintenant 11 protons, 11 neutrons et seulement 10 électrons, ce qui le laisse avec une charge globale de +1. Nous l’appelons maintenant un ion sodium. Le chlore (Cl) dans son état d’énergie le plus faible (appelé état fondamental) a sept électrons dans sa couche extérieure. Encore une fois, il est plus énergetiquement efficace pour le chlore de gagner un électron que d’en perdre sept. Par conséquent, il a tendance à obtenir un électron pour créer un ion avec 17 protons, 17 neutrons et 18 électrons, ce qui lui donne une charge négative nette (-1). Nous l’appelons maintenant un ion chlorure. Dans cet exemple, le sodium donnera son seul électron pour vider sa couche, et le chlore acceptera cet électron pour remplir sa couche. Les deux ions satisfont maintenant à la règle des octets et ont des couches extérieures complètes. Comme le nombre d’électrons n’est plus égal au nombre de protons, chacun est maintenant un ion et a une charge +1 (cation sodium) ou -1 (anion chlorure). Il est à noter que ces transactions ne peuvent normalement avoir lieu que simultanément : pour qu’un atome de sodium perde un électron, il doit être en présence d’un récepteur approprié comme un atome de chlore.

Des liaisons ioniques se forment entre les ions ayant des charges opposées. Par exemple, les ions sodium chargés positivement et les ions chlorure chargés négativement se lient ensemble pour former des cristaux de chlorure de sodium, ou sel de table, créant une molécule cristalline à charge nette nulle.
Les physiologistes désignent certains sels comme des électrolytes (y compris le sodium, le potassium et le calcium), des ions nécessaires à la conduction de l’influx nerveux, des contractions musculaires et de l’équilibre hydrique. De nombreuses boissons sportives et compléments alimentaires fournissent ces ions pour remplacer ceux qui sont perdus du corps par la transpiration pendant l’exercice.
Liaisons covalentes et autres liens et interactions
Une autre façon de satisfaire à la règle de l’octet consiste à partager des électrons entre les atomes pour former des liaisons covalentes. Ces liaisons sont plus fortes et beaucoup plus communes que les liaisons ioniques dans les molécules d’organismes vivants. Nous trouvons couramment des liaisons covalentes dans les molécules organiques à base de carbone, comme notre ADN et les protéines. Nous trouvons également des liaisons covalentes dans des molécules inorganiques comme H2O, CO2 et O2. Les liaisons peuvent partager une, deux ou trois paires d’électrons, formant respectivement des liaisons simples, doubles et triples. Plus il y a de liaisons covalentes entre deux atomes, plus leur connexion est forte. Ainsi, les liaisons triples sont les plus fortes.
La force des différents niveaux de liaison covalente est l’une des principales raisons pour lesquelles les organismes vivants ont de la difficulté à acquérir de l’azote pour la construction de leurs molécules, même si l’azote moléculaire, N2, est le gaz le plus abondant dans l’atmosphère. L’azote moléculaire se compose de deux atomes d’azote triples liés l’un à l’autre et, comme pour toutes les molécules, le partage de ces trois paires d’électrons entre les deux atomes d’azote permet de remplir leurs couches électroniques externes, ce qui rend la molécule plus stable que les atomes d’azote individuels. Cette forte liaison triple rend difficile pour les systèmes vivants de séparer cet azote afin de l’utiliser comme constituant des protéines et de l’ADN.
La formation de molécules d’eau est un exemple de liaison covalente. Les liaisons covalentes lient les atomes d’hydrogène et d’oxygène qui se combinent pour former des molécules d’eau comme le montre la Figure 2.9. L’électron de l’hydrogène répartit son temps entre la couche extérieure incomplète des atomes d’hydrogène et la couche extérieure incomplète des atomes d’oxygène. Pour remplir complètement la couche extérieure de l’oxygène, qui a six électrons mais qui serait plus stable avec huit, deux électrons (un de chaque atome d’hydrogène) sont nécessaires : d’où la formule bien connue H2O. Les deux éléments partagent les électrons pour remplir la couche extérieure de chacun, ce qui les rend les plus stables.
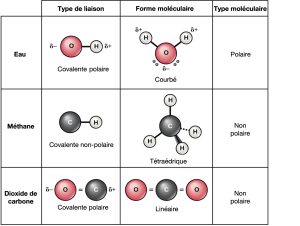
Liaisons covalentes polaires
Il existe deux types de liaisons covalentes : polaires et non polaires. Dans une liaison covalente polaire, la Figure 2.12 montre que les atomes partagent inégalement les électrons et sont plus attirés par un noyau que l’autre. En raison de la distribution inégale des électrons entre les atomes de différents éléments, une charge légèrement positive (δ+) ou légèrement négative (δ—) se développe. Cette charge partielle est une propriété importante de l’eau et est responsable pour bon nombre de ses caractéristiques.
L’eau est une molécule polaire, les atomes d’hydrogène acquérant une charge positive partielle et l’oxygène une charge négative partielle. Cela se produit parce que le noyau de l’atome d’oxygène est plus attrayant pour les électrons des atomes d’hydrogène que le noyau d’hydrogène ne l’est pour les électrons de l’oxygène. Ainsi, l’oxygène a une électronégativité plus élevée que l’hydrogène et les électrons partagés passent plus de temps près du noyau d’oxygène que le noyau des atomes d’hydrogène, ce qui donne aux atomes d’oxygène et d’hydrogène des charges légèrement négatives et positives, respectivement. Une autre façon de le dire est qu’il est plus probable de trouver un électron partagé près d’un noyau d’oxygène que de le trouver près d’un noyau d’hydrogène. Quoi qu’il en soit, l’électronégativité relative de l’atome contribue à développer des charges partielles chaque fois qu’un élément est beaucoup plus électronégatif que l’autre, et les charges générées par ces liaisons polaires peuvent ensuite être utilisées pour former des liaisons hydrogène basées sur l’attraction de charges partielles opposées. (Les liaisons hydrogène, dont nous discutons en détail ci-dessous, sont des liaisons faibles entre des atomes d’hydrogène légèrement chargés positivement et des atomes légèrement chargés négativement dans d’autres molécules.) Étant donné que les macromolécules contiennent souvent des atomes qui diffèrent par leur électronégativité, les liaisons polaires sont souvent présentes dans les molécules organiques.
Liaisons covalentes non polaires
Des liaisons covalentes non polaires se forment entre deux atomes du même élément ou entre des éléments différents qui partagent également les électrons. Par exemple, l’oxygène moléculaire (O2) est non polaire parce que les électrons se répartissent également entre les deux atomes d’oxygène.
La Figure 2.12 montre également un autre exemple de liaison covalente non polaire — le méthane (CH4). Le carbone a quatre électrons dans sa couche la plus externe et il en a besoin quatre de plus pour la remplir. Il obtient ces quatre atomes à partir de quatre atomes d’hydrogène, chaque atome fournissant un, ce qui fait une enveloppe extérieure stable de huit électrons. Le carbone et l’hydrogène n’ont pas la même électronégativité, mais sont similaires ; ainsi, des liaisons non polaires se forment. Les atomes d’hydrogène ont chacun besoin d’un électron pour leur couche la plus externe, qui est remplie lorsqu’elle contient deux électrons. Ces éléments partagent les électrons à parts égales entre les carbones et les atomes d’hydrogène, créant ainsi une molécule covalente non polaire.
Liaisons hydrogène et interactions Van Der Waals
Les liaisons ioniques et covalentes entre les éléments nécessitent de l’énergie pour se rompre. Les liaisons ioniques ne sont pas aussi fortes que les liaisons covalentes, ce qui détermine leur comportement dans les systèmes biologiques. Cependant, les liaisons ne sont pas toutes ioniques ou covalentes. Des liaisons plus faibles peuvent également se former entre les molécules. Deux liaisons faibles qui se produisent fréquemment sont les liaisons hydrogène et les interactions van der Waals. Sans ces deux types de liens, la vie telle que nous la connaissons n’existerait pas. Les liaisons hydrogène fournissent un grand nombre des propriétés essentielles et vitales de l’eau et stabilisent également les structures des protéines et de l’ADN, le bloc constitutif des cellules.
Lorsque des liaisons covalentes polaires contenant de l’hydrogène se forment, l’hydrogène contenu dans cette liaison a une charge légèrement positive parce que l’électron de l’hydrogène est tiré plus fortement vers l’autre élément et s’éloigne de l’hydrogène. Comme l’hydrogène est légèrement positif, il sera attiré par les charges négatives voisines. Lorsque cela se produit, une faible interaction se produit entre le δ+ de l’hydrogène d’une molécule et la charge δ- de la molécule sur une autre molécule avec les atomes les plus électronégatifs, habituellement l’oxygène. Les scientifiques appellent cette interaction une liaison hydrogène. Ce type de liaison est courant et se produit régulièrement entre les molécules d’eau. Les liaisons hydrogène individuelles sont faibles et facilement rompues ; toutefois, elles se produisent en très grand nombre dans l’eau et dans les polymères organiques, créant ainsi une force majeure en combinaison. Les liaisons hydrogène sont également responsables de la compression de la double hélice de l’ADN.
Tout comme les liaisons hydrogène, les interactions de van der Waals sont des attraits ou des interactions faibles entre molécules. Les attractions de van der Waals peuvent se produire entre deux molécules ou plus et dépendent de légères fluctuations des densités d’électrons, qui ne sont pas toujours symétriques autour d’un atome. Pour que ces attractions se produisent, les molécules doivent être très proches les unes des autres. Ces liaisons — ainsi que les liaisons ioniques, covalentes et hydrogène — contribuent à la structure tridimensionnelle des protéines dans nos cellules, qui est nécessaire à leur bon fonctionnement.
Connexion carrière
Chimiste pharmaceutique
Les chimistes pharmaceutiques sont chargés de mettre au point de nouveaux médicaments et d’essayer de déterminer le mode d’action des médicaments anciens et nouveaux. Ils participent à toutes les étapes du processus de mise au point de médicaments. Nous pouvons trouver des médicaments dans l’environnement naturel ou nous pouvons les synthétiser en laboratoire. Dans de nombreux cas, les chimistes changent chimiquement les médicaments potentiels de la nature en laboratoire pour les rendre plus sécuritaires et plus efficaces, et parfois des versions synthétiques de médicaments remplacent la version que nous trouvons dans la nature.
Après la découverte ou la synthèse initiale d’un médicament, le chimiste met au point le médicament, peut-être en le modifiant chimiquement, en le testant pour voir s’il est toxique, puis en concevant des méthodes pour une production efficace à grande échelle. Ensuite, le processus d’approbation du médicament à usage humain commence. Aux États-Unis, la Food and Drug Administration (FDA) s’occupe de l’approbation des médicaments. Il s’agit d’une série d’expériences à grande échelle sur des sujets humains pour s’assurer que le médicament n’est pas nocif et traite efficacement la condition pour laquelle il est destiné. Ce processus prend souvent plusieurs années et nécessite la participation de médecins et de scientifiques, en plus des chimistes, pour effectuer les tests et obtenir l’approbation.
Le paclitaxel (Taxol), un médicament anticancéreux utilisé pour traiter le cancer du sein, est un exemple d’un médicament qui a été découvert dans un organisme vivant. Ce médicament a été découvert dans l’écorce de l’if du Pacifique. Un autre exemple est l’aspirine, isolée de l’écorce de saule. Trouver des médicaments signifie souvent tester des centaines d’échantillons de plantes, de champignons et d’autres formes de vie pour voir s’ils contiennent des composés biologiquement actifs. Parfois, la médecine traditionnelle peut donner à la médecine moderne des indices sur l’endroit où trouver un composé actif. Par exemple, l’humain utilise l’écorce de saule pour fabriquer des médicaments depuis des milliers d’années, remontant à l’Égypte ancienne. Cependant, ce n’est qu’à la fin des années 1800 que les scientifiques et les compagnies pharmaceutiques ont purifié et commercialisé la molécule d’aspirine, l’acide acétylsalicylique, à des fins humaines.
À l’occasion, les médicaments mis au point pour un usage particulier ont des effets imprévus qui permettent une autre utilisation non connexe. Par exemple, les scientifiques ont initialement mis au point le médicament minoxidil (Rogaine) pour traiter l’hypertension artérielle. Lorsqu’il a été testé sur des humains, les chercheurs ont remarqué que les personnes prenant le médicament faisaient pousser de nouveaux cheveux. Finalement, la société pharmaceutique a commercialisé le médicament à des hommes et des femmes atteints d’alopécie pour restaurer les cheveux perdus.
Enfin, un chimiste pharmaceutique peut découvrir des effets négatifs ou même l’absence d’effets. Au début des années 1960, des inventeurs, des médecins et même un sénateur américain ont fait l’éloge des propriétés anticancéreuses d’un nouveau médicament, le Krebiozen, et ont commencé à le commercialiser et à le vendre de façon agressive. Grâce à la spectrométrie infrarouge, la chimiste de la FDA Alma Levant Hayden et son équipe ont découvert que le « médicament miracle » n’était rien de plus qu’un composé courant appelé créatine. La carrière d’un chimiste pharmaceutique peut comprendre le travail de détective, l’expérimentation et la mise au point de médicaments, le tout dans le but d’améliorer la santé des êtres humains.

