6.2 Énergie potentielle, cinétique, libre et d’activation
Objectifs d’apprentissage
À la fin de cette section, vous serez en mesure de faire ce qui suit :
- Définir le terme « énergie »
- Expliquer la différence entre l’énergie cinétique et l’énergie potentielle
- Discuter des concepts d’énergie libre et d’énergie d’activation
- Décrire les réactions endergoniques et exergoniques
Nous définissons l’énergie comme la capacité à effectuer un travail. Comme vous l’avez appris, l’énergie existe sous différentes formes. Par exemple, l’énergie électrique, l’énergie lumineuse et l’énergie thermique sont des types d’énergie différents. S’il s’agit là de types d’énergie familiers que l’on peut voir ou sentir, il en existe un autre qui est beaucoup moins tangible. Les scientifiques associent cette énergie à quelque chose d’aussi simple qu’un objet au-dessus du sol. Pour comprendre la manière dont l’énergie circule dans les systèmes biologiques, il est important de mieux connaître les différents types d’énergie qui existent dans le monde physique.
Types d’énergie
Lorsqu’un objet est en mouvement, il y a de l’énergie. Par exemple, un avion en vol produit une énergie considérable. En effet, les objets en mouvement sont capables d’effectuer un changement ou un travail. Pensez à une boule de démolition. Même une boule de démolition se déplaçant lentement peut causer des dommages considérables à d’autres objets. Cependant, une boule de démolition qui n’est pas en mouvement est incapable d’effectuer un travail. L’énergie des objets en mouvement est l’énergie cinétique. Une balle qui roule à toute vitesse, une personne qui marche, le mouvement rapide d’une molécule dans l’air (qui produit de la chaleur) et le rayonnement électromagnétique comme la lumière ont tous de l’énergie cinétique.
Et si nous soulevions cette même boule de démolition immobile à deux étages au-dessus d’une voiture à l’aide d’une grue ? Si la boule de démolition suspendue est immobile, peut-on lui associer de l’énergie ? La réponse est oui. La boule de démolition suspendue possède une énergie associée qui est fondamentalement différente de l’énergie cinétique des objets en mouvement. Cette forme d’énergie résulte du potentiel de travail de la boule de démolition. Si nous relâchons la boule, elle fonctionnera. Comme ce type d’énergie se réfère au potentiel de travail, nous l’appelons énergie potentielle. Les objets transfèrent leur énergie cinétique et potentielle de la manière suivante : La boule de démolition étant immobile, son énergie cinétique est nulle et son énergie potentielle est de 100 %. Une fois que la boule est libérée, son énergie cinétique commence à augmenter parce qu’elle prend de la vitesse sous l’effet de la gravité. Simultanément, en s’approchant du sol, elle perd de l’énergie potentielle. À mi-chute, elle possède 50 % d’énergie cinétique et 50 % d’énergie potentielle. Juste avant de toucher le sol, la balle a presque perdu son énergie potentielle et possède une énergie cinétique presque maximale. Parmi les autres exemples d’énergie potentielle, on peut citer l’énergie de l’eau retenue derrière un barrage (Figure 6.6) ou une personne qui s’apprête à sauter en parachute depuis un avion.

Nous associons l’énergie potentielle non seulement à l’emplacement de la matière (comme un enfant assis sur une branche d’arbre), mais aussi à la structure de la matière. Un ressort posé sur le sol possède une énergie potentielle s’il est comprimé ; il en va de même pour un élastique tendu. L’existence même des cellules vivantes dépend fortement de l’énergie potentielle structurelle. Au niveau chimique, les liaisons qui maintiennent les atomes des molécules ensemble ont une énergie potentielle. Rappelons que les voies cellulaires anaboliques nécessitent de l’énergie pour synthétiser des molécules complexes à partir de molécules plus simples, et que les voies cataboliques libèrent de l’énergie lorsque les molécules complexes se décomposent. Le fait que la rupture de certaines liaisons chimiques puisse libérer de l’énergie implique que ces liaisons ont une énergie potentielle. En fait, il y a de l’énergie potentielle stockée dans les liaisons de toutes les molécules alimentaires que nous mangeons, que nous finissons par utiliser. En effet, ces liaisons peuvent libérer de l’énergie lorsqu’elles sont rompues. Les scientifiques appellent le type d’énergie potentielle qui existe dans les liaisons chimiques et qui se libère lorsque ces liaisons se rompent l’énergie chimique (Figure 6.7). L’énergie chimique est responsable de la fourniture aux cellules vivantes de l’énergie provenant des aliments. La rupture des liaisons moléculaires au sein des molécules de carburant entraîne la libération de l’énergie.

Énergie libre
Après avoir appris que les réactions chimiques libèrent de l’énergie lorsque les liaisons qui stockent l’énergie se rompent, une autre question importante se pose : comment quantifier et exprimer les réactions chimiques avec l’énergie associée ? Comment comparer l’énergie libérée par une réaction à celle d’une autre réaction ? Nous utilisons une mesure de l’énergie libre pour quantifier ces transferts d’énergie. Les scientifiques appellent cette énergie libre l’énergie libre de Gibbs (abrégée par la lettre G), d’après Josiah Willard Gibbs, le scientifique qui a mis au point cette mesure. Selon la deuxième loi de la thermodynamique, tous les transferts d’énergie impliquent la perte d’une partie de l’énergie sous une forme inutilisable telle que la chaleur, ce qui entraîne une entropie. L’énergie libre de Gibbs se réfère spécifiquement à l’énergie qui est produite lors d’une réaction chimique et qui est disponible après avoir pris en compte l’entropie. En d’autres termes, l’énergie libre de Gibbs est l’énergie utilisable, c’est-à-dire l’énergie disponible pour effectuer un travail.
Toute réaction chimique implique une variation de l’énergie libre, appelée delta G (∆G). Nous pouvons calculer le changement d’énergie libre pour tout système qui subit un tel changement, comme une réaction chimique. Pour calculer ∆G, il faut soustraire la quantité d’énergie perdue en entropie (notée ∆S) de la variation totale d’énergie du système. L’énergie totale du système est l’enthalpie et nous la désignons par ∆H. La formule pour calculer ∆G est la suivante, où le symbole T fait référence à la température absolue en Kelvin (degrés Celsius + 273) :
∆G = ∆H − T∆S
Nous exprimons le changement d’énergie libre standard d’une réaction chimique comme une quantité d’énergie par mole du produit de la réaction (soit en kilojoules ou kilocalories, kJ/mol ou kcal/mol ; 1 kJ = 0,239 kcal) dans des conditions standard de pH, de température et de pression. Nous calculons généralement les conditions standard de pH, de température et de pression à pH 7,0 dans les systèmes biologiques, à 25 degrés Celsius et à 100 kilopascals (1 atm de pression), respectivement. Il convient de noter que les conditions cellulaires varient considérablement par rapport à ces conditions standard, de sorte que les valeurs ∆G calculées pour les réactions biologiques seront différentes à l’intérieur de la cellule.
Réactions endergoniques et réactions exergoniques
Si de l’énergie est libérée lors d’une réaction chimique, la valeur résultant de l’équation ci-dessus sera un nombre négatif. En d’autres termes, les réactions qui libèrent de l’énergie ont un ∆G < 0. Un ∆G négatif signifie également que les produits de la réaction ont moins d’énergie libre que les réactifs, car ils ont cédé de l’énergie libre au cours de la réaction. Les scientifiques appellent les réactions qui ont un ∆G négatif et qui libèrent donc de l’énergie libre des réactions exergoniques. Réfléchissez : exergoniquesignifie que l’énergie sort du système. Ces réactions sont également appelées réactions spontanées, car elles peuvent se produire sans ajouter d’énergie au système. Comprendre quelles réactions chimiques sont spontanées et libèrent de l’énergie libre est extrêmement utile pour les biologistes, car ces réactions peuvent être exploitées pour effectuer des travaux à l’intérieur de la cellule. Il faut faire une distinction importante entre le terme « spontané » et l’idée d’une réaction chimique qui se produit immédiatement. Contrairement à l’usage courant du terme, une réaction spontanée n’est pas une réaction qui se produit soudainement ou rapidement. La rouille du fer est un exemple de réaction spontanée qui se produit lentement, petit à petit, au fil du temps.
Si une réaction chimique nécessite un apport d’énergie plutôt qu’une libération d’énergie, le ∆G de cette réaction sera positif. Dans ce cas, les produits ont plus d’énergie libre que les réactifs. On peut donc considérer les produits des réactions comme des molécules stockant de l’énergie. Ces réactions chimiques sont appelées réactions endergoniques et ne sont pas spontanées. Une réaction endergonique ne se produit pas d’elle-même sans apport d’énergie libre.
Reprenons l’exemple de la synthèse et de la dégradation de la molécule alimentaire, le glucose. N’oubliez pas que la construction de molécules complexes (telles que les sucres) à partir de molécules plus simples est un processus anabolique qui nécessite de l’énergie. Par conséquent, les réactions chimiques impliquées dans les processus anaboliques sont des réactions endergoniques. Par ailleurs, le processus catabolique de décomposition du sucre en molécules plus simples libère de l’énergie dans une série de réactions exergoniques. Comme dans l’exemple de la rouille, la décomposition du sucre implique des réactions spontanées, mais ces réactions ne se produisent pas instantanément. La Figure 6.8 présente d’autres exemples de réactions endergoniques et exergoniques. Les sections suivantes fourniront plus d’informations sur ce qui est nécessaire pour que même les réactions spontanées se déroulent plus efficacement.
Lien visuel

Un concept important dans l’étude du métabolisme et de l’énergie est celui de l’équilibre chimique. La plupart des réactions chimiques sont réversibles. Elles peuvent se déplacer dans les deux sens, en libérant de l’énergie dans l’environnement dans un sens et en absorbant de l’énergie dans l’environnement dans l’autre sens (Figure 6.9). Il en va de même pour les réactions chimiques impliquées dans le métabolisme cellulaire, telles que la décomposition et la construction des protéines, respectivement en acides aminés individuels et à partir de ceux-ci. Dans un système fermé, les réactifs subissent des réactions chimiques dans les deux sens jusqu’à ce qu’ils atteignent un état d’équilibre, c’est-à-dire un état où l’énergie libre est la plus faible possible et où l’entropie est maximale. Pour éloigner les réactifs et les produits d’un état d’équilibre, il faut de l’énergie. Des réactifs ou des produits doivent être ajoutés, retirés ou modifiés. Si une cellule était un système fermé, ses réactions chimiques atteindraient l’équilibre et elle mourrait parce qu’il n’y aurait plus assez d’énergie libre pour effectuer le travail nécessaire au maintien de la vie. Dans une cellule vivante, les réactions chimiques se rapprochent constamment de l’équilibre, mais ne l’atteignent jamais. En effet, une cellule vivante est un système ouvert. Les matériaux entrent et sortent, la cellule recycle les produits de certaines réactions chimiques dans d’autres réactions, et il n’y a jamais d’équilibre chimique. Ainsi, les organismes vivants sont dans une lutte constante contre l’équilibre et l’entropie, qui demande de l’énergie. Cet apport constant d’énergie provient en fin de compte de la lumière du soleil, qui produit des nutriments dans le processus de photosynthèse.
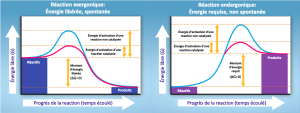
Énergie d’activation
Il existe un autre concept important à prendre en compte concernant les réactions endergoniques et exergoniques. Même les réactions exergoniques nécessitent un petit apport d’énergie avant de pouvoir procéder à leurs étapes de libération d’énergie. Ces réactions entraînent une libération nette d’énergie, mais nécessitent une certaine quantité d’énergie initiale. Les scientifiques appellent cette petite quantité d’énergie nécessaire pour que toutes les réactions chimiques se produisent l’énergie d’activation (ou énergie libre d’activation) (Figure 6.10).
Pourquoi une réaction ∆G négative, qui libère de l’énergie, a-t-elle besoin d’une certaine quantité d’énergie pour se produire ? La raison réside dans les étapes qui se déroulent lors d’une réaction chimique. Lors des réactions chimiques, certaines liaisons chimiques se brisent et de nouvelles se forment. Par exemple, lorsqu’une molécule de glucose se décompose, les liaisons entre les atomes de carbone de la molécule se brisent. Comme il s’agit de liaisons qui stockent de l’énergie, elles libèrent de l’énergie lorsqu’elles sont rompues. Cependant, pour les mettre dans un état permettant la rupture des liaisons, la molécule doit être quelque peu déformée. Un faible apport d’énergie est nécessaire pour atteindre cet état de contorsion. Cet état déformé est l’état de transition, soit un état instable à haute énergie. C’est pourquoi les molécules réactives ne restent pas longtemps dans leur état de transition, mais passent très rapidement aux étapes suivantes de la réaction chimique. Les diagrammes d’énergie libre illustrent les profils d’énergie pour une réaction donnée. Le fait que la réaction soit exergonique ou endergonique détermine si les produits du diagramme existeront dans un état énergétique inférieur ou supérieur à celui des réactifs et des produits. Cependant, indépendamment de cette mesure, l’état de transition de la réaction existe à un niveau d’énergie plus élevé que celui des réactifs, et l’énergie d’activation est donc toujours positive.
D’où provient l’énergie d’activation nécessaire aux réactifs chimiques ? La source d’énergie d’activation nécessaire pour faire avancer les réactions est généralement l’énergie thermique provenant de l’environnement. L’énergie thermique (l’énergie totale de liaison des réactifs ou des produits dans une réaction chimique) accélère le mouvement des molécules, augmentant la fréquence et la force de leurs collisions. Elle déplace également légèrement les atomes et les liaisons au sein de la molécule, les aidant ainsi à atteindre leur état de transition. C’est pourquoi le chauffage d’un système entraîne une augmentation de la fréquence des réactions chimiques au sein de ce système. L’augmentation de la pression dans un système a le même effet. Une fois que les réactifs ont absorbé suffisamment d’énergie thermique de leur environnement pour atteindre l’état de transition, la réaction se poursuit.
L’énergie d’activation d’une réaction particulière détermine la vitesse à laquelle elle se déroule. Plus l’énergie d’activation est élevée, plus la réaction chimique est lente. L’exemple de la rouille du fer illustre une réaction intrinsèquement lente. Cette réaction se produit lentement dans le temps en raison de son énergie d’activation élevée. En outre, la combustion de nombreux combustibles, qui est fortement exergonique, se produira à un taux négligeable à moins qu’une chaleur suffisante provenant d’une étincelle ne surpasse leur énergie d’activation. Cependant, lorsqu’elles commencent à brûler, les réactions chimiques dégagent suffisamment de chaleur pour poursuivre le processus de combustion, en fournissant l’énergie d’activation aux molécules de combustible environnantes. Comme pour ces réactions en dehors des cellules, l’énergie d’activation de la plupart des réactions cellulaires est trop élevée pour que l’énergie thermique puisse être surmontée de manière efficace. En d’autres termes, pour que des réactions cellulaires importantes se produisent à des taux appréciables (nombre de réactions par unité de temps), leurs énergies d’activation doivent être abaissées (Figure 6.10). Les scientifiques appellent cela la catalyse. C’est une très bonne chose pour les cellules vivantes. Les macromolécules importantes, telles que les protéines, l’ADN et l’ARN, emmagasinent une quantité considérable d’énergie et leur décomposition est exergonique. Si la température cellulaire fournissait à elle seule suffisamment d’énergie thermique pour que ces réactions exergoniques franchissent leurs
Lien visuel


