2.3 Carbone
Objectifs d’apprentissage
À la fin de cette section, vous serez en mesure de faire ce qui suit :
- Expliquer pourquoi le carbone est important pour la vie
- Décrire le rôle des groupes fonctionnels dans les molécules biologiques
De nombreuses molécules complexes appelées macromolécules, comme les protéines, les acides nucléiques (ARN et ADN), les glucides et les lipides, comprennent des cellules. Les macromolécules sont un sous-ensemble de molécules organiques (tout liquide, solide ou gaz contenant du carbone) qui sont particulièrement importantes pour la vie. La composante fondamentale de toutes ces macromolécules est le carbone. L’atome de carbone possède des propriétés uniques qui lui permettent de former des liaisons covalentes avec jusqu’à quatre atomes différents, ce qui rend cet élément polyvalent idéal pour servir de composant structurel de base, ou « squelette », des macromolécules.
Les atomes de carbone individuels ont une couche électronique incomplète la plus externe. Avec un numéro atomique de 6 (six électrons et six protons), les deux premiers électrons remplissent la couche intérieure, laissant entrer quatre électrons dans la seconde couche. Par conséquent, les atomes de carbone peuvent former jusqu’à quatre liaisons covalentes avec d’autres atomes pour satisfaire à la règle de l’octet. La molécule de méthane en donne un exemple : elle a la formule chimique CH4. Chacun de ses quatre atomes d’hydrogène forme une seule liaison covalente avec l’atome de carbone en partageant une paire d’électrons. Il en résulte une couche extérieure remplie.
Hydrocarbures
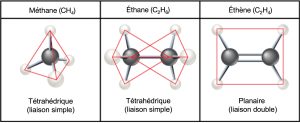
Les hydrocarbures sont des molécules organiques constituées entièrement de carbone et d’hydrogène, comme le méthane (CH4) décrit ci-dessus. Nous utilisons souvent des hydrocarbures dans notre vie quotidienne comme carburant, comme le propane dans un gril à gaz ou le butane dans un briquet. Les nombreuses liaisons covalentes entre les atomes dans les hydrocarbures emmagasinent une grande quantité d’énergie qui se libère lorsque ces molécules brûlent (oxydent). Le méthane, excellent combustible, est la molécule d’hydrocarbure la plus simple, avec un atome de carbone central lié à quatre atomes d’hydrogène différents, comme l’illustre la Figure 2.21. La forme de ses orbitales électroniques détermine la forme de la géométrie de la molécule de méthane, où les atomes résident en trois dimensions. Les carbones et les quatre atomes d’hydrogène forment un tétraèdre à quatre faces triangulaires. Pour cette raison, nous décrivons le méthane comme ayant une géométrie tétraédrique.

En tant que colonne vertébrale des grandes molécules d’êtres vivants, les hydrocarbures peuvent exister sous forme de chaînes de carbone linéaires, d’anneaux de carbone ou de combinaisons des deux. De plus, les liaisons carbone-carbone individuelles peuvent être des liaisons covalentes simples, doubles ou triples, et chaque type de liaison affecte la géométrie de la molécule d’une manière spécifique. Cette forme tridimensionnelle ou la conformation des grandes molécules de la vie (macromolécules) est essentielle à leur fonctionnement.
Chaînes d’hydrocarbures
Les liaisons successives entre les atomes de carbone forment des chaînes hydrocarbonées. Celles-ci peuvent être ramifiées ou non ramifiées. De plus, les différentes géométries de liaisons covalentes simples, doubles et triples d’une molécule modifient la géométrie globale de la molécule, comme l’illustre la Figure 2.22. Les hydrocarbures éthane, éthylène et éthyne servent d’exemples de la façon dont les différentes liaisons carbone-carbone affectent la géométrie de la molécule. Les noms des trois molécules commencent par le préfixe « eth- », qui est le préfixe de deux hydrocarbures carbonés. Les suffixes « -ane », « -ène » et « -yne » font référence à la présence de liaisons carbone-carbone simples, doubles ou triples, respectivement. Ainsi, le propane, le propène et le propyne suivent le même schéma avec trois molécules de carbone, le butane, le butène et le butyne pour quatre molécules de carbone, et ainsi de suite. Les liaisons doubles et triples modifient la géométrie de la molécule : les liaisons simples permettent une rotation le long de l’axe de la liaison ; tandis que les doubles liaisons mènent à une configuration plane et des liaisons triples à une liaison linéaire. Ces géométries ont un impact important sur la forme qu’une molécule particulière peut prendre.
Anneaux d’hydrocarbures
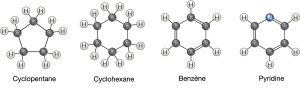
Jusqu’à présent, les hydrocarbures dont nous avons parlé sont des hydrocarbures aliphatiques, qui sont constitués de chaînes linéaires d’atomes de carbone. Un autre type d’hydrocarbure, l’hydrocarbure aromatique, est constitué de cycles fermés d’atomes de carbone avec des liaisons simples et doubles alternées. Nous trouvons des structures cycliques dans les hydrocarbures aliphatiques, parfois avec la présence de doubles liaisons, ce que nous pouvons voir en comparant la structure du cyclohexane au benzène à la Figure 2.23. Des exemples de molécules biologiques qui incorporent le cycle benzénique comprennent certains acides aminés et le cholestérol et ses dérivés, y compris les hormones oestrogène et testostérone. On trouve également le cycle benzénique dans l’herbicide 2,4-D. Le benzène est un composant naturel du pétrole brut et a été classé comme cancérogène. Certains hydrocarbures contiennent à la fois des portions aliphatiques et aromatiques. Le bêta-carotène est un exemple d’un tel hydrocarbure.
Isomères
Le placement tridimensionnel des atomes et des liaisons chimiques dans les molécules organiques est essentiel à la compréhension de leur chimie. Nous appelons des molécules qui partagent la même formule chimique, mais qui diffèrent par le placement (structure) de leurs atomes et/ou liaisons chimiques isomères. Les isomères structuraux (comme le butane et l’isobutane dans la Figure 2.24a [lien vers Biology 2e]) diffèrent par le placement de leurs liaisons covalentes : les deux molécules ont quatre carbones et dix hydrocarbures (C4H10), mais la disposition différente des atomes à l’intérieur des molécules conduit à des différences dans leurs propriétés chimiques. Par exemple, le butane peut être utilisé comme combustible pour les briquets et les torches, tandis que l’isobutane peut servir de frigorigène et de propulseur dans les bombes aérosols.
Les isomères géométriques sont alternativement des placements similaires de leurs liaisons covalentes, mais ils diffèrent dans la façon dont ces liaisons sont faites avec les atomes environnants, en particulier dans les doubles liaisons carbone-carbone. Dans la molécule simple de butène (C4H8), les deux groupes méthyle (CH3) peuvent se trouver sur un côté ou l’autre de la liaison covalente double au centre de la molécule, comme l’illustre la Figure 2.24b [lien vers Biology 2e]. Lorsque les carbones sont liés du même côté de la double liaison, il s’agit de la configuration cis. S’ils se trouvent sur des côtés opposés de la double liaison, il s’agit d’une configuration trans. Dans la configuration trans, les carbones forment une structure plus ou moins linéaire, tandis que les carbones dans la configuration cis font un virage (changement de direction) du squelette en carbone.
Dans les triglycérides (graisses et huiles), les longues chaînes carbonées connues sous le nom d’acides gras peuvent contenir des doubles liaisons, qui peuvent être en configuration cis ou trans, comme l’illustre la Figure 2.25. Les graisses ayant au moins une double liaison entre les atomes de carbone sont des graisses insaturées. Lorsque certaines de ces liaisons sont en configuration cis, la courbure qui en résulte dans le squelette carboné de la chaîne signifie que les molécules de triglycérides ne peuvent pas se rapprocher, de sorte qu’elles restent liquides (huile) à température ambiante. Par ailleurs, les triglycérides à double liaison trans (communément appelés gras trans) contiennent des acides gras relativement linéaires qui peuvent se rapprocher à température ambiante et former des graisses solides. Dans l’alimentation humaine, les gras trans sont liés à un risque accru de maladies cardiovasculaires, de sorte que de nombreux fabricants d’aliments ont réduit ou éliminé leur utilisation au cours des dernières années. Contrairement aux graisses insaturées, nous appelons les triglycérides sans double liaison entre les atomes de carbone graisses saturées, ce qui signifie qu’elles contiennent tous les atomes d’hydrogène disponibles. Les graisses saturées sont solides à température ambiante et sont habituellement d’origine animale.

Énantiomères
Les énantiomères sont des molécules qui partagent la même structure chimique et les mêmes liaisons chimiques, mais qui diffèrent par le placement tridimensionnel des atomes, de sorte qu’il s’agit d’images miroir non superposables. La Figure 2.26 montre un exemple d’acide aminé alanine, où les deux structures ne sont pas superposables. Dans la nature, les formes L des acides aminés sont prédominantes dans les protéines. Certaines formes D d’acides aminés sont observées dans les parois cellulaires des bactéries et des polypeptides d’autres organismes. De même, la forme D du glucose est le principal produit de la photosynthèse et nous voyons rarement la forme L de la molécule dans la nature.

Groupes fonctionnels
Les groupes fonctionnels sont des groupes d’atomes qui se trouvent à l’intérieur des molécules et qui confèrent des propriétés chimiques spécifiques à ces molécules. Nous les trouvons le long du « squelette carbone » des macromolécules. Des chaînes et/ou des anneaux d’atomes de carbone avec substitution occasionnelle d’un élément tel que l’azote ou l’oxygène forment ce squelette carboné. Les molécules ayant d’autres éléments dans leur squelette carboné sont des hydrocarbures substitués.
Les groupes fonctionnels d’une macromolécule sont habituellement fixés au squelette carboné à un ou plusieurs endroits différents le long de sa chaîne et/ou de sa structure annulaire. Chacun des quatre types de macromolécules — protéines, lipides, glucides et acides nucléiques — possède son propre ensemble caractéristique de groupes fonctionnels qui contribuent grandement à ses différentes propriétés chimiques et à sa fonction dans les organismes vivants.
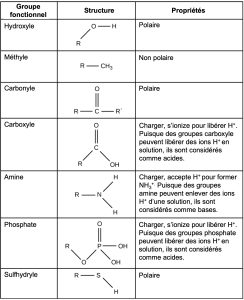
Un groupe fonctionnel peut participer à des réactions chimiques spécifiques. La Figure 2.27 montre certains des groupes fonctionnels importants dans les molécules biologiques. Ils comprennent : hydroxyle, méthyle, carbonyle, carboxyle, amino, phosphate et sulfhydryle. Ces groupes jouent un rôle important dans la formation de molécules comme l’ADN, les protéines, les glucides et les lipides. Nous classons habituellement les groupes fonctionnels comme hydrophobes ou hydrophiles selon leurs caractéristiques de charge ou de polarité. Un exemple de groupe hydrophobe est la molécule de méthyle non polaire. Parmi les groupes fonctionnels hydrophiles, on trouve le groupe carboxyle dans les acides aminés, certaines chaînes latérales d’acides aminés et les acides gras qui forment des triglycérides et des phospholipides. Ce groupe carboxyle s’ionise pour libérer des ions hydrogène (H+) du groupe COOH, ce qui donne le groupe COO– chargé négativement. Cela contribue à la nature hydrophile de toute molécule sur laquelle il se trouve. D’autres groupes fonctionnels, comme le groupe carbonyle, ont un atome d’oxygène partiellement chargé négativement qui peut former des liaisons hydrogène avec les molécules d’eau, ce qui rend la molécule plus hydrophile.
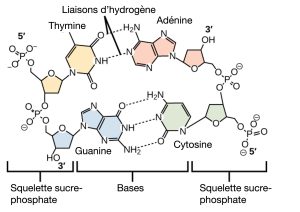
Les liaisons hydrogène entre les groupes fonctionnels (au sein d’une même molécule ou entre différentes molécules) sont importantes pour le fonctionnement de nombreuses macromolécules et les aident à se replier correctement et à maintenir la forme appropriée pour le fonctionnement. Les liaisons hydrogène sont également impliquées dans divers processus de reconnaissance, comme l’appariement de bases complémentaires de l’ADN et la liaison d’une enzyme à son substrat, comme l’illustre la Figure 2.28.