15.4 Maturation de l’ARN chez les eucaryotes
Objectifs d’apprentissage
À la fin de cette section, vous serez en mesure de faire ce qui suit :
- Décrire les différentes étapes de la maturation de l’ARNm chez les eucaryotes
- Comprendre l’importance des exons, des introns et de l’épissage pour les ARNm
- Expliquer comment les ARNt et les ARNr sont traités
Après la transcription, les pré-ARNm eucaryotes doivent subir plusieurs étapes de traitement avant d’être traduits. Les ARNt et les ARNr des eucaryotes (et des procaryotes) subissent également une transformation avant de pouvoir fonctionner comme composants de la machinerie de synthèse des protéines.
Traitement de l’ARNm
Le pré-ARNm eucaryote subit une transformation importante avant d’être prêt à être traduit. Les séquences codant pour les protéines eucaryotes ne sont pas continues, comme c’est le cas chez les procaryotes. Les séquences codantes (exons) sont interrompues par des séquences non codantes (introns), qui doivent être éliminées pour produire un ARNm traduisible. Les étapes supplémentaires de la maturation de l’ARNm eucaryote créent également une molécule dont la demi-vie est beaucoup plus longue que celle d’un ARNm procaryote. Les ARNm des eucaryotes durent plusieurs heures, alors que l’ARNm typique d’E. coli ne dure pas plus de cinq secondes.
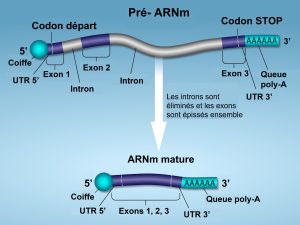
Les pré-ARNm sont d’abord recouverts de protéines stabilisant l’ARN ; celles-ci protègent le pré-ARNm de la dégradation pendant qu’il est traité et exporté hors du noyau. Les trois étapes les plus importantes du traitement du pré-ARNm sont l’ajout de facteurs de stabilisation et de signalisation aux extrémités 5′ et 3′ de la molécule, et l’élimination des introns (figure 15.11). Dans de rares cas, la transcription de l’ARNm peut être « éditée » après sa transcription.
LIEN AVEC L’ÉVOLUTION
Édition de l’ARN chez les trypanosomes
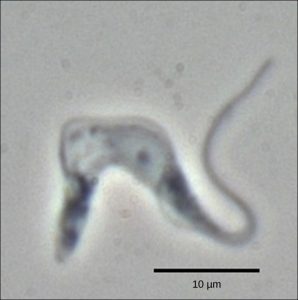
Les trypanosomes sont un groupe de protozoaires comprenant l’agent pathogène Trypanosoma brucei, qui provoque le nagana chez le bétail et la maladie du sommeil chez l’humain dans de vastes régions d’Afrique (figure 15.12). Le trypanosome est transporté par des mouches piqueuses du genre Glossina (communément appelées mouches tsé-tsé). Les trypanosomes, et pratiquement tous les autres eucaryotes, possèdent des organites appelés mitochondries qui fournissent de l’énergie chimique à la cellule. Les mitochondries sont des organites qui expriment leur propre ADN et qui seraient les vestiges d’une relation symbiotique entre un eucaryote et un procaryote englouti. L’ADN mitochondrial des trypanosomes présente une exception intéressante au dogme central : leurs pré-ARNm ne contiennent pas les informations correctes pour spécifier une protéine fonctionnelle. En général, cela est dû au fait qu’il manque plusieurs nucléotides U dans l’ARNm. La cellule effectue une étape supplémentaire de traitement de l’ARN appelée édition de l’ARN pour y remédier.
D’autres gènes du génome mitochondrial codent pour des ARN guides de 40 à 80 nucléotides. Une ou plusieurs de ces molécules interagissent par appariement de bases complémentaires avec certains des nucléotides de la transcription du pré-ARNm. Cependant, l’ARN guide possède plus de nucléotides A que le pré-ARNm n’a de nucléotides U avec lesquels il peut se lier. Dans ces régions, l’ARN guide est bouclé. Les extrémités 3′ des ARN guides ont une longue queue poly-U, et ces bases U sont insérées dans les régions de la transcription du pré-ARNm où les ARN guides sont bouclés. Ce processus est entièrement médié par les molécules d’ARN. En d’autres termes, ce sont les ARN guides, et non les protéines, qui servent de catalyseurs dans l’édition de l’ARN.
L’édition de l’ARN n’est pas un phénomène propre aux trypanosomes. Dans les mitochondries de certaines plantes, presque tous les pré-ARNm sont édités. L’édition de l’ARN a également été identifiée chez des mammifères tels que les rats, les lapins et même les humains. Quelle pourrait être la raison évolutive de cette étape supplémentaire dans le traitement du pré-ARNm? Une possibilité est que les mitochondries, vestiges d’anciens procaryotes, disposent d’une méthode tout aussi ancienne basée sur l’ARN pour réguler l’expression des gènes. À l’appui de cette hypothèse, les modifications apportées aux pré-ARNm diffèrent selon les conditions cellulaires. Bien qu’il s’agisse d’une hypothèse, le processus d’édition de l’ARN pourrait être un vestige d’une époque primordiale où les molécules d’ARN, au lieu des protéines, étaient responsables de la catalyse des réactions.
Coiffe 5′
Alors que le pré-ARNm est encore en cours de synthèse, une coiffe de 7-méthylguanosine est ajoutée à l’extrémité 5′ de l’ARN par une liaison phosphate. Ce groupe fonctionnel protège l’ARNm naissant de la dégradation. En outre, les facteurs impliqués dans la synthèse des protéines reconnaissent la coiffe pour aider à initier la traduction par les ribosomes.
Queue poly-A 3’
Une fois l’élongation terminée, le pré-ARNm est coupé par une endonucléase entre une séquence consensus AAUAAA et une séquence riche en GU, laissant la séquence AAUAAA sur le pré-ARNm. Une enzyme appelée poly-A polymérase ajoute ensuite une chaîne d’environ 200 résidus A, appelée queue poly-A. Cette modification protège davantage le pré-ARNm de la dégradation et constitue également le site de liaison d’une protéine nécessaire à l’exportation de l’ARNm traité vers le cytoplasme.
Épissage des pré-ARNm
Les gènes eucaryotes sont composés d’exons, qui correspondent à des séquences codant pour des protéines (ex-on signifie qu’elles sont exprimées), et de séquences intermédiaires appelées introns (int-ron indique leur rôle d’intermédiaire), qui peuvent être impliqués dans la régulation des gènes mais sont retirés du pré-ARNm au cours du traitement. Les séquences d’introns dans l’ARNm ne codent pas pour des protéines fonctionnelles.
La découverte des introns a surpris les chercheurs des années 1970, qui s’attendaient à ce que les pré-ARNm spécifient des séquences de protéines sans autre traitement, comme ils l’avaient observé chez les procaryotes. Les gènes des eucaryotes supérieurs contiennent très souvent un ou plusieurs introns. Ces régions peuvent correspondre à des séquences régulatrices ; cependant, la signification biologique de la présence de nombreux introns ou d’introns très longs dans un gène n’est pas claire. Il est possible que les introns ralentissent l’expression des gènes parce qu’il faut plus de temps pour transcrire les pré-ARNm contenant beaucoup d’introns. Par ailleurs, les introns peuvent être des séquences non fonctionnelles résultant de la fusion d’anciens gènes au cours de l’évolution. Cette hypothèse est étayée par le fait que des exons distincts codent souvent pour des sous-unités ou des domaines protéiques distincts. Dans la plupart des cas, les séquences d’introns peuvent être mutées sans affecter le produit protéique.
Tous les introns d’un pré-ARNm doivent être complètement et précisément éliminés avant la synthèse des protéines. Si le processus se trompe par un seul nucléotide, le cadre de lecture des exons réunis se décale et la protéine qui en résulte est dysfonctionnelle. Le processus de suppression des introns et de reconnexion des exons est appelé épissage (figure 15.13). Les introns sont enlevés et dégradés alors que le pré-ARNm se trouve encore dans le noyau. L’épissage se produit par un mécanisme spécifique à la séquence qui garantit que les introns seront supprimés et les exons réunis avec l’exactitude et la précision d’un seul nucléotide. Bien que l’intron lui-même soit non codant, le début et la fin de chaque intron sont marqués par des nucléotides spécifiques : GU à l’extrémité 5′ et AG à l’extrémité 3′ de l’intron. L’épissage des pré-ARNm est réalisé par des complexes de protéines et de molécules d’ARN appelés spliceosomes.
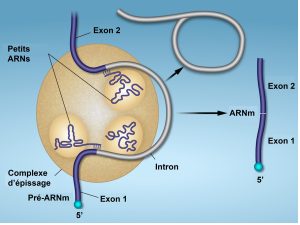
Il convient de noter que plus de 70 introns individuels peuvent être présents et que chacun d’entre eux doit subir le processus d’épissage – en plus de la coiffe 5′ et de l’ajout d’une queue poly-A – juste pour générer une seule molécule d’ARNm traduisible.
Transformation des ARNt et des ARNr
Les ARNt et les ARNr sont des molécules structurelles qui jouent un rôle dans la synthèse des protéines ; cependant, ces ARN ne sont pas eux-mêmes traduits. Les pré-ARNr sont transcrits, traités et assemblés en ribosomes dans le nucléole. Les pré-ARNt sont transcrits et traités dans le noyau, puis libérés dans le cytoplasme où ils sont liés à des acides aminés libres pour la synthèse des protéines.
La plupart des ARNt et des ARNr des eucaryotes et des procaryotes sont d’abord transcrits sous la forme d’une longue molécule-précurseur qui englobe plusieurs ARNr ou ARNt. Des enzymes clivent ensuite les précurseurs en sous-unités correspondant à chaque ARN structurel. Certaines bases des pré-ARNr sont méthylées, c’est-à-dire qu’un groupement fonctionnel méthyle (-CH3) est ajouté pour assurer la stabilité. Les molécules de pré-ARNt subissent également une méthylation. Comme pour les pré-ARNm, l’excision des sous-unités se produit dans les pré-ARNc eucaryotes destinés à devenir des ARNt ou des ARNr.
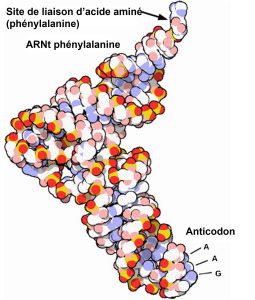
Les ARNr matures représentent environ 50 % de chaque ribosome. Certaines des molécules d’ARN d’un ribosome sont purement structurelles, tandis que d’autres ont des activités catalytiques ou de liaison. Les ARNt matures acquièrent une structure tridimensionnelle grâce à des régions locales d’appariement des bases, stabilisées par des liaisons hydrogène intramoléculaires. L’ARNt se replie pour positionner le site de liaison de l’acide aminé à une extrémité et l’anticodon à l’autre (figure 15.14). L’anticodon est une séquence de trois nucléotides dans un ARNt qui interagit avec un codon d’ARNm par appariement de bases complémentaires.