7.7 Régulation de la respiration cellulaire
Objectifs d’apprentissage
À la fin de cette section, vous serez en mesure de faire ce qui suit :
- Décrire comment l’inhibition de la rétroaction influerait sur la production d’un intermédiaire ou d’un produit dans une voie
- Identifier le mécanisme qui contrôle le taux de transport des électrons dans la chaîne de transport des électrons
La respiration cellulaire doit être régulée afin de fournir des quantités équilibrées d’énergie sous forme d’ATP. La cellule doit également générer un certain nombre de composés intermédiaires qui sont utilisés dans l’anabolisme et le catabolisme des macromolécules. Sans contrôle, les réactions métaboliques s’immobiliseraient rapidement à mesure que les réactions vers l’avant et vers l’arrière atteignaient un état d’équilibre. Les ressources seraient utilisées de façon inappropriée. Une cellule n’a pas besoin de la quantité maximale d’ATP qu’elle peut produire en tout temps : parfois, la cellule doit shunter certains des intermédiaires vers des voies de production d’acides aminés, de protéines, de glycogènes, de lipides et d’acides nucléiques. Bref, la cellule doit contrôler son métabolisme.
Mécanismes de réglementation
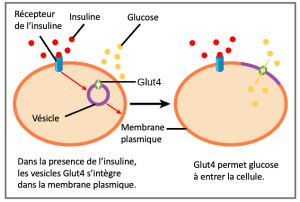
Divers mécanismes sont utilisés pour contrôler la respiration cellulaire. Il existe un certain type de contrôle à chaque stade du métabolisme du glucose. L’accès du glucose à la cellule peut être régulé à l’aide des protéines GLUT qui transportent le glucose (Figure 7.20). Différentes formes de la protéine GLUT contrôlent le passage du glucose dans les cellules de tissus spécifiques.
Certaines réactions sont contrôlées par la présence de deux enzymes différentes, une pour les deux directions d’une réaction réversible. Les réactions qui sont catalysées par une seule enzyme peuvent atteindre l’équilibre et retarder la réaction. En revanche, si deux enzymes différentes (chacune spécifique pour une direction donnée) sont nécessaires pour une réaction réversible, la possibilité de contrôler la vitesse de la réaction augmente et l’équilibre n’est pas atteint.
Un certain nombre d’enzymes impliquées dans chacune des voies, en particulier l’enzyme catalysant la première réaction engagée de la voie, sont contrôlées par la fixation d’une molécule à un site allostérique de la protéine. Les molécules les plus couramment utilisées à ce titre sont les nucléotides ATP, ADP, AMP, NAD+ et NADH. Ces régulateurs, les effecteurs allostériques, peuvent augmenter ou diminuer l’activité enzymatique, selon les conditions prédominantes. L’effecteur allostérique modifie la structure stérique de l’enzyme, ce qui affecte habituellement la configuration du site actif. Cette modification de la structure de la protéine (l’enzyme) augmente ou diminue son affinité pour son substrat, ce qui a pour effet d’augmenter ou de diminuer le taux de réaction. La fixation signale à l’enzyme. Cette liaison peut augmenter ou diminuer l’activité de l’enzyme, fournissant ainsi un mécanisme de rétroaction. Ce type de contrôle de rétroaction est efficace tant que le produit chimique qui l’affecte est attaché à l’enzyme. Une fois que la concentration globale de la substance chimique diminue, elle se diffuse loin de la protéine, et le contrôle est relâché.
Contrôle des voies cataboliques
Les enzymes, les protéines, les vecteurs d’électrons et les pompes qui jouent un rôle dans la glycolyse, le cycle de l’acide citrique et la chaîne de transport des électrons ont tendance à catalyser les réactions non réversibles. Autrement dit, si la réaction initiale a lieu, la voie s’engage à poursuivre les réactions restantes. La libération d’une activité enzymatique particulière dépend des besoins énergétiques de la cellule (comme en témoignent les niveaux d’ATP, d’ADP et d’AMP).
Glycolyse
Le contrôle de la glycolyse commence par la première enzyme de la voie, l’hexokinase (Figure 7.21). Cette enzyme catalyse la phosphorylation du glucose, ce qui aide à préparer le composé pour le clivage à une étape ultérieure. La présence du phosphate chargé négativement dans la molécule empêche également de quitter la cellule. Lorsque l’hexokinase est inhibée, le glucose se diffuse hors de la cellule et ne devient pas un substrat pour les voies respiratoires dans ce tissu. Le produit de la réaction de l’hexokinase est le glucose-6-phosphate, qui s’accumule lorsqu’une enzyme ultérieure, la phosphofructokinase, est inhibée.
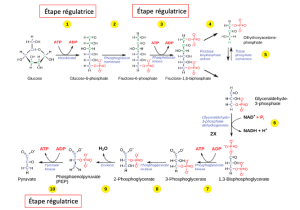
La phosphofructokinase est la principale enzyme contrôlée dans la glycolyse. Des concentrations élevées d’ATP ou de citrate ou un pH plus faible et plus acide diminuent l’activité de l’enzyme. Une augmentation de la concentration de citrate peut survenir en raison d’un blocage du cycle de l’acide citrique. La fermentation, avec sa production d’acides organiques comme l’acide lactique, explique souvent l’acidité accrue d’une cellule ; toutefois, les produits de la fermentation ne s’accumulent généralement pas dans les cellules.
La dernière étape de la glycolyse est catalysée par le pyruvate kinase. Le pyruvate produit peut être catabolisé ou converti en acide aminé alanine. Si l’on n’a pas besoin de plus d’énergie et que l’alanine est en quantité suffisante, l’enzyme est inhibée. L’activité de l’enzyme augmente lorsque les niveaux de fructose-1,6-bisphosphate augmentent. (Rappelons que le fructose-1,6-bisphosphate est un intermédiaire dans la première moitié de la glycolyse.) La régulation de la pyruvate kinase implique la phosphorylation par une kinase (pyruvate kinase), ce qui donne une enzyme moins active. La déphosphorylation par une phosphatase la réactive. Le pyruvate kinase est également réglementée par l’ATP (un effet allostérique négatif).
Si plus d’énergie est nécessaire, plus de pyruvate sera converti en acétyl-coenzyme A par l’action du pyruvate déshydrogénase. Si des groupements acétyle ou du NADH s’accumulent, la réaction est moins nécessaire et la vitesse diminue. Le pyruvate déshydrogénase est également régulé par phosphorylation : une kinase la phosphoryle pour former une enzyme inactive, et une phosphatase la réactive. La kinase et la phosphatase sont également réglementées.
Cycle de l’acide citrique
Le cycle de l’acide citrique est contrôlé par les enzymes qui catalysent les réactions qui produisent les deux premières molécules du NADH (Figure 7.11). Ces enzymes sont l’isocitrate déshydrogénase et de l’α-cétoglutarate déshydrogénase. Lorsque des niveaux adéquats d’ATP et de NADH sont disponibles, les taux de ces réactions diminuent. Lorsqu’il faut plus d’ATP, comme en témoigne la hausse des niveaux d’ADP, le taux augmente. L’alpha-cétoglutarate déshydrogénase sera également touchée par les concentrations de succinyle CoA — un intermédiaire subséquent du cycle — entraînant une diminution de l’activité. Une diminution de la vitesse de fonctionnement de la voie à ce stade n’est pas nécessairement négative, car les niveaux accrus de l’α-cétoglutarate non utilisé par le cycle de l’acide citrique peuvent être utilisés par la cellule pour la synthèse des acides aminés (glutamate).
Chaîne de transport d’électrons
Les enzymes spécifiques de la chaîne de transport des électrons ne sont pas affectées par l’inhibition de la rétroaction, mais le taux de transport des électrons par la voie est influencé par les niveaux d’ADP et d’ATP. Une plus grande consommation d’ATP par une cellule est indiquée par une accumulation d’ADP. À mesure que l’utilisation de l’ATP diminue, la concentration d’ADP diminue et, maintenant, l’ATP commence à s’accumuler dans la cellule. Ce changement dans la concentration relative de l’ADP par rapport à l’ATP déclenche le ralentissement de la chaîne de transport des électrons par la cellule.

