6.5 Enzymes
Objectifs d’apprentissage
À la fin de cette section, vous serez en mesure de faire ce qui suit :
- Décrire le rôle des enzymes dans les voies métaboliques
- Expliquer comment les enzymes fonctionnent comme des catalyseurs moléculaires
- Discuter de la régulation des enzymes par divers facteurs
Une substance qui favorise une réaction chimique est un catalyseur, et les molécules spéciales qui catalysent les réactions biochimiques sont des enzymes. Presque toutes les enzymes sont des protéines, composées de chaînes d’acides aminés, et elles ont pour tâche essentielle d’abaisser les énergies d’activation des réactions chimiques à l’intérieur de la cellule. Pour ce faire, les enzymes se lient aux molécules réactives et les maintiennent de manière à faciliter les processus de rupture et de formation des liaisons chimiques. Il est important de se rappeler que les enzymes ne modifient pas le ∆G de la réaction. En d’autres termes, ils ne changent rien au fait qu’une réaction soit exergonique (spontanée) ou endergonique. En effet, ils ne modifient pas l’énergie libre des réactifs ou des produits. Ils ne font que réduire l’énergie d’activation nécessaire pour atteindre l’état de transition (Figure 6.15).

Site actif de l’enzyme et spécificité du substrat
Les réactifs chimiques auxquels une enzyme se lie sont les substrats de l’enzyme. Il peut y avoir un ou plusieurs substrats, en fonction de la réaction chimique concernée. Dans certaines réactions, un substrat à réaction unique se décompose en plusieurs produits. Dans d’autres cas, deux substrats peuvent s’assembler pour créer une molécule plus grande. Deux réactifs peuvent également entrer dans une réaction, se modifier tous les deux et quitter la réaction sous la forme de deux produits. L’endroit de l’enzyme où le substrat se fixe est le site actif de l’enzyme. C’est là que se déroule l’« action ». Les enzymes étant des protéines, il existe une combinaison unique de résidus d’acides aminés (également chaînes latérales ou groupes R) dans le site actif. Chaque résidu est caractérisé par des propriétés différentes. Ils peuvent être grands ou petits, faiblement acides ou basiques, hydrophiles ou hydrophobes, chargés positivement ou négativement, ou neutres. La combinaison unique des résidus d’acides aminés, de leurs positions, séquences, structures et propriétés, crée un environnement chimique très spécifique au sein du site actif. Cet environnement spécifique est adapté pour se lier, même brièvement, à un (ou plusieurs) substrat(s) chimique(s) spécifique(s). C’est en raison de cette correspondance entre l’enzyme et ses substrats (qui s’adapte pour trouver le meilleur ajustement entre l’état de transition et le site actif), semblable à un casse-tête, que les enzymes sont connues pour leur spécificité. Le « meilleur ajustement » résulte de la forme et de l’attraction du groupe fonctionnel de l’acide aminé sur le substrat. Il existe une enzyme spécifiquement adaptée à chaque substrat et, par conséquent, à chaque réaction chimique, mais il existe également une certaine flexibilité.
Le fait que les sites actifs soient parfaitement adaptés à des conditions environnementales spécifiques signifie également qu’ils sont soumis à des influences environnementales locales. Il est vrai que l’augmentation de la température ambiante accroît généralement la vitesse des réactions, qu’elles soient catalysées par des enzymes ou autres. Cependant, l’augmentation ou la diminution de la température en dehors d’une plage optimale peut affecter les liaisons chimiques à l’intérieur du site actif de telle sorte qu’elles sont moins aptes à lier les substrats. Les températures élevées finissent par provoquer la dénaturation des enzymes, comme d’autres molécules biologiques, un processus qui modifie les propriétés naturelles de la substance. De même, le pH de l’environnement local peut également affecter la fonction enzymatique. Les résidus d’acides aminés du site actif ont leurs propres propriétés acides ou basiques qui sont optimales pour la catalyse. Ces résidus sont sensibles aux changements de pH qui peuvent altérer la façon dont les molécules de substrat se lient. Les enzymes sont conçues pour fonctionner au mieux dans une certaine plage de pH et, comme pour la température, des valeurs extrêmes de pH environnemental (acide ou basique) peuvent entraîner la dénaturation des enzymes.
Forme induite et fonction enzymatique
Pendant de nombreuses années, les scientifiques ont pensé que la liaison enzyme-substrat s’effectuait de manière simple, selon le principe « clé et verrou ». Ce modèle affirmait que l’enzyme et le substrat s’emboîtaient parfaitement en une seule étape instantanée. Cependant, la recherche actuelle soutient une vision plus affinée que les scientifiques appellent l’ajustement induit (Figure 6.16). Ce modèle développe le modèle « clé et verrou » en décrivant une interaction plus dynamique entre l’enzyme et le substrat. Lorsque l’enzyme et le substrat se rencontrent, leur interaction provoque un léger changement dans la structure de l’enzyme qui confirme un arrangement idéal de liaison entre l’enzyme et l’état de transition du substrat. Cette liaison idéale maximise la capacité de l’enzyme à catalyser sa réaction.
Lorsqu’une enzyme lie son substrat, elle forme un complexe enzyme-substrat. Ce complexe abaisse l’énergie d’activation de la réaction et favorise sa progression rapide de plusieurs façons. À la base, les enzymes favorisent les réactions chimiques qui impliquent plus d’un substrat en réunissant les substrats dans une orientation optimale. La région appropriée (atomes et liaisons) d’une molécule est juxtaposée à la région appropriée de l’autre molécule avec laquelle elle doit réagir. Les enzymes favorisent également la réaction du substrat en créant un environnement optimal au sein du site actif pour que la réaction se produise. Certaines réactions chimiques peuvent mieux se dérouler dans un environnement légèrement acide ou non polaire. Les propriétés chimiques qui résultent de la disposition particulière des résidus d’acides aminés dans un site actif créent l’environnement parfait pour que les substrats spécifiques d’une enzyme réagissent.
Vous avez appris que l’énergie d’activation requise pour de nombreuses réactions comprend l’énergie impliquée dans la manipulation ou la légère déformation des liaisons chimiques afin qu’elles puissent se rompre facilement et permettre à d’autres de se reformer. L’action enzymatique peut faciliter ce processus. Le complexe enzyme-substrat peut abaisser l’énergie d’activation en déformant les molécules du substrat de manière à faciliter la rupture des liaisons, ce qui permet d’atteindre l’état de transition. Enfin, les enzymes peuvent également réduire les énergies d’activation en participant à la réaction chimique elle-même. Les résidus d’acides aminés peuvent fournir certains ions ou groupes chimiques qui forment des liaisons covalentes avec les molécules de substrat, étape nécessaire du processus de réaction. Dans ces cas, il est important de se rappeler que l’enzyme retournera toujours à son état initial à la fin de la réaction. L’une des propriétés caractéristiques des enzymes est qu’elles restent finalement inchangées par les réactions qu’elles catalysent. Après avoir catalysé une réaction, une enzyme libère son (ses) produit(s).

Contrôle du métabolisme par la régulation enzymatique
L’idéal serait de disposer d’un scénario dans lequel toutes les enzymes codées dans le génome d’un organisme existeraient en abondance et fonctionneraient de manière optimale dans toutes les conditions cellulaires, dans toutes les cellules et à tout moment. En réalité, c’est loin d’être le cas. Divers mécanismes garantissent que cela ne se produise pas. Les besoins et les conditions cellulaires varient d’une cellule à l’autre et changent au sein des cellules individuelles au fil du temps. Les enzymes nécessaires et les besoins énergétiques des cellules de l’estomac sont différents de ceux des cellules de stockage des graisses, des cellules de la peau, des cellules sanguines et des cellules nerveuses. En outre, une cellule digestive travaille beaucoup plus dur pour traiter et décomposer les nutriments pendant la période qui suit de près un repas que pendant les nombreuses heures qui suivent un repas. Les quantités et la fonctionnalité des différentes enzymes varient en fonction des exigences et des conditions cellulaires.
Étant donné que les taux des réactions biochimiques sont contrôlés par l’énergie d’activation et que les enzymes abaissent et déterminent les énergies d’activation des réactions chimiques, les quantités relatives et le fonctionnement de la variété d’enzymes au sein d’une cellule déterminent en fin de compte quelles réactions se dérouleront et à quelle vitesse. Cette détermination est étroitement contrôlée. Dans certains environnements cellulaires, des facteurs environnementaux tels que le pH et la température contrôlent en partie l’activité enzymatique. Il existe d’autres mécanismes par lesquels les cellules contrôlent l’activité des enzymes et déterminent la vitesse à laquelle les différentes réactions biochimiques se produisent.
Régulation moléculaire des enzymes
Les enzymes peuvent être régulées de manière à favoriser ou à réduire leur activité. Il existe de nombreux types de molécules qui inhibent ou favorisent la fonction enzymatique, et divers mécanismes existent pour ce faire. Par exemple, dans certains cas d’inhibition enzymatique, une molécule inhibitrice est suffisamment similaire à un substrat pour se lier au site actif et empêcher simplement le substrat de se lier. Dans ce cas, l’enzyme est inhibée par inhibition compétitive, car une molécule inhibitrice entre en compétition avec le substrat pour la liaison au site actif (Figure 6.17). En revanche, dans l’inhibition non compétitive, une molécule inhibitrice se lie à l’enzyme à un endroit autre que le site actif, appelé site allostérique, mais parvient néanmoins à empêcher la liaison du substrat au site actif. Certaines molécules inhibitrices se lient aux enzymes à un endroit où leur liaison induit un changement de conformation qui réduit l’activité de l’enzyme, celle-ci ne catalysant plus efficacement la conversion du substrat en produit.
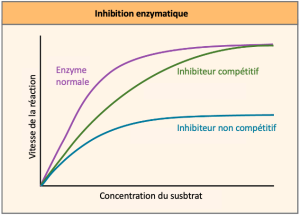
Certaines molécules inhibitrices se lient aux enzymes à un endroit où leur liaison induit un changement de conformation qui réduit l’affinité de l’enzyme pour son substrat. Ce type d’inhibition est une inhibition allostérique (Figure 6.18). La plupart des enzymes à régulation allostérique comportent plus d’un polypeptide, ce qui signifie qu’elles ont plus d’une sous-unité protéique. Lorsqu’un inhibiteur allostérique se lie à une enzyme, tous les sites actifs des sous-unités protéiques sont légèrement modifiés de sorte qu’ils lient leurs substrats avec moins d’efficacité. Il existe des activateurs allostériques et des inhibiteurs. Les activateurs allostériques se fixent à des endroits d’une enzyme éloignés du site actif, induisant un changement de conformation qui augmente l’affinité du ou des sites actifs de l’enzyme pour son ou ses substrats.

Lien quotidien
-

Figure 6.19 Vous êtes-vous demandé comment des drogues pharmaceutiques sont développés ? (crédit : Deborah Austin)
Découverte de médicaments par la recherche d’inhibiteurs d’enzymes clés dans des voies spécifiques
Les enzymes sont des composants clés des voies métaboliques. La compréhension du fonctionnement des enzymes et de la manière dont elles peuvent être régulées est un principe clé pour le développement de nombreux médicaments pharmaceutiques (Figure 6.19) sur le marché aujourd’hui. Les biologistes travaillant dans ce domaine collaborent avec d’autres scientifiques, généralement des chimistes, pour concevoir des médicaments.
Prenons l’exemple des statines, une classe de médicaments qui réduit le taux de cholestérol. Ces composés sont essentiellement des inhibiteurs de l’enzyme HMG-CoA réductase. La HMG-CoA réductase est l’enzyme qui synthétise le cholestérol à partir des lipides dans l’organisme. En inhibant cette enzyme, le médicament réduit le taux de cholestérol synthétisé dans l’organisme. De même, l’acétaminophène, populairement commercialisé sous le nom de Tylenol, est un inhibiteur de l’enzyme cyclo-oxygénase. Bien qu’il soit efficace pour soulager la fièvre et l’inflammation (douleur), les scientifiques ne comprennent pas encore complètement son mécanisme d’action.
Comment les médicaments sont-ils développés ? L’un des premiers défis du développement d’un médicament est d’identifier la molécule spécifique qu’il est censé cibler. Dans le cas des statines, la HMG-CoA réductase est la cible du médicament. Les chercheurs identifient les cibles grâce à des recherches minutieuses en laboratoire. L’identification de la cible ne suffit pas. Les scientifiques doivent également savoir comment la cible agit à l’intérieur de la cellule et quelles réactions se déroulent mal en cas de maladie. Une fois que les chercheurs ont identifié la cible et la voie d’accès, le processus de conception du médicament proprement dit commence. Au cours de cette étape, les chimistes et les biologistes travaillent ensemble pour concevoir et synthétiser des molécules capables de bloquer ou d’activer une réaction particulière. Toutefois, ce n’est qu’un début : si un prototype de médicament réussit à remplir sa fonction, il doit subir de nombreux tests, des expériences in vitro jusqu’aux essais cliniques, avant d’obtenir l’approbation de la FDA pour être mis sur le marché.
De nombreuses enzymes ne fonctionnent pas de manière optimale, voire pas du tout, si elles ne sont pas liées à d’autres molécules d’aide non protéiques spécifiques, soit de manière temporaire par des liaisons ioniques ou hydrogène, soit de manière permanente par des liaisons covalentes plus fortes. Les cofacteurs et les coenzymes sont deux types de molécules d’aide. La liaison à ces molécules favorise une conformation et une fonction optimales pour leurs enzymes respectives. Les cofacteurs sont des ions inorganiques tels que le fer (Fe++) et le magnésium (Mg++). Un exemple d’enzyme nécessitant un ion métallique comme cofacteur est l’enzyme qui construit les molécules d’ADN, l’ADN polymérase, qui a besoin d’un ion zinc lié (Zn++) pour fonctionner. Les coenzymes sont des molécules organiques auxiliaires, dont la structure atomique de base est composée de carbone et d’hydrogène, qui sont nécessaires à l’action des enzymes. Les sources les plus courantes de coenzymes sont les vitamines alimentaires (Figure 6.20). Certaines vitamines sont des précurseurs des coenzymes et d’autres agissent directement comme coenzymes. La vitamine C est une coenzyme pour de multiples enzymes qui participent à la construction du collagène, un composant important du tissu conjonctif. Une étape importante de la dégradation du glucose pour produire de l’énergie est la catalyse par un complexe multienzyme que les scientifiques appellent le pyruvate déshydrogénase. La pyruvate déshydrogénase est un complexe de plusieurs enzymes qui nécessite un cofacteur (un ion magnésium) et cinq coenzymes organiques différents pour catalyser sa réaction chimique spécifique. Par conséquent, la fonction enzymatique est en partie régulée par l’abondance de divers cofacteurs et coenzymes, que l’alimentation de la plupart des organismes fournit.
Compartimentage enzymatique
Dans les cellules eucaryotes, les molécules telles que les enzymes sont généralement compartimentées en différents organites. Cela permet un autre niveau de régulation de l’activité enzymatique. Les enzymes nécessaires à certains processus cellulaires sont parfois hébergées séparément avec leurs substrats, ce qui permet des réactions chimiques plus efficaces. Parmi les exemples de ce type de régulation enzymatique basée sur la localisation et la proximité, on peut citer les enzymes impliquées dans les dernières étapes de la respiration cellulaire, qui ont lieu exclusivement dans les mitochondries, et les enzymes impliquées dans la digestion des débris cellulaires et des matériaux étrangers, qui se trouvent dans les lysosomes.
La rétro-inhibition dans les voies métaboliques
Les molécules peuvent réguler la fonction des enzymes de plusieurs façons. Cependant, une question majeure demeure : Que sont ces molécules et d’où viennent-elles ? Certains sont des cofacteurs et des coenzymes, des ions et des molécules organiques, comme vous l’avez appris. Quelles sont les autres molécules présentes dans la cellule qui assurent la régulation enzymatique, comme la modulation allostérique et l’inhibition compétitive et non compétitive ? La réponse est qu’une grande variété de molécules peut jouer ces rôles. Il s’agit notamment de médicaments pharmaceutiques et non pharmaceutiques, de toxines et de poisons provenant de l’environnement. Les sources les plus pertinentes de molécules régulatrices d’enzymes, en ce qui concerne le métabolisme cellulaire, sont peut-être les produits des réactions métaboliques cellulaires elles-mêmes. De manière très efficace et élégante, les cellules ont évolué pour utiliser les produits de leurs propres réactions pour l’inhibition en retour de l’activité enzymatique. La rétro-inhibition consiste à utiliser le produit d’une réaction pour réguler sa propre production (Figure 6.21). La cellule répond à l’abondance de produits spécifiques en ralentissant leur production lors de réactions anaboliques ou cataboliques. Ces produits de réaction peuvent inhiber les enzymes qui ont catalysé leur production par les mécanismes que nous avons décrits ci-dessus.
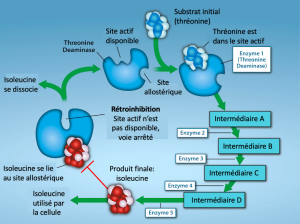
La production d’acides aminés et de nucléotides est contrôlée par une inhibition en retour. En outre, l’ATP est un régulateur allostérique de certaines des enzymes impliquées dans la dégradation catabolique du sucre, le processus qui produit l’ATP. Ainsi, lorsque l’ATP est abondante, la cellule peut empêcher sa production ultérieure. Rappelez-vous que l’ATP est une molécule instable qui peut se dissocier spontanément en ADP et en phosphate inorganique. S’il y avait trop d’ATP dans une cellule, une grande partie de l’ATP serait perdue. Par ailleurs, l’ADP sert de régulateur allostérique positif (activateur allostérique) pour certaines des mêmes enzymes que l’ATP inhibe. Ainsi, lorsque les niveaux relatifs d’ADP sont élevés par rapport à l’ATP, la cellule est incitée à produire davantage d’ATP par le biais du catabolisme des sucres.

