6.3 Les lois de la thermodynamique
Objectifs d’apprentissage
À la fin de cette section, vous serez en mesure de faire ce qui suit :
- Discuter du concept d’entropie
- Expliquer les première et deuxième lois de la thermodynamique
La thermodynamique est l’étude de l’énergie et du transfert d’énergie dans la matière physique. La matière et son environnement pertinents pour un cas particulier de transfert d’énergie sont classés comme un système, et tout ce qui se trouve en dehors de ce système est l’environnement. Par exemple, lorsqu’on chauffe une casserole d’eau sur la cuisinière, le système comprend la cuisinière, la casserole et l’eau. Transferts d’énergie à l’intérieur du système (entre la cuisinière, la casserole et l’eau). Il existe deux types de systèmes : les systèmes ouverts et les systèmes fermés. Un système ouvert est un système dans lequel l’énergie et la matière peuvent être transférées entre le système et son environnement. Le système de la cuisinière est ouvert, car il peut perdre de la chaleur dans l’air. Un système fermé est un système qui peut transférer de l’énergie, mais pas de matière à son environnement.
Les organismes biologiques sont des systèmes ouverts. Les échanges d’énergie entre eux et leur environnement, car ils consomment des molécules qui stockent de l’énergie et libèrent de l’énergie dans l’environnement en effectuant un travail. Comme toutes les choses du monde physique, l’énergie est soumise aux lois de la physique. Les lois de la thermodynamique régissent le transfert d’énergie dans et entre tous les systèmes de l’univers.
La première loi de la thermodynamique
La première loi de la thermodynamique traite de la quantité totale d’énergie dans l’univers. Elle indique que cette quantité totale d’énergie est constante. En d’autres termes, il y a toujours eu et il y aura toujours exactement la même quantité d’énergie dans l’univers. L’énergie existe sous différentes formes. Selon la première loi de la thermodynamique, l’énergie peut être transférée d’un endroit à un autre ou se transformer en différentes formes, mais elle ne peut être ni créée ni détruite. Les transferts et les transformations d’énergie ont lieu en permanence autour de nous. Les ampoules électriques transforment l’énergie électrique en énergie lumineuse. Les poêles à gaz transforment l’énergie chimique du gaz naturel en énergie thermique. Les plantes réalisent l’une des transformations énergétiques les plus utiles sur le plan biologique : la conversion de l’énergie solaire en énergie chimique stockée dans les molécules organiques (Figure 6.2). La Figure 6.11 présente des exemples de transformations énergétiques.
Le défi pour tous les organismes vivants est d’obtenir de l’énergie de leur environnement sous des formes qu’ils peuvent transférer ou transformer en énergie utilisable pour effectuer un travail. Les cellules vivantes ont évolué pour relever ce défi avec brio. L’énergie chimique stockée dans les molécules organiques telles que les sucres et les graisses est transformée par une série de réactions chimiques cellulaires en énergie dans les molécules d’ATP. L’énergie contenue dans les molécules d’ATP est facilement accessible pour effectuer un travail. Parmi les exemples de travaux que les cellules doivent effectuer, citons la construction de molécules complexes, le transport de matériaux, le mouvement de battement des cils ou des flagelles, la contraction des fibres musculaires pour créer un mouvement et la reproduction.

La deuxième loi de la thermodynamique
Les tâches principales d’une cellule vivante, à savoir l’obtention, la transformation et l’utilisation de l’énergie pour travailler, peuvent sembler simples. Cependant, la deuxième loi de la thermodynamique explique pourquoi ces tâches sont plus difficiles qu’il n’y paraît. Aucun des transferts d’énergie dont nous avons parlé, ainsi que tous les transferts et transformations d’énergie dans l’univers, n’est totalement efficace. Dans chaque transfert d’énergie, une certaine quantité d’énergie est perdue sous une forme inutilisable. Dans la plupart des cas, il s’agit d’énergie thermique. D’un point de vue thermodynamique, les scientifiques définissent l’énergie thermique comme l’énergie qui se transfère d’un système à un autre sans effectuer de travail. Par exemple, lorsqu’un avion vole dans l’air, il perd une partie de son énergie sous forme d’énergie thermique en raison du frottement avec l’air environnant. Ce frottement réchauffe l’air en augmentant temporairement la vitesse des molécules d’air. De même, une partie de l’énergie est perdue sous forme d’énergie thermique au cours des réactions métaboliques cellulaires. C’est une bonne chose pour les créatures à sang chaud comme nous, car l’énergie thermique nous aide à maintenir notre température corporelle. Au sens strict, aucun transfert d’énergie n’est totalement efficace, car une partie de l’énergie est perdue sous une forme inutilisable.
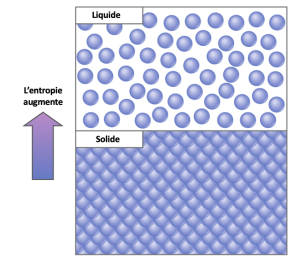
Un concept important dans les systèmes physiques est celui de l’ordre et du désordre (ou du hasard). Plus un système perd d’énergie dans son environnement, moins il est ordonné et plus il est aléatoire. Les scientifiques appellent entropie la mesure du caractère aléatoire ou désordonné d’un système. Une entropie élevée signifie un désordre important et une faible énergie (Figure 6.12). Pour mieux comprendre l’entropie, pensez à la chambre d’un étudiant. Si l’on n’y met pas d’énergie ou de travail, la pièce deviendra rapidement désordonnée. Il existerait dans un état très désordonné, à forte entropie. L’énergie doit être mise dans le système, sous la forme d’un travail et d’un rangement de la part de l’élève, afin de ramener la pièce à un état de propreté et d’ordre. Cet état est celui d’une faible entropie. De même, une voiture ou une maison doit être constamment entretenue afin de la maintenir dans un état ordonné. Laissée à elle-même, l’entropie d’une maison ou d’une voiture augmente progressivement par la rouille et la dégradation. Les molécules et les réactions chimiques ont également des quantités variables d’entropie. Par exemple, lorsque les réactions chimiques atteignent un état d’équilibre, l’entropie augmente, et lorsque les molécules à forte concentration en un endroit se diffusent et se répandent, l’entropie augmente également.
Lien scientifique
Transfert d’énergie et entropie résultante
Mettez en place une expérience simple pour comprendre comment l’énergie est transférée et comment il en résulte un changement d’entropie.
- Prenez un bloc de glace. Il s’agit d’eau sous forme solide, qui présente donc un ordre structurel élevé. Cela signifie que les molécules ne peuvent pas bouger beaucoup et qu’elles sont dans une position fixe. La température de la glace est de 0°C. Par conséquent, l’entropie du système est faible.
- Laissez fondre la glace à température ambiante. Quel est l’état des molécules dans l’eau liquide ? Comment le transfert d’énergie a-t-il eu lieu ? L’entropie du système est-elle plus ou moins élevée ? Pourquoi ?
- Chauffez l’eau jusqu’au point d’ébullition. Qu’arrive-t-il à l’entropie du système lorsque l’eau est chauffée ?
Pensez à tous les systèmes physiques de cette manière : les êtres vivants sont très ordonnés et ont besoin d’un apport constant d’énergie pour se maintenir dans un état de faible entropie. Lorsque les systèmes vivants absorbent des molécules stockant de l’énergie et les transforment par le biais de réactions chimiques, ils perdent une certaine quantité d’énergie utilisable au cours du processus, car aucune réaction n’est totalement efficace. Elles produisent également des déchets et des sous-produits qui ne sont pas des sources d’énergie utiles. Ce processus augmente l’entropie de l’environnement du système. Étant donné que tout transfert d’énergie entraîne une perte d’énergie utilisable, la deuxième loi de la thermodynamique stipule que tout transfert ou transformation d’énergie augmente l’entropie de l’univers. Même si les êtres vivants sont très ordonnés et maintiennent un état de faible entropie, l’entropie totale de l’univers augmente constamment en raison de la perte d’énergie utilisable à chaque transfert d’énergie qui se produit. Essentiellement, les êtres vivants mènent un combat permanent contre l’augmentation constante de l’entropie universelle.