10.3 Le contrôle du cycle cellulaire
Objectifs d’apprentissage
À la fin de cette section, vous serez en mesure de :
- Comprendre comment le cycle cellulaire est contrôlé par des mécanismes qui sont à la fois internes et externes à la cellule
- Expliquer comment les trois « points de contrôle » internes surviennent à la fin de la phase G1, à la transition entre les phases G2 et M et durant la métaphase
- Décrire les molécules qui contrôlent le cycle cellulaire grâce à une régulation positive et négative
La durée du cycle cellulaire est extrêmement variable, même au sein des cellules d’un organisme unicellulaire. Chez les humains, la fréquence du renouvellement cellulaire va de quelques heures, au premier stade du développement embryonnaire, à une moyenne de deux à cinq jours pour les cellules épithéliales, jusqu’à une vie humaine entière passée en phase G0 pour des cellules spécialisées, comme les neurones du cortex ou les cellules du muscle cardiaque.
Le temps qu’une cellule passe dans chaque phase du cycle cellulaire varie également. Lorsque des cellules de mammifères à prolifération rapide sont développées en culture (en dehors de l’organisme sous des conditions de culture optimales), le cycle cellulaire dure environ 24 heures. Dans les cellules humaines à prolifération rapide avec un cycle cellulaire de 24 heures, la phase G1 dure environ neuf heures, la phase S dure 10 heures, la phase G2 dure environ 4 heures 30 et la phase M dure approximativement 30 minutes. À titre de comparaison, dans les ovules fécondés (et embryons précoces) des mouches à fruits, le cycle cellulaire est terminé en huit minutes environ. Ceci s’explique parce que le noyau de l’ovule fécondé se divise de nombreuses fois par la mitose, mais ne subit pas de cytocinèse avant qu’un « zygote » multinucléé ne soit produit, avec de nombreux noyaux situés le long de la périphérie de la membrane cellulaire, ce qui raccourcit la durée du cycle de la division cellulaire. Chez les « invertébrés » et les « vertébrés », le moment où les événements du cycle cellulaire se produisent est contrôlé par des mécanismes qui sont à la fois internes et externes à la cellule.
Régulation du cycle cellulaire par des événements externes
L’initiation et l’inhibition de la division cellulaire sont toutes les deux déclenchées par des événements externes à la cellule lorsqu’elle est sur le point d’entamer le processus de réplication. Un événement peut être aussi simple que la mort de cellules voisines ou aussi radical que la sécrétion d’hormones de croissance, comme l’hormone de croissance humaine (HGH ou hGH). Un manque de HGH peut inhiber la division cellulaire, provoquant le nanisme, alors qu’un excès de HGH peut causer le gigantisme. L’entassement des cellules peut aussi inhiber la division cellulaire. Pas contraste, la taille de la cellule est un facteur susceptible d’initier la division cellulaire : À mesure que la cellule grossit, elle devient inefficace sur le plan physiologique, en raison de l’accroissement de son rapport surface/volume. La solution à ce problème est la division.
Quelle que soit la source du message, la cellule en reçoit le signal et une série d’événements à l’intérieur de la cellule lui permettent d’entrer en interphase. À partir de ce moment-là, il faut que chaque paramètre nécessaire à chacune des phases du cycle cellulaire soit présent sinon le cycle ne peut continuer.
Régulation aux points de contrôle internes
Il est essentiel que les cellules filles créées soient la réplication exacte de la cellule mère. Des erreurs dans la réplication ou la distribution des chromosomes entraînent des mutations qui peuvent être transmises à chaque nouvelle cellule produite à partir d’une cellule anormale. Pour éviter qu’une cellule compromise continue de se diviser, des mécanismes de surveillance internes interviennent aux trois principaux points de contrôle du cycle cellulaire : Un point de contrôle est l’un des nombreux points du cycle d’une cellule eucaryote capable d’arrêter la progression d’une cellule vers l’étape suivante jusqu’à ce que les conditions soient de nouveau favorables. Ces points de contrôle sont situés à la fin de la phase G1, à la transition entre G2 et M, et durant la métaphase (Figure 10.11).
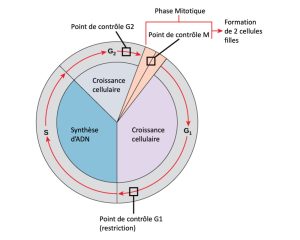
Le point de contrôle G1
Le point de contrôle G1 détermine si les conditions sont favorables pour que la division cellulaire puisse se poursuivre. Le point de contrôle G1, aussi appelé le point de restriction (dans les levures), est l’endroit où la cellule s’engage irréversiblement dans le processus de la division cellulaire. Des facteurs externes, comme les facteurs de croissance, influencent énormément le passage d’une cellule à travers le point de contrôle G1. En plus de vérifier si les réserves et la taille de la cellule sont adéquates, le point de contrôle G1 examine si l’ADN génomique a subi une lésion éventuelle. Une cellule qui ne satisfait pas à tous les critères ne pourra progresser vers la phase S. La cellule peut interrompre le cycle et essayer de corriger la condition problématique, ou alors, elle peut se diriger vers la phase G0 et attendre de recevoir des signaux additionnels lorsque les conditions s’améliorent.
Le point de contrôle G2
Le point de contrôle G2 interdit l’entrée dans la phase mitotique si certaines conditions ne sont pas remplies. Tout comme au point de contrôle G1, la taille de la cellule et les réserves de protéines sont évaluées. Toutefois, le rôle le plus important du point de contrôle G2 est de veiller à ce que les chromosomes aient été répliqués et que l’ADN répliqué n’ait subi aucune lésion. Si les mécanismes du point de contrôle détectent des problèmes avec l’ADN, le cycle cellulaire est arrêté, et la cellule essaie de terminer la réplication de l’ADN ou de réparer l’ADN endommagé.
Le point de contrôle M
Le point de contrôle M entre en jeu lorsque l’étape de la métaphase de la caryocinèse est presque terminée. Le point de contrôle M est également connu sous le nom de point de contrôle du fuseau, parce qu’il détermine si les chromatides sœurs sont correctement attachées aux microtubules du fuseau. Sachant que la séparation des chromatides sœurs durant l’anaphase est une étape irréversible, le cycle ne peut progresser que lorsque les kinétochores de chaque paire de chromatides sœurs sont fermement attachés à au moins deux fibres du fuseau issues des pôles opposés de la cellule.
Lien vers l’apprentissage
Regardez ce qui se passe aux points de contrôle G1, G2 et M en visitant ce site Web (http://openstax.org/l/cell_checkpnts) pour visualiser une animation du cycle cellulaire (en anglais).
Molécules régulatrices du cycle cellulaire
En plus des points de contrôle internes, il existe deux groupes de molécules intracellulaires qui régulent le cycle cellulaire. Ces molécules régulatrices peuvent soit favoriser la progression de la cellule vers la phase suivante (régulation positive), soit l’interrompre (régulation négative). Les molécules régulatrices peuvent agir individuellement, ou elles peuvent influer sur l’activité ou la production d’autres protéines régulatrices. Par conséquent, la défaillance d’une seule molécule régulatrice n’aura probablement aucun effet sur le cycle cellulaire, surtout si plus d’un mécanisme contrôle le même événement. Une molécule régulatrice qui fonctionne mal ou pas du tout peut cependant avoir des répercussions vastes et potentiellement fatales à la cellule si de multiples processus sont affectés.
Régulation positive du cycle cellulaire
Deux groupes de protéines, les cyclines et les kinases cycline-dépendantes (Cdk) sont des protéines régulatrices positives. Elles sont responsables de la progression de la cellule à travers les divers points de contrôle. Au cours du cycle cellulaire, les niveaux des quatre cyclines fluctuent selon un parcours prévisible (Figure 10.12). Des signaux externes et internes déclenchent des augmentations de la concentration des cyclines. Après que la cellule passe à la prochaine étape du cycle cellulaire, les cyclines qui étaient activées à l’étape précédente sont dégradées par des enzymes cytoplasmiques, comme le montre la Figure 10.12 ci-dessous.
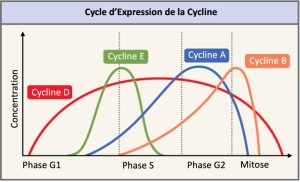
Les cyclines régulent le cycle cellulaire uniquement lorsqu’elles sont étroitement liées aux Cdk. Pour être totalement activé, le complexe Cycline/Cdk doit également être phosphorylé dans des endroits spécifiques pour activer le complexe. Comme toutes les kinases, les Cdk sont des enzymes (kinases) qui, à leur tour, phosphorylent d’autres protéines. La phosphorylation active la protéine en changeant sa forme. Les protéines phosphorylées par des Cdk interviennent dans la progression de la cellule vers la prochaine phase. (Figure 10.13). Les niveaux de Cdk sont relativement stables au cours du cycle cellulaire; cependant, les concentrations de cyclines fluctuent et déterminent le moment où sont formés les complexes Cycline/Cdk. Les différentes cyclines et kinases cycline-dépendantes se lient à des moments précis dans le cycle cellulaire et par conséquent, elles interviennent dans la régulation de différents points de contrôle.
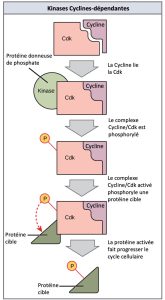
Les fluctuations cycliques des niveaux de cyclines étant largement dépendantes du stade du cycle cellulaire, et non d’événements spécifiques, la régulation du cycle cellulaire se fait généralement par des molécules Cdk seules ou par des complexes Cycline/Cdk. Sans une concentration particulière de complexes Cycline/Cdk complètement activés, le cycle cellulaire ne peut pas passer à travers les points de contrôle.
Bien que les cyclines soient les principales molécules régulatrices qui déterminent l’élan vers l’avant du cycle cellulaire, il existe plusieurs autres mécanismes qui règlent avec précision la progression du cycle avec des effets négatifs, plutôt que positifs. Ces mécanismes vont essentiellement bloquer la progression du cycle cellulaire jusqu’à ce que les conditions problématiques soient résolues. Les molécules qui empêchent l’activation complète des Cdk s’appellent des inhibiteurs de Cdk. Nombre de ces molécules inhibitrices surveillent, directement ou indirectement, un événement particulier du cycle cellulaire. Les molécules inhibitrices ne débloqueront les Cdk que lorsqu’un événement particulier qu’elles surveillent sera achevé.
Régulation négative du cycle cellulaire
Le second groupe de molécules qui interviennent dans la régulation du cycle cellulaire est constitué de molécules régulatrices négatives qui interrompent le cycle cellulaire. Rappelons-nous que dans la régulation positive, les molécules actives favorisent la progression du cycle.
La protéine du rétinoblastome (Rb), la p53 et la p21 sont les molécules régulatrices négatives les mieux comprises. Les protéines du rétinoblastome sont un groupe de protéines présentes dans de nombreuses cellules qui interviennent dans la suppression des tumeurs. Il convient de noter ici que les désignations 53 et 21 renvoient aux masses moléculaires fonctionnelles des protéines (p) en kilodaltons (un dalton est égal à une unité de masse atomique, qui est égale à un proton ou un neutron ou 1 g/mol). Ce que nous savons sur la régulation du cycle cellulaire provient en grande partie de travaux de recherche réalisés avec des cellules qui ont perdu leur contrôle régulateur. Ces trois protéines régulatrices ont été découvertes endommagées ou ne fonctionnant pas dans des cellules qui avaient commencé à se répliquer de manière anarchique (p. ex. cellules devenues cancéreuses). Dans chaque cas, la principale cause de la progression effrénée de la cellule à travers le cycle cellulaire était une copie défectueuse de la protéine régulatrice.
Les protéines Rb, p53 et p21 agissent surtout au point de contrôle G1. La protéine p53 est une protéine qui possède plusieurs fonctions et a un impact important sur l’engagement d’une cellule vers la division, parce qu’elle agit en présence d’ADN endommagé dans des cellules qui subissent les processus préparatoires de la phase G1. Si p53 détecte des lésions dans l’ADN, elle interrompt le cycle cellulaire, puis sollicite l’aide d’enzymes spécifiques pour réparer l’ADN. Si l’ADN ne peut être réparé, p53 peut déclencher l’apoptose, ou encore le suicide de la cellule, afin d’éviter la prolifération de chromosomes endommagés. L’augmentation des niveaux de p53 déclenche la production de p21. La protéine p21 fait respecter l’interruption du cycle dictée par p53 en liant et en inhibant l’activité des complexes Cycline/Cdk. À mesure que le stress exercé sur la cellule s’intensifie, de plus hauts niveaux de p53 et de p21 s’accumulent, ce qui réduit les chances que la cellule passe en phase S.
Rb surveille principalement la taille de la cellule, et exerce son influence régulatrice sur d’autres protéines régulatrices positives. À l’état activé et déphosphorylé, Rb se lie à des protéines appelées facteurs de transcription, ou plus couramment, E2F (Figure 10.13). Les facteurs de transcription « activent » des gènes spécifiques, permettant la production de protéines codées par ces gènes. Lorsque Rb est liée à un E2F, la production de protéines nécessaires à la transition G1/S est inhibée. À mesure que la taille de la cellule augmente, Rb est lentement phosphorylée jusqu’à ce qu’elle devienne inactive. Rb libère E2F, lequel peut maintenant activer le gène qui produit la protéine nécessaire à la transition, et cette inhibition particulière est alors levée. Pour que la cellule réussisse à passer à travers chaque point de contrôle, tous les régulateurs positifs doivent être « activés », et tous les régulateurs négatifs doivent être « désactivés ».
Lien visuel
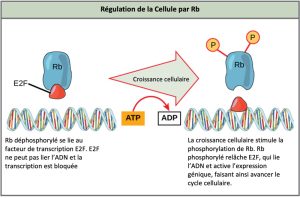
La protéine Rb et d’autres protéines qui exercent une régulation négative sur le cycle cellulaire sont parfois appelées des suppresseurs de tumeurs. D’après vous, pourquoi est-il approprié de désigner ces protéines par le terme « suppresseur de tumeur »?

