14.6 Réparation de l’ADN
Objectifs d’apprentissage
À la fin de cette section, vous serez en mesure de faire ce qui suit :
- Discuter des différents types de mutations dans l’ADN
- Expliquer les mécanismes de réparation de l’ADN
La réplication de l’ADN est un processus très précis, mais des erreurs peuvent parfois se produire, comme une ADN polymérase insérant une mauvaise base. Les erreurs non corrigées peuvent parfois entraîner de graves conséquences, comme le cancer. Les mécanismes de réparation corrigent les erreurs. Dans de rares cas, les erreurs ne sont pas corrigées, ce qui entraîne des mutations ; Dans d’autres cas, les enzymes de réparation sont elles-mêmes mutées ou défectueuses.
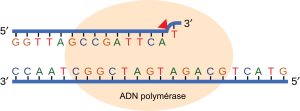
La plupart des erreurs lors de la réplication de l’ADN sont rapidement corrigées par la capacité de correction d’épreuve de l’ADN polymérase elle-même. (Figure 14.17). Lors de la correction d’épreuve, l’ADN pol lit la base nouvellement ajoutée avant d’ajouter la suivante, afin qu’une correction puisse être effectuée. La polymérase vérifie si la base nouvellement ajoutée s’est correctement appariée avec la base du brin complémentaire. S’il s’agit de la bonne base, le nucléotide suivant est ajouté. Si une base incorrecte a été ajoutée, l’enzyme effectue une coupure au niveau de la liaison phosphodiester et libère le mauvais nucléotide. Ceci est effectué par l’action d’exonucléase 3′ de l’ADN pol. Une fois que le mauvais nucléotide a été retiré, il peut être remplacé par le bon.
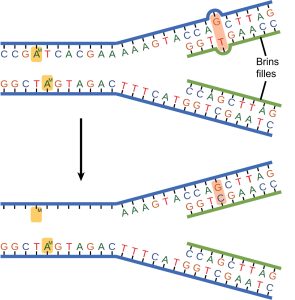
Certaines erreurs ne sont pas corrigées lors de la réplication, mais le sont une fois la réplication terminée ; ce type de réparation est connu sous le nom de réparation des mésappariements (Figure 14.18). Des enzymes de réparation spécifiques reconnaissent le nucléotide mal apparié et excisent la partie du brin qui le contient ; la région excisée est ensuite resynthétisée. Si le mésappariement n’est pas corrigé, cela peut entraîner des dommages plus permanents lorsque l’ADN non compatible est répliqué. Comment les enzymes de réparation des mésappariements reconnaissent-elles laquelle des deux bases est incorrecte? Chez E. coli, après réplication, la base azotée adénine acquiert un groupement méthyle ; le brin d’ADN parental aura des groupements méthyle, tandis que le brin nouvellement synthétisé en est dépourvu. Ainsi, l’ADN polymérase est capable d’éliminer les bases mal incorporées du brin non méthylé nouvellement synthétisé. Chez les eucaryotes, le mécanisme n’est pas très bien compris, mais on pense qu’il implique la reconnaissance de brèches non scellées par la ligase dans le nouveau brin, ainsi qu’une association continue à court terme de certaines des protéines de réplication avec le nouveau brin fille après la réplication.
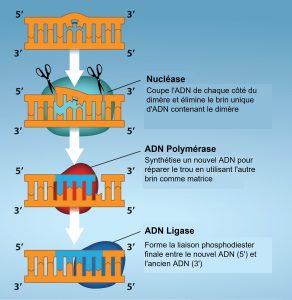
Un autre type de mécanisme de réparation, la réparation par excision de nucléotides, est similaire à la réparation des mésappariements, sauf qu’elle est utilisée pour éliminer les bases endommagées plutôt que les bases mal appariées. Les enzymes de réparation remplacent les bases anormales en faisant une incision aux extrémités 3′ et 5′ de la base endommagée (Figure 14.19). Le segment d’ADN est retiré et remplacé par les nucléotides correctement appariés par l’action de l’ADN pol. Une fois les bases remplies, l’espace restant est scellé avec une liaison phosphodiester catalysée par l’ADN ligase. Ce mécanisme de réparation est souvent utilisé lorsque l’exposition aux UV provoque la formation de dimères de pyrimidine.
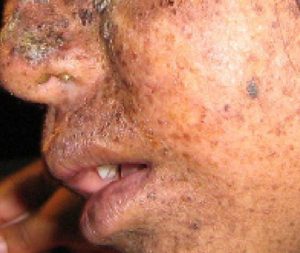
Un exemple bien étudié d’erreurs non corrigées est observé chez les personnes souffrant de xeroderma pigmentosum (Figure 14.20). Les personnes touchées ont une peau très sensible aux rayons UV du soleil. Lorsque les individus sont exposés à la lumière UV, des dimères de pyrimidine, en particulier ceux de thymine, se forment ; les personnes atteintes de Xeroderma pigmentosum ne sont pas en mesure de réparer les dommages. Ceux-ci ne sont pas réparés en raison d’un défaut dans les enzymes de réparation de l’excision des nucléotides, alors que chez les individus normaux, les dimères de thymine sont excisés et le défaut est corrigé. Les dimères de thymine déforment la structure de la double hélice de l’ADN, ce qui peut causer des problèmes lors de la réplication de l’ADN. Les personnes atteintes de xeroderma pigmentosum peuvent avoir un risque plus élevé de contracter un cancer de la peau que celles qui n’en sont pas atteintes.
Les erreurs dans la réplication de l’ADN ne sont pas la seule raison pour laquelle des mutations apparaissent dans l’ADN. Les mutations, des variations dans la séquence nucléotidique d’un génome, peuvent également survenir en raison de dommages à l’ADN. Ces mutations peuvent être de deux types : induites ou spontanées. Les mutations induites sont celles qui résultent d’une exposition à des produits chimiques, aux rayons UV, aux rayons X ou à un autre agent environnemental. Par exemple, Charlotte Auerbach et J.M Robson ont découvert les effets mutagènes du gaz moutarde. Les mutations spontanées se produisent sans aucune exposition à un agent environnemental ; elles sont le résultat de réactions naturelles qui se produisent dans le corps.
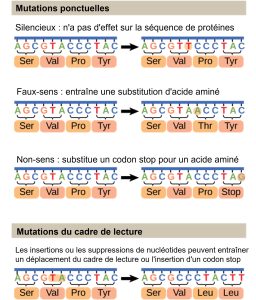
Les mutations peuvent avoir un large éventail d’effets. Les mutations ponctuelles sont les mutations qui affectent une seule paire de bases. Les mutations nucléotidiques les plus courantes sont les substitutions, dans lesquelles une base est remplacée par une autre. Ces substitutions peuvent être de deux types, soit des transitions, soit des transversions. La substitution de transition fait référence au remplacement d’une purine ou d’une pyrimidine par une base du même type ; par exemple, une purine telle que l’adénine peut être remplacée par la purine guanine. La substitution par transversion fait référence au remplacement d’une purine par une pyrimidine, ou vice versa ; par exemple, la cytosine, une pyrimidine, est remplacée par de l’adénine, une purine. Certaines mutations ponctuelles ne sont pas détectables dans le produit final ou phénotype ; celles-ci sont connues sous le nom de mutations silencieuses. Les mutations silencieuses sont généralement dues à une substitution dans des parties non-codantes de l’ADN, ou dans la troisième base d’un codon, qui représente souvent le même acide aminé que le codon d’origine. D’autres mutations ponctuelles peuvent entraîner le remplacement d’un acide aminé par un autre, ce qui peut altérer la fonction de la protéine. Les mutations ponctuelles qui génèrent un codon d’arrêt peuvent entraîner l’arrêt prématuré d’une protéine.
Certaines mutations peuvent entraîner une augmentation du nombre de copies d’un même codon. Celles-ci sont appelées expansions répétées de trinucléotides et entraînent des régions répétées du même acide aminé. Les mutations peuvent également être le résultat de l’ajout d’une ou plusieurs base, appelé insertion, ou de la suppression d’une ou plusieurs base, également appelée délétion. Si une insertion ou une délétion entraîne l’altération du cadre de lecture translationnel (une mutation par décalage du cadre de lecture), la protéine résultante est généralement non fonctionnelle. Parfois, un morceau d’ADN d’un chromosome peut être transféré sur un autre chromosome ou dans une autre région du même chromosome ; c’est ce qu’on appelle aussi la translocation. Ces types de mutations sont illustrés à la Figure 14.21.
Les mutations dans les gènes de réparation sont connues pour causer le cancer. De nombreux gènes de réparation mutés ont été impliqués dans certaines formes de cancer du pancréas, du côlon et du cancer colorectal. Les mutations peuvent affecter les cellules somatiques ou germinales. Si de nombreuses mutations s’accumulent dans une cellule somatique, elles peuvent entraîner des problèmes tels que la division cellulaire incontrôlée observée dans le cancer. Si une mutation a lieu dans les cellules germinales, la mutation sera transmise à la génération suivante, comme dans le cas de l’hémophilie et de la xeroderma pigmentosum.

