14.5 Réplication de l’ADN chez les eucaryotes
Objectifs d’apprentissage
À la fin de cette section, vous serez en mesure de faire ce qui suit :
- Discuter des similitudes et des différences entre la réplication de l’ADN chez les eucaryotes et les procaryotes
- Énoncer le rôle de la télomérase dans la réplication de l’ADN
Les génomes eucaryotes sont beaucoup plus complexes et plus grands que les génomes procaryotes. Les eucaryotes ont également un certain nombre de chromosomes linéaires différents. Le génome humain compte 3 milliards de paires de bases par ensemble haploïde de chromosomes, et 6 milliards de paires de bases sont répliquées pendant la phase S du cycle cellulaire. Il existe de multiples origines de réplication sur chaque chromosome eucaryote ; les humains peuvent avoir jusqu’à 100 000 origines de réplication dans le génome. Le taux de réplication est d’environ 100 nucléotides par seconde, beaucoup plus lent que la réplication procaryote. Chez la levure, qui est un eucaryote, des séquences spéciales connues sous le nom de séquences de réplication autonome (SRA) se trouvent sur les chromosomes. Ceux-ci sont équivalents à l’origine de la réplication chez E. coli.
Le nombre d’ADN polymérases chez les eucaryotes est beaucoup plus élevé que chez les procaryotes : 14 sont connus, dont cinq sont connus pour avoir des rôles majeurs lors de la réplication et ont été bien étudiés. Ils sont connus sous le nom de pol α, pol β, pol γ, pol δ et pol ε.
Les étapes essentielles de la réplication sont les mêmes que chez les procaryotes. Par contre, comme l’ADN eucaryote est lié à des histones pour former des structures appelées nucléosomes, celles-ci doivent être retirées puis remplacées pendant le processus de réplication, ce qui contribue à expliquer le taux de réplication plus lent chez les eucaryotes. La chromatine (le complexe que forme l’ADN et les protéines) peut subir certaines modifications chimiques, de façon à libérer l’ADN des histones et le rendre accessible aux enzymes de la machinerie de réplication de l’ADN. À l’origine de la réplication, un complexe de pré-réplication est assemblé avec d’autres protéines initiatrices. L’hélicase et d’autres protéines sont ensuite recrutées pour démarrer le processus de réplication (tableau 14.2).
Tableau 14.2. Différence entre la réplication procaryote et la réplication eucaryote
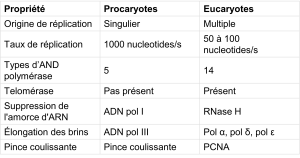
Une hélicase utilisant l’énergie de l’hydrolyse de l’ATP ouvre l’hélice de l’ADN. Des fourches de réplication se forment à chaque origine de réplication le long des chromosomes. L’ouverture de la double hélice provoque un enroulement excessif, ou surenroulement, dans l’ADN devant la fourche de réplication. Ceux-ci sont éliminés par l’action des topoisomérases. Les amorces sont formées par l’enzyme primase, et en utilisant l’amorce, l’ADN pol peut commencer la synthèse. Trois ADN polymérases sont alors impliqués : α, δ et ε. L’ADN pol α ajoute un court fragment d’ADN (20 à 30 nucléotides) à l’amorce d’ARN sur les deux brins, puis passe le relais à une deuxième polymérase. Alors qu’un des brins est synthétisé en continu par l’enzyme pol ε, le brin discontinu est synthétisé par le δ pol. Une protéine nommée pince coulissante, connue aussi sous le nom de PCNA (proliferating cell nuclear antigen), maintient l’ADN pol en place afin qu’elle ne glisse pas sur l’ADN. Lorsque la pol δ rencontre l’amorce d’ARN sur le brin discontinu, elle la déplace de la matrice d’ADN. L’amorce d’ARN est ensuite remplacée par des nucléotides d’ADN. Après le remplacement des amorces d’ARN par de l’ADN, les fragments d’Okazaki sur le brin discontinu sont liés par l’ADN ligase, qui forme la liaison phosphodiester.
Réplication des télomères
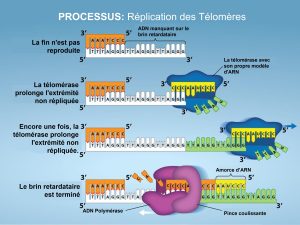
Contrairement aux chromosomes procaryotes, les chromosomes eucaryotes sont linéaires. Comme vous l’avez appris, l’enzyme ADN pol ne peut ajouter des nucléotides que dans la direction 5′ à 3′. Sur le brin continu, la synthèse se poursuit jusqu’à ce que la fin du chromosome soit atteinte. Sur le brin discontinu, l’ADN est synthétisé en courts tronçons, chacun étant initié par une amorce distincte. Lorsque la fourche de réplication atteint l’extrémité du chromosome linéaire, il n’y a aucun moyen de remplacer l’amorce à l’extrémité 5′ du brin inférieur. L’ADN aux extrémités du chromosome reste donc non apparié et, au fil du temps, ces extrémités, appelées télomères, peuvent devenir progressivement plus courtes à mesure que les cellules continuent de se diviser.
Les télomères comprennent des séquences répétitives qui ne codent pour aucun gène particulier. Chez l’humain, une séquence de six paires de bases, TTAGGG, est répétée 100 à 1 000 fois dans les régions télomères. D’une certaine manière, ces télomères protègent l’ADN contre la perte de gènes lorsque les cellules continuent de se diviser. Les télomères sont ajoutés aux extrémités des chromosomes par une enzyme distincte, la télomérase (Figure 14.15), dont la découverte a aidé à comprendre comment ces extrémités chromosomiques répétitives sont maintenues. L’enzyme télomérase contient une partie catalytique et une molécule d’ARN intégré qui sert de matrice pour l’ajout d’ADN sur le brin discontinu. La télomérase se fixe à l’extrémité du chromosome, et des nucléotides d’ADN complémentaires à la matrice d’ARN sont ajoutés à l’extrémité 3′ du brin d’ADN. Une fois que l’extrémité 3′ de la matrice du brin discontinu est suffisamment allongée, l’ADN polymérase peut ajouter les nucléotides complémentaires aux extrémités des chromosomes. Ainsi, les extrémités des chromosomes sont répliquées.
La télomérase est généralement active dans les cellules germinales et les cellules souches adultes. Elle n’est pas active dans les cellules somatiques adultes. Pour la découverte de la télomérase et de son mécanisme d’action, Elizabeth Blackburn, Carol W. Greider et Jack W. Szostak (Figure 14.16) ont reçu le prix Nobel de médecine et de physiologie en 2009. Des recherches ultérieures utilisant des cellules HeLa (obtenues auprès d’Henrietta Lacks) ont confirmé que la télomérase est présente dans les cellules humaines. Et en 2001, des chercheurs, dont Diane L. Wright, ont découvert que la télomérase est nécessaire pour que les cellules des embryons humains prolifèrent rapidement.

La télomérase et le vieillissement
Les cellules qui subissent une division cellulaire continuent de voir leurs télomères raccourcis, car la plupart des cellules somatiques ne fabriquent pas de télomérase. Cela signifie essentiellement que le raccourcissement des télomères est associé au vieillissement. Avec l’avènement de la médecine moderne, des soins de santé préventifs et des modes de vie plus sains, la durée de vie humaine a augmenté et il y a une demande croissante pour que les gens paraissent plus jeunes et aient une meilleure qualité de vie en vieillissant.
En 2010, des scientifiques ont découvert que la télomérase peut inverser certaines conditions liées à l’âge chez la souris. Cela peut avoir un potentiel en médecine régénérative. 2 Des souris déficientes en télomérase ont été utilisées dans ces études ; ces souris présentent une atrophie tissulaire, un épuisement des cellules souches, une défaillance des organes et une diminution des capacités de réparation des lésions tissulaires. La réactivation de la télomérase chez ces souris a provoqué l’extension des télomères, réduit les dommages à l’ADN, inversé la neurodégénérescence et amélioré la fonction des testicules, de la rate et des intestins. Ainsi, la réactivation des télomères peut avoir un potentiel pour traiter les maladies liées à l’âge chez l’humain.
Le cancer se caractérise par une division cellulaire incontrôlée de cellules anormales. Les cellules accumulent des mutations, prolifèrent de manière incontrôlable et peuvent migrer vers différentes parties du corps par un processus appelé métastase. Les scientifiques ont observé que les cellules cancéreuses ont des télomères considérablement raccourcis et que la télomérase est active dans ces cellules. Fait intéressant, ce n’est qu’après que les télomères aient été raccourcis dans les cellules cancéreuses que la télomérase est devenue active. Si l’action de la télomérase dans ces cellules peut être inhibée par des médicaments pendant le traitement du cancer, la division des cellules cancéreuses pouvant potentiellement être arrêtée.
Notes de bas de page
2Jaskelioff et coll., « Telomerase reactivation reverses tissue degeneration in aged telomerase-deficient mice », Nature 469 (2011): 102-7.

