9.3 Réponse au signal
Objectifs d’apprentissage
À la fin de cette section, vous serez en mesure de faire ce qui suit :
- Décrire comment les voies de signalisation dirigent l’expression des protéines, le métabolisme cellulaire et la croissance des cellules.
- Identifier la fonction de la PKC, la PKA et des MAPK dans les voies de transduction du signal
- Reconnaître le rôle de l’apoptose dans le développement et le maintien d’un organisme sain
À l’intérieur de la cellule, les ligands se lient à leurs récepteurs internes, ce qui leur permet d’agir directement sur l’ADN de la cellule et sur les mécanismes de production de protéines. Grâce à des voies de transduction du signal, les récepteurs de la membrane plasmique produisent divers effets sur la cellule. Les résultats des voies de signalisation sont extrêmement variés et dépendent du type de cellule impliquée ainsi que des conditions externes et internes. Un petit échantillon de réponses est décrit ci-dessous.
Expression génétique
Certaines voies de transduction régulent la transcription de l’ARN. D’autres régulent la traduction des protéines à partir de l’ARNm. La MAP kinase ERK est un exemple de protéine qui régule la traduction dans le noyau. La voie MAPK/ERK (également connue sous le nom de voie Ras-Raf-MEK-ERK) est une chaîne de protéines dans la cellule qui communique un signal à partir d’un récepteur à la surface de la cellule jusqu’à l’ADN nucléaire. La MAPK ERK est activée dans une cascade de phosphorylation lorsque le facteur de croissance épidermique (EGF) se lie au récepteur de l’EGF (voir figure 9.10). Après sa phosphorylation, ERK entre dans le noyau et active une protéine kinase qui, à son tour, régule la traduction des protéines (figure 9.14).
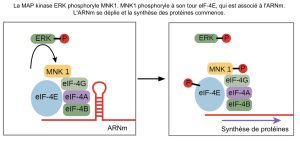
Un autre mécanisme de régulation des gènes fait intervenir la PKC, une protéine qui agit comme un inhibiteur. Un inhibiteur est une molécule qui se lie à une protéine et l’empêche de fonctionner ou réduit sa fonction. Dans ce cas, l’inhibiteur est une protéine appelée Iκ-B, qui se lie à la protéine régulatrice NF-κB. (Le symbole κ représente la lettre grecque kappa). Lorsque Iκ-B est lié à NF-κB, le complexe ne peut pas entrer dans le noyau de la cellule, mais lorsque Iκ-B est phosphorylé par la PKC, il ne peut plus lier NF-κB, et NF-κB (un facteur de transcription) peut entrer dans le noyau et initier la transcription de l’ARN. Dans ce cas, la phosphorylation a pour effet d’inactiver un inhibiteur et d’activer ainsi le processus de transcription.
Augmentation du métabolisme cellulaire
Le résultat d’une autre voie de signalisation affecte les cellules musculaires. L’activation des récepteurs β-adrénergiques des cellules musculaires par l’adrénaline entraîne une augmentation de l’AMP cyclique (AMPc) à l’intérieur de la cellule. Également connue sous le nom d’épinéphrine, l’adrénaline est une hormone (produite par la glande suprarénale située au sommet du rein) qui prépare l’organisme à faire face à des situations d’urgence de courte durée. L’AMP cyclique active la PKA (protéine kinase A), qui phosphoryle à son tour deux enzymes. La première enzyme favorise la dégradation du glycogène en activant le glycogène phosphorylase kinase (GPK) intermédiaire qui, à son tour, active le glycogène phosphorylase (GP) qui catabolise le glycogène en ses monomères de glucose constitutifs. (Rappelons que l’organisme convertit l’excès de glucose en glycogène pour le stocker à court terme. Lorsque l’on a besoin d’énergie, le glycogène est rapidement reconverti en glucose). La phosphorylation de la seconde enzyme, le glycogène synthase (GS), inhibe sa capacité à former du glycogène à partir du glucose. De cette manière, une cellule musculaire obtient une réserve de glucose prête à l’emploi en activant sa formation par la dégradation du glycogène et en inhibant l’utilisation du glucose pour former du glycogène, évitant ainsi un cycle futile de dégradation et de synthèse du glycogène. Le glucose est alors disponible pour être utilisé par la cellule musculaire en réponse à une soudaine poussée d’adrénaline – le réflexe de « combat ou fuite ».
Croissance cellulaire
Les voies de signalisation cellulaire jouent également un rôle majeur dans la division cellulaire. Normalement, les cellules ne se divisent pas à moins d’être stimulées par des signaux provenant d’autres cellules. Les ligands qui favorisent la croissance cellulaire sont appelés facteurs de croissance. La plupart des facteurs de croissance se lient à des récepteurs membranaires qui ont un des domaines enzymatique tyrosines kinases intracellulaires. Ces récepteurs à la surface des cellules sont appelés récepteurs tyrosine kinases (RTK). L’activation des RTK déclenche une voie de signalisation qui comprend une protéine G monomérique appelée RAS, qui active la voie des MAP kinases décrite précédemment. L’enzyme MAP kinase stimule alors l’expression de protéines qui interagissent avec d’autres composants cellulaires pour initier la division cellulaire.
CONNEXIONS CARRIÈRES
Biologiste du cancer
Les biologistes du cancer étudient les origines moléculaires du cancer dans le but de développer de nouvelles méthodes de prévention et des stratégies de traitement qui inhiberont la croissance des tumeurs sans nuire aux cellules normales de l’organisme. Comme indiqué précédemment, les voies de signalisation contrôlent la croissance cellulaire. Ces voies de signalisation sont contrôlées par des protéines de signalisation, qui sont à leur tour exprimées par des gènes. Les mutations de ces gènes peuvent entraîner un mauvais fonctionnement des protéines de signalisation. Cela empêche la cellule de réguler son cycle cellulaire, ce qui déclenche une division cellulaire non limitée et peut devenir un cancer. Les gènes qui régulent les protéines de signalisation constituent un type d’oncogène, c’est-à-dire un gène susceptible de provoquer un cancer. Le gène codant la RAS est un oncogène qui a été découvert à l’origine lorsque des mutations de la protéine RAS ont été associées au cancer. D’autres études ont montré que 30 % des cellules cancéreuses présentent une mutation du gène RAS qui entraîne une croissance incontrôlée. Si elle n’est pas maîtrisée, la division cellulaire incontrôlée peut conduire à la formation de tumeurs et de métastases, c’est-à-dire à la croissance de cellules cancéreuses dans de nouveaux endroits du corps.
Les biologistes du cancer ont pu identifier de nombreux autres oncogènes qui contribuent au développement du cancer. Par exemple, HER2 est un récepteur de surface cellulaire qui est présent en quantités excessives dans 20 % des cancers du sein humains. Les biologistes du cancer ont réalisé que la duplication du gène entraînait une surexpression de HER2 chez 25 % des patientes atteintes d’un cancer du sein et ont mis au point un médicament appelé Herceptin (trastuzumab). Herceptin est un anticorps monoclonal qui cible HER2 pour qu’il soit éliminé par le système immunitaire. Le traitement par Herceptin permet de contrôler la signalisation par HER2. L’utilisation de Herceptin en association avec la chimiothérapie a permis d’augmenter le taux de survie global des patientes atteintes d’un cancer du sein métastatique.
De plus amples informations sur la recherche en biologie du cancer sont disponibles sur le site web de la National Cancer Institute (https://www.cancer.gov/research/areas/biology).
Mort cellulaire
Lorsqu’une cellule est endommagée, superflue ou potentiellement dangereuse pour un organisme, elle peut déclencher un mécanisme de mort cellulaire programmée, ou apoptose. L’apoptose permet à une cellule de mourir d’une manière contrôlée qui empêche la libération de molécules potentiellement nuisibles à l’extérieur de la cellule. Il existe de nombreux points de contrôle internes qui surveillent la santé d’une cellule ; si des anomalies sont observées, une cellule peut spontanément déclencher le processus d’apoptose. Cependant, dans certains cas, tels qu’une infection virale ou une division cellulaire incontrôlée due à un cancer, les mécanismes normaux de contrôle et d’équilibre de la cellule échouent. Des signaux externes peuvent également déclencher l’apoptose. Par exemple, la plupart des cellules animales normales possèdent des récepteurs qui interagissent avec la matrice extracellulaire, un réseau de glycoprotéines qui fournit un support structurel aux cellules d’un organisme. La liaison des récepteurs cellulaires à la matrice extracellulaire déclenche une cascade de signalisation à l’intérieur de la cellule. Toutefois, si la cellule s’éloigne de la matrice extracellulaire, la signalisation cesse et la cellule subit l’apoptose. Ce système empêche les cellules de se déplacer dans l’organisme et de proliférer de manière incontrôlée, comme c’est le cas pour les cellules tumorales qui forment des métastases.
Un autre exemple de signalisation externe conduisant à l’apoptose se produit dans le développement des cellules T. Les lymphocytes T sont des cellules immunitaires qui se lient aux macromolécules et aux particules étrangères et les ciblent pour qu’elles soient détruites par le système immunitaire. Normalement, les cellules T ne ciblent pas les protéines du « soi » (celles de leur propre organisme), un processus qui peut conduire à des maladies auto-immunes. Afin de développer leur capacité à distinguer le soi du non-soi, les cellules T immatures sont soumises à un dépistage visant à déterminer si elles se lient à des protéines dites du soi. Si le récepteur du lymphocyte T se lie aux protéines du soi, la cellule déclenche l’apoptose pour éliminer la cellule potentiellement dangereuse.
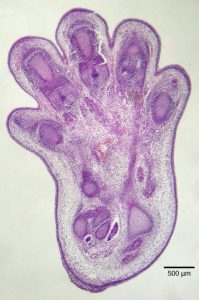
L’apoptose est également essentielle au développement embryologique normal. Chez les vertébrés, par exemple, les premiers stades du développement comprennent la formation de tissus semblable à une toile entre les doigts et les orteils (figure 9.15). Au cours du développement normal, ces cellules inutiles doivent être éliminées, ce qui permet la formation de doigts et d’orteils complètement séparés. Un mécanisme de signalisation cellulaire déclenche l’apoptose, qui détruit les cellules situées entre les doigts en développement.
Terminaison de la cascade de signaux
La signalisation aberrante souvent observée dans les cellules tumorales est la preuve que l’arrêt d’un signal au moment opportun peut être tout aussi important que l’initiation d’un signal. L’une des méthodes pour arrêter un signal spécifique consiste à dégrader le ligand ou à l’éliminer afin qu’il ne puisse plus accéder à son récepteur. L’une des raisons pour lesquelles les hormones hydrophobes telles que l’œstrogène et la testostérone déclenchent des événements durables est qu’elles se lient à des protéines porteuses. Ces protéines permettent aux molécules insolubles d’être solubles dans le sang, mais elles protègent également les hormones de la dégradation par les enzymes circulantes.
À l’intérieur de la cellule, de nombreuses enzymes différentes inversent les modifications cellulaires résultant des cascades de signalisation. Par exemple, les phosphatases sont des enzymes qui enlèvent le groupe phosphate attaché aux protéines par les kinases dans un processus appelé déphosphorylation. L’AMP cyclique (AMPc) est dégradé en AMP par la phosphodiestérase, et la libération des réserves de calcium est inversée par les pompes à Ca2+ situées dans les membranes externes et internes de la cellule.

