9.2 Propagation du signal
Objectifs d’apprentissage
À la fin de cette section, vous serez en mesure de faire ce qui suit :
- Expliquer comment la liaison d’un ligand déclenche la transduction du signal dans la cellule.
- Reconnaître le rôle de la phosphorylation dans la transmission des signaux intracellulaires
- Évaluer le rôle des seconds messagers dans la transmission des signaux
Une fois qu’un ligand se lie à un récepteur, le signal est transmis à travers la membrane et dans le cytoplasme. La poursuite d’un signal de cette manière est appelée transduction du signal. La transduction du signal n’a lieu qu’avec les récepteurs de la surface cellulaire, qui ne peuvent pas interagir avec la plupart des composants de la cellule tels que l’ADN. Seuls les récepteurs internes sont capables d’interagir directement avec l’ADN dans le noyau pour initier la synthèse des protéines.
Lorsqu’un ligand se lie à son récepteur, il se produit des changements de conformation qui affectent le domaine intracellulaire du récepteur. Les changements conformationnels du domaine extracellulaire lors de la liaison du ligand peuvent se propager à travers la région transmembranaire du récepteur et conduire à l’activation du domaine intracellulaire ou de ses protéines associées. Dans certains cas, la fixation du ligand entraîne la dimérisation du récepteur, ce qui signifie que deux récepteurs se lient l’un à l’autre pour former un complexe stable appelé dimère. Un dimère est un composé chimique formé par l’union de deux molécules (souvent identiques). La liaison des récepteurs de cette manière permet à leurs domaines intracellulaires d’entrer en contact étroit et de s’activer mutuellement.
La liaison du ligand initie une voie de transduction
Une fois que le ligand est lié au récepteur à la surface de la cellule, l’activation des composants intracellulaires du récepteur déclenche une chaîne d’événements appelée la voie de transduction, parfois appelée cascade de signalisation. Dans une voie de transduction, les seconds messagers et les protéines activées interagissent avec des protéines spécifiques, qui sont à leur tour activées dans une réaction en chaîne qui conduit finalement à un changement dans une ou plusieurs activité de la cellule (figure 9.10), tel qu’une augmentation du métabolisme ou de l’expression d’un gène spécifique. On appelle ce changement de l’activité cellulaire la réponse au signal. Les événements de la cascade se produisent en série, un peu comme le courant d’une rivière. Les interactions qui se produisent avant un certain point sont définies comme des événements en amont, et les événements qui se produisent après ce point sont appelés événements en aval.
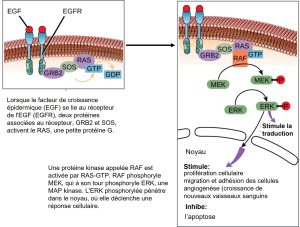
Vous pouvez constater que les voies de transduction peuvent se compliquer très rapidement, car la plupart des protéines cellulaires peuvent affecter différents événements en aval de la réponse, en fonction des conditions au sein de la cellule. Une voie unique peut diverger lors de la cascade de signalisation, de façon à activer des voies de transduction multiples qui donneront des réponses différentes à partir d’un même signal. Un autre élément de complication est l’intégration des signaux des voies, dans laquelle les signaux de deux ou plusieurs récepteurs différents activent la même réponse dans la cellule. L’intégration des signaux permet de s’assurer que plusieurs exigences externes sont satisfaites avant qu’une cellule ne s’engage dans une réponse spécifique. Ces variations de réponse cellulaire, dépendamment de la divergence et/ou de l’intégration des voies de transduction, sont dues aux différences d’expression des protéines dans les différents types de cellules.
Les effets des signaux extracellulaires peuvent également être amplifiés par des cascades enzymatiques. Au début du signal, un seul ligand se lie à un seul récepteur. Cependant, l’activation d’une enzyme couplé à un récepteur peut activer de nombreuses copies d’un composant de la cascade de signalisation, ce qui amplifie le signal à chaque étape de la voie de transduction.
Mécanismes de signalisation intracellulaire
L’induction d’une voie de transduction dépend de la modification d’un composant cellulaire par une enzyme. De nombreuses modifications enzymatiques peuvent se produire, et elles sont reconnues à tour de rôle par le composant suivant en aval. Voici quelques-uns des événements les plus courants de la signalisation intracellulaire.
Phosphorylation
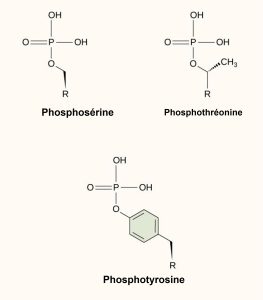
L’une des modifications chimiques les plus courantes dans les voies de signalisation est l’ajout d’un groupe phosphate [PO4]3- à une molécule telle qu’une protéine dans un processus appelé phosphorylation. Le phosphate peut être ajouté à un nucléotide tel que le GMP pour former le GDP ou le GTP. Les phosphates sont également souvent ajoutés aux résidus de sérine, thréonine et tyrosine des protéines, où ils remplacent le groupe hydroxyle de l’acide aminé (figure 9.11). Le transfert du phosphate est catalysé par une enzyme appelée kinase. Les différentes kinases sont nommées d’après le substrat qu’elles phosphorylent. La phosphorylation des résidus sérine et thréonine active souvent les enzymes. La phosphorylation des résidus de tyrosine peut soit affecter l’activité d’une enzyme, soit créer un site de liaison qui interagit avec les composants en aval de la cascade de signalisation. La phosphorylation peut activer ou inactiver des enzymes, et l’inversion de la phosphorylation, la déphosphorylation par une phosphatase, inversera l’effet.
Les seconds messagers
Les seconds messagers sont de petites molécules qui propagent un signal suite à la liaison de la molécule de signalisation (ligand) au récepteur. Ces molécules contribuent à diffuser un signal dans le cytoplasme en modifiant le comportement de certaines protéines cellulaires. Trois seconds messagers sont particulièrement communs dans les voies de transduction des cellules animales : le calcium, l’AMP cyclique (AMPc) et les phospholipides d’inositol, soit le diacylglycérol (DAG) et l’inositol triphosphate (IP3).
L’ion calcium est un second messager très répandu. La concentration libre d’ions calcium (Ca2+) dans une cellule est très faible, car les pompes ioniques de la membrane plasmique l’éliminent continuellement en utilisant l’adénosine-5′-triphosphate (ATP). À des fins de signalisation, le Ca2+ est stocké dans des vésicules cytoplasmiques, telles que le réticulum endoplasmique et les mitochondries, ou est accessible depuis l’extérieur de la cellule. Lors de la signalisation, les récepteurs couplés aux canaux ioniques spécifiques aux ions calcium, une fois liées à leur ligand, permettent aux niveaux élevés de Ca2+ présents à l’extérieur de la cellule ou dans les compartiments de stockage intracellulaires de diffuser dans le cytoplasme. La diffusion des ions calcium dans le cytoplasme augmente la concentration de Ca2+ cytoplasmique, et comme leur concentration augmente, ils peuvent maintenant servir de second messager. La réponse à l’augmentation de Ca2+ varie et dépend du type de cellule concerné. Par exemple, dans les cellules β du pancréas, la signalisation du Ca2+ conduit à la libération de l’insuline, et dans les cellules musculaires, une augmentation du Ca2+ conduit à des contractions musculaires.
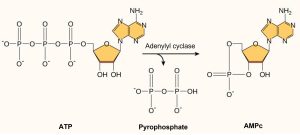
L’AMP cyclique (AMPc) est un autre second messager utilisé dans de nombreux types de cellules. L’AMP cyclique est synthétisée par l’enzyme adénylate cyclase à partir de l’ATP (figure 9.12). Le rôle principal de l’AMPc dans les cellules est de se lier à une enzyme appelée la protéine kinase AMPc-dépendante (PKA) et de l’activer. La PKA régule de nombreuses voies métaboliques vitales : elle phosphoryle les résidus de sérine et de thréonine de ses protéines cibles, les activant au passage. La PKA est présente dans de nombreux types de cellules, et les protéines cibles sont différentes dans chaque type de cellule. Ces différences sont à l’origine de la variation des réponses à l’AMPc dans les différentes cellules.
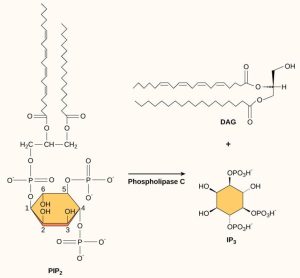
Présents en faibles concentrations dans la membrane plasmique, les phospholipides d’inositol sont des phospholipides dans la membrane cytoplasmique qui peuvent également être transformés en seconds messagers. Comme ces molécules sont des composants membranaires, elles sont situées à proximité des récepteurs transmembranaires et peuvent facilement interagir avec eux. Le phosphatidylinositol (PI) est le principal phospholipide qui joue un rôle dans la signalisation cellulaire. Des enzymes appelées kinases phosphorylent le PI pour former du PI-phosphate (PIP) et du PI-bisphosphate (PIP2).
L’enzyme phospholipase C clive le PIP2 pour former du diacylglycérol (DAG) et de l’inositol triphosphate (IP3) (Figure 9.13). Ces produits du clivage du PIP2 servent de seconds messagers. Le diacylglycérol (DAG) demeure ancré dans la membrane plasmique et active la protéine kinase C (PKC), qui phosphoryle alors les résidus sérine et thréonine de ses protéines cibles. L’IP3 diffuse dans le cytoplasme et se lie aux récepteurs à canaux ioniques spécifiques à IP3 du réticulum endoplasmique pour libérer du Ca2+ à partir des réserves contenues dans le réticulum endoplasmique, ce qui stimule davantage la PKC et poursuit la cascade de signalisation.