7 Chapitre 7 – La ventilation mécanique
Unité 1 : Établissement et choix du type de ventilation
Partie A : Qui nécessite la ventilation mécanique
Partie B : Les modes de la ventilation mécanique
Partie C : Comment le souffle et la pression générée dans le circuit sont transmis au système pulmonaire du patient
Unité 2 : Choix des paramètres
Partie A : Les modes contrôlé, assisté/contrôlé, SIMV, CPAP et les contrôleurs associés
Partie B : Les variables de phases et les paramètres associés
Unité 3 : Ajustement de la ventilation mécanique
Partie A : L’ajustement des paramètres
Partie B : Optimisation de la ventilation mécanique (analyse des courbes)
Partie C : Optimisation de la ventilation (PaCO2)
Partie D : Optimisation de l’oxygénation (PaO2)
Unité 4 : Les effets secondaires reliés à la ventilation mécanique
Partie A : Les effets secondaires pulmonaires
Partie B : Les effets secondaires non pulmonaires
Unité 5 : Le sevrage et la discontinuation de la ventilation mécanique
Partie A : Les modes développés pour le sevrage (PAV+, NAVA et les modes automatisés)
Partie B : L’évaluation du patient
Partie C : L’extubation
Unité 1 : Établissement et choix du type de ventilation
Partie A : Qui nécessite la ventilation mécanique
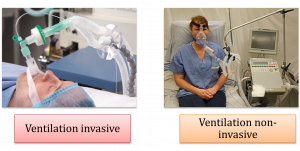 plus spécifiquement quel type de ventilation mécanique serait appropriée : une ventilation mécanique invasive ou une ventilation mécanique non-invasive.
plus spécifiquement quel type de ventilation mécanique serait appropriée : une ventilation mécanique invasive ou une ventilation mécanique non-invasive.
Les critèes d’évaluation pour la ventilation mécanique invasive et non-invasive
Ventilation mécanique invasive
- diminution du niveau de conscience avec signes d’apnée ou d’hypopnée
- hypoventilation (PaCO2 > 55 mmHg pH < 7.25)
- shunt réfractaire + détresse respiratoire
- PaO2 < 70 mmHg SpO2 < 90% avec FiO2 ≥ 60%
- anxiété, sudeur, pâleur, tachycardie, tachypnée, utilisation des muscles accessoires, paradoxe diaphragmatique
- autres : MIP < 20 mmHg, capacité vitale < 10 – 15 ml/kg
Ventilation mécanique non-invasive
- patient conscient et capable de protéger ses voies aériennes
- toux efficace
- F.R > 25/min.
- PaCO2 45 – 60 mmHg
- pH 7.25 -7.30
On préviligie toujours une ventilation mécanique non-invasive pour…
- Éviter les complications associées aux voies aériennes artificielles (atrophie musculaire, pneumonies nosocomiales, aspirations)
- Diminuer le montant ou le besoin de sédation
- Permettre au patient de parler, avaler, protéger ses voies aériennes
- Augmenter la flexibilité d’initier et retirer l’interface
- Permettre une meilleure qualité de vie si le patient nécessite un support ventilatoire à la maison
Indications qui nous guide pour initier une ventilation mécanique non-invasive
-
-
- F.R au-dessus de 25/min.
- pH 7.25-7.30
- PaCO2 45 – 60 mmHg
-
-
-
- arrêt cardio-respiratoire
- hypotension
- fistule trachéo-oesophagienne
- incapacité de protéger les voies aériennes
- trauma facial ou crânien
- patient qui ne coopère pas
-
Contre-indications relatives de la ventilation non-invasive
-
-
- sécrétions très épaisses
- anormalités nasopharyngées
- obésité morbide
-
Partie B : Les modes de base en ventilation mécanique
- souffle contrôlé (obligatoire)
- La machine donne un souffle à un temps déterminé par la fréquence respiratoire réglée. La machine calcule le TCT (total cycle time) qui détermine le cycle entre chaque souffle
- Ex : F.R réglée 12/min. TCT = 60/12 = 5 secondes
- C’est la machine qui initie (déclenche) l’inspiration et NON le patient et c’est aussi la machine qui termine l’inspiration
- Les souffles contrôlés sont tous identiques
- La machine donne un souffle à un temps déterminé par la fréquence respiratoire réglée. La machine calcule le TCT (total cycle time) qui détermine le cycle entre chaque souffle
- souffle assisté
- Un souffle assisté est initié par l’effort du patient. On utilise ce terme lorsqu’on active le mode assist/control
- Alors c’est le patient qui initie le souffle mais c’est la machine qui termine le souffle
- Même si le patient initie l’inspiration, tous les souffles sont identiques
- souffle spontané
- Un souffle spontané est initié par le patient et terminé par le patient
- Les modes qui permettent au patient de recevoir des souffles spontanés sont CSV (continuous spontaneous ventilation), PSV (pressure support ventilation), CPAP (continuous positive airway pressure), PAV (proportionnal assit ventilation), NAVA (neurally adjusted ventilator assist) et APRV (airway pressure release ventilation)
- Le mode SIMV (synchronized intermittent mandatory ventilation) permet au patient de recevoir des souffles contrôlés, assistés et spontanés
- Si l’opérateur veut livrer un support au patient pour les souffles spontanés il ou elle doit régler une pression de support (pressure support)
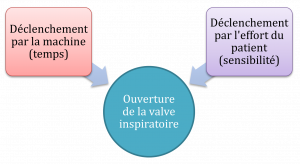
- Déclenchement par la machine
- Temps calculé par la machine via la fréquence respiratoire réglée (TCT – total cycle time = 60 secondes / F.R)
- Souffle manuel (Manual breath) : quand l’opérateur active cette fonction le ventilateur livre un souffle contrôlé au patient (utiliser beaucoup en néonatologie)
- Déclenchement par le patient
- pression : la contraction des muscles inspiratoires crée une pression négative dans le système qui est détecté par le ventilateur. Quand la pression chute à la valeur réglée de la sensibilité (-1 à -5 cmH2O) le ventilateur livre un souffle assisté ou spontané au patient; le type de souffle livré est déterminé par le mode
- débit : le souffle est livré au patient lorsque le ventilateur mesure une diminution du débit dans le circuit
- Par exemple: l’opérateur ajuste un débit de base (bias flow) de 6 lpm et une sensibilité de 2 lpm : pendant l’expiration statique le ventilateur ajoute 6 lpm dans le circuit. Lorsque le patient fait un effort et qu’il retire 2 lpm du système le ventilateur livre un souffle assisté ou spontané au patient
- électricité diaphragmatique : l’insertion d’une sonde œsophagienne muni d’électrodes sensibles au voltage permet de reconnaitre les contractions diaphragmatiques; cette technologie est utilisée avec le Servo-i lorsque NAVA est activée
- volume : technologie utilisée par la compagnie Phillips en mode non-invasive
Partie C : Comment le souffle et la pression générée dans le circuit sont transmis au système pulmonaire du patient
Les sources d’alimentation qui permettent aux ventilateurs de générer une pression positive ou négative pour ventiler les patients sont électrique ou pneumatique. Dans la majorité des cas une ventilation à pression positive est utilisée pour ventiler les patients. La pression générée dans le ventilateur crée le gradient de pression qui permet au gaz de s’écouler de la machine vers le patient et augmenter les pressions alvéolaires.
Les technologies varient d’un ventilateur à l’autre. Voici quelques exemples :
- valves à ressort
- valves avec aiguille
- injecteurs
- piston
Lorsqu’on détermine qu’un patient nécessite une ventilation mécanique on choisit premièrement si la thérapie sera administrée de façon invasive ou non-invasive; deuxièmement on choisit le mode ou le type de souffle qui sera livré au patient et troisièmement on choisit comment le souffle va augmenter les pressions alvéolaires du patient.
Pour que le ventilateur génère une pression dans le circuit et les poumons du patient, il délivre le souffle soit en contrôlant la pression inspiratoire, le débit/volume inspiratoire ou le temps inspiratoire. Les paramètres choisis qui sont associés au mode et au contrôleur permettent au ventilateur de déterminer les étapes de la respiration du patient qu’on appelle les variables de phases.
Variables de phase
- L’initiation du souffle – déclenchement
- Le contrôle ou la limite qui va permettre aux poumons de se remplir d’air
- La fin du souffle – cyclage
- La baseline – le montant de pression qui demeure dans les poumons à la fin de l’expiration – PEEP (positive end expiratory pressure) et le débit de base ajouté dans le circuit pendant l’expiration statique lorsqu’une sensibilité au débit est réglée
Unité 2 : Choix des paramètres
Partie A : Les modes contrôlé, assisté/contrôlé, SIMV, CPAP et les contrôleurs associés
1. CMV/ assisteur-contrôleur (A/C)
Chaque souffle donné par le ventilateur est obligatoire ou assisté; pour le mode CMV (continous mandatory ventilation) le déclenchement se fait par la machine, pour le mode A/C (assist/control) le déclenchement se fait par la machine et/ou le patient. Lorsque c’est le patient qui déclenche le souffle on utilise le terme souffle assisté. Alors en A/C nous devons régler une sensibilité.
Avantages d’utiliser ces modes :
- assure une ventilation minute minimale
- chaque souffle que le patient reçoit est identique ce qui diminue le stress sur le poumon
- chaque souffle que le patient reçoit est idientique qui peut augmenter le confort chez les patients
Désavantages d’utiliser ces modes :
- peut être difficile à prévenir l’alcalose respiratoire
- ↑ Paw moyenne dans les poumons et les effets secondaires associés à la ventilation mécanique
- ↑ chances de développer l’atrophie musculaire; à noter que ceci se produit avec tous les modes
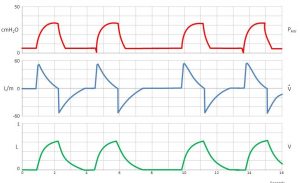
L’opérateur peut choisir de donner des souffles soit en contrôlant la pression, le débit/volume, le contrôleur double ou le temps. Habituellement chez les adultes on ventile soit à la pression ou au débit/volume. En néonatologie on ventile plutôt avec le contrôleur double. Les machines spécialisées qui peuvent ventiler les patients avec des très hautes fréquences (100 – 1000/minute) utilise le temps comme contrôleur.
Voici les avantages si on choisit un contrôleur de pression :
- le débit varie avec l’effort du patient (soufffle assisté) et peut améliorer le confort du patient
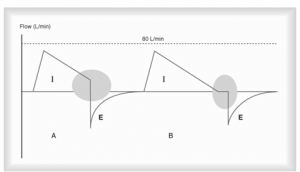
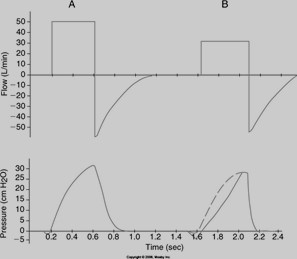
- l’opérateur peut ajuster un Ti et l’optimiser en PCV (pressure control ventilation)
- dans le diagramme A le Ti est non-optimisé
- dans le diagramme B le Ti est optimisé et il y a une petite pause ajoutée
- administre une pression constante et peut diminuer le barotraumatisme (à noter qu’on prévient quand même le barotraumatisme en contrôleur de débit/volume car on règle l’alarme de haute pression et on prévient l’augmentation d’une pression alvéolaire > 30 cmH2O – 40 cmH2O
Voici les désavantages si on choisit un contrôleur de pression :
- le Vt/VE varient en contrôleur de pression avec :
- les changements des mécaniques respiratoires
- l’effort du patient
- or le stress imposé sur les poumons peut varier
Voici les avantages si on choisit un contrôleur de débit/volume :
- administre un Vt/VE spécifique même si les mécaniques respiratoires varient
- utiliser surtout lorsqu’on veut contrôler étroitement le Vt par exemples :
- ARDS (on veut ventiler le poumon avec le même stress)
- pour contrôler étroitement la PaCO2 chez un traumatisme crânien
Voici les désavantages si on choisit un contrôleur de débit/volume :
- le débit réglé peut être insuffisant chez les patients qui assistent le souffle contrôlé par le débit; pour évaluer si c’est le cas on analyse la courbe de pression-temps afin d’évaluer si le débit réglé rencontre les demandes du patient.
- si le débit est insuffisant pendant que le ventilateur fourni le souffle assité au patient la pression dans le système va chuter (allure concave de la courbe comme dans le diagramme 1 et le diagramme B); on observe ceci surtout chez les patients qui ont un travail respiratoire augmenté.
- si le débit du patient est égal ou inféreiur au débit réglé la courbe de pression – temps sera normal (comme dans le diagramme A).
L’opérateur peut choisir un contrôleur double. Ce type de contrôleur a été inventé pour prendre avantage des caractéristiques du contrôleur de pression et du contrôleur de débit/volume. Lorsque l’opérateur choisit un contrôleur double il règle un volume sauf que la machine contrôle la pression pour cibler le volume réglé. Voici le vocabulaire que les compagnies utilise pour nommer leur contrôleur double : PRVC (pressure regulated volume control), VC+ (volume control +), auto-flow, volume garantee, AVAPS (average volume-assured pressure support).
Principe de fonctionnement :
- le ventilateur administre une pression au patient dans le but de cibler le Vt réglé par l’opérateur
- si le Vt délivré < Vt réglé le ventilateur augmente progressivement la pression jusqu’à ce que le Vte soit égal au Vt réglé
- si le Vt délivré > Vt réglé le ventilateur diminue progressivement la pression jusqu’à ce que le Vte soit égal au Vt réglé
- le ventilateur ne permet pas à la PiP d’atteindre environ 5 cmH2O de moins que l’alarme de haute pression; alors c’est important d’ajuster l’alarme de haute pression à 35 cmH2O. Si l’alarme de haute pression est ajustée à 40 cmH2O certains ventilateurs vont limiter leur pression inspiratoire à 38 cmH2O qui est dans la limite dangereuse
OU
- le ventilateur donne un ‘test breath’ en contrôleur de débit/volume; pendant ce souffle le ventilateur ajoute une petite pause et évalue la pression de plateau
- au prochain souffle le ventilateur passe à un contrôleur de pression et initie le premier souffle en contrôleur de pression à la pression de plateau mesurée au souffle précédant
- les pressions administrées pour les prochains souffles seront ajustés en fonction du Vte et du Vt réglé
- comme mentionner plus haut le ventilateur ne permet pas à la PiP d’atteindre environ 5 cmH2O de moins que l’alarme de haute pression et alors c’est important d’ajuster l’alarme de haute pression à 35 cmH2O
Exemple (principe de fonctionnement 1)
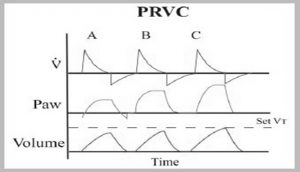
Voici les avantages si on choisit un contrôleur double :
- le Vt demeure relativement constant en utilisant un contrôleur de pression
- lorsque les mécaniques respiratoires du patient s’améliorent la pression livrée diminue sans compromettre le Vt
- le débit varie en fonction de l’effort du patient
Voici les désavantages si on choisit un contrôleur double :
- une inspiration active ↑ Vt livré au patient et le ventilateur s’ajuste en diminuant la pression au prochain souffle; cet ajustement peut augmenter l’asynchronie patient/ventilateur
- si une fuite est présente la différence entre le Vt réglé et le Vte peut être détectée par la machine comme étant une détérioration des mécaniques respiratoires et peut répondre en ↑ la PIP pour les prochains souffles
2. SIMV (synchronized intermittent mandatory ventilation)
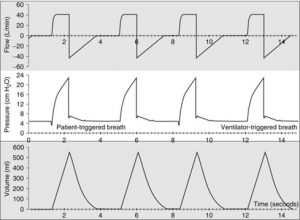
Le ventilateur établi une fenêtre de temps (égal au TCT) pour chaque cycle respiratoire établi par la fréquence respiratoire réglée. Au début de chaque fenêtre le ventilateur évalue si le patient fait un effort inspiratoire. Si le ventilateur ne ressent aucun effort inspiratoire il fournira un souffle contrôlé; s’il ressent un effort inspiratoire au début de la fenêtre il fournira un souffle assisté; si le patient respire spontanément après que le souffle obligatoire ou assisté a été donné le patient recevra des souffles du type spontané pour le restant de la durée du cycle respiratoire.
Alors pour les souffles obligatoires ou assistés l’opérateur peut choisir de contrôler les souffles soit par la pression, le débit/volume ou double. Pour les souffles spontanés le support est contrôlé en réglant une pression de support.
Avantages d’utiliser le mode SIMV :
- permet au patient de respirer spontanément (avec une pression de support)
- ↓ Paw moyenne car habituellement on règle une pression de support moins élevée pour les souffles spontanés
Désavantages d’utiliser le mode SIMV :
- ↑ l’asynchronie patient/ventilateur lorsque 2 contrôleurs sont utilisés pour ventiler le patient
- contrôleur de débit/volume pour les souffles A/C et pression de support pour les souffles spontanés → les centres respiratoires semblent sensibles lorsqu’on ventile avec 2 contrôleurs et le patient peut devenir inconfortable
- ↑ WOB si les souffles contrôlés et spontanés ne sont pas synchronisés (observé fréquemment lorsque le patient souffre de tachypnée)
- asynchronie en présence d’efforts irréguliers; dans le diagramme ci-dessous les souffles spontanés sont encardrés
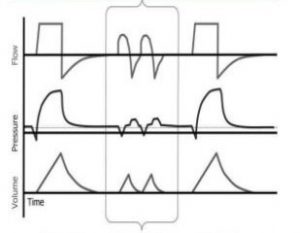
On peut déduire qu’il doit y avoir des variations entre le contrôleur de pression qui fournit un support pour les souffles controlés/assistés versus le contrôleur de pression qui fournit un support pour les souffles spontanés. Effectivement, la différence est configurée au niveau du cyclage c’est à dire comment le souffle est terminé.
Les types de cyclage avec une pression de support (comment le souffle termine t-il?)
- Par défaut le cyclage se fait à 25% du débit inspiratoire de pointe (PIFR). Les compagnies ont choisi cette valeur car les recherches ont démontré que les poumons sont presque remplis à pleine capacité lorsque le débit est chute à 25% du débit de pointe inspiratoire.
L’opérateur peut changer ce pourcentage.
On voudrait faire ce changement pour diminuer ou augmenter le Ti.
- Le cyclage peut se faire par le temps. Par défaut le temps maximal inspiratoire est réglé à 5 secondes (pour les ventilateurs adultes). Cette façon de cycler en PSV est nécessaire lorsqu’il y a une fuite dans le système.
- C’est pour cette raison que les ventilateurs néonatals demandent à l’opérateur d’ajuster automatiquement un Ti car les enfants sont souvent intubés avec un tube endotrachéal sans ballonnet et donc il y a souvent la présence d’une fuite. Dans une telle situation le cyclage se fait soit au débit ou au temps; le premier ressenti par la machine cause le cyclage.
- Par une limite de pression de 1 – 2 cmH2O au-dessus de la pression de support réglée.
Les indications de la pression de support sont multiples. C’est probablement pourquoi que c’est le contrôleur le plus utilisé pour ventiler les patients..
- Pour ventiler le patient avec un support maximal afin de reposer le patient; habituellement on débute entre 10 – 15 cmH2O et on augmente progressivement afin de maintenir un Vt idéal entre 4 – 8 ml/kg selon la condition du patient
- Pour ventiler le patient en lui permettant de prendre des souffles spontanés tout en limitant le travail respiratoire (WOB)
- Pour débuter le sevrage en diminuant progressivement la pression de support
- Pour ventiler le patient avec un support minimal; on règle une pression de support entre 5 – 8 cmH2O pour contrer la résistance offerte par la tubulure. Cette ventilation nous permet de déterminer si le patient est prêt pour la discontinuation de la ventilation mécanique (SBT 5/5)
Voici les avantages si on choisit un mode spontané avec les souffles supportés avec une pression de support :
- ↓ Paw moyenne
- prévient l’atrophie musculaire (attention ici : les nouvelles recherches indiquent tout à fait le contraire)
- ↑ synchronie patient/ventilateur (patient a plus de contrôle – Ti/TE, débit)
- permet le sevrage
- pendant le sevrage le ventilateur nous permet d’évaluer la ventilation du patient comparativement à l’utilisation du ‘T-piece’
Voici les désavantages si on choisit un mode spontané avec les souffles supportés avec une pression de support :
- ↑ WOB (comme toute ventilation mécanique l’asynchronie patient-ventilateur peut être présente)
- peut provoquer l’hypoventilation (c’est pour ceci qu’on règle toujours des paramètres d’apnée dans un mode spontané)
3. Mode spontané – CPAP avec et sans pression de support (PSV)
Le ventilateur administre seulement des souffles du type spontané. Le thérapeute peut ajuster juste une PEEP ou une PEEP avec une pression inspiratoire (pressure support).
-
-
-
-
-
-
- PEEP
- PEEP + pression de support
-
-
-
-
-
Ce mode peut être administré de façon non-invasive (NIV) ou invasive.
À noter que certaines compagnies permettent à l’opérateur d’utiliser un contrôleur double dans le mode spontané. La vocabulaire associé est habituellement VOLUME SUPPORT. Le principe de fonctionnement est le même que les contrôleurs doubles tels PRVC, VC+, auto-flow, etc. La seule différence est au niveau du cyclage qui se fait comme en pression de support. Le cyclage se fait lorsque le débit inspiratoire chute à 25% du débit inspiratoire de pointe.
Partie B : Les variables de phases et les paramètres associés
Dans la partie A on a présenté les modes et les contrôleurs qui sont les plus populaires en ventilation mécanique. Il y a plusieurs combinaisons et le thérapeute doit comprendre les paramètres qui y sont associés. Ci-dessous vous allez retrouver les paramètres de base pour chacune des combinaisons. Le paramètre provoquant le déclenchement, le paramètre limité et le paramètre provoquant le cyclage. On n’a pas indiqué la PEEP, la FiO2 ni le débit de base pour la sensibilité car ce sont des paramètres de base pour tous les modes/contrôleurs.
1. Mode A/C – contrôleur de pression
- A/C, F.R, pression inspiratoire, Ti
- déclenchement – temps ou patient
- limite – pression
- cyclage – temps (déterminé par le Ti)
2. Mode A/C – contrôleur de débit/volume
- A/C, F.R, débit, volume courant, pause inspiratoire
- déclenchement – temps ou patient
- limite – débit réglé
- cyclage – temps (le ventilateur divise le Vt par le débit réglé)
3. Mode A/C – contrôleur double
- A/C, F.R, volume courant, Ti
- déclenchement – temps ou patient
- limite – pression
- cyclage – temps (Ti)
4. SIMV – contrôleur de pression
- SIMV, F.R, pression inspiratoire, Ti, pression de support
- déclenchement : temps ou patient
- limite – pression inspiratoire et pression de support
- cyclage – temps (Ti) et le 25% débit inspiratoire de pointe
5. SIMV – contrôleur de débit/volume
- SIMV, F.R, débit, volume courant, pause inspiratoire, pression de support
- déclenchement : temps ou patient
- limite – débit réglé et pression de support
- cyclage – temps calculé par le ventilateur et 25% débit inspiratoire de pointe
6. SIMV – contrôleur double
- SIMV, F.R, volume courant, Ti, pression de support
- déclenchement – temps ou patient
- limite – pression (PCV) et pression de support
- cyclage – temps (Ti) et 25% débit inspiratoire de pointe
7. Mode spontané avec pression de support
- Mode spontané (CPAP ou PSV ou CSV), pression de support
- déclenchement – patient
- limite – pression de support
- cyclage – 25% débit inspiratoire de pointe
- paramètres d’apnée
8. Mode spontané avec contrôleur double (volume support)
- Mode spontané (CPAP ou PSV ou CSV), volume courant
- déclenchement – patient
- limite – pression
- cyclage – 25% débit inspiratoire de pointe
- paramètres d’apnée
9. Mode spontané sans support inspiratoire
- Mode spontané (CPAP)
- déclenchement – patient
- limite – pression
- cyclage – patient
- paramètres d’apnée
Unité 3 : Ajustement de la ventilation mécanique
Partie A : L’ajustement des paramètres
La ventilation minute
La ventilation minute devrait être réglée pour maintenir une PaCO2 normale pour le patient. La PaCO2 dépend de la production du gaz carbonique et de la ventilation alvéolaire.
La production du gaz carbonique d’une personne dépend :
- du métabolisme
- de la surface corporelle
- du sexe
La ventilation alvéolaire dépend :
- du volume courant
- de la fréquence respiratoire
- de l’espace mort alvéolaire
Les recherches ont démontré qu’une ventilation appropriée pour un homme doit être réglée à 4.0 X surface corporelle et que pour une femme c’est 3.5 X surface corporelle. L’échelle de Dubois nous permet de déterminer la surface corporelle de nos patients.
Une deuxième façon d’estimer la ventilation minute est de multiplier le poids idéal du patient par 100.
Le volume courant normal pour les mammifères est de 5 – 7 ml/kg. En ventilation mécanique on ventile habituellement entre 6 – 8 ml/kg selon le poids idéal du patient et de 4 – 8ml/kg pour les enfants et les bébés et les patients qui souffrent de maladies pulmonaires hétérogènes. Plus spécifiquement, des volumes courants aussi petits que 4- 6 ml/kg peuvent être utilisés pour les patients qui ont des pathologies pulmonaires hétérogènes tels le syndrome de détresse respiratoire, des maladies pulmonaires unilatérales, etc. Nous en discuterons de façon plus détaillée dans le chapitre pour la ventilation mécanique appliquée.
En situation d’urgence nous ne pouvons pas toujours mesurer le patient pour calculer le poids idéal. Alors nous devons faire une estimation. On note le sexe du patient et on estime sa taille. Par exemple pour une femme de petite taille, environ 5 pieds, on initie avec un Vt de 300 – 400 ml et une Ve d’environ 5 – 5.5 lpm. Pour un homme de grande taille, environ 6’2” pieds, on initie avec un Vt de 500 – 700 ml et une Ve d’environ 8 – 9 lpm.
C’est seulement quand le patient est stabilisé qu’on peut le mesurer, calculer son poids idéal et apporter les changements nécessaires.
Le débit inspiratoire et son patron
Lorsqu’on choisit un contrôleur de débit/volume on règle le montant du débit qu’on veut administrer au patient habituellement entre 40 – 100 Lpm. On règle aussi le Vt. Le ventilateur calcule le Tid nécessaire pour livrer le Vt réglé.
La machine calcule le Tid en divisant le Vt par le débit réglé
ex : Tid = 0.5 L / 60 L/min./60 secondes = 0.5 seconde
Après l’initiation de la ventilation mécanique avec un contrôleur de débit/volume on devrait analyser la courbe de pression/temps pour s’assurer qu’on rencontre la demande du patient.
Pour certains ventilateurs on peut choisir la courbe de débit. Les courbes de débit disponibles sont la courbe carrée ou la courbe descendante.
- en choisissant l’onde carrée le débit demeure constant pendant l’inspiration
- ce type de débit diminue le Tid nécessaire pour livrer le Vt réglé
- la turbulence du débit dans le système augmente; l’augmentation de la turbulence augmente la PiP mais la PA demeure la même
- la Paw moyenne diminue car le Tid est plus court qu’avec l’onde descendante
- si le ventilateur nous permet de choisir l’onde de débit on choisit habituellement l’onde descendante
- ce type d’onde ressemble plus à l’inspiration normale et on prédit qu’elle est plus confortable
- le Tid est plus long qu’avec l’onde carrée car plus de temps est requis pour livrer le Vt
- moins de turbulence est créée dans le système et donc la PiP diminue
- la Paw moyenne augmente car le Tid est plus long
Il existe l’onde ascendante et l’onde sinusuïdale. L’onde ascendante est disponible sur le Servo-i. L’onde sinusoïdale n’est pas disponible sur les ventilateurs modernes en ce moment.
 Pour d’autres ventilateurs, plus précisement les ventilateurs construit par la compagnie Draeger, un Ti total doit être réglé en contrôleur de débit/volume. Comme les autres ventilateurs le Tid est calculé avec le débit et le Vt réglés. Par conséquent, le Tis est indirectement déterminé par le Ti total et le Tid calculé.
Pour d’autres ventilateurs, plus précisement les ventilateurs construit par la compagnie Draeger, un Ti total doit être réglé en contrôleur de débit/volume. Comme les autres ventilateurs le Tid est calculé avec le débit et le Vt réglés. Par conséquent, le Tis est indirectement déterminé par le Ti total et le Tid calculé.
Dans ce diagramme, on observe que le contrôleur est un débit carré et qu’il y a une pause avant l’expiration. Ceci peut être le résultat de 2 possibilités : soit que l’opérateur a réglé une pause inspiratoire OU soit que l’opérateur travaille avec un Draeger et qu’il a choisi un contrôleur de débit avec un Ti suffisamment long résultant en un Tid + Tis.
La pression inspiratoire
En contrôleur de pression on initie la pression entre 10 – 15 cmH2O et on augmente par cran de 2 – 3 cmH2O pour l’adulte afin de fournir un Vt idéal.
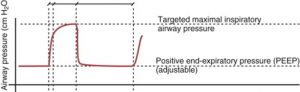
Dépendamment du ventilateur on peut ajuster une pression inspiratoire de pointe ou on peut ajuster une pression inspiratoire au-dessus de la PEEP (driving pressure).
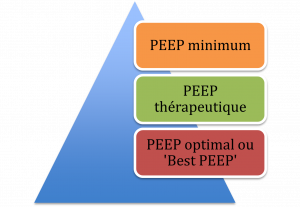
La PEEP
La PEEP permet de recruter les alvéoles collapsés et de recruter les zones d’atélectasie.
La PEEP minimale est de 0 – 5 cmH2O
La PEEP thérapeutique est de 5 – 10 cmH2O
La Best PEEP est au-dessus de 10 – 15 cmH2O. Elle permet de recruter le plus d’alvéoles possible tout en minimisant les effets secondaires associés. On augmente la PEEP par cran de 2 cmH2O et évalue l’état cardiorespiratoire du patient: habituellement la PaO2/SaO2, la compliance pulmonaire statique et l’état cardiaque (F.C, TA, SvO2, PaCO2 – PetCO2).
Partie B : Optimisation de la ventilation mécanique
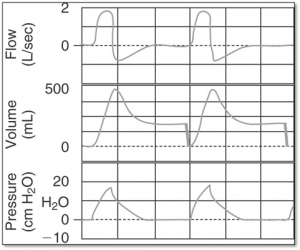
Interprétation des graphiques de base (pression, débit, volume) pour des circonstances anormales
L’effet des mécaniques respiratoires avec un contrôleur de pression
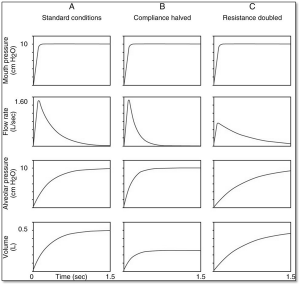
Le graphique A démontre des courbes dans des conditions normales.
Le graphique B démontre une situation dont la compliance pulmonaire statique est diminuée. Dans ces circonstances le poumon accepte moins de volume et donc nécessite moins de temps pour se remplir. En contrôleur de pression on observe souvent des pauses inspiratoires avec un Ti réglé normal 0.8 – 1.2 sec.
Si on ventile avec un contrôleur de débit/volume plus de pression se développera dans le système pour livrer le débit et le Vt réglés.
Le graphique C démontre une situation dont la résistance aérienne est augmentée. Dans ces circonstances le débit qui peut s’écouler dans les voies aériennes diminue et donc plus de temps est nécessaire pour administrer un Vt normal.
Si on ventile avec un contrôleur de débit/volume plus de pression se développera dans le système pour administrer le débit et le Vt réglés.
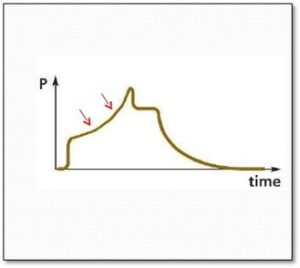
Emprisonnement d’air et Auto-PEEP
C’est important d’évaluer la présence de l’auto-PEEP chez les patients ventilés. Une auto-PEEP augmente la Paw moyenne chez le patient et peut augmenter les complications associées à la ventilation mécanique surtout le barotraumatisme, le volutraumatisme et l’hypotension.
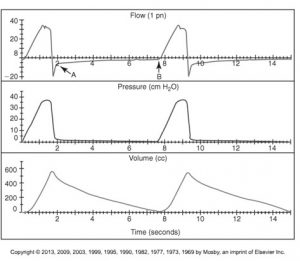
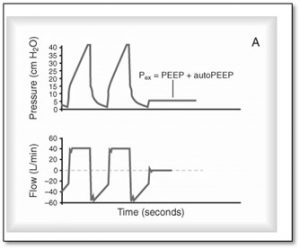
En activant la pause expiratoire comme démontré dans diagramme A, la valve expiratoire se ferme pendant l’expiration statique. En présence d’auto-PEEP le débit des voies aériennes continu de s’écouler dans la tubulure. Un équilibre se produit entre le poumon et le ventilateur et la pression mesurée estime l’auto-PEEP du patient.
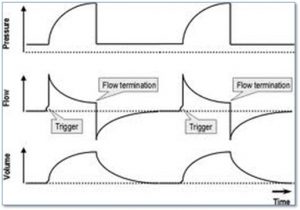
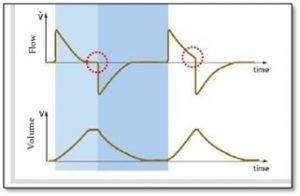
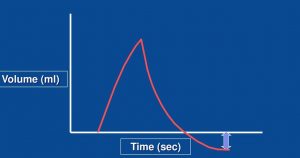
Présence d’une fuite et l’expiration active
Pour évaluer s’il y a présence d’une fuite ou si le patient fait une expiration active on peut évaluer le graphique de Vt/t
- la présence d’une fuite
- l’expiration active
L’expiration active en évaluant la courbe de pression 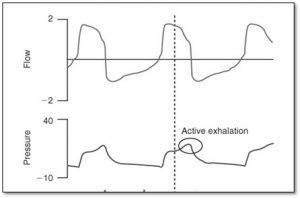
Cette observation nous indique que le Ti est trop long pour le patient et qu’il ou elle veut expirer avant que la valve expiratoire ouvre
L’expiration prématurée 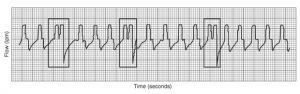
Lorsqu’on observe 2 souffles très rapprochés l’un à l’autre ceci peut être une indication que l’expiration s’est produite trop tôt. Donc le patient déclenche un 2ième souffle immédiatement après produisant presque du ‘breathstacking’. Très souvent on peut améliorer la situation en augmentant le Vt réglé
L’asynchronie avec un déclenchement inefficace
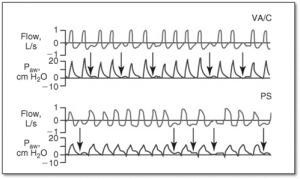
Partie C : Optimisation de la ventilation
Après l’initiation de la ventilation mécanique, on devrait évaluer si la synchronie patient/ventilateur est bonne, que le travail respiratoire est au minimum, que l’oxygénation, la ventilation et l’équilibre acido-basique sont optimisés tout en réduisant les effets secondaires.
Ajustement des paramètres de ventilation
Lorsque le patient est stabilisé et que sa ventilation est contrôlée on peut employer la formule suivante pour faire des ajustements précis au niveau de la F.R et /ou le Vt.
Vt(1) × F.R(1) × PaCO2(1) = Vt(2) × F.R(2) × PaCO2(2)
Aujourd’hui on ventile les patients en leur administrant une sédation lègère. Or les centres respiratoires sont habituellement encore fonctionnels et les patients sont souvent ventilés avec un mode spontané et une pression de support. Donc on utilise moins cette formule car c’est plutôt le patient qui détermine sa ventilation minute.
Par contre, c’est quand même important d’évaluer les gaz sanguins afin d’assurer qu’on ventile le patient de façon appropriée. Le patient peut se présenter avec plusieurs types de déséquilibres acido-basique et on doit comprendre quels sont les limites et/ou les changements possibles dans la façon qu’on ventile le patient.
- Acidose respiratoire
- maladie qui affecte le SNC (surdosage, hypoventilation, trauma crânien)
- maladie neuromusculaire (ALS, Guillain-Barré)
- maladie qui augmente le WOB (MPOC, fibrose)
En ventilation mécanique
-
- augmentation de la ventilation alvéolaire pour corriger la PaC02
- lorsque le paramètres de ventilation sont maximisés on accepte l’hypercapnie permissive afin de réduire les effets secondaires causés par la ventilation mécanique (volutrauma et baratrauma)
- Paramètres maximisés :
- Pression de plateau de 30 cmH2O
- Fréquence respiratoire 30 – 35/min.
- Paw moyenne ≥ 10 cmH2O
- Paramètres maximisés :
De plus on doit différencier si le patient souffre d’une acidose respiratoire aigue ou chronique afin de maintenir un équilibre acido-basique approprié pour la physiologie du patient.
- Poumons normaux
- ce type de patient nécessite une ventilation normale c’est à dire que l’indication de la ventilation mécanique est pour protéger le voies aériennes ou pour prévenir une défaillance imminente
- le but de la ventilation est de maintenir une PaCO2 et un pH normal
- dans ces cas les paramètres de la ventilation ne sont PAS maximisés
- Poumons chroniques
- ce type de patient vit souvent avec des ABG chroniques c’est à dire une PaCO2 environ de 60 mmHg avec un HCO3 autour du 32 mEq/L
- le but de la ventilation est de maintenir l’équilibre acido-basique normal pour le patient
- Acidose métabolique
- gain H(anion gap) : ketoacidose, défaillance rénale, ˄acide lactique
- perte HC03 (anion gap normal) : diarrhée, ¯ de la réabsorption HC03
En ventilation mécanique
-
- si ce type de patient nécessite la ventilation mécanique c’est qu’il ou elle n’est pas capable de maintenir un travail respiratoire adéquat pour soutenir l’hyperventilation
- habituellement les patients souffrant d’acidose métabolique hyperventilent et donc nous devons aussi les hyperventiler; on tente de minimiser cette hyperventilation à une PaCO2 de 30 – 35 mmHg afin de réduire l’effet de la vasoconstriction cérébrale
- si le patient déclenche chaque souffle nous essayons de le maintenir confortable
- ici on accepte la PaCO2 contrôlée par la ventilation du patient
- si la ventilation est contrôlée par le ventilateur on maintient une PaCO2 autour du 30 – 35 mmHg pour essayer de maintenir le pH au-dessus de 7.25
- Alcalose métabolique
- perte H+ : vomissement, drainage gastrique
- gain HC03 : hypokalémie, diurétique
En ventilation mécanique
-
- l’alcalose métabolique est souvent observée chez les patients aux soins intensifs suite à l’administration des solutions/médicaments tels les diurétiques, les stéroïdes, lactate de Ringer’s, TPN
- la compensation maximale pour une alcalose métabolique est une PaCO2 d’environ 55 – 60 mmHg. On laisse ces patients faire leur propre compensation. Cette alcalose pourrait aussi être bénéfique pendant le sevrage de la ventilation mécanique car la sensation de dyspnée est probablement diminuée.
- Alcalose respiratoire
- hypoxémie
- ASA, xanthine
- ventilation iatrogénique
- maladie du parenchyme (Récepteur J, Hering-Breuer)
- désordre du SNC (trauma, méningite, encéphalite)
- problème métabolique (septicémie, maladie hépatique)
En ventilation mécanique
-
- prévenir l’asynchronie
- maintenir le pt confortable (anxiété, sédation)
- corriger la cause ( fièvre, douleur, anxiété)
Si la cause ne peut pas être corrigé l’hyperventilation persistera chez ces patients même si on tente de réduire le support de la ventilation mécanique.
- Déséquilibres mixtes
En ventilation mécanique
-
- on ne fait pas de changements car habituellement le pH est normal
Situations dans lesquelles nous voulons maintenir une PaCO2 anormale
- Hyperventilation iatrogénique
Utiliser pour diminuer une pression intracrânienne élevée (ICP ˃ 20 mmHg). L’hypocapnée provoque une vasoconstriction cérébrale diminuant la perfusion et la pression cérébrale. Cette thérapie est très controversée car cette diminution peut aussi induire l’hypoxie des cellules nerveuses centrales et aggraver la situation déjà précaire. Une hyperventilation légère, c’est-à-dire maintenir la PaCO2 entre 30 – 35 mmHg, est plutôt utilisée.
- Hypercapnie permissive
Diminution du support ventilatoire afin de réduire les effets secondaires d’une ventilation à pression positive lorsqu’il devient impossible de maintenir une normocapnée. Les groupes de patients qui en bénéficient sont habituellement les patients souffrant de ARDS, status asthmaticus, MPOC, fibrose kystique, fibrose pulmonaire sévère.
Valeurs de PaCO2 et pH acceptables : PaCO2 50 – 150 mmHg, pH ≥ 7.10 (habituellement on tente de la maintenir ≥ 7.25)
-
- L’hypercapnie permissive serait contre-indiquée chez ces 2 groupes de patients
- augmentation de la pression intracrânienne
- instabilité cardiovasculaire (ischémie, CHF, hypertension pulmonaire)
- L’hypercapnie permissive serait contre-indiquée chez ces 2 groupes de patients
-
- Techniques utilisées pour gérer l’hypercapnie permissive
- sédation
- diminution de la production de C02 : – paralysant (fonctionne rarement)
- refroidir le pt
- diminuer le glucose administré
- administrer des tampons pour maintenir le pH ≥ 7.25 (att’n avec administration de NaHC03; la réaction d’hydrolyse augmente la PaC02)
- Techniques utilisées pour gérer l’hypercapnie permissive
D’autres techniques et procédures qui peuvent influencer la ventilation alvéolaire
- succionner : utiliser cathéter de succion en ligne
- instiller : non recommander car peut augmenter les risques d’infection; on utilise l’instillation seulement si on doit déboucher le tube endotrachéale ou trachéal lorsqu’obstrué
- administrer des médicaments via aérosol (MDI, VMN, USN, SVN)
- bronchodilatateurs : doubler la dose
- stéroïdes
- antibiotiques : tobramycine
- mucolytiques : pulmozyne, mucomyst
- solution hypertonique
- bronchoscopie
- physiothérapie
- positionner le patient
- semi-fowler – minimum de 30 à 45 degrés (diminution VAP)
- tourner le pt souvent (prévient V/Q mismatch, aide l’atélectasie)
- maintenir le confort du patient
- agitation
- asynchronie avec le ventilateur
- frustration avec la communication
Partie D : Optimisation de l’oxygénation
L’oxygénation des patients est déterminée par la FiO2, la Paw moyenne, les vasodilatateurs pulmonaires, l’hygiène bronchique et la position de pronation. Une FiO2 sécuritaire est ≤ 50% – 60%. Lorsque les demandes d’oxygènation augmente et que la FiO2 augmente surtout ≥ 60% on doit augmenter la Paw moyenne et utiliser d’autres techniques pour améliorer l’oxygénation du patient.
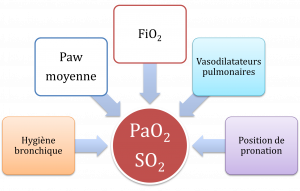
La Paw moyenne
- les techniques pour augmenter la Paw moyenne
- ajouter une PEEP et déterminer la Best PEEP
- pour trouver la Best PEEP on augmente la PEEP de 2 – 3 cmH2O Q2 -5min.
- à chaque fois on évalue si cette augmentation améliore la Cst, le Vte en contrôleur de pression ou la PiP en contrôleur de débit, la SpO2/PaO2
- en même temps on évalue l’impact néfaste sur le système cardiovasculaire (F.C, TA, PvO2)
- on devrait aussi évaluer si l’espace mort physiologique augmente en évaluant la PetCO2 – PaCO2
- temps et aussi longtemps que l’oxygénation s’améliore sans causer d’effets secondaires sur le système cardiovasculaire on augmente progressivement la PEEP; lorsque les effets néfastes cardiovasculaire apparaissent, ceci nous indique qu’on a surpassé la Best PEEP et on diminue sa valeur à celle précédente
- augmenter le Ti
- ajouter une pause inspiratoire
- diminuer le TCT (total cycle time)
- augmenter la pression inspiratoire
- ajouter une PEEP et déterminer la Best PEEP
Dans certaines situations nous pouvons faire un recrutement pulmonaire (30/30 ou 40/40) ou ajouter des soupirs à la ventilation de façon périodique. Nous pouvons aussi le faire avant et après une succion, une bronchoscopie, après le transport du patient, durant une physiothérapie.
Les recherches démontrent que juste faire un recrutement pulmonaire pour une période de 30 secondes ou de 40 secondes n’est pas suffisant pour maintenir le recrutement et améliorer l’oxygénation. On devrait plutôt trouver la Best PEEP après avoir fait le recrutement. Voici une des méthodes suggérée, la méthode de recrutement/dérecrutement :
-
- faire un recrutement de 30/30 ou 40/40
- on diminue la PEEP de 2 -3 cmH2O à chaque 2 – 5 minutes
- lorsqu’on observe une diminution de la Cst et/ou la SpO2 du patient pendant le dérecrutement ceci nous indique que le poumon commence à dérecruter
- on fait un 2ième recrutement
- on ajuste la PEEP environ 2 cmH2O au-dessus du point de dérecrutement
Certains modes de ventilation ont été développés pour augmenter la Paw moyenne tels la ventilation à haute fréquence (HFJV et HFO) et airway pressure release ventilation (APRV ou Bilevel ou Bivent)
HFO et HFJV
-
- ce type de ventilateur est un contrôleur de temps. C’est-à-dire que le Vt et la PiP peuvent varier en fonction des changements des mécaniques. On règle une fréquence respiratoire plus que 4X la fréquence respiratoire normale (au-dessus de 150 – 1000/minute ou 3 – 15 Hz tout en délivrant des Vt inférieur à l’espace mort anatomique. L’échange gazeux ne peut donc pas s’expliquer classiquement VA = (Vt – VD) X F.R). L’échange gazeux avec la ventilation à haute fréquence s’expliquer par :
- convection de l’air
- l’effet Pendelluft
- la vélocité asymétrique
- la dispersion Taylor
- la diffusion moléculaire
- ce type de ventilateur est un contrôleur de temps. C’est-à-dire que le Vt et la PiP peuvent varier en fonction des changements des mécaniques. On règle une fréquence respiratoire plus que 4X la fréquence respiratoire normale (au-dessus de 150 – 1000/minute ou 3 – 15 Hz tout en délivrant des Vt inférieur à l’espace mort anatomique. L’échange gazeux ne peut donc pas s’expliquer classiquement VA = (Vt – VD) X F.R). L’échange gazeux avec la ventilation à haute fréquence s’expliquer par :
Initiation et ajustements des paramètres pour l’adulte :
-
-
- Paw : ajuster le Bias flow (30 – 40 Lpm) et le bouton Paw (MEAN); on ajuste la Paw initiale 3 – 5 cmH2O > Paw délivré pendant la ventilation mécanique conventionnelle; habituellement la Paw initiale pour HFO est de 25 – 30 cmH2O; on augmente la Paw par cran de 2 – 3 cmH2O pour améliorer l’oxygénation Évaluer la radiographie dans le but d’obtenir une inflation entre T8–T9 et utiliser le monitorage continue des gaz artériels avec les électrodes transcutanées
- Amplitude : utiliser la PIP de CMV comme amplitude de HFO et augmenter par cran de 3 à 5 cmH2O pour obtenir une bonne vibration (wiggle ‘CWF’) de la poitrine (clavicule jusqu’à la mi-cuisse) et une TcPCO2 optimale. Attendre 15 minutes et augmenter l’amplitude à nouveau si la PaCO2 n’est pas acceptable (souvent on débute avec une amplitude de 50 – 60 cmH2O et on peut augmenter jusqu’à 90 – 100 cmH2O pour obtenir une bonne vibration et ventilation)A noter : la pression est atténuée par la résistance du ETT :95% – ETT 5 mm91% – ETT 7 mm84% – ETT 9 mm
- Fréquence : installer une fréquence de 5 Hz pour l’initiation de HFO; à noter que lorsqu’on diminue la fréquence avec HFO on augmente le Vt délivré qui augmente la ventilation minute délivré au patient
- TI% : ajuster à 33% pour l’initiation de HFO (I = 33% et E = 67%) et ne pas dépasser 50%; le TI% influence aussi la ventilation car en augmentant le TI% on augmente le Vt délivré; ce paramètre influence donc la ventilation et l’oxygénation
- Débit (bias flow) : 30 – 40 LPM
- Paramètres pour la population néonatal et pédiatrique
Paramètres Néonatologie Pédiatrie Débit (bias flow) 10 – 15 lpm 15 – 30 lpm F.R 10 – 15 Hz 10 – 15 Hz Amplitude CWF : nombril CWF : nombril ou mi-cuisse pour enfants plus vieux
-
APRV
-
- un mode ventilatoire qui délivre deux niveaux de pressions ou de CPAP. On règle une haute pression soit entre 15 – 35 cmH2O pour une phase inspiratoire plus longue que la normale soit entre 4 – 15 secondes pour ensuite cycler à une basse pression soit entre 0 cmH2O – 15 cmH2O pour une période expiratoire très courte soit de 0.5 – 1.5 secondes.
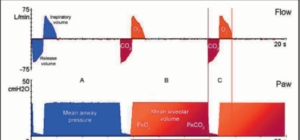
-
- lorsqu’on choisit le temps au niveau de la basse pression (Tlow) on doit évaluer la courbe expiratoire débit/temps pour assurer la présence d’une PEEP intrinsèque; habituellement on ajuste le débit expiratoire entre 75% – 50% du débit expiratoire de pointe (PEFR); ensuite on peut faire une pause expiratoire afin de vérifier si la PEEP intrinsèque est située dans l’écart acceptable soit entre 5 – 10 cmH20
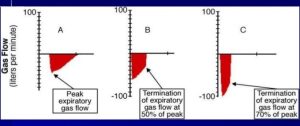
- lorsqu’on choisit le temps au niveau de la basse pression (Tlow) on doit évaluer la courbe expiratoire débit/temps pour assurer la présence d’une PEEP intrinsèque; habituellement on ajuste le débit expiratoire entre 75% – 50% du débit expiratoire de pointe (PEFR); ensuite on peut faire une pause expiratoire afin de vérifier si la PEEP intrinsèque est située dans l’écart acceptable soit entre 5 – 10 cmH20
Initiation et ajustements des paramètres pour l’adulte :
-
-
- Pression haute (Phigh) : on initie la PH en se référant à la pression de plateau ou la pression moyenne
- Temps au niveau de pression élevée (Thigh) : 4 – 15 sec.; habituellement on initie à 6 sec.
- Pression basse (Plow) : habituellement on initie avec une pression de 0 cmH2O; si après quelques heures de l’initiation le poumon est encore dérecruté ou que l’oxygénation est inadéquate on peut l’augmenter jusqu’à 5 cmH2O (la valeur zéro est la valeur la plus utilisée car elle minimise la résistance au débit expiratoire pendant l’expiration afin de maximiser le déplacement d’un debit/volume expiratoire pour une période très courte
- Temps au niveau de la basse pression (Tlow) : 0.5 – 1.5 sec.; on initie à 0.5 – 1.0 sec et évalue immédiatement la courbe expiratoire débit/temps pour assurer la présence d’une PEEP intrinsèque; habituellement on ajuste le débit expiratoire entre 75% – 50% du débit expiratoire de pointe (PEFR)
- On devrait évaluer le Vte et ajuster les paramètres pouir qu’idéalement le Vte se retrouve entre de 4- 6 ml/kg
- Options :
- pression de support : on devrait la maintenir à 0
- Automatic tube compensation (ATC) : ajuster à 80%
- sensibilité : 25% (AVEA)
-
Les vasodilatateurs (NO et caripul)
-
- les vasodilatateurs pulmonaires administrés sous forme gazeux comme l’oxyde nitrique (NO) ou via aérosol comme l’époprosténol (caripul) permettent de provoquer une vasodilatation pulmonaire sélective.
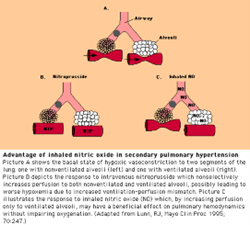
- les vasodilatateurs pulmonaires administrés sous forme gazeux comme l’oxyde nitrique (NO) ou via aérosol comme l’époprosténol (caripul) permettent de provoquer une vasodilatation pulmonaire sélective.
-
- le médicament administré via la voie pulmonaire va se rendre aux alvéoles ventilés. Lorsque le médicament diffuse de l’alvéole vers la circulation il causera une vasodilatation pulmonaire, diminuera la résistance vasculaire pulmonaire et améliorera le V/Q mismatch et l’oxygénation
- donc les buts thérapeutiques des vasodilatateurs pulmonaires sont d’augmenter le débit pulmonaire et d’augmenter l’oxygénation
- les indications pour l’administration des vasodilatateurs pulmonaire sont ARDS, l’hypertension pulmonaire, l’hypertension persistante du nouveau-né, l’hernie diaphragmatique, certaines maladies congénitales cardiaques, l’embolie pulmonaire
La position de pronation
-
- La position de pronation est efficace car elle améliore le V/Q mismatch et l’oxygénation; les changements suivants permettent d’expliquer ces observations :
- change la distribution de la perfusion pulmonnaire
- diminue la pesanter du coeur et de l’abdomen sur le poumon et améliore la FRC (capacité résiduelle fonctionnelle)
- améliore la clearance mucocilaire
- La position de pronation est efficace car elle améliore le V/Q mismatch et l’oxygénation; les changements suivants permettent d’expliquer ces observations :
L’hygiène bronchique
-
- les techniques pour l’hygiène bronchique sont :
- tourner ou asseoir le pt
- drainage posturale, percussion, vibration
- succion
- bronchodilatateur
- humidité
- tête du lit à un minimum de 30 degré (diminuer VAP)
- les techniques pour l’hygiène bronchique sont :
Unité 4 : Les effets secondaires reliés à la ventilation mécanique
Partie A : Les effets secondaires pulmonaires
Les effets secondaires de la ventilation mécanique sur le système pulmonaire se divise en 2 catégories :
- VALI (ventilator associated lung injury) : réfère aux traumatismes macroscopiques associés à la ventilation mécanique tels le barotraumatisme, la pneumonie causé par l’intubation et la ventilation mécanique (VAP) et l’asynchronie
- VILI (ventilator induced lung injury) : réfère aux traumatismes microscopiques (dans l’acinus pulmonaire) induits par la ventilation mécanique tels le volutrauma, le biotrauma et l’atélectrauma; les changements observés pour VILI sont semblables aux changements observés dans le syndrome ARDS
Le barotraumatisme
Le barotraumatisme est défini comme étant un traumatisme causé par la pression positive associée à la ventilation mécanique et le gaz sous pression cause la rupture des alvéoles. L’air voyage dans l’interstitium, dans les tissus périvasculaires et suit les voies aériennes non-cartilagineuses pour se rendre vers l’hile, le médiastin et même l’espace pleural.
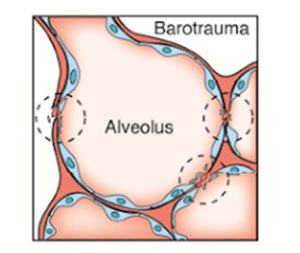
Les types de barotraumatisme
Emphysème sous-cutanée : l’air provenant des alvéoles rupturés se rend dans les tissus sous-cutané; ce type de barotrauma n’est pas douloureux et nécessite aucun traitement.
Pneumonthorax : l’air provenant des alvéoles rupturés se rend au médiastin et pénètre dans la plèvre; le pneumothorax peut être aymptomatique ou peut être sous pression et critique.
Pneumopéricardium : l’air provenant des alvéoles rupturés se rend au médiastin et pénètre dans le péricarde; ce type de barotrauma peut mimiquer une tamponade.
Pneumopéritonium : l’air provenant des alvéoles rupturés traverse le diaphragme pour pénètrer dans le péritoine; ce type de barotraume est très douloureux et diminue l’efficacité de la contraction diaphragmatique.
Pneumomédiastinum : l’air provenant des alvéoles rupturés se rend au médiastin et ne pénètre ni les tissus sous-cutané ni les séreuses; ce type de barotrauma peut causer des signes multiples tels l’emphysème sous-cutané, signes d’une tamponade, SOB, etc.
Si les signes des barotraumatismes sont sèvères on peut administrer 100% oxygène, diminuer la PEEP (0) si non-traitée et insérer une aiguille pour retirer l’air emprisonné.
Les patients prédisposés à développer un barotraumatisme sont :
- ↑ PIP, ↓ PEEP
- physiopathologie pulmonaire prédisposant à la formation de bulles emphysèmateux (bullous – blebs)
- ↑ PEEP avec ↑ Vt
- aspiration du contenu gastrique
- pneumonie nécrosante (S. aureus, T.B, mycoses, PCP, Streptococcus, les gram négatif ex : Pseudomonas)
La pneumonie associée à la ventilation mécanique
Les patients ventilés mécaniquement ont des grandes chances de développer une pneumonie. Le développement de la pneumonie se produit 48 hrs après l’intubation et l’initiation de la ventilation mécanqiue et le risque ↑ de 1 – 3% jour; même si les ETT ont un ballonnet, ces derniers ne préviennent pas l’aspiration de quantités minimes des fluides oraux
Diagnostic
| Pneumonie | Infection trachéobronchique |
|
Changements radiologiques
2 des 4 signes suivants : . fièvre . augmentation ou diminution du compte des globules blancs . secrétions purulentes . hypoxémie
|
Pas de changements radiologiques
2 des 4 signes suivants: . fièvre . augmentation ou diminution du compte des globules blancs . secrétions purulentes . hypoxémie |
Stratégies préventives
- ventilation non-invasive
- suivre les procédures pour prévenir les infections (ex : laver les mains)
- position semi-décubitus (tête du lit 30 – 45 degrés)
- changer les circuits de façon appropriée (↓ changements – ↓ VAP)
- HME
- aspiration des sécrétions
- utilisation des cathéters de succion à circuit fermé
- hygiène oropharyngienne avec agent antiseptique
- prévenir une accumulation du volume gastrique
- intubation orale est préférentielle (↓ sinusite)
- contrôler les ulcères gastriques
- bonne nutrition
L’asynchronie : voir notes de l’unité 3
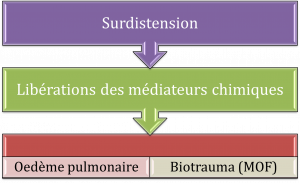
Le volutraumatisme
Le volutraumatisme est définie comme étant un traumatisme microscopique relié à la surdistension alévolaire, le dommage induit à l’épithélium alvéolaire et le processus inflammatoire associé. Les médiateurs chimiques relâchés du poumon voyagent dans la circulation sanguine et affectent d’autres organes corporels (biotrauma).
L’atélectrauma
L’atélectrauma est définie comme étant du trauma microscopique causé par l’ouverture et la fermeture répétées des alvéoles provoquant des traumatismes aux alvéoles et aux capillaires pulmonaires; on observe 3 complications : 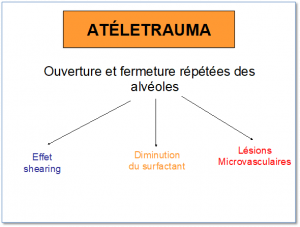
- l’effet shearing
- une diminution du surfactant
- des lésions microvasculaires
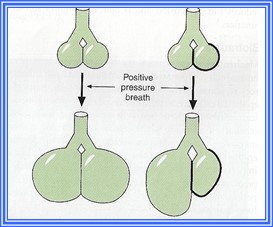 L’effet shearing : une tension se développe entre des alvéoles qui ont des compliances différentes; cette tension cause du dommage à l’épithélium et l’inflammation
L’effet shearing : une tension se développe entre des alvéoles qui ont des compliances différentes; cette tension cause du dommage à l’épithélium et l’inflammation
La diminution du surfactant : l‘ouverture et la fermeture répétées des alvéoles cause un ‘wahout’ des molécules de surfactant et diminue la concentration alvéolaire
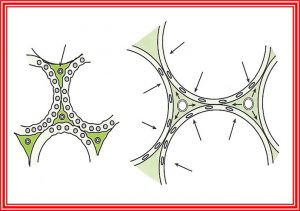 Des lésions microvasculaires : la surdistension des alvéoles cause l’écrasement des capillaires alvéolaires mais la distension des capillaires extra alévolaires; cette distension peut rupturer ces capillaires
Des lésions microvasculaires : la surdistension des alvéoles cause l’écrasement des capillaires alvéolaires mais la distension des capillaires extra alévolaires; cette distension peut rupturer ces capillaires
Les résultats d’une expérience avec 3 poumons de rats ventilés avec des pressions de 45 cmH2O et un Vt de 15 ml/kg.
Poumon 1 : poumon normal avant l’expérience 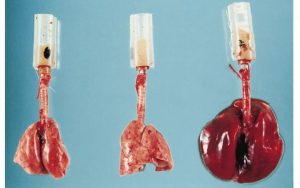
Poumon 2 : poumon ventilé pour 5 minutes
Poumon 3 : poumon ventilé pour 15 minutes
On observe que les poumons deviennent oedèmateux et engorgés de sang.
Stratégie préventives
- ventiler avec Vt 4 – 6 ml/kg
- diminue le volutrauma et l’atélectrauma
- utiliser la balloune oesophagienne pour déterminer la pression transpulmonaire car c’est plutôt celle-ce qui nous indique si une surdistension est présente
- ventiler avec une PEEP appropriée (Best PEEP)
- diminue l’effet shearing et stabilise le surfactant
- ventiler avec une pression de plateau < 30 cmH2O
- diminue le barotraumatisme
Effets de la ventilation mécanique sur la distribution du débit gazeux et le débit sanguin pulmonaire
Lorsqu’on ventile le poumon avec une pression positive la ventilation alvéolaire est plutôt distribuée dans les parties non-dépendantes du poumon; ceci altère le rapport V/Q et l’échange gazeux est moins efficace.
La surdistension des capillaires alvéolaires causent une zone 1 et augmente l’espace mort; de plus la ventilation à pression positive augmente le diamètre des voies aériennes et l’espace mort anatomique.
Changement histologique du diaphragme
La ventilation à pression positive induit la faiblesse diaphragmatique; les recherches démontrent qu’il y a une diminution des fibres musculaires et une atrophie surtout lorsque le diaphragme demeure inactif. Alors on devrait maintenir une ventilation spontanée/assistée si possible et diminuer la pression de support le plus tôt possible.
Les recherches démontrent que l’utilisation des modes PAV et NAVA préviennent la diminution et l’atrophie des fibres musculaires. Le sevrage avec ces modes permet un meilleur entrainement des muscles respiratoires et le temps que le patient doit recevoir une ventilation mécanique est diminué.
Toxicité d’oxygène
Le niveau d’une FiO2 sans risque n’est pas connue; la communauté médicale est d’accord qu’une FiO2 ≥ 60% administré pour une période prolongée (> 48 heures) augmente la toxicité d’oxygène; pour cette raison, on maintient la FiO2 < 50% avec une PaO2 de 60 mmHg et une SaO2 de 90%.
Atélectasie d’absorption
L’administration de hautes concentrations de FiO2 > 70% crée l’atélectasie particulièrement dans les unités alvéolaires où il y a de l’hypoventilation.
Partie A : Les effets secondaires non pulmonaires
Le système cardiovasculaire
Les effets secondaires cardiovasculaires lors de la ventilation mécanique à pression positive sont multiples :
- réduction du retour veineux et du débit cardiaque
- augmentation de la résistance vasculaire pulmonaire et altération de la fonction des ventricules droit et gauche
- réduction de la perfusion coronarienne
-
- réduction du retour veineux et du débit cardiaque
Cette réduction est reliée aux changements des pressions pleurales pendant la ventilation mécanique à pression positive surtout avec l’ajout d’une PEEP. La diminution de la pression pleurale pendant l’inspiration spontanée est renversée pendant le souffle avec pression positive.
Respiration spontanée Souffle avec pression positive
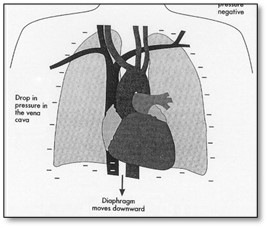
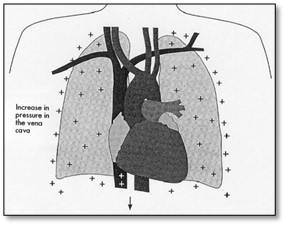
La réduction du retour veineux au coeur droit pendant l’inspiration d’un souffle avec pression positive est le résultat d’une diminution du gradient de pression entre les veines systémiques et les veines caves supérieures et inférieures. La réduction du retour veineux au coeur droit réduit évidemment le débit cardiaque vers les poumons et le coeur gauche. Chez les personnes normales ne souffrant pas de désordres cardiopulmonaires vont compenser par une augmentation de la fréquence cardiaque et une vasoconstriction systémique.
-
- augmentation de la résistance vasculaire pulmonaire et altération de la fonction des ventricules droit et gauche
Si on ventile un patient avec des gros Vt ou des hauts PEEP surtout > 15 cmH20 les capillaires alvéolaires peuvent devenir écrasés (zone 1) et augmenter la résistance vasculaire pulmonaire. Encore ici, les personnes normales ne souffrant pas d’une défaillance cardiaque droite compensent facilement et le volume systolique droit est maintenu. Par contre, chez les personnes souffrant d’une défaillance cardiaque droite une dilatation du coeur droit et même une déviation du septum vers la gauche peut se produire. La diminution du volume systolique droit et la diminution du retour veineux au coeur gauche par la déviation du septum diminue le débit cardiaque et peut causer l’hypotension.
Une echocardiographie cardiaque peut facilement confirmer ce phénomène. Ces personnes répondent très bien au bolus fluidique.
-
- réduction de la perfusion coronarienne
Une réduction de la perfusion coronarienne peut se produire suite à la diminution du débit cardiaque, des spasmes vasculaires et/ou une compression des coronaires causée par l’augmentation des pressions intrathoraciques.
La pression intracrânienne
Le montant du débit cérébral est déterminé par la pression de perfusion cérébrale (CPP)
CPP = MAP – ICP
Pendant la ventilation à pression positive, la perfusion cérébrale diminuent suite à une diminution de la MAP et une augmentation de la ICP (ICP augmente suite à la diminution du retour veineux). Pour les patients normaux, ces changements ne causent pas de problèmes; le danger est présent pour les patients souffrant d’une augmentation de la ICP qui pourraient développer de l’œdème cérébral.
Stratégies préventives :
- maintenir une PaCO2 de 25 – 35 mmHg pour 24 – 36 heures (seulement si ICP ↑; à noter que cette stratégie est controversée, même que de nouvelles recherches indiquent qu’il y a plus de dommage en utilisant cette stratégie.
- certains centres hospitaliers maintiennent la PaCO2 entre 32 – 35 mmHg
Les effets sur le système urinaire
La redistribution de la perfusion rénale dans le cortex et la médulla réanal durant une ventilation à pression positive serait probablement la cause d’une diminution dans la production d’urine. Il y a une augmentation de la réabsorption du sodium et de l’eau ainsi diminuant l’excrétion du montant d’urine et de créatinine.
Les effets sur le système hépatique et gastrointestinal
Pour certains patients, la fonction hépatique diminue et la bilirubine augmente. Les causes possibles sont : ↓ débit cardiaque, ↓ débit veineux hépatique et les changements au niveau du mouvement du diaphragme.
L’ischémie de la muqueuse gastrique et la distension gastrique sont aussi des effets secondaires de la ventilation mécanique. La formation d’ulcères est commune. C’est une des raisons pourquoi tous les patients ventilés recoivent des médicaments qui diminuent la production d’acide gastrique.
La malnutrition
Les patients ventilés sont sujets à la malnutrition pour des raisons médicales, chirurgicales et suite aux états hypermétaboliques qui sont associés avec leurs conditions (fièvre, guérison des tissus, etc.). Plusieurs de ces patients souffrent déjà de malnutrition provoquée par une maladie chronique qui a précipité l’insuffisance respiratoire.
Le montant de calories administrées à ces patients est important à contrôler. Trop de calories peut augmenter le métabolisme et donc la consommation d’oxygène et la production de CO2 et une restriction des calories peut restreindre le processus de guérison, diminuer la force musculaire nécessaire pour maintenir une ventilation alvéolaire adéquate et altérée la réponse immunitaire.
Unité 5 : Le sevrage et la discontinuation de la ventilation mécanique
Partie A : Les modes développés pour le sevrage (PAV+, NAVA et les modes automatisés)
PAV+ (proportionnal assist ventilation)
PAV+ est un mode spontané qui délivre une pression ajustée par la machine. Cette pression est déterminée par les mécaniques pulmonaires mesurées par la machine, l’effort du patient et le pourcentage de support réglé par l’opérateur.
Le ventilateur mesure les mécaniques respiratoires du patient ainsi que l’auto-PEEP à chaque 4ième – 10ième souffle. Il ajoute une pause respiratoire de 0.3 seconde pour calculer la compliance du système et calcule la résistance en analysant la courbe du débit expiratoire. En calculant les mécaniques du patient le ventilateur détermine la pression minimale qui sera administré pour l’inspiration; cette pression est ensuite ajustée selon le pourcentage de support ajusté par l’opérateur. L’opérateur évalue la barre WOB pour déterminer l’ajustement de ce support. 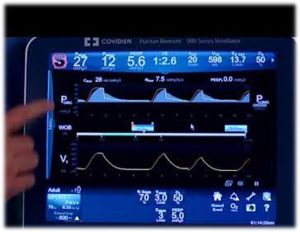
L’effort du patient détermine la 2ième portion de la pression qui sera délivrée. Pour se faire le ventilateur évalue les changements du débit dans le système 200X/seconde qui dépendent de la force musculaire, principalement le diaphragme. Le ventilateur administre un débit au patient tant et aussi longtemps que le diaphragme contracte. C’est la grande différence entre PAV+ et PSV. En PSV, le patient doit seulement déclencher la machine pour qu’un débit circule dans le système afin d’atteindre la pression réglée par l’opérateur.
La pression de pointe (PiP) en PAV+
PiP = P1 + P2
-
- P1 est la pression minimale qui sera délivrée au patient; cette pression est déterminée par les mécaniques respiratoires calculées par la machine et le pourcentage de support ajusté par l’opérateur
- P2 est déterminée par les changements de débits dans le système créée par la contraction des muscles respiratoires principalement le diaphragme
Les paramètres à régler avec PAV+ sont :
-
-
- PEEP, FiO2, sensibilité, Esens (cyclage), pente
- Pourcentage de support
- le pourcentage de support peut être réglé entre 5-95%; habituellement on choisit entre 30-80%
- lorsqu’on initie le mode on peut commencer à 80% et diminuer le support selon notre évaluation
- pour nous guider on évalue la barre du WOB; si l’indicateur est dans la région verte ceci indique que le travail respiratoire du patient est minimal
- on peut aussi initier à 50%; lorsqu’on initie à 50% ceci nous permet d’évaluer l’efficacité du diaphragme car la pression délivré avec un support de 50% a un rapport de 1 : 1 ce qui signifie que le changement de pression dans le système causer par la contractrion du diaphragme sera équivalent à la pression générée par le ventilateur; si on observe qu’une pression minimale est délivrée par la machine ceci nous indique que la contraction musculaire est faible et qu’on devra suivre les protocoles de sevrage établie par la compagnie afin de développer la force musculaire respiratoire du patient.
- un pourcentage de support de 30% est équivalent à un support minimal; on peut extuber le patient s’il rencontre les critères
-
NAVA (neurally adjusted ventilatory assist)
Ce mode est disponible sur le Servo-i. Pour que le mode fonctionne on doit insérer un cathéter Edi muni de 9 électrodes au bout distal qui permettent de mesurer l’activité électrique du diaphragme. On l’insère dans l’oesophage via la cavité orale ou nasale jusqu’à l’estomac. 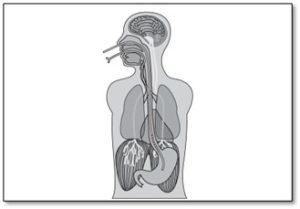
Voici les critères utilisés pour évaluer si le cathéter est bien positionné :
-
-
- mesurer la distance N/G nez-oreille-processus xyphoïde moins 4 cm
- noter le marqueur en cm à la bouche ou le nez après l’insertion
- ausculter l’estomac lorsque de l’air est injecté via le port d’alimentation
- faire une pause expiratoire (la courbe Edi devient positif quand le patient inspire)
- observer le moniteur sur le ventilateur
-
Les paramètres à régler avec le mode NAVA :
-
-
- activer le mode NAVA
- choisir la PEEP, FiO2,
- niveau de NAVA 0.0 – 15.0 cmH2O/uV (typiquement on choisit entre 0.5 – 4.0 cmH2O/uV et on apporte des ajustements entre 0.1 – 0.2 cmH2O/uV)
-
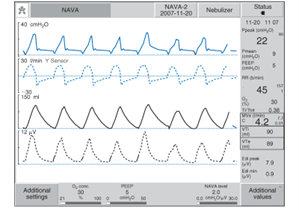
Le signal du cathéter Edi est mesuré 60 X/sec. et donc la réponse du ventilateur est très rapide. La pression ajoutée dans le circuit est équivalent à la mesure d
u Edi X niveau NAVA réglé + PEEP. Le cyclage se produit lorsque le Edi diminue à 70% du Edi peak. À noter que les électrodes sont positionnées au niveau du diaphragme et qu’une respiration paradoxale donc sans contraction diaphragmatique, ne sera pas détecté par le cathéter Edi.
Lorsque le niveau de NAVA est de 1 cmH2O/uV on peut considérer à extuber le patient s’il ou elle rencontre les critères.
Les modes automatisés
| MODE | VENTILATEUR | BRÈVE DESCRIPTION |
| 1. Automode | Servo-i | Le ventilateur passe d’un mode contrôlé à un mode spontané en Volume Support lorsque le patient respire spontanément; si le patient fait des périodes d’apnées, le ventilateur retourne en mode contrôlé et vice versa |
| 2. ASV (adaptive support ventilation) | Hamilton | Le ventilateur ajuste le support ventilatoire en contrôlant la ventilation avec PRVC ou VS en fonction des mesures cliniques tels les mécaniques respiratoires, les débits/Vte/Ti,etc |
| 3. Smart Care | Evita XL | Le ventilateur ajuste la pression de support en fonction des mesures cliniques tels la PetCO2, la Paw, la PEEP, la F.R, le Vte |
| 4. MMV (mandatory minute ventilation) | Draeger | La ventilation minute minimale calculée par le ventilateur est déterminée par la FR et le Vt réglés par l’opérateur. Lorsque la ventilation minute diminue en-dessous des paramètres réglés le ventilateur choisis le mode SIMV-VG pour ventiler le patient. Si la ventilation minute du patient est au-dessus de la ventilation minute réglé le ventilateur ventile en PSV. |
Partie B : L’évaluation du patient
Le renversement ou l’allègement de la condition qui a mené à l’insuffisance du système respiratoire est le critère le plus important à évaluer avant de décider de discontinuer la ventilation mécanique. Le clinicien doit déterminer si la condition du patient s’est améliorée et si sa condition clinique est stable. Les autres questions importantes à se poser sont :
- est-ce que la pathologie est renversée
- quelles sont les critères d’oxygénation du patient
- Voici les critères d’oxygénation acceptable
- FiO2 ≤ 40%
- PaO2 ≥ 60 mmHg ou SpO2 ≥ 90%
- PEEP ≤ 5 – 8 cmH2O
- pH ≥ 7.25
- Voici les critères d’oxygénation acceptable
- quel est l’état hémodynamique du patient
- Voici les critères pour une hémodynamie acceptable
- pas de vasopresseurs ou une dose minimale
- Voici les critères pour une hémodynamie acceptable
- est-ce que le patient peut faire des efforts respiratoires
Si le patient rencontre les critères d’acceptabilité pour débuter le sevrage on peut initier une période de respirations spontanées avec un support minimal (SBT trial) pour une durée de 30 – 120 minutes. Les recherches démontrent qu’une durée de 30 minutes est suffisante pour faire une bonne évaluation. En général, les premières 3 minutes nous indiquent si le patient tolère l’essai ou non. Les différents types de support minimal utilisés sont :
-
-
-
-
-
-
- PSV 5/5
- PAV 30%
- T-Piece,
- NAVA 1 cmH20/uv
-
-
-
-
-
L’évaluation du SBT est le critère le plus important qui nous indique si le patient peut être discontinué de la ventilation mécanique. Pendant l’essai on évalue le confort du patient, l’échange gazeux, le patron respiratoire et l’hémodynamie.
Voici des signes qui indiquent qu’on devrait arrêter l’essaie :
| Confort du patient | Oxygénation | Patron respiratoire | Hémodynamie |
| anxiété, diaphorèse, dyspnée
|
Détérioration de la SpO2 | F.R >30 – 35/min.
Vt < 250 – 300 ml |
↓ TA de 20 mmHg
↑ TA de 30 mmHg TA > 180 mmHg Changement de la TA diastolique de 10 mmHg ↑ F.C de 20% ou > 140/min. |
Partie C : L’extubation
Losque le patient tolère la période d’une respiration spontanée, on doit évaluer s’il ou elle est prêt pour l’extubation.
Voici les questions à se poser pour bien évaluer si le patient peut être extubé :
-
-
- est-ce qu’il est capable de respirer spontanément
- est-ce qu’elle est capable de protéger ses voies aériennes
- est-ce qu’elle a une bonne toux et est capable de mobiliser les sécrétions
- est-ce qu’il y a une fuite alentour du ballonnet (minimum 110 mL ⇒ 20% des patients n’auront pas de fuite surtout les femmes)
-
Voici les complications et les traitements post-extubation :
-
-
- raucité de la voix, mal de gorge, toux, ↑ sécrétions
- Tx : humidité
- stridor causer par l’œdème sub-glottique
- Tx : humidité froide, épinéphrine, héliox, ré-intuber et administrer de la dexamethasone
- stridor causer par un laryngospasme (plus fréquent au bloc opératoire)
- Tx : CPAP, bloqueur neuromusculaire, ré-intubation
- hypoxémie, crépitements gras, toux causer par une aspiration
- Tx : oxygénothérapie, humidité, antibiothérapie, ré-intubation et hygiène bronchique
- pour diminuer les chances d’aspiration on devrait arrêter le gavage ≈ 2 hrs avant l’extubation
- raucité de la voix, mal de gorge, toux, ↑ sécrétions
-

