5 Chapitre 5 – La pharmacologie respiratoire
Unité d’apprentissage 1 : Introduction à la pharmacologie
Partie A : Introduction à la pharmacologie
Partie B : Administration et calculs en pharmacologie
Unité d’apprentissage 2 : Le système nerveux et la pharmacologie respiratoire
Partie A : Les systèmes nerveux central et autonome
Partie B : Le contrôle nerveux du système pulmonaire
Partie C : Les bronchodilatateurs
Partie D : Les corticostéroïdes
Partie E : Les techniques d’administration
Unité d’apprentissage 1 – Introduction à la pharmacologie
Partie A : Introduction à la pharmacologie
En thérapie respiratoire, la pharmacologie est orientée surtout pour le traitement des désordres pulmonaires et pour traiter la population nécessitant des traitements dans le domaine des soins critiques. Aujourd’hui, des progrès considérables ont été effectués dans le domaine de la pharmacologie qui fait en sorte que l’espérance de vie est grandement augmentée.
Les fonctions complexes de l’organisme humain sont régularisées par des agents chimiques tels des hormones, des médiateurs chimiques et des neurotransmetteurs. Ces agents chimiques interagissent avec les cellules de l’organisme pour modifier leurs fonctions. En pharmacologie, ces modifications sont utilisées pour traiter une maladie, pour faire un diagnostic d’une maladie ou pour prévenir le développement d’une maladie. Les agents chimiques utilisés en pharmacologie sont nommés « drogues ». Des exemples de drogues sont : l’oxygène, le ventolin, l’adrénaline, les vitamines, etc.
Identification d’un médicament
Au Canada, les médicaments sont réglementés par le gouvernement fédéral. Ces médicaments peuvent être vendus par une ou plusieurs compagnies pharmaceutiques. Cela oblige le gouvernement fédéral à avoir des standards pour l’approbation des médicaments, et d’autres standards pour l’usage des médicaments.
Chaque médicament aura les noms suivants :
-
- Nom chimique
- Nom de code
- Nom générique
- Nom commercial (trade)
Exemple :
-
- Nom chimique : 4-(5-cyclopentyloxy-carbonylamino-1-methyl-indol-3-ylmethyl)-3-methoxy-N-o-tolysulfonylbenzamide
- Nom du code : ICI 204,219
- Nom générique : zafirlukast
- Nom officiel : zafirlukast
- Nom commercial : Accolate (AstraZeneca)
Ordonnance (prescription) d’un médicament
C’est l’ensemble de l’information donnant l’autorisation à un patient d’utiliser un médicament suivant un usage spécifique. Dans les milieux hospitaliers, les prescripteurs doivent utiliser les feuilles d’ordonnances réglementaires de l’hôpital. Certains thérapeutes respiratoires peuvent être autorisés à prescrire certains médicaments selon les actes régissant la santé d’une province. Dans certains hôpitaux de la province, les pharmaciens ou les thérapeutes respiratoires peuvent substituer un médicament administré par nébuliseur (SVN) par un médicament administré sous forme d’inhalation (MDI). Exemple : Ventolin 5 mg (nébule) pour du Ventolin 6 inhalations (MDI).
Principes d’action des médicaments
Il y a trois phases distinctes entre le moment où nous prenons un médicament et le moment où nous ressentons ses effets. Ces trois phases sont : les phases pharmaceutique, pharmacocinétique et pharmacodynamique.
1) La phase pharmaceutique
C’est l’étape où le prescripteur choisit la forme du médicament et la voie d’administration afin d’obtenir des effets thérapeutiques souhaitables pour le patient dans un délai de temps approprié.
Lorsqu’un médicament est prescrit (médicaments respiratoires ou autre), l’efficacité, la sécurité et la simplicité de l’administration doivent toutes être considérées. 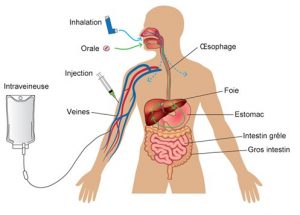 Les médicaments peuvent être administrés via les voies orale (entérale), parentérale, inhalation, transdermale, topique et intranasale.
Les médicaments peuvent être administrés via les voies orale (entérale), parentérale, inhalation, transdermale, topique et intranasale.
On utilise la voie d’inhalation pour déposer les médicaments directement dans le système respiratoire. Les médicaments sont administrés sous forme aérosol, c’est-à-dire, la dispersion d’un liquide en particules très fines. On peut aussi administrer ces particules via une poudre sèche. Voici différents types de dispositifs nous permettant d’administrer ces médicaments par voie orale ou nasale :
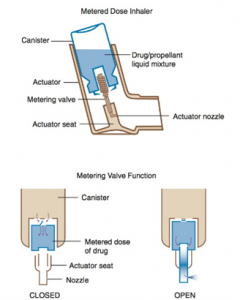

a) Aérosol doseur (MDI) :
Cette technique de livraison est grandement utilisée à cause de sa simplicité d’utilisation et de sa taille compacte. Elle permet la livraison de médicaments respiratoires à des patients respirant spontanément et à des patients intubés recevant de la ventilation mécanique. Chaque médicament est commercialisé avec un contenant d’une couleur spécifique. Souvent, les patients décrivent leurs médicaments par la couleur de leur contenant. Cependant, il est important de toujours vérifier l’étiquette de l’aérosol doseur avant d’en faire l’administration.
Le réservoir d’aérosol doseur contient :
- (1) le médicament : poudre micronisée ou solution aqueuse (1% médicament actif)
- (2) agent propulsant (propellant) (60 à 80%)
- (3) agent de dispersion : maintient le médicament en suspension (surfactant).
Voici quelques classes de médicaments communément administrées par aérosol doseur :
- Les bronchodilatateurs adrénergiques (exemple : salbutamol)
- Les anticholinergiques (exemple : atrovent)
- Les corticostéroïdes (exemple : flovent)
Parfois, les aérosols doseurs combinent 2 catégories de médicaments par exemple le SYMBICORT (bronchodilatateur long terme + stéroïde).
Caractéristiques d’un aérosol doseur :
- Seulement une fraction du médicament atteint le site pulmonaire désiré, car une quantité importante de l’aérosol est déposée au niveau de l’oropharynx
- Le dosage qui atteint la région désirée est difficilement prévisible
- Il existe des accessoires qui facilitent l’utilisation d’un aérosol doseur :
- Aérochambre
- Aérochambre avec masque
- Aérovent (ventilateur)
- Breath-actuated inhaler
- Dose counters

b) Inhalateur à poudre sèche (DPI)
L’inhalateur à poudre sèche est activé lorsque le patient inspire. Il est relativement peu dispendieux, ne nécessite pas d’agent propulseur et ne nécessite pas une coordination de l’activation et de la respiration du client. Cependant, la dispersion de la poudre en particules respirables nécessite la création d’un débit turbulent. Un débit turbulent est obtenu lorsque le client peut générer un débit inspiratoire suffisamment élevé. Il ne peut donc pas être utilisé par tous les clients. Il est nécessaire de vérifier le débit inspiratoire nécessaire pour l’activation de l’inhalateur à poudre sèche de chaque médicament.
Caractéristiques :
- La plupart des dispositifs à poudre sèche nécessitent une substance transporteuse pour permettre à la poudre médicamenteuse d’être plus facilement inspirée : lactose ou glucose.
- La performance optimale de chaque DPI’s est obtenue à un débit inspiratoire spécifique.
- Cette méthode de livraison est limitée habituellement par la création d’un débit inspiratoire entre 40 et 60 lpm. (difficile pour les enfants et pour certains clients ayant une capacité respiratoire restreinte)
- Le niveau d’humidité influence la livraison de médicaments
- La déposition dans les poumons est comparable à un aérosol doseur.
c) Respimat (SMI) 
Nouvelle technologie permettant l’administration de certains médicaments respiratoires sous forme de bruine.
d) Micro nébuliseur (SVN)
L’administration de médicaments par micro nébuliseur  est utilisée depuis plus de 100 ans. Cependant, on a réduit considérablement cette approche de livraison. Les raisons qui expliqueraient cette réduction sont:
est utilisée depuis plus de 100 ans. Cependant, on a réduit considérablement cette approche de livraison. Les raisons qui expliqueraient cette réduction sont:
On a une perte considérable de médicaments durant l’administration
Administration continuelle
Volume résiduel demeurant dans le nébuliseur (attention solution ayant moins de 2 ml
On doit fréquemment nettoyer le nébuliseur, sinon, on risque de réduire la performance de l’appareil (concentration du médicament) et aussi la stagnation du médicament dans le nébuliseur peut être une source d’infection
Le temps d’administration du médicament est considérable (entre 10 et 15 minutes pour un traitement).
Les facteurs influençant la performance des SVN sont :
- Design de l’appareil et le volume résiduel :
- Plus grand est le volume résiduel plus grande est la perte de médicaments administrés
- 3 mL = on perd environ 50% de la dose du médicament
- 5 mL = environ 70% de la dose du médicament sera administré
- Plus grand est le volume résiduel plus grande est la perte de médicaments administrés
- La pression du gaz et sa densité :
- On doit fournir un débit entre 6 et 8 lpm. Plus grand est le débit fourni au nébuliseur, plus petites sont les particules et plus court est le temps requis pour administrer le médicament.
- Plus la densité est petite, moins le gaz est turbulent qui diminue l’impaction et augmente la déposition au niveau pulmonair
- Nébulisation continuelle
- Perte considérable de médicaments
- Administration aux enfants :
- Moins de dépositions de médicaments au site d’action désiré, car : plus petites voies respiratoires, fréquence respiratoire accrue, respiration par le nez, coopération dépend de la compréhension de l’enfant, pleurs (temps inspiratoire très court et longue expiration)
- La composition du médicament:
- viscosité
- Humidité et température :
- certains médicaments doivent être réfrigérés
Voici les éléments à prendre en considération avant de déterminer le dispositif approprié pour le patient :

2) La phase pharmacocinétique
La pharmacocinétique est la phase qui étudie les facteurs qui influencent la concentration du médicament dans le plasma. Cette concentration s’élève et diminue dans le plasma selon 4 processus : 
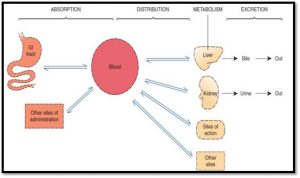
Les effets secondaires ressentis par un médicament résultent aussi de ces processus.
L’absorption : le mouvement par lequel un médicament passe de son site d’administration jusqu’à la circulation sanguine. Un médicament peut être administré par différentes voies ce qui influence la vitesse d’absorption du médicament. Par exemple, un médicament administré par voie orale pourrait être absorbé dans l’estomac ou l’intestin ce qui fait varier considérablement la vitesse d’absorption, puisqu’il est influencé par des facteurs chimiques et qu’il doit parcourir le système digestif avant d’être absorbé. Certains médicaments sont inactivés par l’acidité de l’estomac, d’autres doivent être pris à jeun ou, d’autres pris avec de la nourriture (car absorber par l’intestin). Lorsqu’on administre un médicament par voie sous-cutanée, intramusculaire ou intraveineuse, la vitesse d’absorption sera plus rapide et le degré d’absorption est plus important.
La distribution : les médicaments sont distribués aux organes cibles via la circulation sanguine. Donc les organes qui reçoivent une grande proportion de la circulation tels le cerveau, le coeur, le foie et le rein vont réagir rapidement comparativement aux organes qui en reçoivent moins tels les muscles, la peau, les os et le tissu adipeux. La plupart des médicaments ne sont pas distribués de façon uniforme dans les liquides corporels. Certains médicaments sont restreints dans le plasma tandis que d’autres peuvent diffuser à travers les cellules (liposolubles) et d’autres sont transportés par diffusion facilitée ou par transport actif. La distribution d’un médicament dépend de l’affinité du médicament aux protéines transporteurs, la grosseur moléculaire et la solubilité.
La barrière hématoencéphalique : cette barrière est sélective et ne laisse passer que les médicaments liposolubles dans le cerveau et liquide céphalorachidien. Toutefois, avec l’âge elle devient de plus en plus permissive et donc les personnes plus âgées sont plus susceptibles de ressentir des effets secondaires sur le système nerveux central.
La membrane placentaire : cette barrière constitue une barrière non sélective pour les médicaments. Alors les médicaments peuvent atteindre le foetus et occasionner une toxicité foetale.
Le métabolisme : le métabolisme, ou la biotransformation, des médicaments correspond aux modifications chimiques du principe actif dans l’organisme. Cette transformation se produit principalement dans le foie. Les métabolites produits sont plutôt hydrosolubles et donc éliminés facilement par les reins. Dans la majorité des cas, les médicaments sont inactivés par la biotransformation, mais certains deviennent activés. Les médicaments absorbés par le système gastro-intestinal se rendent au foie par le système porte hépatique avant de se rendre dans la circulation systémique. Certains médicaments sont inactivés et d’autres activés par ce premier passage hépatique. Certains facteurs peuvent altérer le métabolisme d’un médicament, notamment les troubles hépatiques, l’âge, la génétique, l’alimentation et la prise d’autres médicaments.
L’induction enzymatique : l’abus de certaines drogues peut augmenter le taux des enzymes qui inactivent la drogue à une dose donnée; alors souvent la dose thérapeutique utilisée n’est pas efficace et des ajustements sont nécessaires.
La biodisponibilité représente la fraction du principe actif qui atteint la circulation sanguine et qui produit un effet sur l’organisme. Elle correspond à la vitesse d’absorption et la quantité de médicaments absorbés. La personne qui prescrit un médicament prend en considération la biodisponibilité lorsqu’il décide de la posologie du médicament. Toutes les voies d’administration possèdent une biodisponibilité différente sauf pour la voie intraveineuse qui, elle, a une biodisponibilité de 100%.
La biodisponibilité de médicaments respiratoires est la fraction des médicaments qui atteint la circulation systémique :
On mesure le ratio L/T (lung availability / total systemic availability) afin de mesurer la biodisponibilité des médicaments respiratoires. Ce rapport nous permet de mesurer le montant de médicament inhalé qui a été absorbé et distribué aux poumons versus à la circulation systémique (ce qui cause les effets secondaires indésirables). Plus le ratio est grand, plus qu’il y a de médicaments délivrés aux poumons; plus le ratio est petit moins qu’il y a de médicament délivré aux poumons comparé à la portion retrouvée dans la circulation systémique.
Voici 2 exemples de la biodisponibilité de médicaments respiratoires administrés via aérosol
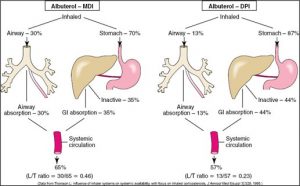
Facteurs qui influencent le rapport L/T :
-
-
-
-
- Le type d’équipement utilisé : MDP, DPI, SMI, etc.
- Passage hépatique : % du médicament qui est éliminé par le foie
- Rincer sa bouche : élimine la portion du médicament de l’oropharynx qui se rend à l’estomac
-
-
-
L’élimination (excrétion) : soit le médicaments primaire et/ou les métabolites sont éliminés par les organes excréteurs suivants : reins, G.I, poumons, salive, lait maternel. L’élimination des médicaments est évaluée en mesurant la demi-vie d’un médicament. C’est le temps pris par l’organisme pour se débarrasser de la moitié de la concentration sanguine du médicament. C’est un mécanisme important utilisé pour déterminer la fréquence à laquelle on administre un médicament. Généralement après 4 – 5 demi-vies, près de 97% du médicament est éliminé de l’organisme.
3) La phase pharmacodynamique
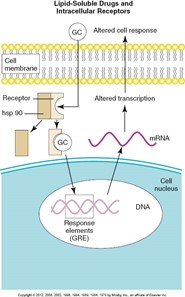
C’est la phase qui décrit comment le médicament modifie les fonctions cellulaires. Ce processus étudie l’interaction entre un récepteur et le médicament. La plupart des médicaments vont se lier à un récepteur (protéine) membranaire tandis que d’autres peuvent diffuser à l’intérieur des cellules et se lier à des protéines intracellulaires et se rendre jusqu’à l’ADN.
En pharmacodynamie le médicament peut produire (agoniste) ou bloquer (antagoniste) un effet.
Il existe plusieurs types de récepteurs. Voici quelques exemples :
Les médicaments hydrosolubles qui doivent se lier à un récepteur (protéine) présente dans la membrane plasmique.
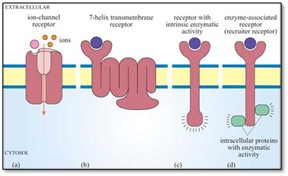
Les médicaments liposolubles qui peuvent traverser la membrane plasmique et le noyau et interagir avec l’ADN.
Interactions des médicaments
- Synergisme:
- L’effet global produit par 2 médicaments est plus grand que la somme des 2 médicaments lorsqu’ils agissent seul sur le même organe par différents mécanismes d’action
- Ex : ventolin (adrénergique) + atrovent (anti-cholinergique)
- Potentielle :
- Lorsqu’un médicament peut augmenter l’effet d’un autre
Termes utilisés pour décrire les réponses individuelles aux médicaments
- Idiosyncrasie:
- Opposé de la réponse habituelle prévisible chez un individu ou aucun effet
- Hypersensibilité:
- Réponse allergique à un médicament
- Tolérance:
- Diminution de l’intensité de la réponse à un médicament avec le temps
- Tachyphylaxie :
- Diminution rapide de la réponse à un médicament
Partie B : Adminstration des médicaments et calculs pharmacologiques
Les médicaments peuvent être administrés par voie orale (pilule ou liquide), par inhalation, via le derme et par la voie parentérale (sous-cutané, intramusculaire, intraosseux et intraveineux).
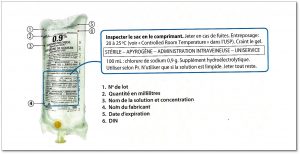
Les compagnies pharmaceutiques préparent les médicaments et doivent inscrire l’information du médicament sur l’étiquette. En plus d’y trouver le nom générique et commercial, on peut lire la teneur de médicaments contenus dans un comprimé, la concentration dans un liquide, etc.
Le médecin peut prescrire des doses correspondant exactement à la dose indiquée sur l’étiquette, mais très souvent, il peut prescrire une dose plus ou moins élevée.
Voici des exemples d’étiquettes :

Il existe trois types de calculs qui sont utilisés pour l’administration des médicaments :
- Liquides, comprimés ou capsules ayant une concentration donnée
- Calculs impliquant les pourcentages
- Calculs pour les intraveineuses
Calculs pour les liquides, comprimés et capsules ayant une concentration donnée et les calculs impliquant les pourcentages
Calcul pour les liquides, comprimés et capsules
Dose originale / quantité = dose désirée / quantité
Exercises
Exercices suivants sont des calculs de liquide/comprimé/capsule
1. Comprimé de théophylline de 200 mg. Vous avez besoin de 1 gramme. Combien de comprimés de théophylline devez-vous administrer?
2. Vous devez administrer 15 mg de phénobarbital à votre patient. La solution contient 120mg/30 mL. Combien de mL allez-vous donner au patient?
L’unité de certains médicaments (insuline, pénicilline, héparine) est en unités au lieu de mg ou g. Les problèmes sont résous de la même façon.
3. L’héparine de sodium est disponible en 1000 u/mL. Combien de mL avez-vous besoin d’administrer si le patient a besoin de 500 unités.
Exercice suivant est un calcul basé sur le poids du patient : Ne pas oublier : 1 Kg = 2,2 Lbs
4. Vous devez préparer une dose d’atropine pour un patient pesant 60 kg. La solution d’atropine est d’une concentration de 0,4 mg/mL et la dose administrée désirée est de 0,05 mg/kg.
Exercices suivants sont des calculs impliquant les pourcentages
Se souvenir : 1 : 100 ou 1% = 1 g / 100 mL (toujours g/mL)
5. Combien de mg d’isoprotérénol a-t-il dans 2 mL d’une solution 1 : 200?
6. Combien de mucomyst 20% a-t-on besoin pour préparer 5 cc de mucomyst 10%?
7. Combien de mg de procaine HCl y a-t-il dans 3 cc d’une solution 2%?
Les intraveineuses
Lorsqu’on administre des médicaments par voie parentérale on doit utiliser des seringues et des aiguilles pour préparer et administrer les médicaments.
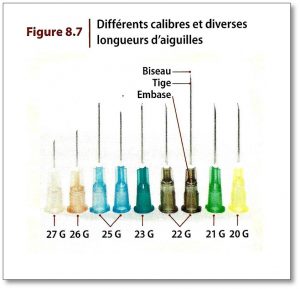

Le calibre de l’aiguille choisi dépend de la viscosité du produit lorsqu’on prépare le médicament et dépend du tissu dans lequel sera injecté le médicament. Pour une injection sous-cutanée, l’aiguille doit être courte et son calibre fin. Pour une injection intramusculaire, l’aiguille doit être longue et de plus gros calibre.
Sous-cutanée : aiguille entre 1,2 – 1,6 cm calibre 25 – 27 G
Intramusculaire : aiguille entre 2,5 – 3,7 cm calibre 21 – 22 G
La voie intraveineuse constitue un accès direct à la circulation sanguine. L’absorption du médicament est donc importante et le début d’action quasi immédiat.
Les systèmes de perfusion comprennent une solution intraveineuse et un perfuseur.
Voici l’exemple d’une solution normal salin 0.9%.
Voici les systèmes de perfusion : pompe volumétrique ou par gravité
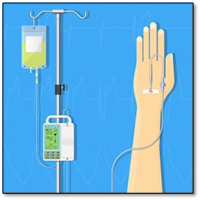
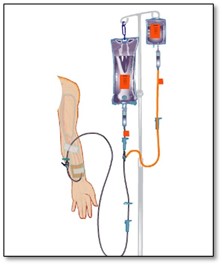
Le calcul du débit de perfusion d’une solution intraveineuse
Le plus souvent, le médecin prescrit le débit de perfusion en débit horaire (mL/h ou mL/min.)
Si la solution intraveineuse perfuse par gravité, il faut trouver le débit en gouttes/min.
Si on utilise une pompe volumétrique, on programme les données dans le perfuseur tels le débit horaire (mL/hr), la quantité à perfuser (mL) ou la durée de perfusion (min ou hrs).
Exercises
Exercices de calculs pour déterminer le débit de l’intraveineuse
1. On veut administrer 1 litre d’une solution en 3 heures. Quel est le débit en gouttes/min. s’il y a 15 gouttes/mL?
2. Quel est le débit nécessaire pour délivrer 10 ug/min d’épinéphrine si la solution contient 500 ug/250 mL? (facteur de gouttes est de 15 gouttes/mL.)
3. On ajoute 200 mg de dopamine dans 250 mL D5W. Quel débit est nécessaire pour administrer 10 ug/kg/min. pour un adulte pesant 70 kg. (facteur gouttes = 15 gouttes/mL.)
Exercices de calculs de dilution
On dilue les médicaments déjà préparés afin de diminuer leur concentration avant de les administrer directement dans une veine. Cette action diminue l’irritation de la veine. Les volumes utilisés pour administrer les médicaments dilués varient entre 5 mL et 250 mL. Si le volume à administrer est en dessous de 50 mL on l’administre à l’aide d’une seringue. Si le volume à administrer est au-dessus de 50 mL il est préférable de le diluer dans un sac de solution (100 mL ou 250 ml).
4. On veut diluer 1 mL d’une concentration de phényléphrine de 10 mg/mL à une concentration de 0.1 mg/mL. Dans combien de normal salin devrons nous le diluer pour obtenir la nouvelle concentration?
5. On veut administrer 5 mg d’éphédrine à un patient. Si on retire 1 mL d’une concentration de 50 mg/mL, combien de normal salin devrons nous diluer pour obtenir une concentration de 5 mg/mL?
Exercices de calculs supplémentaires
6. Le département de pharmacie vous fournit un médicament dont la concentration est de 50 mg / 2 mL. Ce médicament s’administre à raison de 50 mg/Kg chez un enfant naissant. L’enfant pèse 3500 g.
a) Quelle dose doit-on donner à cet enfant?
b) Combien de mL de ce médicament doit-on préparer pour donner la bonne dose?
7. Une solution injectable de glycopyrrolate de 0,2 mg/mL est utilisée pour la nébulisation. Combien de mL a t-on besoin pour préparer une dose de 1,5 mg ?
8. Nous devons infuser une solution à 10 mg/min. La concentration de la solution est de 500 mg/250 mL. Le nombre de gouttes/mL de l’appareillage est de 15 gtts/mL. Trouvez le débit (gtts/min) ?
9. Un résident veut administrer 10 mL d’une solution d’acétylcystéine 6% à un patient. Par contre la fiole disponible est d’une concentration de 20%. Combien de mL de 20% de la solution doit-il administrer pour obtenir le même effet thérapeutique?
10. Le médecin a demandé de diluer 100 mL d’une solution beclomethasone 2% à une solution 1%. Combien de mL d’eau doit-on ajouter au mélange original pour avoir la bonne concentration ?
Unité d’apprentissage 2 : Le système nerveux et la pharmacologie respiratoire
Partie A : Le système nerveux central et le système nerveux autonome
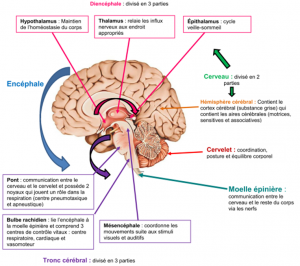
L’encéphale et la moelle épinière forment les deux parties du système nerveux central
- l’encéphale est divisé en 3 parties : le cerveau, le cervelet et le tronc cérébral
- la moelle épinière s’étend du trou occipital jusqu’à la 1ière ou 2ième vertèbre lombaire
L’information provenant des récepteurs sensoriels sera véhiculée par des fibres afférentes somatiques (peau, organe des sens, muscles squelettiques, articulations) jusqu’au système nerveux central. La réponse du système nerveux central sera envoyée via une voie motrice ou efférente aux organes effecteurs (muscles, glandes, viscères).
La voie motrice se subdivise en
- système nerveux somatique
- système nerveux autonome
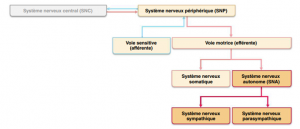
Pour comprendre les médicaments en thérapie respiratoire on doit comprendre le fonctionnement du système nerveux autonome. Ce système est parfois qualifié d’involontaire c’est-à-dire que la conscience ne le contrôle pas.
Il est divisé en 2 catégories
- système nerveux sympathique
- système nerveux parasympathique
Généralement ces systèmes agissent de façon contraire sur un même viscère (organes qui se retrouvent dans les cavités du corps; ex: cavité thoraco-abdominale).
Interaction des systèmes sympathique et parasympathique
La plupart des viscères sont doublement innervés, c’est-à-dire qu’ils reçoivent des fibres des deux systèmes. Le système stimulateur peut être soit le sympathique, soit le parasympathique selon l’organe. Par exemple, le sympathique augmente l’activité cardiaque alors que le parasympathique la diminue. Cependant, le parasympathique augmente les activités digestives alors que le sympathique les diminue.
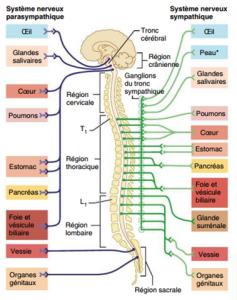
Le système nerveux autonome (SNA) règle les activités des muscles lisses, du muscle cardiaque et des glandes. On le dit autonome mais il est en fait réglé par des centres situés dans l’encéphale, soit le cortex, l’hypothalamus et le bulbe rachidien. Le système nerveux somatique contrôle les muscles squelettiques, alors que le système nerveux autonome contrôle les viscères.
Comparaisons entre le système nerveux somatique et le système nerveux autonome
Les systèmes nerveux somatique et autonome sont différents, mais ils se complètent bien. Par exemple, un travail intense qui requiert l’activité des muscles squelettiques entraîne aussi une augmentation de la fréquence cardiaque et respiratoire afin d’accommoder les besoins accrus des muscles squelettiques.
Dans les voies nerveuses du système nerveux somatique un nerf relie le système nerveux central aux muscles et/ou glandes.
Pour le système nerveux autonome, il y a deux neurofibres efférentes et un ganglion entre les deux. La première neurofibre est dite préganglionnaire; la deuxième neurofibre est dite postganglionnaire et se rend du ganglion à l’effecteur. Les premières neurofibres (préganglionnaires) sont myélinisées, bien que moins que ceux du système nerveux somatique; les deuxièmes neurofibres (postganglionnaires) ne sont pas myélinisées. Voici 2 diagrammes démontrant l’anatomie du système nerveux sympathique et parasympathique.
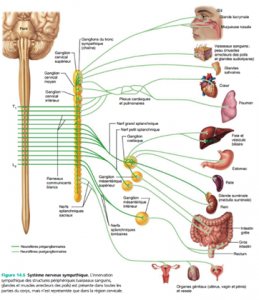
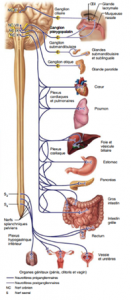
Quant aux neurotransmetteurs on retrouve dans le système somatique seulement de l’acétylcholine (Ach) et dans le système autonome on retrouve de l’Ach et de la noradrénaline (NA).

Les effets produits par les neurotransmetteurs sur les organes cibles pourront être de nature excitatrice ou inhibitrice selon les récepteurs situés sur les cellules cibles.

Rôle du système nerveux sympathique et parasympathique
a) Système nerveux sympathique
C’est le système qui intervient pour nous préparer à la fuite ou à la lutte lorsque nous nous sentons menacés, lorsque nous avons peur ou lorsqu’on fait de l’exercice.
Effets :
-
-
- Augmente le rythme et la force des battements cardiaques
- Augmente le rythme de la respiration
- Dilate les pupilles
- Dilate les bronches
-
b) Système nerveux parasympathique
Son activité se manifeste plutôt dans les situations neutres. Il est surtout associé au repos, à la digestion et à l’élimination de déchets. Il vise à réduire notre consommation d’énergie en nous permettant d’accomplir des fonctions de base vitales.
Effets :
-
-
- Augmente l’activité du système digestif, contribuant ainsi à l’apport d’énergie
- Ralentit la fréquence respiratoire et la fréquence cardiaque.
-
Ces deux systèmes servent pour les mêmes viscères, mais ils ont un effet contraire, c’est-à-dire que lorsque l’un stimule, l’autre inhibe.
Exemple de l’innervation du système nerveux autonome sur le coeur :

Physiologie du système nerveux autonome
Pour qu’une fibre nerveuse puisse communiquer avec une autre fibre nerveuse, un muscle, un organe ou une glande elle doit libérer des neurotransmetteurs pour permettre la transmission de l’influx nerveux à l’effecteur. On classe les fibres nerveuses et les récepteurs selon le neurotransmetteur libéré au synapse.
Récepteurs cholinergiques: associés à l’acétylcholine (Ach)
-
-
- situés au niveau des axones pré-ganglionnaires sympathiques et parasympathiques
- situés au niveau des axones post-ganglionnaires parasympathiques
- exception : fibres post ganglionnaire sympathique qui innervent les glandes sudoripare. Tous les autres fibres post-ganglionnaires sympathiques libèrent de la noradrénaline et sont donc dites adrénergiques.
-
On retrouve 2 types de récepteurs qui peuvent se lier à l’acétylcholine. Les récepteurs nicotiniques et les récepteurs muscariniques.

Récepteurs adrénergiques : associés à la noradrénaline (NA) et à l’adrénaline
-
-
- situés au niveau des axones post-ganglionnaires sympathique
-
On retrouve 5 types de récepteurs adrénergiques qui peuvent se lier à la noradrénaline et l’adrénaline. Les récepteurs alpha 1 et 2 et les récepteurs béta 1, 2 et 3.
|
Principales localisations |
Effets de la liaison de la NA (et adrénaline par la médulla surrénale) | |
| α1 |
Vaisseaux sanguins desservant la peau, les muqueuses, les organes abdominaux, les reins, les glandes salivaires
|
Vasoconstriction des vaisseaux sanguins (↑ TA) |
| α2 |
Membrane plasmique des plaquettes sanguines |
Facilitation de la coagulation sanguine
|
| β1 |
Principalement le cœur
Reins
|
↑ de la fréquence et de la force de contraction
Déclenchement de la sécrétion de la rénine |
| β2 |
Poumons
Vaisseaux sanguins desservant le coeur, le foie et les muscles squelettiques
|
Bronchodilatation
Vasodilatation |
|
β3
|
Tissu adipeux |
Lipolyse
|
Exemples de médicaments qui stimulent les récepteurs adrénergiques

Vocabulaire employé en pharmacologie
- Parasympathomimétique ou cholinergique
- cholinergiques nicotiniques
- cholinergiques muscariniques direct ou indirect
- Parasympatholytique ou anti-cholinergique
- Sympathomimétique ou adrénergique
- Sympatholytique ou anti-adrénergique
Partie B : Le contrôle nerveux du système pulmonaire
Les deux branches du système nerveux autonome contrôlent la fonction du système pulmonaire. Les deux classes de médicaments agissant sur le SNA maintenant utilisés en pharmacologie pour contrôler les réponses du système pulmonaire sont les adrénergiques et les anti-cholinergiques. Les tissus qui sont sensibles à l’innervation du SNA dans le système pulmonaire sont :
- Les muscles lisses dans les voies aériennes
- Les glandes sécrétrices (glandes séromuqueuses et cellules caliciformes)
- L’épithélium bronchique
- Les vaisseaux sanguins bronchiques et pulmonaires
D’autres récepteurs sont aussi présents dans les tissus pulmonaires. Ces récepteurs sont sensibles aux médiateurs chimiques relâchés durant le processus inflammatoire. Ces récepteurs sont : les récepteurs d’histamine, de prostaglandines, de leucotriènes, les bradykinines, l’adénosine et le PAF (platelet activating factor).
L’innervation sympathique du système pulmonaire
Le système nerveux sympathique exerce ses effets en agissant de façon directe et indirecte. Les effets directs sont permis par la libération de la NA au bout terminal d’un axone. 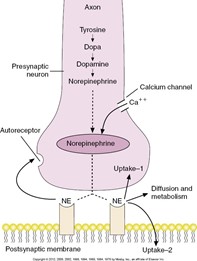 Les effets indirects sont possibles suite à la libération de l’adrénaline et de la NA par la médulla surrénale.
Les effets indirects sont possibles suite à la libération de l’adrénaline et de la NA par la médulla surrénale.
À noter que les muscles lisses des voies aériennes ne sont pas innervés par des nerfs provenant du SNA. Donc ce sont les hormones circulantes (NA et adrénaline) qui stimulent les récepteurs alpha et bêta des muscles lisses.
Les effets de la stimulation sympathique sur le système pulmonaire sont :
- Bronchodilatation (via l’adrénaline, car aucune terminaison nerveuse sympathique ne rejoint les muscles lisses des voies aériennes)
- Augmentation des sécrétions de type aqueux
- Augmentation de l’activité mucociliaire
Les récepteurs sont distribués inégalement dans les voies aériennes. Or l’effet des médicaments va varier selon les récepteurs stimulés ou inhibés.

Les effets de la NA et de l’adrénaline sur les vaisseaux sanguins pulmonaires et bronchiques sont les suivants :
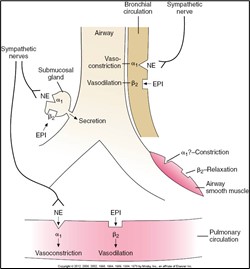
L’innervation parasympathique du système pulmonaire
Le poumon est innervé par le nerf vague. Il libère de l’acétylcholine lorsqu’il est stimulé. L’ACH se lie aux récepteurs muscariniques et cause la bronchoconstriction des voies aériennes et augmente la production des sécrétions. 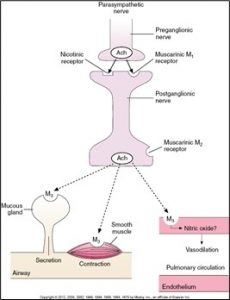 Les fibres du nerf vague sont plus denses dans la partie du hile pulmonaire et diminuent à mesure qu’on descend vers la périphérie.
Les fibres du nerf vague sont plus denses dans la partie du hile pulmonaire et diminuent à mesure qu’on descend vers la périphérie.
Effets de la stimulation parasympathique sur le système pulmonaire :
- Bronchoconstriction
- Augmentation des sécrétions de type visqueux
- Vasodilatation des vaisseaux pulmonaires
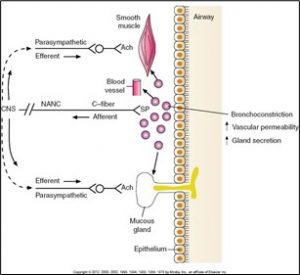
Terminaisons nerveuses qui ne sont pas du type adrénergique/cholinergique (NANC)
Des recherches ont démontré qu’il existe d’autres types de terminaisons nerveuses dans le système pulmonaire autre que les terminaisons nerveuses associées au SNA. Les diagrammes ci-dessous démontrent comment une bronchodilatation et une bronchoconstriction peuvent se produire sans de stimulation via le système nerveux.

Partie C : Les bronchodilatateurs
1. Les bronchodilatateurs adrénergiques (sympathomimétiques)
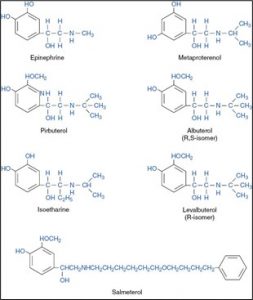
Les sympathomimétiques utilisés comme bronchodilatateurs sont soit des catécholamines ou des dérivés des catécholamines.
Exemples de catécholamines et ses dérivés :

a) Le métabolisme des catécholamines
Toutes les catécholamines sont inactivées par l’enzyme COMT (catéchol-o-méthyl-transférase) retrouvée principalement dans le foie et les reins. La durée d’action de ces substances est courte soit de quelques minutes à quelques heures.
Ces substances sont aussi facilement détruites par le tractus gastro-intestinal (TGI), la chaleur et la lumière. C’est pour cette raison que ces médicaments sont entreposés dans un contenant foncé.
De plus, l’oxydation de ces molécules les rend d’une couleur rose. Parfois, nous pouvons observer l’effet du changement de couleur dans les sécrétions du patient ou dans l’équipement de thérapie respiratoire.
Durant plusieurs années, les recherches tentaient d’augmenter le temps d’action de ce groupe de médicaments, surtout les médicaments utilisés pour contrôler la bronchoconstriction. Les observations ont démontré qu’en modifiant le noyau catéchol des catécholamines la durée d’action augmentait jusqu’à une durée de 6 heures, car ils ne sont plus détruits par l’enzyme COMT.
De plus, les recherches ont démontré qu’en allongeant la chaîne latérale de ces médicaments, la spécificité pour les récepteurs bêta2 augmente et donc limite les effets secondaires cardiaques causés par la stimulation des récepteurs bêta1. Or, l’administration orale est maintenant possible suite à ces changements. La nouvelle génération de catécholamines utilisée pour contrôler le système pulmonaire est plus efficace qu’auparavant.
b) Indications de l’utilisation des bronchodilatateurs adrénergiques
On administre les bronchodilatateurs adrénergiques spécifiques aux récepteurs B2 pour causer la relaxation des muscles lisses des voies aériennes afin de diminuer l’obstruction des bronches et la résistance aérienne. Les maladies qui peuvent causer une bronchoconstriction des voies aériennes sont : l’asthme, la bronchite aigüe ou chronique, l’emphysème, la fibrose kystique et la bronchiectasie.
Ces médicaments stimulent aussi l’activité mucociliaire et diminuent un peu l’inflammation.
On peut aussi administrer des bronchodilatateurs moins spécifiques aux récepteurs B2; l’épinéphrine en aérosol (1 : 1000) et la racémique épinéphrine. Les 2 médicaments stimulent tous les récepteurs adrénergiques béta1, beta2 et alpha1; l’épinéphrine stimule Beta > alpha, la racémique épinéphrine alpla > beta. Les 2 vont permettre une bronchodilatation et une vasoconstriction des voies respiratoires supérieures. La racémique épinéphrine est le médicament qui est plutôt administré pour diminuer l’inflammation lors d’une croupe, d’une épiglottite, d’une bronchiolite et l’oedème post-extubation.
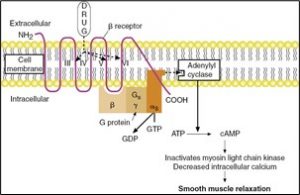
c) Mode d’action des bronchodilatateurs adrénergiques
Comme nous l’avons mentionné un peu plus tôt la stimulation des récepteurs bêta2 au niveau des muscles lisses bronchiques va permettre une bronchodilatation pulmonaire. Les bronchodilatateurs court terme (agisssant 4 – 6 hrs) s’attachent aux récepteurs béta2 présents dans la membrane plasmique et stimule la protéine G qui augmente la formation de AMP cyclique.
d) La durée d’action des bronchodilatateurs adrénergiques
Depuis plusieurs années on a développé des médicaments bronchodilatateurs ayant une durée d’action plus élevée que les bronchodilatateurs traditionnels. Un désavantage des bronchodilatateurs de courte durée est qu’ils ne contrôlent pas la bronchoconstriction pendant la nuit (durée seulement de 4-6 heures) et nécessite un horaire assez strict d’administration durant le jour (QID). Donc maintenant on administre des bronchodilatateurs à court terme durant les crises aiguës et des bronchodilatateurs à long terme (12 heures à 24 heures) pour le maintien. Les bronchodilatateurs long terme ont une durée d’action plus longue car leur chaîne latérale est beaucoup plus longue et ils peuvent s’insérer à l’intérieur de la membrane plasmique et donc sont inactivés plus difficilement.

On classe les bronchodilatateurs adrénergiques en 2 catégories : court terme (SABA ou BACA) et long terme (LABA ou BALA).
- SABA – short acting beta agonist BACA – bronchodilatateurs à court action
- LABA – long acting beta agonist BALA – bronchodilatateurs à longue action
e) Les effets secondaires des bronchodilatateurs adrénergiques
Les anciens bronchodilatateurs adrénergiques causaient beaucoup plus d’effets secondaires car ils n’étaient pas aussi spécifiques aux récepteurs bêta2. On note tout de même quelques effets secondaires avec l’administration des bronchodilatateurs adrénergiques modernes.
- Tolérance et tachyphylaxie :
- Il y a une désensibilisation des récepteurs bêta 2 aux médicaments adrénergiques. Les corticostéroïdes peuvent renverser cette désensibilisation.
- Tremblements:
-
- Causé par la stimulation des récepteurs bêta 2 sur les muscles squelettiques
- Une tolérance se développe après quelques jours à quelques semaines
- Surtout avec le salbutamol sous forme oral
3. Effets cardiaques:
-
- Cause une tachycardie suite à la vasodilatation périphérique (tachycardie réflexe)
- Certaines recherches démontrent qu’il y a présence de récepteurs bêta2 même sur le cœur
- Cet effet secondaire peut être bénéfique pour les MPOC qui souffrent de défaillance cardiaque congestive (diminue la post-charge et améliore le débit cardiaque sans augmenter la consommation d’oxygène au cœur)
4. Effets sur le système nerveux central:
-
- Maux de tête
- Insomnie
- Nervosité et anxiété (peut être causé par les tremblements)
5. Chute de la PaO2:
-
- Habituellement négligeable (pas plus que 10 mmHg)
- Causé par :
- Diminution de la vasoconstriction hypoxique
- Le médicament est délivré aux régions où la ventilation est plus élevée augmentant ainsi le déséquilibre V/Q
6. Sensibilité aux sulfites:
-
- Utilisés comme préservatifs dans les solutions
- Peuvent causer des bronchospasmes
- À noter que ce n’est pas toutes les solutions qui contiennent des sulfites (vérifier les ingrédients)
7. Déséquilibre métabolique:
-
- Hyperglycémie (augmente la glycogénolyse)
- Hypokaliémie (augmente l’activité de la pompe Na+/K+)
f) Recommandations dans l’usage des B2 agonistes bronchodilatateurs
-
- Utiliser les B-adrénergiques en inhalation autant que possible. Cette voie permet d’avoir un début d’action rapide, une dose thérapeutique minimale ainsi que des effets secondaires minimaux.
- Surveiller les effets secondaires surtout cardiaque. Les patients avec des arythmies devraient avoir une supervision constante.
- Éduquer les patients au niveau de la technique employée et miser sur l’utilisation de l’aérochambre. Éduquez-les également sur les médicaments utilisés et leurs indications (court terme vs long terme).
- L’utilisation des B-adrénergiques de longue durée ne devrait pas être administrée à répétition dans des cas d’urgence, car l’accumulation de ces médicaments augmente les effets toxiques.
- Pour la plupart des asthmatiques (légers à modérer), un corticostéroïde (anti-inflammatoire) devrait aussi être administré..
8. Les bronchodilatateurs communs
- SABA
- Salbutamol (ventolin)
- Terbutaline (bricanyl)
- Épinéphrine
- Racemic épinéphrine (vaponérphrine); utiliser pour traiter l’inflammation des voies aériennes supérieures
- LABA
- Formotérol (oxeze, foradil)
- Salmétérol (serevent)
- Indacatérol (Onbrez breezhaler)
- Olodatérol (striverdi respimat)
2- Les bronchodilatateurs anti-cholinergiques (parasympatholytiques)
Comme les bronchodilatateurs adrénergiques, les anti-cholinergiques sont divisés en deux classes soit les agents court terme (SAAC ou ACCA) et les agents long terme (LAAC ou ACLA). Ces médicaments sont surtout administrés pour les personnes souffrant de maladies pulmonaires obstructives chroniques. Des recherches ont démontré que l’utilisation d’un bronchodilatateur anti-cholinergique avec un bronchodilatateur adrénergique améliore grandement les fonctions pulmonaires des personnes souffrant de MPOC. Ils peuvent aussi être utilisés chez les asthmatiques en synergie avec le ventolin.
Ce genre de médicament est aussi disponible sous forme de vaporisant nasal pour les symptômes associés aux rhinites allergiques ou non allergiques et à la grippe.
a) Indications de l’utilisation des bronchodilatateurs anti-cholinergique
L’indication primaire de son utilisation est donc le maintien du traitement chez les MPOC. L’utilisation d’un bronchodilatateur anti-cholinergique en synergie avec un bronchodilatateur adrénergique est bénéfique chez les patients souffrant de MPOC qui requièrent plus de médicaments pour soulager l’obstruction des voies respiratoires ainsi que chez les asthmatiques sévères qui ne répondent pas aux bronchodilatateurs adrénergiques. Cette combinaison offre les avantages suivants :
- Les sites d’action se complètent : les anti-cholinergiques agissent plus au niveau des voies centrales tandis que les bêta adrénergiques agissent plus au niveau des petites voies périphériques
- Leurs mécanismes d’action sont différents mais complémentaires
- Leur pharmacocinétique est aussi complémentaire : les bêta agonistes agissent plus vite mais moins longtemps tandis que les anti-cholinergiques agissent moins vite mais plus longtemps
- Effets additifs possibles et diminution de dose individuelle
b) Mode d’action des bronchodilatateurs anti-cholinergiques
Les agents anti-muscariniques compétitionnent avec l’acétylcholine aux récepteurs muscariniques des muscles lisses des voies respiratoires. Comme nous l’avons vu un peu plus tôt, la bronchoconstriction et l’augmentation des sécrétions sont dues à l’activation des récepteurs M3. Les médicaments anti-cholinergiques vont donc aller agir sur ce récepteur pour renverser la bronchoconstriction.
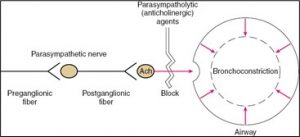

c) Les effets secondaires des bronchodilatateurs anti-cholinergiques
L’atrovent et le spiriva sont des médicaments complètement ionisés ce qui fait qu’ils sont très peu distribués ailleurs dans le corps comparativement à l’atropine qui était administrée auparavant. Les effets secondaires sont donc moindres. Les plus communs sont les suivants :
- Toux
- Bouche sèche
- Attention, car augmente la pression oculaire si entre en contact avec les yeux (SVN)
d) Les bronchodilatateurs anticholinergiques communs
- SAAC
- Ipratropium bromide (atrovent)
- LAAC
- Tiotropium bromide (spiriva)
- Aclidinium bromide (tudorza genuair)
- Glycopyrronium bromide (seebri breezhaler)
- Umeclidinium bromide (incruse ellipta)
- Les combinaisons (adrénergiques + anticholinergiques)
- Ipratropium (ACCA) + Salbutamol (BACA) – (combivent)
- Glycopyrronium (ACLA) + Indacaterol (BALA) – (ultibro breezhaler)
- Umeclidinium (ACLA) + Vilanterol (BALA) – (anoro ellipta)
- Aclidinium (ACLA) + Formoterol (BALA) – (duaklir genuair)
- Tiotropium (ACLA) + Olodaterol (BALA) – (inspiolto respimat)
Partie D : Les corticostéroïdes
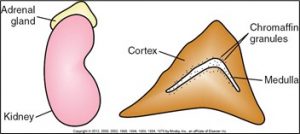
Les stéroïdes sont des hormones produites par le cortex surrénal qui régularisent les fonctions métaboliques des cellules. Leurs effets sont les suivants :
- stabilise et augmente la glycémie
- stabilise la tension artérielle et intensifie les effets des catécholamines
- mobilise les acides gras et les protéines et favorise leur utilisation à des fins énergétiques
- les protéines mobilisées sont utilisées pour fabriquer des enzymes et réparer les tissus
Lorsque le stress est augmenté (ex : hémorragie, trauma, infection, émotions, etc), la sécrétion des stéroïdes augmente : tous les effets mentionnés ci-haut sont amplifiés et un effet anti-inflammatoire est ajouté.
a) Indications de l’utilisation des corticostéroïdes
L’inflammation des voies aériennes est l’indication majeure pour l’utilisation des stéroïdes. L’asthme est une maladie caractérisée par une inflammation des voies aériennes. L’inflammation est causée par la présence de cellules inflammatoires, les éosinophiles, les mastocytes (basophiles), les lymphocytes T et les macrophages. Les médiateurs chimiques libérés par ces cellules provoquent la bronchoconstriction, l’œdème de la muqueuse et l’hyperactivité des glandes séromuqueuses. Alors le traitement avec les stéroïdes réduit le processus inflammatoire et les phénomènes pulmonaires associés.
Les stéroïdes utilisés pour traiter les asthmatiques sont des glucocorticostéroïdes. La voie d’inhalation peut être utilisée pour administrer le médicament. La voie orale pour contrôler l’inflammation des voies aériennes et la voie nasale pour contrôler l’inflammation des cavités nasales.
Les stéroïdes peuvent aussi être administrés par voie orale (pilule) ou parentérale (I.V.). Ils sont administrés I.V. dans les cas d’urgence et de façon orale pour les asthmatiques sévères. Chez les asthmatiques sévères, l’utilisation des stéroïdes inhalés en conjonction avec l’utilisation systémique permet de diminuer la dose systémique et diminuer les effets secondaires néfastes causés par ces médicaments. Les effets secondaires sont multiples et même graves. C’est pour ceci qu’on préfère la voie d’inhalation.
Les effets secondaires par voie orale ou parentérale :
- augmentation de certains types d’infection (infections opportunistes)
- rétention d’eau (syndrome de Cushing, hypertension)
- diabète sucré
- myopathie
- ostéoporose
- retard de la croissance
- glaucome
- rougeur dans le visage
- vergetures
- retard de la cicatrisation
- changement d’humeur
Les effets secondaires par voie d’inhalation :
- dysphonie
- candidose orale (muguet)
- pour diminuer ces effets secondaires on doit rincer la bouche/gorge après l’inhalation du médicament
b) Mode d’action des corticostéroïdes
Les stéroïdes diffusent à l’intérieur du noyau des cellules pour modifier la transcription de l’ADN. Ils vont modifier la synthèse des protéines anti-inflammatoires et inhiber la synthèse des protéines inflammatoires. 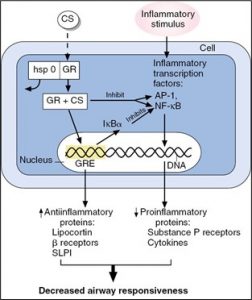
Les corticostéroïdes en inhalation prennent quelques heures à quelques jours avant d’exercer leurs effets anti-inflammatoires. Un corticostéroïde oral ou intraveineux sera donc nécessaire chez les patients souffrant d’une exacerbation d’asthme ou de MPOC.
Voici les effets généraux des corticostéroïdes :
- Diminution du processus inflammatoire
- Diminution de la margination des cellules blanches et donc ↑ dans la circulation sanguine
- Augmente les effets des médicaments B-adrénergiques (1-4 heures après) de 3 façons :
- Augmente le nombre des récepteurs Béta sur les cellules
- Augmente l’affinité des B-adrénergiques sur ces récepteurs
- Prolonge la durée d’action des B2 en diminuant le processus de « uptake »
Noter bien : Un des effets secondaires des stéroïdes exogènes (systémiques) est la suppression du mécanisme de rétro-inhibition hypothalamique-pituitaire. 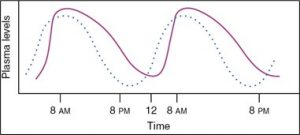 Pour cette raison, certains points sont importants à noter lors de l’administration systémique de ce groupe de médicaments :
Pour cette raison, certains points sont importants à noter lors de l’administration systémique de ce groupe de médicaments :
- Ne jamais arrêter brusquement les stéroïdes
- Administrer tôt le matin
- Administrer une fois à 2 fois par jour
- Administrer tôt, en phase aiguë, pour obtenir une synergie avec les B-agonistes
c) Les médicaments corticostéroïdes
- Les stéroïdes
- Fluticasone (flovent)
- Budesonide (pulmicort)
- Ciclesonide (alvesco)
- Béclométhasone (Qvar)
- Mometasone furoate (asmanex)
- Arnuity Ellipta (fluticasone furoate)
- Les combinaisons
- Salmeterol (BALA) + Fluticasone (CSI) – (advair)
- Formoterol (BALA) + Budesonide (CSI) – (symbicort)
- Formoterol (BALA) + Mométasone furoate (CSI) – (zenhale)
- Vilanterol (BALA) + Fluticasone (CSI) – (breo ellipta)
- Vilanterol (BALA) + Umeclidinium (ACLA) + Fluticasone (CSI) – (trelegy ellipta)
Partie E : Les techniques d’administration
1- MDI – Technique d’administration

Ensuite choisir la technique qui sera privilégiée 




Attentions particulières :
- On suggère parfois d’envoyer la première dose dans l’atmosphère lorsqu’un MDI n’a pas été utilisé pour une période prolongée (crémage)
- On doit rincer la bouche après avoir pris des corticostéroïdes : candidose oropharyngée
- Il n’y a pas de compteur pour signaler le montant de médicaments dans le réservoir
- Il y a réduction du montant de médicaments propulsés (dosage) avec une baisse de la température ambiante. On suggère aux clients de maintenir leur réservoir à l’intérieur de leur manteau durant la saison d’hiver
- L’atrovent (anticholinergique) peut augmenter la pression oculaire… on doit utiliser un aérochambre pour prendre ce médicament ou encore le prendre en insérant l’ouverture directement dans la bouche c’est-à-dire en refermant les lèvres sur l’embouchure
2 – DPI – Technique d’administration

3 – SMI – Technique d’administration



