2
Unité d’apprentissage 1 : La physiologie cardio-circulatoire et les déséquilibres associés
Partie A : L’anatomie du coeur
Partie B : L’activité électrique du coeur
Partie C : La circulation sanguine
Partie D : Le choc cardiovasculaire et la vérification de l’efficacité de la circulation en milieu clinique
Unité d’apprentissage 2 : L’électrophysiologie cardiaque
Partie A : Notions de base
Partie B : La fréquence cardiaque
Partie C : Les arythmies
Partie D : Les 12 dérivations de l’ECG
Partie E : Direction du vecteur moyen
Partie F : Comment évaluer le bloc de branche, l’hypertrophie et l’infarctus avec un ECG 12 dérivations
Unité d’apprentissage 3 : L’hémodynamie
Partie A : L’équipement
Partie B : Les valeurs hémodynamiques
Partie C : L’interprétation des valeurs
Unité 1 : La physiologie cardiocirculatoire et les déséquilibres associés
Partie A : L’anatomie du cœur
Le cœur est constitué de quatre cavités : deux oreillettes et deux ventricules. La cloison qui divise l’intérieur est appelée cloison interauriculaire et le septum interventriculaire. 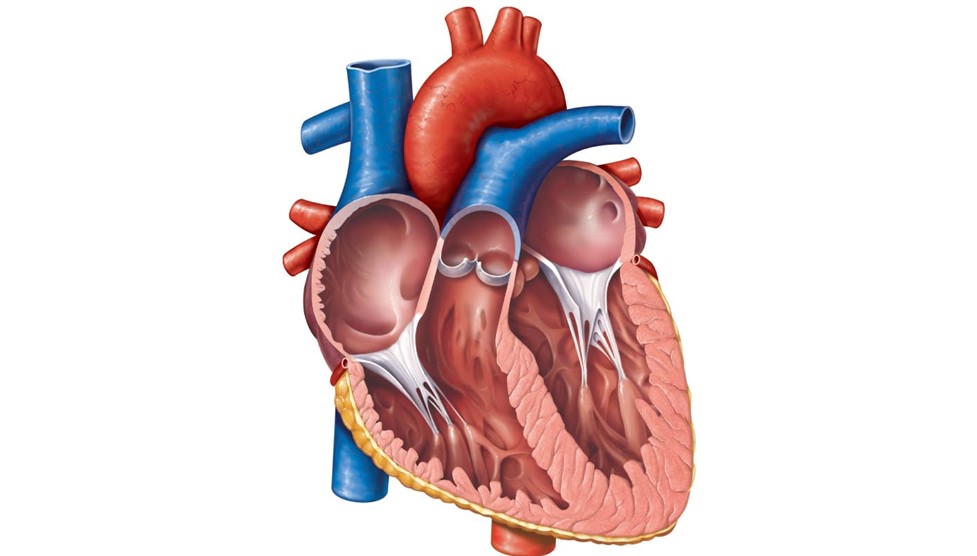 Le ventricule droit constitue la majeure partie de la face antérieure du cœur tandis que le ventricule gauche domine la partie postéro-inférieure formant l’apex.
Le ventricule droit constitue la majeure partie de la face antérieure du cœur tandis que le ventricule gauche domine la partie postéro-inférieure formant l’apex.
On pourrait dire que le cœur est vraiment constitué de deux pompes. L’oreillette et le ventricule droit pompent le sang désoxygéné apporté par les veines corporelles aux poumons et en même temps l’oreillette et le ventricule gauche pompent le sang oxygéné provenant des poumons via les veines pulmonaires à travers la circulation systémique.
Le cœur n’est pas plus gros qu’un poing fermé mesurant de 12 à 14 cm. Il est logé à l’intérieur du médiastin et est placé obliquement dans le thorax; il s’étend de la 2ième côte au 5ième espace intercostal les deux tiers environ de sa masse se trouvant à gauche de l’axe médian du sternum et l’autre tiers à droite.  Sa base est orientée vers l’épaule droite, son apex vers la hanche gauche et il repose sur le diaphragme (PMI : choc de la pointe maximale ressenti entre la 5ième et la 6ième côte.
Sa base est orientée vers l’épaule droite, son apex vers la hanche gauche et il repose sur le diaphragme (PMI : choc de la pointe maximale ressenti entre la 5ième et la 6ième côte.
Le cœur est enveloppé dans un sac appelé le péricarde. Il est formé de deux couches, le péricarde fibreux et le péricarde séreux. Le péricarde fibreux est la couche superficielle (externe). Cette couche est dense et résistante. Son rôle principal est de protéger le cœur et de l’ancrer aux structures environnantes tels le diaphragme et les gros vaisseaux.  Le péricarde séreux est une couche plus mince formée de deux membranes : la membrane pariétale et la membrane viscérale; la membrane pariétale fait contact avec le péricarde fibreux et la membrane viscérale (épicarde) enveloppe directement le cœur. La très mince cavité entre ces deux membranes renferme un liquide qui lubrifie celles-ci et permet au cœur de battre dans un environnement qui a relativement peu de friction.
Le péricarde séreux est une couche plus mince formée de deux membranes : la membrane pariétale et la membrane viscérale; la membrane pariétale fait contact avec le péricarde fibreux et la membrane viscérale (épicarde) enveloppe directement le cœur. La très mince cavité entre ces deux membranes renferme un liquide qui lubrifie celles-ci et permet au cœur de battre dans un environnement qui a relativement peu de friction.
La paroi du cœur est formée de trois couches : l’épicarde, le myocarde et l’endocarde. L’épicarde est la membrane viscérale du péricarde séreux. Le myocarde, la couche intermédiaire, est composée principalement de cellules musculaires et constitue l’essentiel de la masse du cœur. L’arrangement des cellules musculaires forme des faisceaux spiralés ou circulaires et relient toutes les parties du cœur et renforcent la portion interne du myocarde. L’endocarde, la couche interne, est formé de cellules pavimenteuses qui tapissent les cavités du cœur et recouvre les valves auriculo-ventriculaires. Cette couche lisse est en continuité avec l’endothélium des gros vaisseaux sanguins.
Le sang qui circule dans les cavités cardiaques nourrit très peu les tissus cardiaques. Le myocarde est trop épais pour que la diffusion puisse répondre aux besoins de toutes les cellules. Donc, l’irrigation du cœur se fait par l’intermédiaire des artères coronaires droite et gauche. Ces artères naissent à la base de l’aorte et encerclent le cœur dans le sillon auriculo-ventriculaire.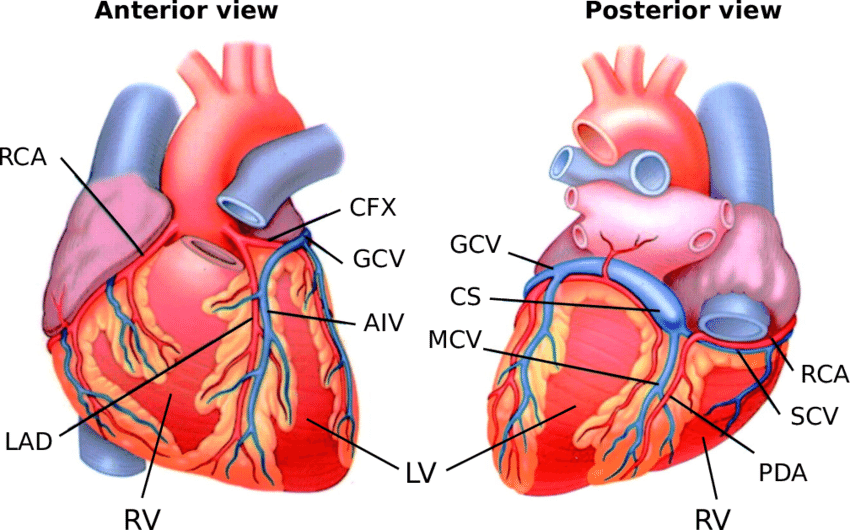
L’artère coronaire gauche se subdivise en le rameau interventriculaire antérieur et le rameau circonflexe; l’artère coronaire droite se subdivise en rameau marginal et le rameau interventriculaire postérieur. Après son passage dans les lits capillaires du myocarde le sang désoxygéné est recueilli par les veines du cœur dont le trajet est plus ou moins jumelé à celui des artères coronaires. Ces veines peuvent se déverser soit dans le sinus coronaire (65 – 75%) qui déverse le sang dans l’oreillette droite ou dans les veines de Thébésius qui dirigent le sang dans le cœur droit et gauche; le sang désoxygéné qui se verse dans le cœur gauche contribuant au shunt anatomique.
Choix multiples et associations
Cas cliniques avec les réponses
Partie B : L’activité électrique du cœur
Anatomie microscopique du muscle cardiaque
Le muscle cardiaque est strié comme les muscles squelettiques et ses contractions s’effectuent suivant le même mécanisme de glissement des myofilaments.
Dans les cellules myocardiques on observe des jonctions appelés disques intercalaires qui ne sont pas présentes dans les muscles squelettiques. Ces disques contiennent des desmosomes et des jonctions ouvertes. Les desmosomes retiennent les cellules ensemble par des fibres spéciales empêchant les cellules de se séparer lors des contractions cardiaques répétées et les jonctions ouvertes permettent la transmission des ions d’une cellule à l’autre. Or, lors de la dépolarisation les changements ioniques se transmettent rapidement d’une cellule à l’autre.

Le muscle cardiaque a besoin d’un apport continuel d’énergie et c’est pour cette raison qu’on y observe beaucoup de mitochondries. Comparativement au muscle squelettique qui peut se contracter même si l’oxygène est insuffisant (respiration anaérobique), le muscle cardiaque a une respiration presque exclusivement aérobie et ne peut fonctionner avec une lourde dette d’oxygène.
La dépolarisation des cellules myocardiques et des cellules automatiques (‘pacemaker cells)
Cellules myocardiques

Phase 0 : – entrée de Na+ par les canaux sensibles au voltage
Phase 1 : – ouverture des canaux de K+ sensible au voltage
Phase 2 : – entrée du Ca++ par les canaux de Ca++ type L
– entrée de Na+ (probablement par ces mêmes canaux)
Phase 3 : – mouvement de K+ > mouvement de Na+ et de Ca++
– fermeture des canaux de Ca++
Phase 4 – retour du potentiel membranaire par pompe Na+/K+
Cellules automatiques
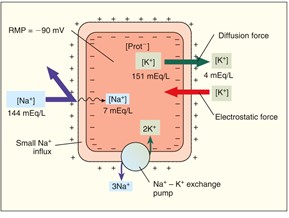
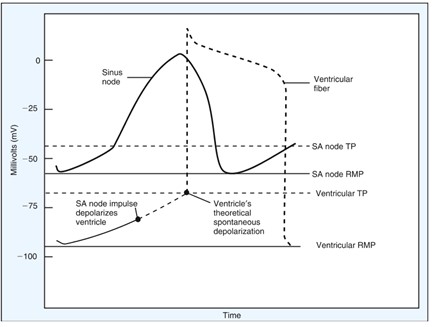
Dans le diagramme ci-dessus on observe que les cellules automatiques sont un peu plus perméables au Na+ comparativement aux cellules myocardiques. Après la repolarisation de tous les cellules cardiaques les ions Na+ rentrent dans les cellules automatiques et ceci permet à ces cellules de rejoindre le seuil d’excitation automatiquement c’est à dire sans stimulus.
De plus, les cellules automatiques ont un potentiel membranaire plus élevé comparativement aux autres cellules cardiaques leur permettant d’atteindre le seuil d’excitation plus facilement (nœud SA, nœud AV, les fibres de Purkinje) 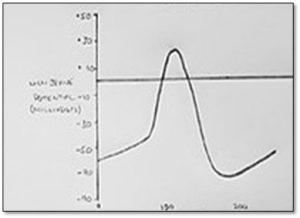
Voici un diagramme représentant les potentiels d’action des 2 types de cellules cardiaques.
Le système de conduction
Ce système de conduction, qui est constitué d’un réseau de myocytes cardiaques spécialisés, assure la propagation de chaque cycle cardiaque. Le système de conduction assure la contraction coordonnée du myocarde.
L’excitation du coeur commence habituellement dans le noeud sinusal. Lorsque celui-ci se dépolarise le courant électrique se propage par les jonctions ouvertes dans les oreillettes jusqu’au noeud auriculo-ventriculaire.  Du noeud AV, le potentiel d’action rejoint le faisceau de His. C’est à ce niveau que le potentiel d’action peut se propager des oreillettes aux ventricules (le squelette fibreux du coeur isole électriquement les oreillettes des ventricules).
Du noeud AV, le potentiel d’action rejoint le faisceau de His. C’est à ce niveau que le potentiel d’action peut se propager des oreillettes aux ventricules (le squelette fibreux du coeur isole électriquement les oreillettes des ventricules).
Le potentiel d’action suit ensuite les branches droite et gauche pour enfin rejoindre les fibres de Purkinje qui transmettent rapidement le potentiel d’action de l’apex du coeur vers le haut et le reste du myocarde.
Le noeud sinusal agit comme le centre rythmogène naturel du coeur car c’est lui qui se dépolarise plus rapidement que les autres cellules cardionectrices.
. rythme du noeud sinusal : 60 – 100/min.
. rythme du noeud AV : 40 – 60/min.
. rythme ventriculaire : 20 – 40/min.
La fréquence cardiaque et la force de contraction peuvent varier en fonctions de la stimulation du système nerveux autonome et des hormones circulantes.
Les différences générales entre le muscle cardiaque et squelettique
. loi du tout ou rien
– dans le muscle squelettique le nombre de fibres musculaires stimulés dépend du nombre de stimulus envoyés par le système nerveux; le muscle cardiaque lui, se contracte d’un bloc c’est-à-dire qu’il se contracte ou il ne se contracte pas du tout
– cette propriété est permise par la présence des jonctions ouvertes qui laissent passer la dépolarisation d’une cellule à une autre et de la présence d’un système de conduction qui consiste à produire des potentiels d’action et à les propager dans le cœur : alors le cœur agit comme une seule entité contractile (syncytium fonctionnel)
. moyens de stimulation
– dans le muscle squelettique chaque fibre musculaire doit être stimulée individuellement par une terminaison nerveuse comparativement au cœur qui contient des cellules auto-excitables pouvant produire elles-mêmes leur dépolarisation et la propager au reste du cœur (le cœur est quand même alimenté par des connexions nerveuses qui peuvent modifier le rythme et la force de contraction cardiaque afin d’assurer que les demandes de l’organisme sont rencontrées)
– environ 1% des fibres cardiaques sont cardionectrices, c’est-à-dire qu’elles peuvent dépolariser spontanément; les cellules cardionectrices sont situées dans les régions suivantes : (1) le nœud sinusal, (2) le nœud auriculo-ventriculaire, (3) le faisceau auriculo-ventriculaire (faisceau de His), (4) les branches droite et gauche du faisceau auriculo-ventriculaire et (5) les myofibrilles de conduction cardiaque des parois ventriculaires (Marieb fig. 19.14)
. longueur de la période réfractaire absolue
– dans les fibres musculaires squelettiques, la période réfractaire absolue dure de 1 à 2 ms et la contraction de 20 à 100 ms tandis que dans les fibres musculaires cardiaques la période réfractaire absolue dure environ 250 ms soit presque aussi longtemps que la contraction
– cette longue période réfractaire empêche les contractions tétaniques qui mettraient fin à l’action de pompage du coeur
Les facteurs qui influencent le système de conduction
Le système de conduction du cœur est capable de maintenir un rythme sans stimuli du système nerveux. Par contre, le système nerveux autonome jour un rôle important dans la régulation de la fonction cardiaque en ajustant la fréquence et la contractilité du muscle lorsque les demandes corporelles changent (ex : exercice)
Les centres de régulation pour le système cardiaque sont situés dans le bulbe rachidien. Le centre cardio-accélérateur sympathique projette des prolongements jusqu’aux neurones moteurs du segment T1 à T5 de la moelle épinière. Ces neurones font synapse avec des neurones postganglionnaires (cervicaux et thoraciques). De là, ces neurofibres atteignent le cœur où elles font synapse avec les nœuds sinusal, AV et les fibres musculaires contractiles. Les neurofibres du centre cardio-inhibiteur parasympathique vont du bulbe rachidien au cœur en passant par les nerfs vagues qui innervent les nœuds SA et AV.
| Branche du système |
Neurotransmetteur |
Type de récepteur |
Réponse du myocarde |
| Sympathique
|
Nor-adrénaline |
Adrénergique (B1 sur le muscle cardiaque et B2 dans les artères coronaires |
↑ FC et ↑ force contractilité ↑ circulation coronarienne
|
| Parasympathique
|
Acétylcholine |
Cholinergiques Muscariniques |
↓ FC (hyperpolarisation des cellules) |
D’autres facteurs peuvent influencer la performance du cœur tels la température, le montant de glucose disponible, la thyroxine, les électrolytes surtout le K+ et le Ca2+.
Partie C : La circulation sanguine
La circulation sanguine
Le sang qui vient de l’organisme est relativement pauvre en oxygène et riche en gaz carbonique. Il entre dans l’oreillette droite par les veines caves supérieure et inférieure pour se rendre aux poumons via le ventricule droit d’où partent les artères pulmonaires. Dans les poumons, le sang se débarrasse du gaz carbonique et s’enrichie d’oxygène. Le sang retourne au cœur gauche via les veines pulmonaires (les seules veines du corps qui sont riches en oxygène). 
Le côté gauche du cœur expulse le sang dans l’aorte. De là, les artères systémiques transportent le sang jusqu’aux tissus où la diffusion des gaz et des nutriments est possible à travers les capillaires. Le sang encore une fois chargé de gaz carbonique (CO2) et pauvre en oxygène (O2) retourne au côté droit du cœur via les veines systémiques et le cycle se répète continuellement.
La pression sanguine et le débit sanguin
Tout liquide propulsé par une pompe dans un circuit fermé comme le réseau artériel, capillaire et veineux, peut circuler seulement si une différence de pression existe dans le système.
La pression aortique monte et descend à chaque battement cardiaque; la valeur à retenir est la pression artérielle moyenne (MAP) car c’est cette pression qui propulse le sang dans les tissus. À noter que la pression diminue au fur et à mesure que le sang s’écoule dans les vaisseux sanguins. Le gradient de pression dans le système est environ 120mmHg qui assure une circulation continuelle à travers les vaisseux sanguins. 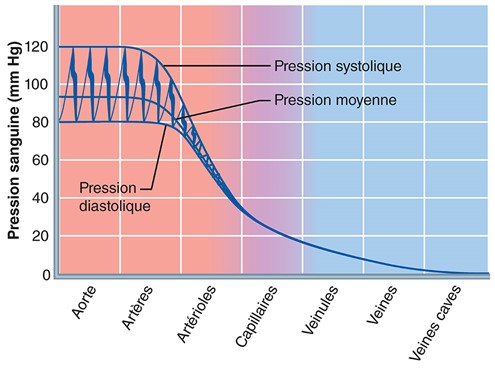
Régulation de la pression sanguine
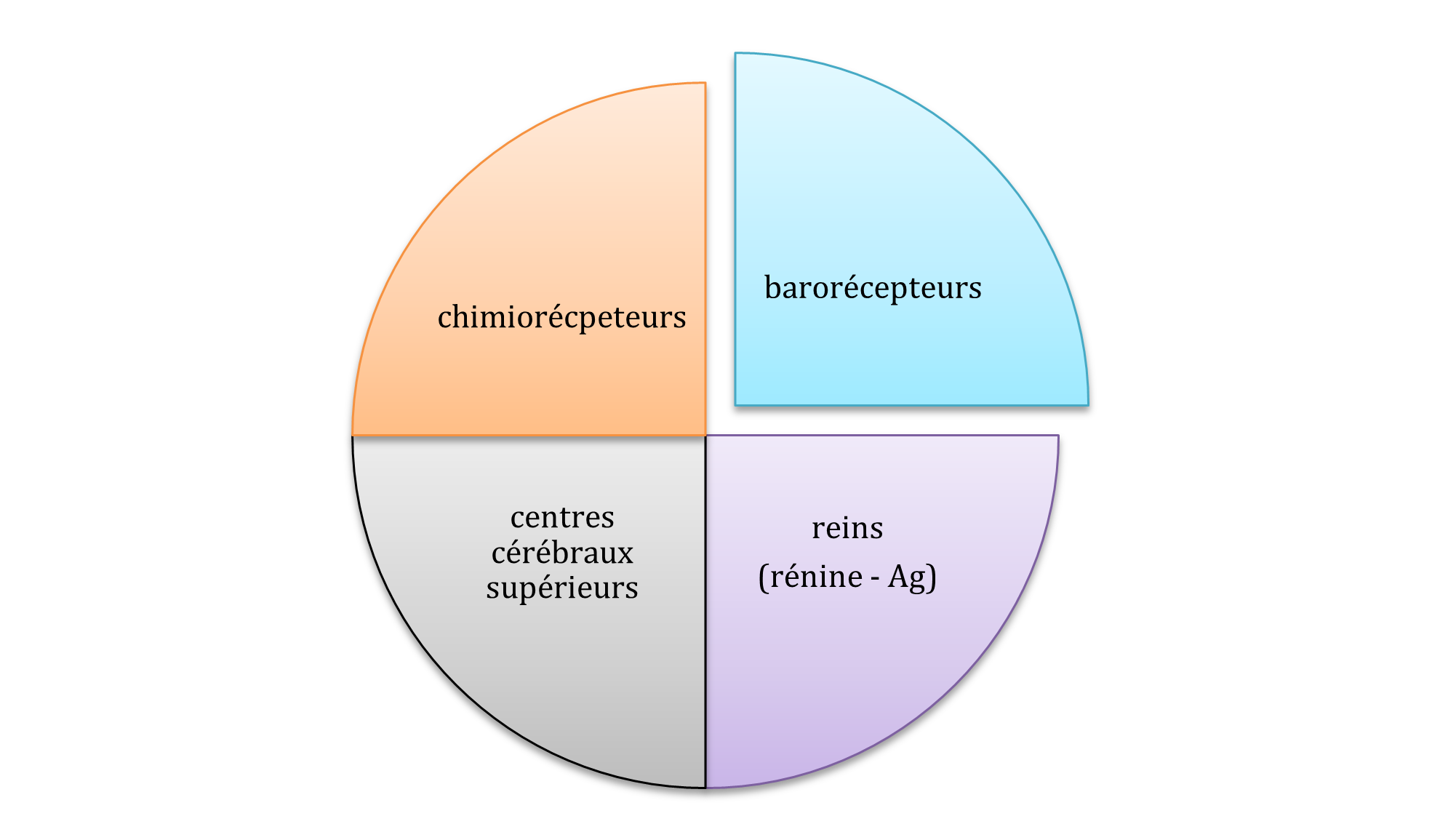
Régulation de la pression sanguine court terme
L’activité des centres cardioaccélérateur et vasomoteur est modifiée par des influx sensitifs provenant de plusieurs sources dont le plus important est le réflexe provenant des barorécepteurs. Ces derniers sont des récepteurs sensoriels sensibles aux changements de la pression sanguine. Ils sont retrouvés dans la crosse de l’aorte et les sinus carotidiens. Lorsqu’il y a une baisse de la pression sanguine les centres cardioaccélérateur et vasomoteur reconnaissent cette baisse via une diminution des stimulations provenant des barorécepteurs et augmente l’activité du système nerveux sympathique.
En temps normal, le système nerveux autonome envoie sans cesse des influx nerveux au système cardiaque et vasculaire (plutôt les artérioles); l’innervation cardiaque est fortement innervée par le système parasympathique et les artérioles du système vasculaire sont presque toujours partiellement contractées via une stimulation continue du système sympathique.
Le degré de vasoconstriction varie d’un organe à l’autre. Le tonus varie selon les conditions locales des tissus (niveau O2, CO2, pH, K+), la présence de certaines hormones et selon l’activité du système sympathique.
Voici les effets cardiovasculaires lorsque les centres vasomoteur et cardiaque sont stimulés :
Centre cardiaque : augmentation de la fréquence cardiaque et augmentation de la force de contraction
Centre vasomoteur : vasoconstriction des vaisseaux sanguins des tissus suivants :
. le système digestif
. le système rénal
. les muqueuses
. la peau
Donc le débit sanguin est diminué dans les tissus subissant une vasoconstriction; ceci a pour but d’augmenter le débit sanguin et la pression sanguine vers les tissus en besoin dont les systèmes nerveux, cardiaque et parfois musculaire.
Lorsque le système nerveux sympathique est stimulé, il se produit une vasoconstriction dans les tissus mentionnés ci-haut et il se produit une vasodilatation des artères coronaires et des artères irrigant les tissus musculaires (la vasodilatation des artères musculaires dépendent beaucoup de l’activité physique).
Les vaisseaux sanguins du système nerveux central s’adaptent selon les besoins locaux des neurones.
Les chimiorécepteurs retrouvés eux aussi dans la crosse de l’aorte et les sinus carotidiens ont un effet sur la pression sanguine. Ceux-ci sont plus importants pour le contrôle de la respiration mais lorsque la pression sanguine chute en-dessous de 80 mmHg ils activent les centres cardioaccélérateur et vasomoteur. Les changements chimiques suivants vont aussi stimulés les centres cardioaccélérateur.
Les centres cérébraux supérieurs peuvent modifier la pression sanguine par l’intermédiaire de relais avec les centres du bulbe rachidien par exemple lors de la réaction lutte ou fuite.
Autres : médiateurs chimiques tel l’histamine, ADH, facteur natriurétique
Régulation de la pression sanguine long terme
La régulation à long terme se fait via des mécanismes rénaux. Lorsque le volume et/ou la pression artérielle varient les reins peuvent retenir ou sécréter plus d’eau par l’intermédiaire du système rénine-angiotensine-aldostérone.
Partie D : Le choc cardiovasculaire et la vérification de l’efficacité de la circulation en milieu clinique
Le choc cardiovasculaire ou circulatoire est défini comme étant une insuffisance du montant d’oxygène apporté aux tissus. Dans le milieu clinique, on reconnait le choc lorsque la pression sanguine est basse soit une pression systolique < 80 – 90 mmHg. Ce signe est alarmant car il signifie que le patient est en phase de décompensation.
Voici d’autres signes classiques qui peuvent y être associés soit dans la phase de compensation ou dans la phase de décompensation :
. pouls faible et filant
. fréquence cardiaque élevée
. peau pâle et froide (exception : choc neurogénique)
. état de conscience altéré (somnolence, confusion, etc.)
. perte de conscience
. diminution du débit urinaire
. pression sanguine basse (signe tardif et alarmant du choc)
Le choc peut être une conséquence d’une dépression du débit cardiaque et/ou une perte du tonus artériel. Afin d’apprécier les dynamiques de l’état de choc il faut bien comprendre les déterminants qui affectent le débit cardiaque et la résistance vasculaire.
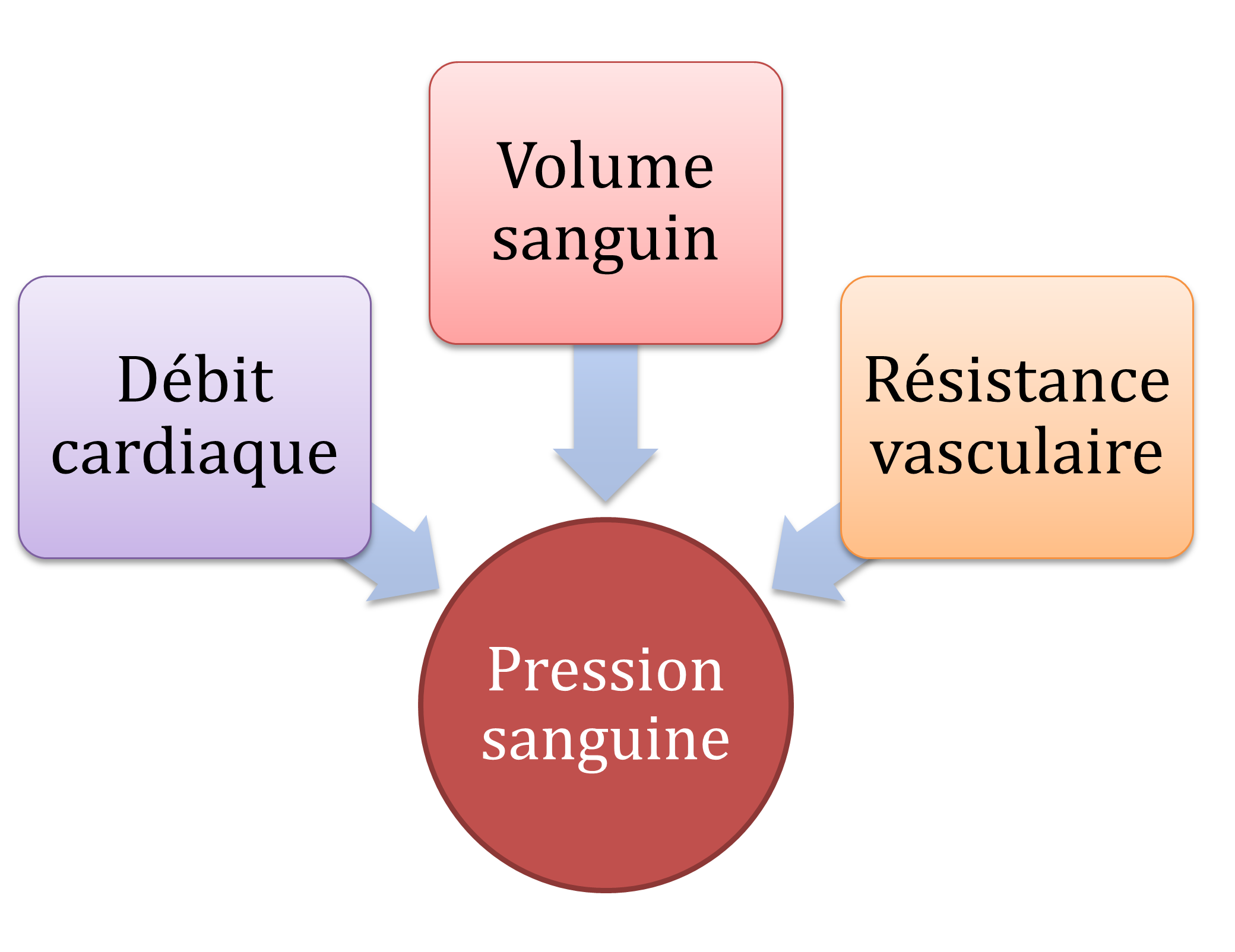
Lorsque le débit cardiaque, le volume sanguin et/ou la résistance vasculaire diminuent, cela provoque une diminution de la pression sanguine. Les trois catégories causant le choc cardiovasculaire sont associés directement à des changements au niveau des trois éléments mentionnés ci-haut. Les patients peuvent souffrir d’un choc hypovolémique, un choc cardiogénique causant une diminution du débit cardiaque ou d’un choc vasogénique.
| Choc hypovolémique | Choc cardiogénique | Choc vasogénique (perte du tonus vasculaire) |
| .↓ du volume sanguin;
(une perte de volume de 20 – 25% ↓ la précharge)
Ex : .trauma – hémorragie .Brûlures 2ième et 3ième degré .déshydratation .diarrhée ↓ volume d’éjection
Rx : . remplacer les fluides perdus (cristalloïdes). . produits sanguins |
. ↓ contractilité cardiaque .↓compliance ventriculaire
. hypertrophie ventriculaire . sténose ou insuffisance valvulaire . arythmies ↓ volume d’éjection
Rx: . traiter la cause . augmenter la force de contraction avec des inotropes + . diminuer la précharge si possbile avec des diurétiques . diminuer la postcharge avec des vasodilatateurs |
1. choc septique : infection du sang
2. choc anaphylactique : hypersensibilité type 1 3. choc neurogénique (↓ activité sympathique
Rx : . traiter la cause . fluides . vasopresseurs
|
|
|
|
Choix multiples et associations
Études de cas
Cas # 1
Un homme est transféré à la salle de réveil après avoir subi une chirurgie de réparation du gros intestin. Avant et pendant la chirurgie le patient a perdu un montant significatif de sang. Il a reçu plusieurs unités de sang et du plasma dans la salle d’opération.
Voici ses signes vitaux :
Pouls : 106/min. T.A : 82/35 mmHg F.R : 12/min. par le ventilateur (encore sous l’effet des anesthésiques et narcotiques)
Tests sanguins : Hb : 75 g/L WBC : 6,0 x 103 lactate : 4,62 mmol/L
Quels signes sont anormaux?
Est-ce que la pression sanguine du patient indique qu’il est en phase de compensation ou de décompensation? Expliquer.
De quel type de choc souffre le patient?
Cas # 2
Un jeune homme est poignardé à la poitrine pendant une querelle. A son arrivée au centre hospitalier, il est cyanosé et inconscient.
Est-ce que le patient souffre d’un choc cardiovasculaire? Quels signes devriez-vous évaluer?
Quelles sont les causes qui pourraient expliquer les observations du cas présenté?
Le patient décompense rapidement. Il devient bradycarde avec un pouls de 40/min. Il est cyanosé central et périphérique. L’équipe fait 1 ultrason de la cavité thoracique. On observe une tamponnade cardiaque. Expliquer quel est ce désordre et comment il provoque le choc chez ce patient.
Cas # 3
Une jeune femme âgée de 18 ans est transportée par ambulance à l’urgence. Elle s’est fait piquée par une abeille et quelques minutes suite à l’évènement ses lèvres ont commencé à enfler et elle se plaignait de difficulté à avaler.
Son évaluation clinique est la suivante :
Neurologique : confuse (difficulté à répondre aux questions posées)
Pouls : 126/min. TA : 72/39 mmHg Resp : 18/min
L’équipe médicale diagnostique un choc anaphylactique.
Décrivez cet état.
Expliquer les signes cardiovasculaires observés.
Cas # 4
Une femme âgée de 57 ans est admise à l’unité des soins coronariens avec un diagnostique de sténose aortique. Elle explique que depuis quelques mois lorsqu’elle jardine elle se sent progressivement plus dyspnéique et étourdie. À deux 2 reprises elle s’est même évanouie.
Le soir de son admission à l’hôpital pour une chirurgie de réparation de la valve aortique, l’infirmier vous appelle pour évaluer la patiente parce qu’elle se plaint de dyspnée. Son évaluation clinique est la suivante :
Pouls : 116/min. TA : 94/56 mmHg Resp : 20/min.
Périphérie : peau est pâle et froide avec de la cyanose périphérique (doigts)
Définir la sténose aortique et la syncope. Quels changements circulatoires sont attribués à la sténose aortique?
Expliquer la tachycardie et la pâleur de la peau.
A l’hôpital, est-ce que les signes vitaux mesurés indiquent que la patiente est en phase de compensation ou de décompensation?
Unité 2 : L’électrophysiologie cardiaque
Partie A : Notions de base
Les courants électriques dans le cœur peuvent être enregistrés au moyen d’un électrocardiographe. Le tracé obtenu est l’électrocardiogramme (ECG). Pour enregistrer l’ECG, on utilise 12 dérivations standard, dont 3 sont bipolaires et mesurent la différence de voltage entre un bras et une jambe. Les 9 autres dérivations sont unipolaires. L’ensemble des dérivations fournit un tableau de l’activité électrique du cœur. Chaque dérivation est un point de vue différent du même stimulus électrique.
L’électrocardiogramme normal
L’ECG est enregistré sur un papier millimétré. La hauteur et la profondeur d’une onde sont mesurées en mm.
L’échelle :
1 mm vertical correspond à 0.1 mv 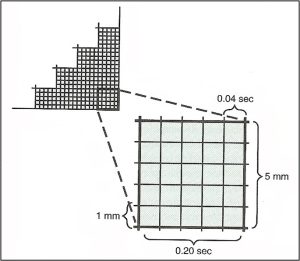
1 mm horizontal correspond à 0,04 sec.
5 petits carreaux entre chaque trait gras représentent 0,20 sec.
Une onde de dépolarisation se déplaçant vers une électrode positive produit une déflection positive. Une dépolarisation s’éloignant de l’électrode produit une déflection négative.
Un ECG typique est composé de 5 ondes : les ondes P-QRS-T
. l’onde P est de faible amplitude et dure environ 0,08 sec. (représente la dépolarisation des oreillettes)
. l’intervalle PR (ou PQ) est d’une durée de 0.12 – 0.20 sec. (≤ 5 petits carreaux) 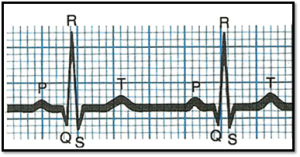
. le complexe QRS normal est < 0.12 sec. ou < 3 carreaux (représente l’activité électrique des ventricules)
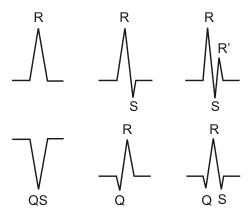
→ l’onde Q : 1ière déflection négative (pas toujours présente)
→ l’onde R : 1ière déflection positive
→ l’onde S : déflection négative après l’onde R
. l’onde T dure environ 0,16 sec. Elle représente la repolarisation ventriculaire
Le complexe QRS – les possibilités
Partie B : La fréquence cardiaque
La fréquence est notée en cycles par minutes (ou battements/min.) et est normalement régularisée par le nœud SA. Lorsque les mécanismes de commandes normaux sont défectueux, d’autres régions peuvent prendre les commande et initier une dépolarisation. On appelle ces pacemakers des pacemakers ectopiques.
Différentes façons peuvent être utilisées pour calculer la F.C.
- Pour un rythme régulier :
- Repérez une onde R qui tombe sur un trait gras
- Comptez 300, 150, 100, 75, 60, 50 pour chacun des traits gras qui suivent
- L’endroit où tombe l’onde R suivante détermine la F.C
- Si la 2ième onde R tombe entre deux chiffres, il s’agit de diviser par 5 la différence des valeurs des deux traits gras pour connaître la valeur de chaque ligne

- Pour un rythme régulier :
- Mesurer le nombre de petits carreaux entre 2 ondes R et diviser ce nombre par 1500.
- Pour la plupart des bandes d’ECG vous allez noter la présence de petites lignes en- haut de la bande de l’ECG. Le temps entre 2 lignes est de 3 secondes et pour 3 lignes de 6 secondes. Il suffit d’additionner le nombre de QRS présents pour une durée de 6 secondes et de multiplier ce nombre par 10.
Partie C : Les arythmies
Comment identifier une arythmie?
-
- déterminer la fréquence cardiaque
- déterminer le rythme : régulier ou irrégulier
- déterminer la présence de l’onde P et sa relation avec sont complexe QRS
- mesurer l’intervalle PR
- noter s’il y a des changements du segment ST
A noter : les arythmies peuvent être identifiées en utilisant une seule dérivation mais pour faire l’interprétation de bloc de branches, la présence d’infarctus, d’hypertrophie, etc. on doit utiliser une 12 dérivation.
Les arythmies causées par un problème avec le nœud sinusal :
. tachycardie sinusale
rythme régulier
F.C > 100/min. 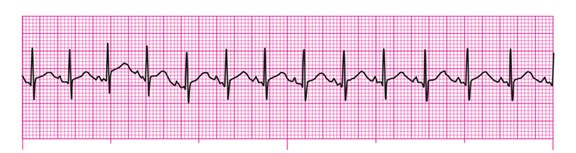
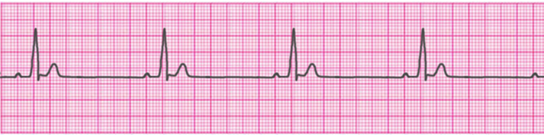
. bradycardie sinusale
rythme régulier
F.C < 60/min. (att’n chez les personnes en bonne condition physique)
. arythmie sinusale
rythme irrégulier qui est en synchronie avec l’inspiration et l’expiration surtout chez les jeunes
F.C est habituellement normale

Les arythmies causées par un problème avec les oreillettes :
. contraction prématurée auriculaire
rythme irrégulier
une ectopie auriculaire se dépolarise avant le nœud SA ou se dépolarise après une période R-R prolongée (escape beat). L’onde P de cette dépolarisation n’a pas la même forme de celui du nœud SA
une pause s’observe avant le prochain battement normal du nœud SA
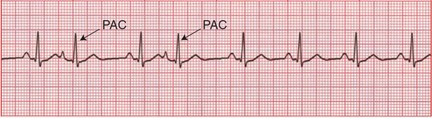
. tachycardie auriculaire
rythme légèrement irrégulier / F.C 150-250
un PAC devient irritable et se dépolarise rapidement avant le nœud SA
les ondes P sont de formes différentes et peuvent être cachées dans le QRS
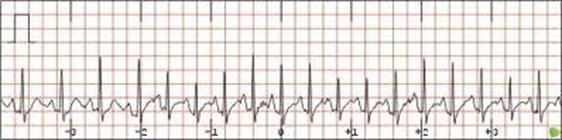
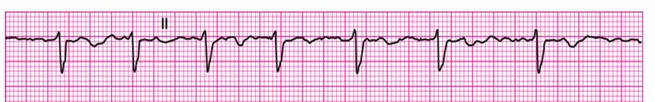
. fibrillation auriculaire
rythme irrégulier / irrégulier
les oreillettes deviennent irritées et il y a présence de centaines de pacemaker qui se dépolarisent avant le noeud SA
à une fréquence > 300/min.
difficile de discerner les ondes P et PRI

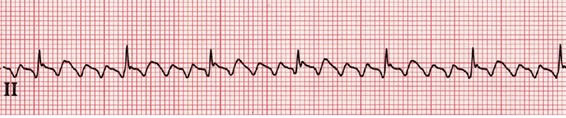
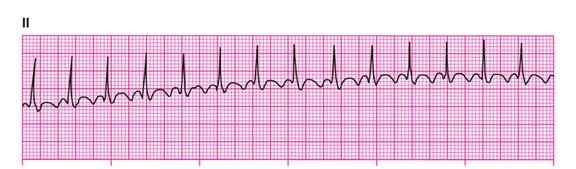
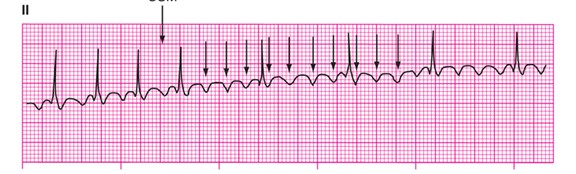
. flutter auriculaire
rythme régulier ou irrégulier
un amas de cellules auriculaires se dépolarisent > 250 – 300/min.
le nœud AV se dépolarise à chaque 2, 3 ou 4 impulsion
les ondes P se caractérisent par leur forme en dents de scies ou requin
Les arythmies causées par le nœud AV :
. extrasystole nodale
une impulsion est générée par le nœud AV avant le nœud S
l’électricité se dirige vers les oreillettes et les ventricules donc l’onde P peut être inversée et observée avant, pendant ou après le QRS
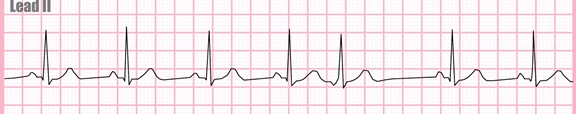
. rythme jonctionnel
rythme régulier
F.C entre 40 – 60/min.

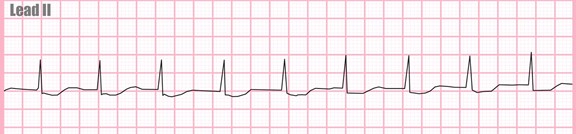
. rythme jonctionnel accéléré
rythme régulier
F.C entre 60 – 100/min.
. tachycardie supraventriculaire
rythme régulier qui peut être provoquer par un problème avec le nœud AV ou par un problème auriculaire
F.C entre 150 – 250/min.

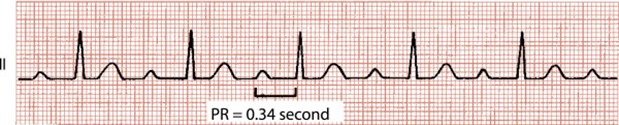
. bloc AV du premier degré
le nœud SA se dépolarise normalement sauf que le nœud AV se dépolarise avec un délai plus que 0.2 seconde (plus que 5 carreaux)
. PRI : allongé; chaque P est suivi d’un QRS; R-R régulier
. bloc AV du deuxième degré Mobitz 1 (Wencheback)
PRI se prolonge jusqu’à ce qu’il ne conduise plus l’impulsion
. PRI : irrégulier R-R : irrégulier

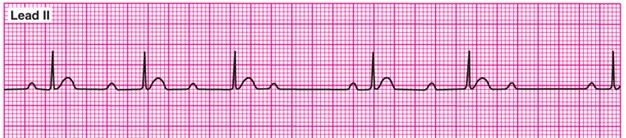
. bloc AV du deuxième degré Mobitz 2
le nœud AV conduit de façon intermittent les impulsions
. PRI : régulier R-R : régulier ou irrégulier
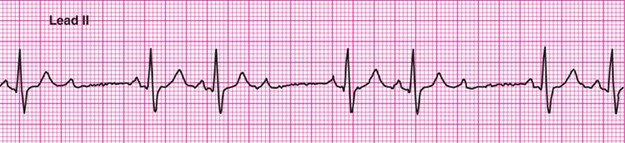


. bloc AV du troisième degré
aucune impulsion des oreillettes est conduit par le nœud AV = bloc complet
soit un pacemaker de la jonction AV ou des ventricules permet la dépolarisation des ventricules
. PRI : irrégulier R-R : régulier (QRS étroit ou large)
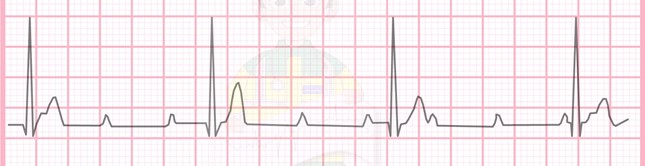
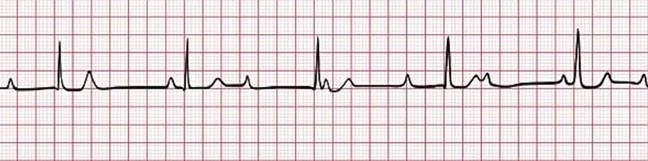

Les arythmies causées par les ventricules :
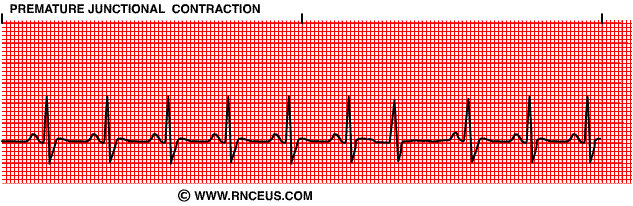
. extrasystole ventriculaire
une ectopie ventriculaire se dépolarise avant le nœud SA
rythme irrégulier avec QRS large suivi d’une pause

. couplet : 2 ESV consécutives (couplet ou triplet)
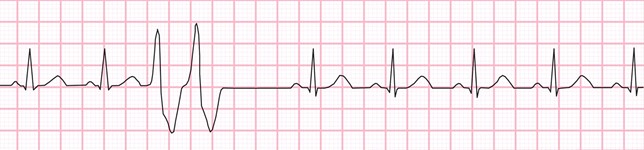
. bigéminisme : cycle avec 1 dépolarisation normal suivi de 1 ESV
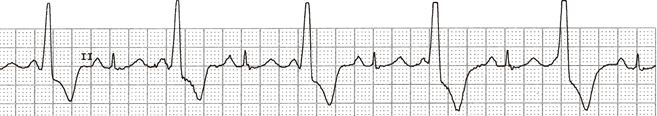
. trigéminisme : cycle avec 2 dépolarisation normal suivi de 1 ESV
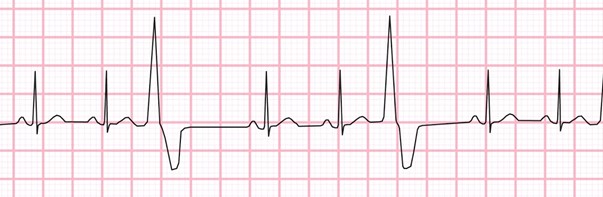 . quadrégiminisme : cycle avec 3 dépolarisation normal suivi de 1 ESV
. quadrégiminisme : cycle avec 3 dépolarisation normal suivi de 1 ESV
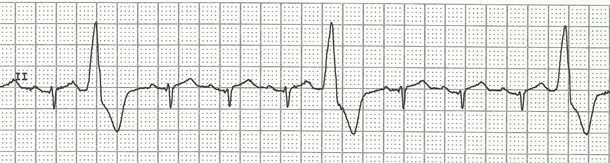
. phénomène R sur T : lorsqu’un ESV se dépolarise en même temps que la repolarisation des ventricules donc sur l’onde T – peut provoquer une arythmie dangereuse telle la fibrillation ou la tachycardie ventriculaire

. rythme idioventriculaire
pacemaker ventriculaire qui contrôle le rythme cardiaque
rythme régulier avec une F.C 20 – 40/min.
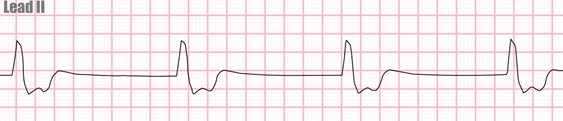
. tachycardie ventriculaire
un pacemaker irrité se dépolarise à une F.C 150-250/min.
ce rythme est souvent associé sans pouls
le rythme est souvent régulier
si le rythme est irrégulier on lui donne le nom de tachycardie polymorphique
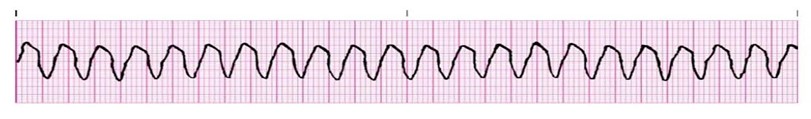
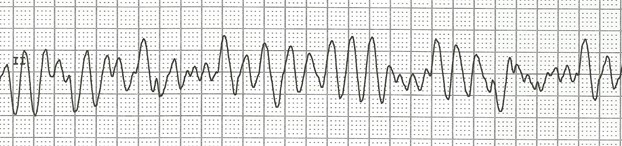
. fibrillation ventriculaire / flutter ventriculaire
plusieurs pacemaker ventriculaires se dépolarisent d’une façon désorganisée
est associée à l’arrêt cardiaque
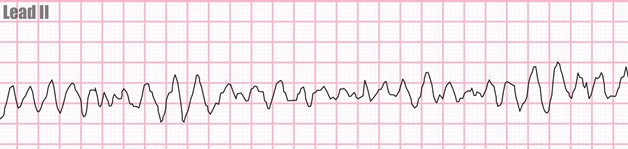
Partie D : Les 12 dérivations de l’ECG
L’ECG est composé de 12 dérivations dont 6 sont les dérivations des membres et 6 sont les dérivations thoraciques (précordiales). Pour obtenir les dérivations des membres les électrodes sont placées sur les bras droit et gauche et sur la jambe gauche (triangle d’Einthoven). Une 4ième électrode est placée sur la jambe droite pour agir comme électrode de terre commune (ground).
Chaque côté du triangle formé par les trois électrodes représente une dérivation soit D1, D2 et D3. Pour chaque paire d’électrode l’une est positive et l’autre négative.
D1 : bras droit est négatif, bras gauche est positif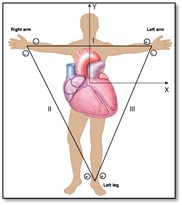
D2 : bras droit est négatif, jambe gauche est positive
D3 : bras gauche est négatif, jambe gauche est positive
En amplifiant le voltage de l’ECG on peut obtenir trois autres dérivations à partir des électrodes positionnées sur les membres. Elles sont les dérivations AVR, AVL et AVF. 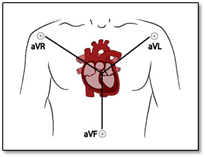 La dérivation AVR se sert du bras droit (right), la dérivation AVL utilise le bras gauche (left) et la dérivation AVF utilise le pied gauche (foot). Ces dérivations (l’électrode est positive) sont unipolaires car elles utilisent seulement une électrode pour lire les changements électriques du cœur.
La dérivation AVR se sert du bras droit (right), la dérivation AVL utilise le bras gauche (left) et la dérivation AVF utilise le pied gauche (foot). Ces dérivations (l’électrode est positive) sont unipolaires car elles utilisent seulement une électrode pour lire les changements électriques du cœur.
Les six dérivations précordiales sont enregistrées à partir d’une électrode positive (donc unipolaire) placée à 6 positions différentes sur le thorax. Les dérivations thoraciques sont dénommées de V1 à V6. Elles sont positionnées progressivement de la droite à la gauche du patient. Les dérivations V1 et V2 sont placées en regard des cavités droites du cœur, les dérivations V3 et V4 siègent en regard du septum interventriculaire et les dérivations V5 et V6 sont en regard des cavités gauches du cœur. Ces électrodes enregistrent les changements électrochimiques du cœur dans le plan horizontal (transverse). 
Chaque dérivation enregistre l’activité électrique du cœur à partir d’un angle différent. Donc, on observe les différentes régions du cœur afin d’en faire l’analyse.
Si l’on veut de l’information au niveau des changements électrochimiques du cœur droit et au niveau du ventricule gauche postérieur nous devons placer les électrodes à ces endroits, c’est-à-dire ajouter les dérivations suivantes :
. V3R – placée entre V2R (V1) et V4R
. V4R – placée au niveau de la 5ième espace droite ligne mi-claviculaire
. V5R – placée au niveau de la 5ième espace droite ligne axillaire
. V7 – placée au niveau de la 5ième espace postérieure ligne axillaire
. V8 – placée au niveau de la 5ième espace ligne scapulaire
. V9 – placée au niveau de la 5ième espace à gauche de la colonne vertébrale
Partie E : Direction du vecteur moyen
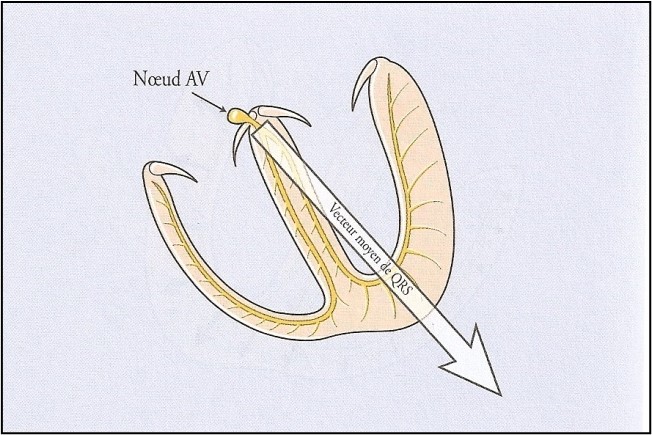
La représentation vectorielle de l’activité électrique est démontrée dans la figure suivante. Tous les vecteurs cheminent à travers la paroi ventriculaire comme ceci : 
Si nous additionnons tous les petits vecteurs électriques lors de la dépolarisation ventriculaire (en considérant leur direction et leur amplitude), nous obtenons un grand vecteur moyen de QRS qui ressemble à ceci :
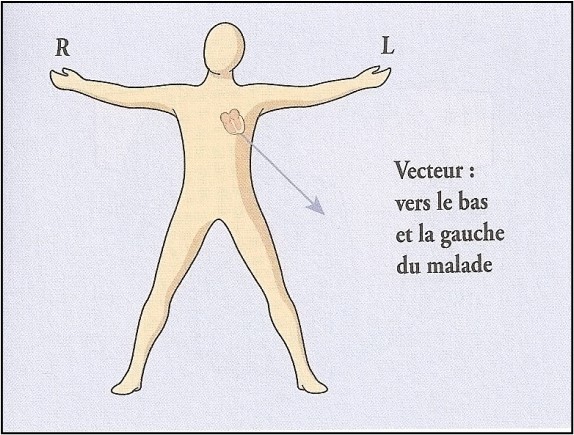
Si le cœur est déplacé, le vecteur est également déplacé dans la même direction
– chez les sujets très obèses le diaphragme et le cœur sont remontés dans le thorax de telle sorte que le vecteur moyen de QRS peut se diriger directement vers la gauche
– en cas d’hypertrophie (augmentation de la taille) de l’un des ventricules, l’activité électrique, plus grande sur ce côté, déplace le vecteur dans ce sens
– dans l’infarctus du myocarde le vecteur moyen sera aussi déplacé car une zone morte dans le cœur existe où il n’y a pas de dépolarisation
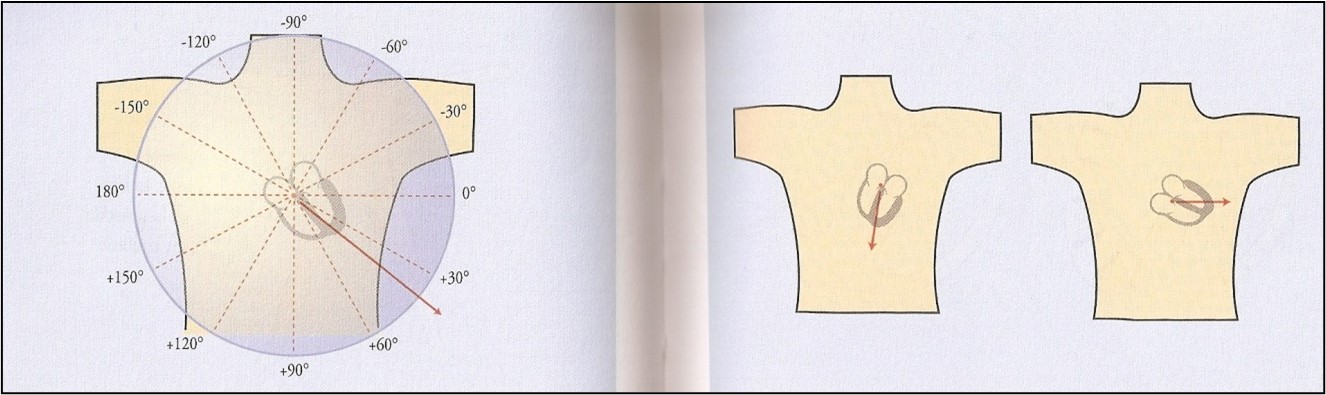
Une 12 dérivations pour un client avec un cœur normal. Remarquez que pour faire la lecture rapide d’un ECG seulement une dérivation est utilisée. Habituellement on choisit la dérivation D2 car elle suit directement le vecteur normal moyen du cœur.
Lorsqu’on fait l’analyse de la 12 dérivations on doit déterminer avant tout s’il y a présence d’une arythmie. Par la suite on peut déterminer si l’axe du coeur est normal pour ensuite poursuivre l’analyse complète.
Une façon simple de déterminer l’axe du cœur est d’évaluer le QRS dans les dérivations D1, AVF, D2
Normal : le complexe QRS est plus positif que négatif en D1 et AVF
Déviation axiale droite : le complexe QRS est plus négatif que positif en D1
Déviation axiale gauche non-pathologique : le complexe QRS est plus positif en D1 mais plus négatif en AVF
Déviation axiale gauche pathologique : le complexe QRS est positif en D1 mais plus négatif en AVF et D2
Voici en ECG démontrant une déviation axiale gauche pathologique. Cette anormalité est pathologique car elle signifie que la branche antérieure de la branche gauche du coeur ne se dépolarise pas. Or les changements bioélectriques de la dépolarisation se produit uniquement via la branche postérieure de la branche gauche du coeur. Donc il y a moins d’électricité qui se déplace vers la bas.


Partie F : Comment évaluer le bloc de branche, l’hypertrophie et l’infarctus avec un ECG 12 dérivations
Bloc de branche droit et le bloc de branche gauche
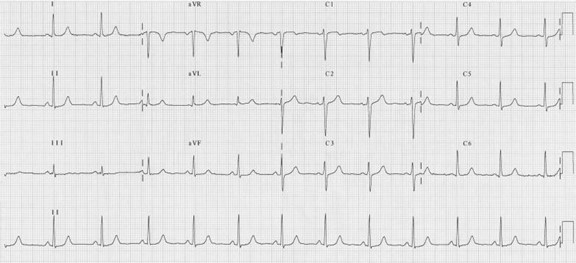
Bloc de branche droit (RBBB) :
Bloc de branche gauche (LBBB) :

L’hypertrophie du ventricule gauche

Ischémie
Les signes d’ischémie incomplète (ne causant pas de lésion ou de nécrose myocardique) sur l’ECG sont : ondes T inversées et/ou sous-décalage du segment ST.

Lésion et infarctus du muscle cardiaque
On peut observer différents changements au niveau de l’onde T et/ou du segment ST lorsque les cellules myocardiques souffrent d’ischémie. La sévérité de l’ischémie et la région atteinte déterminent les changements observés sur l’ECG.

En cas d’infarctus transmural l’ischémie/l’anoxie est complète et on peut observer les changements évolutifs suivants sur l’ECG :
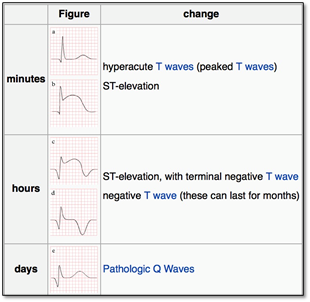
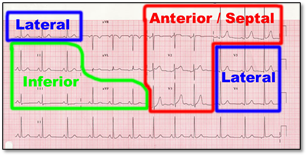
Différentes parties du myocarde peuvent être atteints. On distingue les parties suivantes:
. septal/antérieur, inférieur, latéral
. postérieur, infarctus coeur droit (pas indiqué sur le dessin ci-dessous)
Partie G : Les étapes pour vous guider lors de l’analyse d’un ECG 12 dérivations
- Identifier la présence d’une arythmie
- Identifier s’il y a présence d’un bloc de branche et évaluer l’axe du cœur
-Bloque de branche droite : QRS large et en forme d’oreilles de lapin dans V1 et V2 (avec onde S approfondie dans V6.)
– Bloque de branche gauche (Arrête ici!) : QRS large dans V5, V6, et D1 (avec onde S approfondie dans V1)
3. Reconnaître la présence d’un infarctus et identifier la région affectée
-Onde T augmentée
-Segment ST sus-décalé
-Onde Q approfondie et allongée (plus de 1/3 de l’onde R et plus que .04 sec)
-Onde R réduite ou complètement absente (segment QS)
-le bloc de branche gauche signifie la présence de l’infarctus
| Région Antérieur | V1, V2, V3, V4 |
| Région Latérale | D1, aVL, V5, V6 |
| Région Inférieure | D2, D3, AVF |
4.Reconnaître s’il y a de l’ischémie
-Onde T inversée
-Segment ST sous-décalé
5. Reconnaître s’il y a de l’hypertrophie
-Hypertrophie ventriculaire droite : Onde R augmentée dans V1 et onde S approfondie dans V6.
–Hypertrophie ventriculaire gauche : Onde R augmentée dans V6 et onde S approfondie dans V1.
*Loi de 35 : Lorsque la somme de l’élévation de l’onde R la plus élevée et de l’onde S la plus profonde équivaut à plus de 35mm (7 gros carrés)
Unité d’apprentissage 3 : L’hémodynamie
Partie A : L’équipement
L’hémodynamie signifie l’évaluation des propriétés mécaniques du système cardiovasculaire c’est-à-dire l’évaluation de la pression sanguine, le débit cardiaque, le volume sanguin et la résistance vasculaire. N’oublie pas que le système cardiovasculaire est divisé en deux systèmes : le système pulmonaire et le système systémique. L’étude des valeurs hémodynamiques nous permettent d’évaluer l’efficacité et les changements dans les deux systèmes.
Les mesures hémodynamiques obtenues nécessitent l’insertion d’un cathéter à l’intérieur d’un vaisseau sanguin. Cette technique est de nature invasive et donc l’utilisation est limitée chez les patients critiques.
Les mesures hémodynamiques peuvent être obtenues en insérant une ligne artérielle (artère radiale ou fémorale – sites les plus communs) et/ou en insérant un cathéter dans une grosse veine (jugulaire interne, sous-clavière, fémorale). Deux types de cathéters veineux sont insérés dans les patients critiques. On peut insérer un cathéter simple (ligne centrale pour évaluer la pression veineuse centrale) ou un cathéter plus complexe, le cathéter pulmonaire (Swan Ganz). Le cathéter pulmonaire permet d’évaluer l’hémodynamie du système systémique et du système pulmonaire.
- la ligne artérielle
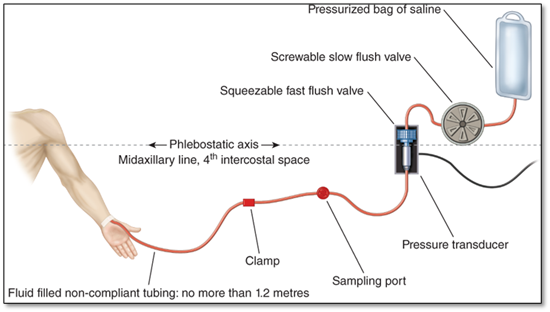
La ligne artérielle permet d’évaluer la pression sanguine de façon continue. De plus on peut retirer le sang artériel pour évaluer les ABG.
- la ligne centrale
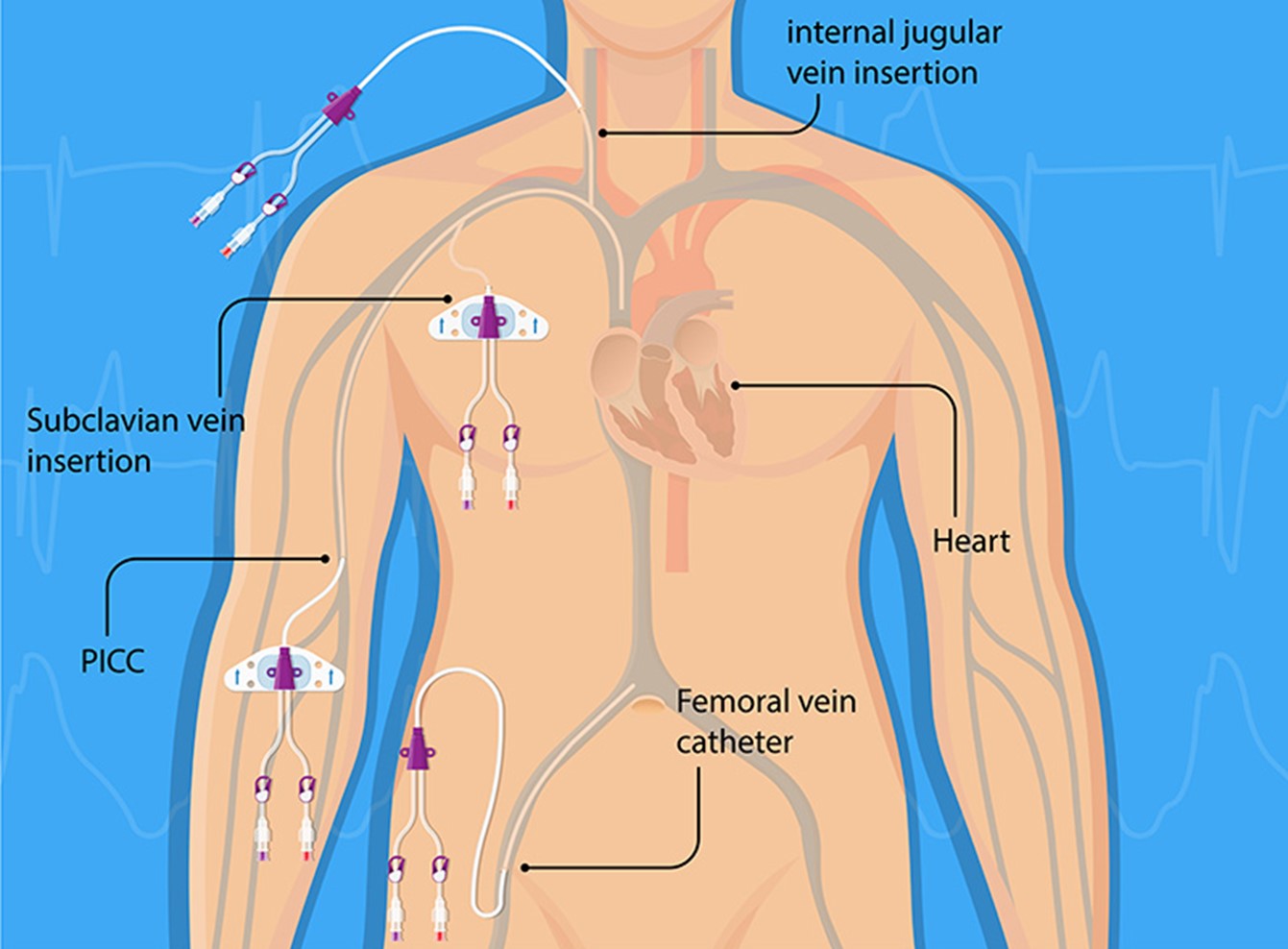
La ligne centrale permet d’évaluer la pression centrale veineuse (CVP), retirer du sang, administrer des médicaments et la nutrition parentérale.
- le cathéter pulmonaire
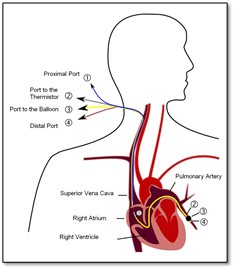

Le cathéter pulmonaire permet d’évaluer l’hémodynamie des systèmes systémique et pulmonaire, le débit cardiaque, retirer du sang et administrer des médicaments. Il est plus complexe et associé avec plus de complications.
- pneumothorax iatrogénique surtout quand on l’insère via la veine sous-clavière
- provocation d’arythmies lors de l’introduction
- site d’infections
- formation d’un thrombus
- infarctus pulmonaire
- cathéter mal positionné (devrait se situé dans la zone 3 du poumon)
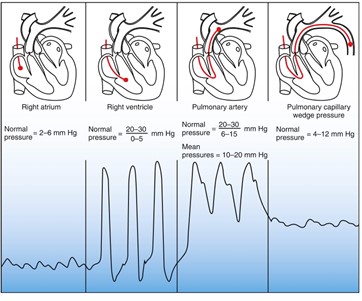
Lorsque le cathéter est avancé dans l’oreillette droite, un ballonnet est gonflé avec 1 ml d’air. Ceci permet au cathéter d’avancer avec l’aide du débit sanguin. Il passe de l’oreillette droite vers le ventricule droit et ensuite devient bloquer dans une des branches d’une artère pulmonaire. L’emplacement du cathéter est évalué en observant les changements des ondes de pressions hémodynamiques de l’oreillette droite jusqu’à la branche de l’artère pulmonaire. Lorsque le cathéter est situé dans l’artère pulmonaire le ballonnet est dégonflé et une radiographie est prise pour confirmer sa position. Le bout distal du cathéter devrait être positionné dans la zone 3.
Partie B : Les valeurs hémodynamiques


Partie C : L’interprétation des valeurs
Pression veineuse centrale (CVP)
- mesurer au bout proximale
-
mesure la précharge du cœur droit
-
valeur normale < 6 mmHg
- CVP basse est signe d’hypovolémie
- CVP élevée est signe soit d’une hypervolémie ou une défaillance du cœur droit
Pression de l’artère pulmonaire (PAP)
- mesurer au bout distal
- représente la pression dans l’artère pulmonaire qui dépend du débit sanguin pulmonaire et de la résistance vasculaire pulmonaire
- la valeur normale est une systolique de 20 – 30 mmHg et une diastolique de 6 – 15 mmHg
-
PAP diminuée est signe soit d’une hypovolémie, une vasodilatation pulmonaire via oxyde nitrique, caripul, viagra, etc
-
PAP augmentée est signe d’une hypertension vasculaire pulmonaire primaire ou secondaire
-
La pression de l’artère pulmonaire bloquée (PCWP, PAOP)
- mesurer quand la balloune au bout distal est gonflé et que le débit pulmonaire est interrompu
- la valeur normale est 6 – 12 mmHg; on accepte jusqu’à 18 mmHg chez une personne ventilée mécaniquement
- PCWP diminuée est signe soit d’hypovolémie ou une vasodilatation
- PCWP augmentée est signe soit d’hypervolémie ou une défaillance cardiaque gauche
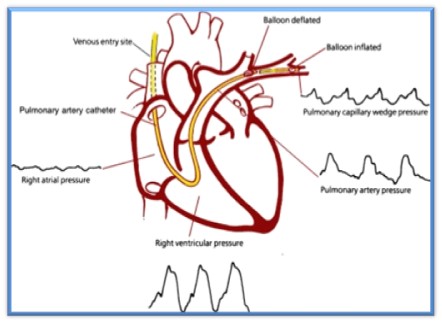

Le débit cardiaque
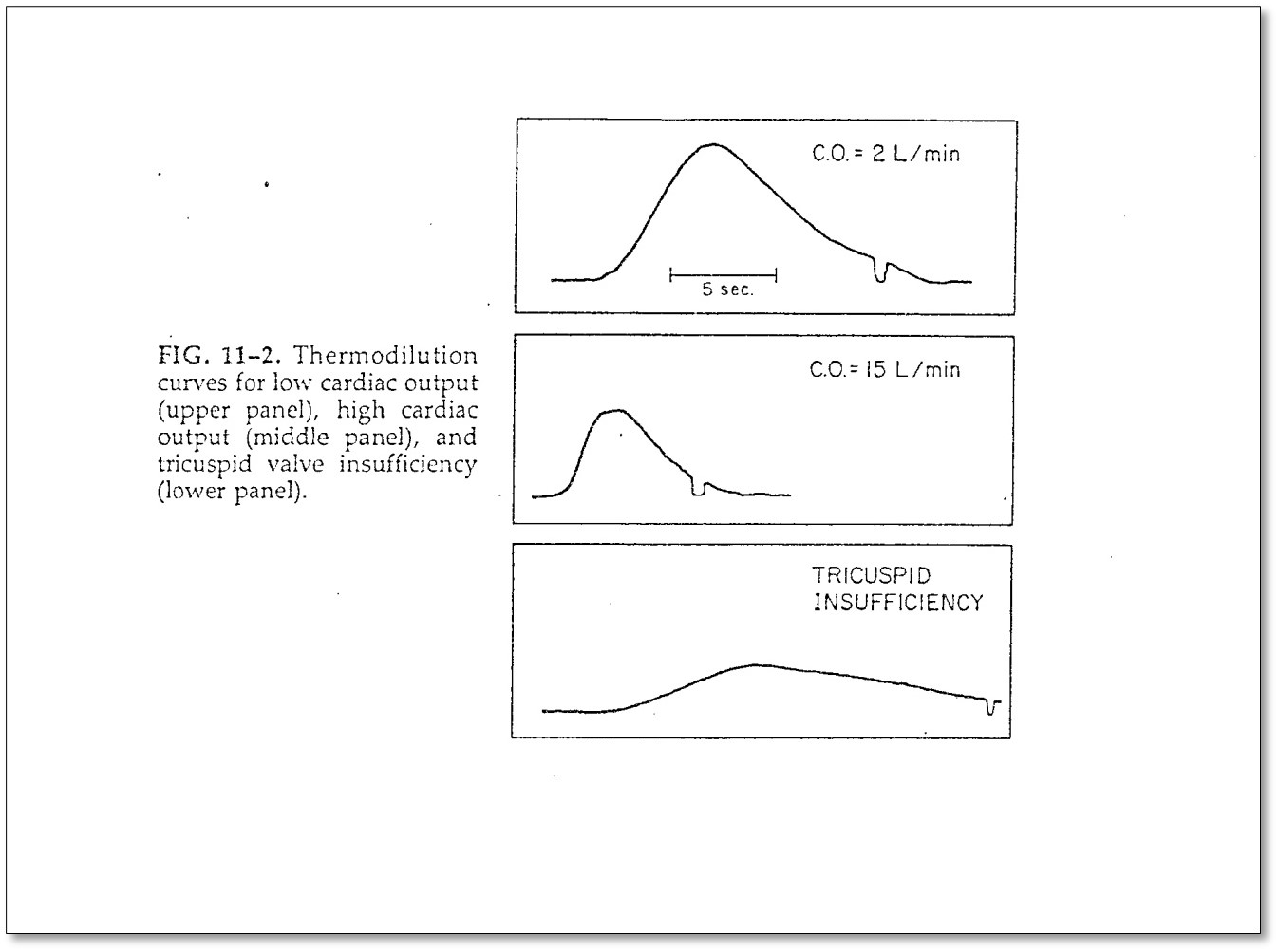
Le grand avantage d’insérer le cathéter pulmonaire est la possibilité de mesurer directement le débit cardiaque. La technique de thermorégulation rend ceci possible.
- technique de thermodilution
- un volume de 10 mL de NaCl ou de 5% dextrose est injecté à l’ouverture proximale; la température du liquide est de 21º ou de 0º
- la température du sang est continuellement mesurée par le thermistor au bout distal du cathéter et le changement de température peut être détecté après l’injection du bolus
- le changement de température détecté sur un temps donné est évalué par un ordinateur branché au thermistor et le débit cardiaque peut être calculé
En évaluant directement le débit cardiaque et les pressions hémodynamiques systémiques et pulmonaires on peut déduire plus facilement quel est le désordre présent chez le patient et le traiter adéquatement.

