8
Justine Verville-Fiset
Table des matières
Unité d’apprentissage 1 – Machine d’anesthésie et préparation pré-opératoire
Partie A : Machine d’anesthésie
Partie B : L’évaluation pré-opératoire
Partie C : Surveillance en anesthésie
Partie D : Remplacement liquidien
Unité d’apprentissage 2 – Les concepts de l’anesthésie générale
Partie A : Terminologie et étapes de l’anesthésie
Partie B : Médicaments en anesthésie
Partie C : Anesthésie locorégionale
Partie D : Le positionnement
Unité d’apprentissage 3 – Le maintien et les complications anesthésiques
Partie A : Principes du maintien en anesthésie
Partie B : Anesthésie obstétricale
Partie C : Transfusion sanguine
Unité d’apprentissage 1 – Machine d’anesthésie et préparation pré-opératoire
Partie A: La machine d’anesthésie
L’anesthésie est un mode de spécialité où les thérapeutes respiratoire doivent être capable d’appliquer des connaissances qui sont propre à cette spécialité. L’équipement qui est utilisé diffère des autres secteurs, et pour cette raison qu’il est important de s’y pencher.
Tout d’abord, la machine d’anesthésie comporte plusieurs options. On y trouve un ventilateur, un moniteur de surveillance, un système d’oxygène indépendant ainsi qu’une multitude de surface pour faciliter le travail des thérapeutes respiratoire et des anesthésistes.
Le ventilateur qui s’y rattache permet d’offrir une ventilation non-invasive (à court terme) ou invasive (de court à long terme). Lorsqu’on fait référence à la ventilation non-invasive, on parle ici de ventilation manuelle. Une étape clé en anesthésie qui sera discuté plus loin. En terme de ventilation invasive, il existe plusieurs modes de ventilation qui permettre une ventilation efficace, que ce soit pour une chirurgie de courte durée, ou de la ventilation à plus long terme. Les différents modes qui sont disponibles peuvent différer dans leur terminologie, mais ils offrent tout de même les mêmes possibilités qu’un ventilateur conventionnel.
Une des particularités du ventilateur est l’omniprésence du soufflet qui peut se décliner en 2 différentes catégories; soit le soufflet ascendant et le soufflet descendant. L’utilité des soufflets et d’effectuer un mouvement vertical pour ainsi provoquer un déplacement d’air. Ce déplacement d’air fait référence aux volumes d’air qui seront administrés aux patients. Plus le mouvement du soufflet est grand, plus le volume administré sera important.
Le souffle ascendant:
Mouvement vertical vers le bas à l’inspiration et mouvement vertical vers le haut à l’expiration.
Le souffle descendant:
Mouvement vertical vers le haut à l’inspiration et mouvement vertical vers le bas à l’expiration.
La majorité des ventilateurs en anesthésie sont aussi muni d’une valve d’échappement d’excès des gas (APL en anglais). Cette valve ne peut être en fonction que lorsqu’une ventilation est effectuée en mode manuel. La fonction principale de cette valve est de limiter la pression qui est dans le circuit du patient. Ainsi, on limite les risques d’inconfort, de barotrauma et volutrauma. En anesthésie, on se doit de mettre une certaine pression de gas dans le circuit pour permettre une ventilation manuelle efficace. Sans cette pression, le ballon de réanimation ne serait pas en mesure de se gonfler, et ainsi offrir des souffles aux patients. Une pression minimale de 5 cmH20 est ainsi recommandé pour effectuer une ventilation manuelle. Une ventilation manuelle efficace et sécuritaire devrait se faire avec une pression entre 5 à 15 cmH20 au maximum.
Attention de bien faire la distinction entre la ventilation manuelle et la pré-oxygénation.
| Pré-oxygénation | Ventilation manuelle |
| Patient est conscient
Aucune limitation à mettre via la valve APL
|
Patient inconscient
Doit mettre une pression d’au moins 5cmH20 avec la valve APL |
Ces valves, en plus de se retrouver sur certaines machines d’anesthésie, elle peuvent être intégré à même certains circuits. On peut penser aux circuits semi-ouvert dont le Jackson-Rees et le circuit en bain. Généralement, ces circuits sont particulièrement utilisés dans les milieux pédiatriques.
Un autre élément particulier des machines d’anesthésie est la chaux sodée. Ce mécanisme permet de purifier les éléments du circuit afin de diminuer les concentrations de gaz anesthésique et de dioxyde de carbone. La chaux sodée est un contenant ayant des granules qui sont essentiellement 3 composés soit: l’hydroxyde de calcium (Ca(OH)2), d’hydroxyde de sodium (NaOH) et d’hydroxyde de potassium (KOH). Les gaz expirés entre en contact avec les composés de la chaux sodée puis une multitude de réaction chimique se produit afin d’éliminer le CO2 du circuit. Il y a des éléments qui doivent être respectés afin de préserver l’intégrité de la chaux sodée et ainsi permettre son bon fonctionnement.
- La taille des granules. Plus celles-ci sont petites, plus la surface d’échange augmente.
- La grosseur du contenant de chaux sodée. Plus celle-ci est grosse, plus un débit lent pourra y passer afin de permettre un échange efficace
- Le taux d’humidité. Plus le taux d’humidité est élevé, plus les granules seront saturés en eau et rendra les échanges inefficaces.
Une des particularités des chaux sodées disponible sur le marché est l’indicateur d’efficacité, qui se veut un indicateur visible. En effet, lorsque les granules de la chaux sodés ont été en contact avec les gaz, celles-ci changent de couleur. Les granules contiennent un indicateur coloré qui fait en sorte que la chaux sodée peut passer du blanc au rose (lorsque le phénolphtaléine est utilisé comme indicateur coloré) ou du blanc au mauve (lorsque le violet d’éthyle est utilisé comme indicateur coloré). Il est recommandé de changer l’intégrité de la chaux sodée lorsque les granules sont colorés entre 50 à 70% du contenant total. Laisser une chaud sodée qui serait saturé n’assurerait pas une bonne échange des gaz et laisserais place à la ré-inspiration du CO2
Le débit des gaz qui est utilisé avec les machines d’anesthésie à un grand impact qui n’est pas négligeable sur l’utilisation des gaz anesthésiques. Ces gaz sont offert dans des contextes d’anesthésie, car ils permettre de maintenir des anesthésie générales facilement et efficacement. Ils seront abordés plus en détails plus tard dans ce chapitre. Il est important d’être conscient de l’utilisation des différents débits des gaz pour avoir une utilisation juste des ressources physique et financière de ceux-ci. Il existe plusieurs techniques pour gérer l’utilisation du débit des gaz en anesthésie, mais nous allons mettre nos efforts sur la stratégie de débit bas.
L’utilisation d’un débit bas fait référence à un débit de gaz qui est inférieur à la ventilation alvéolaire du patient. Généralement, on parle d’un débit entre 0.5 et 1 LPM. Certaines études ont démontrés des effets bénéfiques de l’utilisation d’un débit bas dont la diminution des coûts des agents volatils, amélioration du contrôle de la température du corps, une meilleure gestion de l’hémodynamie ainsi que de moins grands impacts au niveau environnemental. Il va de soi qu’il faut quand-même prendre en considération les effets néfastes d’avoir un débit bas, qui sont: une plus grande accumulation des différents gaz dans le circuit et la possibilité d’offrir un mélange hypoxique si une FiO2 trop petite est sélectionné.
Les gaz anesthésiques qui sont utilisés servent à offrir une anesthésie générale aux patients. Il va de soi qu’il est important de les manipuler et de les utiliser avec soins. Une mauvaise utilisation de ceux-ci pourrait causer des fuites dans l’air ambiant et venir affecter l’équipe de soins. Une attention particulière doit ainsi être apporté au système de livraison de ces agents volatils ainsi qu’au système anti-pollution qui sont disponible en anesthésie.
Dans un premier temps, c’est via des vaporisateurs que la distribution des agents volatils est possible chez les patients. Il est important avant de manipuler les gaz anesthésique de bien comprendre leur fonctionnement et effets secondaires, sans quoi la sécurité du patient pourrait en être grandement affecté. Les vaporisateurs permettent d’offrir les gaz en toute confiance grâce à divers mécanismes de sécurités:
- Chaque vaporisateur est de différente couleur et est associé à son propre médicament (ex. Sévoflurane = jaune)
- Il n’est pas possible d’ouvrir 2 différents vaporisateur de façon simultané
- Les gaz sont leur propre système de clé de remplissage, ce qui fait en sorte qu’il ne serait pas possible de remplir un vaporisateur avec le mauvais gaz
- Clé de fermeture durant les transports
Afin de terminer ce chapitre, il est important comme thérapeute respiratoire de bien comprendre les différentes composantes de la machine d’anesthésie, mais aussi d’être en mesure d’effectuer la maintenance et le dépannage de celle-ci. Un test de maintenance doit être fait à chaque jour sur la machine d’anesthésie même afin de s’assurer de l’intégrité de celle-ci. Il est de la responsabilité du TR de bien être en mesure de faire ces tests et de reconnaître lorsque l’intégrité de la machine ne peut être assurée.
Partie B: L’évaluation pré-opératoire
L’évaluation pré-opératoire est un élément clé pour une bonne préparation des techniques qui seront réalisés par les anesthésistes et les thérapeutes respiratoire. Une anesthésie ne pourrait se faire sans une évaluation du patient. Ce moment permet à l’équipe de valider plusieurs informations qui seront pertinente pour une anesthésie optimale. L’évaluation pré-opératoire à plusieurs but dont:
- Élaborer un plan anesthésique qui répond aux besoins du patient
- Expliquer les risques et bénéfices de la ou les procédures anesthésique
- Obtenir un consentement éclairé
- Valider l’état de santé du patient et demander des tests d’appoints au besoin
- Établir une relation de confiance
- Diminuer le niveau de stress et d’anxiété
Typiquement, l’évaluation préopératoire sera faite quelques minutes / heures avant la chirurgie. Il est cependant possible qu’un anesthésiste décide de voir un patient quelques jours / semaines avant une chirurgie. Généralement, ce type de visite sera pour les patients plus complexe nécessitant des tests plus poussés avant la chirurgie (ex : échographie cardiaque). Cependant, il est important de noter que même si l’anesthésiste a vu le patient il y a quelques semaines, celui-ci sera réévaluer la journée même de la chirurgie.
Points importants qui seront demandés aux patients pour se préparer à l’anesthésie et la chirurgie :
- Être à jeun pour au moins 8hrs
- Liquides clairs OK jusqu’à 3hrs avant la chirurgie
- Arrêter la prise d’anticoagulants (typiquement 7 jours avant la chirurgie)
- Éviter les saignements excessifs
- Doubler la dose des anti-inflammatoires
- Préparer le corps à une réponse anti-inflammatoire adéquate
- Arrêter les médicaments oraux pour la gestion des hypoglycémies
- Prendre seulement la moitié de la dose d’insuline le matin même de la chirurgie
Dépistage de l’intubation difficile:
Le dépistage de l’intubation difficile est hyper important afin de bien comprendre et anticiper les possibles difficultés possibles lors de l’intubation. On doit être en mesure de valider si une intubation sera potentiellement difficile, et aussi préparer l’équipement d’intubation en conséquence de notre évaluation.
L’acronyme LEMON est utilisé afin de faire un dépistage structuré.
| L | Look externally. Regarder l’apparence du visage. Est-ce qu’il y a des signes de trauma, de sang, de difformités importantes etc? | Considéré difficile si : Sang, signe de trauma ou difformités importantes |
| E | Evaluate : On inclue l’évaluation de l’ouverture de la bouche et la distance thyro-mentionnière | Ouverture de la bouche :
Considéré difficile si : < 2 doigts ou < 3 cm chez la femme et < 3.5 cm chez l’homme Distance thyro-mentionnière : Considéré difficile si : < 3 doigts ou < 6.5 cm |
| M | Mallampati : Permet d’évaluer la visualisation des structures de la bouche | Considéré difficile si : Mallampati classe 3 ou 4 |
| O | Obésité et obstruction : On note l’indice de masse corporel du patient et les signes d’obstruction. Les signes d’obstructions sont principalement si le patient à une masse au cou, une inflammation quelconque | Considéré difficile si : BMI 29 ou si obstruction quelconque |
| N | Neck mobility : On évalue si le patient est en mesure de faire un mouvement latéral et vertical complet. | Considéré difficile si : Atteinte à la mobilité |
Matériel d’intubation difficile :
Lorsqu’on dépiste une intubation difficile, il est de notre travail de sélectionner le matériel d’intubation difficile qui sera le plus approprié pour notre cas, selon les caractéristiques du patient.
| Matériel: | Avantages : | Inconvénients : |
| Glydescope
|
Permet une visualisation directe
Excellent pour éducation Facile d’utilisation |
Pas recommandé lorsqu’il y a beaucoup de sang ou sécrétions
Grosse lame, doit avoir une bonne ouverture de la bouche Pas nécessairement transporté facilement |
| Bronchoscope
|
Permet une visualisation directe
Excellent pour éducation |
Pas recommandé lorsqu’il y a beaucoup de sang ou sécrétions
Nécessite une expertise de manipulation |
| Troop pillow | Permet d’aligner les voies aériennes
Utilisé principalement chez les gens obèses Facile d’utilisation |
Difficile de l’enlever après l’induction |
| Fast track
|
Permet de confirmer la ventilation
Idéal pour une intubation à « l’aveugle » |
Nécessite une bonne connaissance du matériel
Beaucoup de préparation et lubrifiant |
| Lame McCoy
|
Permet de soulever l’épiglotte facilement
Utilisé lorsqu’une difformité aux structures est anticipés |
Nécessite une bonne connaissance du matériel |
Dépistage de la ventilation difficile :
Il est aussi important d’être en mesure de valider si on anticipe une ventilation difficile ou non. Il est faux de penser que si on dépiste l’intubation difficile, automatiquement la ventilation sera aussi difficile. On doit évaluer d’autres composantes afin de confirmer la difficulté associée à la ventilation.
L’acronyme MOANS est utilisé afin de faire un dépistage structuré.
| M | Mask seal. : Ici on évalue si le patient démontre des signes qui auraient une incidence sur la capacité à maintenir le masque étanche (barbe, tube nasogastrique, difformité, etc) | Considéré difficile si : un élément anormal est noté |
| O | Obésité et obstruction : On note l’indice de masse corporel du patient et les signes d’obstruction. Les signes d’obstructions sont principalement si le patient à une masse au cou, une inflammation quelconque | Considéré difficile si : BMI 29 ou si obstruction quelconque |
| A | Âge: Plus un patient est âgé, plus la structure de la mâchoire se perd. | Considéré difficile si : Âge 55 ans |
| N | No teeth : On évalue la dentition du patient. | Considéré difficile si : le patient n’a pas de dent, ou à un dentier amovible. L’absence de dent aura un impact sur la structure de la mâchoire |
| S | Stiff lung : On évalue si le patient est connu pour avoir une maladie pulmonaire | Considéré difficile si : le patient est connu pour avoir une maladie pulmonaire qui affectera la compliance ou la résistance pulmonaire |
Évaluation des risques anesthésiques:
L’échelle “ASA” est utilisée pour évaluer les risques anesthésiques. Ceci nous indique donc l’état du patient et ses probabilités d’avoir des complications en lien avec sa chirurgie. L’échelle s’étend de 1 à 6. 1 étant considéré un patient en santé et 6 un patient considéré mort.
L’évaluation de l’ASA est une tâche qui est fait par l’anesthésiste pour chaque patient qui aura une chirurgie
| Classe | Définition |
| ASA 1 | Patient sain |
| ASA 2 | Patient présentant une seule affection systémique modérée (ex. Diabète) |
| ASA 3 | Patient présentant une affection systémique sévère qui limite l’activité (ex.: MPOC) |
| ASA 4 | Patient présentant une pathologie avec un risque pour la vie permanente (ex.: insuffisance rénale dialysée) |
| ASA 5 | Patient dont l’espérance de vie ne dépasse pas 24 hrs avec ou sans traitement |
| ASA 6 | Patient en état de mort cérébrale |
| U / E | Urgence |
Partie C: La surveillance en anesthésie
Le monitorage en anesthésie est une étape vitale afin de bien préparer le patient. Il est important de connaître le patient afin de lui offrir le monitorage approprié selon ses caractéristiques. L’association Canadienne des anesthésistes est assez claire au sujet des moniteurs qui doivent être présent pour une chirurgie.
Tout d’abord, afin de réaliser n’importe quelle chirurgie, le patient doit obligatoirement avoir les moniteurs suivants en place : Saturomètre, ECG 3 dérivations, tension artérielle non-invasive ainsi qu’une lecture de CO2 expiré (lorsqu’une anesthésie générale est offerte).
Toujours selon l’association Américaine des anesthésistes, les moniteurs suivants se doivent d’être dans la salle d’opération pour être accessible dans l’immédiat, si nécessaire.
- Mesure de température
- Stimulateur nerveux
- Stéthoscope
- Éclairage d’appoint
Outre les moniteurs obligatoires, plusieurs autres moniteurs sont possibles d’être utilisés en anesthésie. En voici une liste :
- ECG 5 dérivations
- Sonde à température
- Ligne artérielle
- Ligne centrale
- Cathéter artère pulmonaire (Swan-Ganz)
- Stimulateur nerveux
- Cathéter urinaire
- Moniteur de l’index bispectral (BIS)
Comme professionnel de la santé, il est de notre devoir de bien connaître les moniteurs que nous utilisons, et ce, dans n’importe quel contexte.
Moniteur fréquence et rythme cardiaque:
Peut être soit avec 3 ou 5 dérivations, selon les besoins des patients.
- Le placement avec 3 électrodes nécessitera le noir, blanc et le rouge
- Le placement avec 5 électrodes nécessitera le noir, blanc, rouge, brun et vert
- o Lors de l’utilisation d’un ECG à 5 dérivations, il est possible d’avoir les dérivations V5 et DII. Celles-ci permettent d’avoir une meilleure visualisation de l’électricité du ventricule gauche. De plus, il est reconnu que les épisodes cardiaques qui sont le plus noté durant une chirurgie sont liés au ventricule gauche.
L’oxymètre est typiquement utilisé sur les doigts du patient. Cependant, certaines chirurgies ne nous donnent pas accès aux extrémités du patient. Dans de telles situations, il est alors préférable de placer le saturomètre au lobe d’oreille ou encore sur une narine.
Les machines d’anesthésies sont munies d’un analyseur de gaz pour mesurer les concentrations inspirés et expirés des gaz. Il est super important de s’assurer d’avoir un bon niveau d’oxygène EXPIRÉ lors de la pré-oxygénation. Généralement, on procède à l’intubation lorsque le O2 expiré atteint au minimum 70%.
En plus d’analyser les gaz tel l’oxygène, l’air et le N2O, la machine analyse aussi les gaz anesthésiques.
Gestion de la température corporelle :
La gestion de la température est aussi un élément clé durant une chirurgie. Pour plusieurs raisons, le corps est beaucoup plus à risque d’hypothermie durant une chirurgie.
En temps normal, le corps est en mesure de régulariser notre température corporelle.
| Hypothermie : | Hyperthermie : |
| Vasoconstriction cutanée
Augmentation de la chaleur Frisson Thermogénèse chimique (nouveau-né) |
Vasodilatation cutanée
Sudation Inhibition de la production de la chaleur |
Facteurs externes qui augmentent les pertes de chaleur :
- Température de la salle d’opération (en dessous de 20 oC)
- Solution de badigeonnage (désinfection du site opératoire)
- Irrigation du site opératoire
- Liquide intraveineux
- Gaz inspiratoires (si pas de HME)
- Médicaments
- Agents Halogénés = vasodilatation cutanée
- Relaxants musculaires = empêchent le frisson
Le problème est que lorsqu’un patient est soumis à une anesthésie, le corps n’est pas en mesure de travailler adéquatement afin de maintenir cette température corporelle. Les patients sont ainsi beaucoup plus à risque de faire des hypothermies. On considère une hypothermie modérée lorsque la température est entre 33 à 36 oC et sévère lorsque la température est sous 33 oC
Mécanismes de perte de chaleur du corps :
- Radiation (60%)
- Évaporation (22%)
- Conduction (3%)
- Convection (15%)
Conséquences de l’hypothermie per opératoire :
- o Métabolique
- o Baisse de l’élimination des médicaments
- o Hématologique
- o ↓ du nombre de facteurs de coagulation, ↓ de l’activité plaquettaire
- o Respiratoire
- o ↑ de l’affinité de Hb pour l’O2
- o Bronchospasme chez l’asthmatique
- o Cardiovasculaire
- o Arythmies, si frisson… attention +++ patient cardiaque car ↑ métabolisme de 200% et consommation d’O2 de 500 à 700%
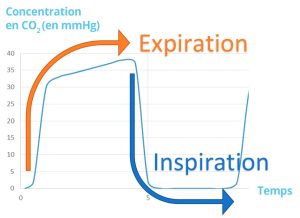
Capnographie :
Le capnographe permet d’offrir une lecture de CO2 expiré. Il est possible d’utiliser un tel moniteur dans plusieurs contextes, mais il est obligatoire seulement en anesthésie lorsqu’un patient est sous anesthésie générale. Ce moniteur est assez fiable et il est possible de prendre des décisions cliniques sur les données qu’on peut obtenir. Typiquement, on peut noter une différence entre le CO2 alvéolaire (ETCO2) et le CO2 artériel (PaCO2) d’environ 5 mmHg.
Il existe 2 type de capnographe. Le side stream est l’utilisation d’une tubulure qui est reliée au circuit d’anesthésie. L’appareil ainsi aspire un échantillon de gaz pour analyser le CO2. On doit généralement attendre 2 à 3 souffles avant d’avoir une lecture. Le mainstream est l’ajout d’une pièce au circuit afin de lire avec une lumière infrarouge le CO2. Ce type de capnographe cause un plus grand espace mort.
Partie D: Remplacement liquidien
Le remplacement fluidique est particulièrement important lorsqu’on pense que la majorité des patients qui arrivent pour une chirurgie sont à jeun. Le corps à des besoins métaboliques qui peuvent être régler grâce à notre maintien fluidique.
En temps normal, le corps excrète environ 2 000 ml d’eau par jour par, principalement les reins, mais aussi les poumons, le tube digestif et la peau.
Lorsqu’on pense à un remplacement de fluide en anesthésie, on doit considérer les points suivants : les besoins de bases, le remplacement pour le jeûne, les pertes sanguines et les pertes liées au troisièmes espace.
Besoins de bases :
Dans un premier temps, on doit penser aux besoins de bases. Chaque personne à un besoin de consommation de liquide qui lui est propre, et qui est déterminé par le poids actuel du patient (et non le poids idéal).
Pour remplacer les besoins de base on utilise la règle 4-2-1:
4 ml/Kg/hr: Pour le premier 10 Kg du poids corporel
2 ml/Kg/hr: Pour le deuxième 10 Kg du poids corporel
1 ml/Kg/hr: Pour chaque autre Kg qui suit
Exemple: adulte pesant 60 Kg:
10 Kg x 4 ml/hr= 40 ml/hr
10 Kg x 2 ml/hr= 20 ml/hr
40 Kg x 1 ml/hr= 40 ml/hr
———————————-
60 Kg 100 ml/hr
Ce calcul nous donne un volume qui s’exprime en ml/hr. Si on prend l’exemple du patient de 60KG, il devra consommer 100ml à chaque h afin de maintenir un équilibre fluidique. Il va de soi que nous ne consommons pas nécessairement ce liquide à chaque hr, mais de façon générale, notre corps nous envoie les signaux nécessaires afin de rencontrer nos besoins à chaque jour.
En anesthésie cependant, ce calcul nous aide à déterminer les besoins de base pour le patient. Nous essayons le plus possible de respecter les besoins de base et ainsi, encore pour ce patient, allons viser une administration de 100 ml à chaque h de sa chirurgie.
Il faut penser que nos besoins de bases doivent aussi être pris en considération dans n’importe quelle situation où il est impossible de s’hydrater, comme lorsqu’un patient est intubé et ventilé !
Remplacement de jeûne:
Le remplacement de jeûne est utilisé seulement lorsque le patient à passer un nombre X, sans avoir bu. Si on se souvient bien, un temps de jeûne est nécessaire afin d’avoir une chirurgie. Il faut ainsi prendre en considération que durant ces heures de jeûnes, qui peuvent varier, le patient n’a pas répondu à ses besoins de bases. Il est ainsi déficitaire dans ses besoins de bases.
La formule pour calculer le remplacement de jeûne est la suivante :
Besoin de base X # heure de jeûne
Il est important de prendre en considération la façon dont on offre le remplacement de jeûne. On ne doit pas remplacer le jeûne trop rapidement afin de ne pas causer de tort à notre patient. On doit remplacer ce fluide de cette façon :
| 1e hr de la chirurgie | ½ du montant calculé |
| 2e hr de la chirurgie | ¼ du montant calculé |
| 3e hr de la chirurgie | ¼ du montant calculé |
Que faire lorsque la chirurgie ne dure pas 3 hrs ? Et bien, il est possible de continuer d’offrir le remplacement à la salle de réveil !
Cristalloïdes :
Solution qui peut traverser la membrane semi-perméable. Ils sont surtout administrés pour remplacer les besoins de base, le jeûne, les remplacements liées à la perte du 3e espace ainsi que les pertes liées au système gastro-intestinal (vomissement et diarrhée).
Lorsqu’ils sont donnés pour le remplacement des pertes sanguines, les cristalloïdes sont administrés en ratio 3 :1.
Solution isotonique :
C’est une solution artificielle qui possède la même osmolarité (275-295 mOsm/L) que le plasma. Il y aura donc une pression osmotique identique entre les liquides.
Lorsqu’on administre une solution isotonique, elle va rester dans l’espace intravasculaire sans affecter le liquide intracellulaire et interstitiel. Il y a donc une augmentation du volume intravasculaire. Cependant après 2 heures, il reste moins de 20% de la solution isotonique dans ce compartiment.
Considération : Attention, peut causer une surcharge liquidienne si donné en grande quantité ou patient avec défaillance cardiaque
Indication: Hypotension (causée par hypovolémie)
Remplacement liquidien de base et de jeûne
Exemples: Normal salin 0.9 %: 308 mOsm/L et Lactate Ringer: 275 mOsm/L
Solution hypotonique:
C’est une solution artificielle qui possède une osmolarité inférieure au plasma. Lorsqu’on donne une solution hypotonique, elle diffuse vers le liquide interstitiel et le liquide intracellulaire. Il en résulte une augmentation du liquide interstitiel et du LIC en plus d’une diminution du liquide intravasculaire
Considération : Attention, peut faire un shift et augmenter la PIC et peut aggraver la perte liée au 3eespace
Indications : Hypertension, Diabète kétoacidose, thérapie de diurétiques
| Normal salin 0.45% | 154 mOsm/L |
| Normal salin 0.33% | 103 mOsm/L |
| Dextrose 2.5 % (D2.5W) | 126 mOsm/L |
| Dextrose 5% (D5W) | 260 mOsm/L |
Solution hypertonique :
C’est une solution artificielle qui possède une osmolarité supérieure aux autres liquides corporels.
Lorsqu’on administre une solution hypertonique, le liquide interstitiel et le liquide cérébral vont diffuser dans le compartiment intravasculaire. Il y a donc une augmentation du liquide intravasculaire et une diminution du liquide interstitiel et du LIC.
Contre-Indication :Diabète Kétoacidose **déshydratation cellulaire
Indications : œdème post opératoire, hypotension, maintenir un débit urinaire adéquat
| D5W + Normal salin 0.45% | 406 mOsm/L |
| D5W + Normal salin 0.9% | 560 mOsm/L |
Unité d’apprentissage 2: Les concepts de l’anesthésie générale
A: La terminologie en anesthésie
Tout dépendant de la chirurgie et de l’état de santé du patient, l’anesthésiste offrira le meilleur plan de traitement au patient.
On peut diviser en 2 grandes catégories les anesthésies possibles ; soit l’anesthésie générale et l’anesthésie locorégionale. Ce module focalisera sur l’anesthésie générale.
Terminologie importante
Une anesthésie générale se découpe en plusieurs étapes distinctes. On débute avec l’induction, qui représente l’accueil du patient jusqu’à son intubation. Par la suite, on tombe dans le maintien, qui est la garde de la stabilité hémodynamique durant la chirurgie. Finalement, nous avons l’émergence qui débute lorsque nous voulons réveiller le patient.
L’induction peut se faire d’une multitude de façon que nous allons voir sous peu. Elle implique la préoxygénation, la « façon » dont le patient perdra conscience, la ventilation manuelle ainsi que l’intubation.
- Préoxygénation
- Induction (IV, IM, Inhalatoire)
- Ventilation manuelle
- Intubation
Pré-oxygénation
En anesthésie, nous avons la chance d’avoir une lecture, pratiquement instantanée, des pourcentages des gaz inspirés et expirés. C’est grâce à ces valeurs que nous allons nous assurer que notre préoxygénation.
Il est aussi impératif d’avoir le matériel adéquat pour faire une pré-oxygénation (masque #3 femme et #4 homme) ainsi qu’une bonne étanchéité du masque avec le patient. Par la suite, on peut s’assurer d’une pré-oxygénation efficace lorsque notre fraction d’oxygène expirée atteint 70%. Une fois ce chiffre magique atteint, il est sécuritaire de procéder avec l’administration de médicaments afin de causer la perte de conscience.
Induction par intraveineuse :
Méthode la plus classique. On ne fait que donner des médicaments qui cause la perte de conscience, tel du propofol et ainsi le patient devient sous anesthésie et nous pouvons procéder à l’intubation.
Malgré que cette technique soit la plus simple et la plus utilisée, nous devons être en mesure de bien analyser lorsque les médicaments font leurs effets et que le patient a bel et bien perdu conscience.
Lorsque du Propofol est administré comme médicament principal pour l’induction, on pourra confirmer la perte de conscience grâce au réflexe ciliaire qui sera perdu. Ainsi, lorsqu’on passe doucement notre doigt sur les cils du patient, on ne notera aucun mouvement, si notre perte de conscience est réussie.
À l’inverse, lorsque la Kétamine est administrée, on note une hyperexcitation suivie d’une période d’accalmie. On pourra ainsi noter une augmentation de la fréquence cardiaque avant que celle-ci ne baisse de nouveau. Le tout dure seulement quelques secondes. Chez certains patients, on peut aussi noter des mouvements lors de cette excitation.
Induction à séquence rapide
Une induction à séquence rapide implique l’administration de médicament afin de causer la perte de conscience, mais une multitude de techniques devront être faites afin de diminuer les risques d’aspiration, qui sont le but de cette technique. Cette technique est ainsi privilégiée pour des patients étant plus à risques d’aspiration telle que : les gens obèses, les femmes enceintes, les gens atteints de GERD, les cas d’urgences, les occlusions intestinales et bien plus!
Toujours dans l’optique de diminuer les risques d’aspiration, aucune ventilation manuelle ne sera utilisée durant cette technique. Il va de soi que la pré-oxygénation efficace prendra un rôle très important dans cette induction.
Une dernière technique primordiale de cette induction est la pression cricoïde. Celle-ci devra être débutée dès l’administration des médicaments (graduellement, afin de ne pas causer de douleur au patient). La pression cricoïde a pour but de bloquer l’œsophage. Il ne faut pas sous-estimer la pression nécessaire afin de venir bloquer l’œsophage. Typiquement, une pression entre 7 à 9 livres est nécessaire afin de réussir cette technique. Il est important de se rappeler que la pression cricoïde pourra être relâchée seulement lorsque l’intubation est confirmée.
Induction par inhalation
L’induction par inhalation est caractérisée par l’utilisation de gaz anesthésique afin de causer la perte de conscience. On peut y arriver de 2 différentes façons; soit par la technique à un souffle (single breath) ou la technique d’inhalation graduelle.
La technique à un souffle consiste à saturer le circuit anesthésique d’un gaz. La valve SIBI peut être utilisé afin d’y arriver. Lorsque le circuit est saturé, on le place rapidement sur le visage du patient et on lui demande de prendre une grande inspiration. La grande quantité de gaz qui est dans le circuit devrait être suffisante afin de réaliser l’induction.

La technique d’inhalation graduelle consiste à ajouter un gaz anesthésique durant la pré-oxygénation.
Peut importe la technique qui est utilisé, il est important de s’assurer d’utiliser un gaz anesthésique qui ne sera pas irritant pour les voies aériennes afin d’éviter des complications (ex. bronchoconstriction). Les instructions qui seront données au patient seront aussi importante afin de bien réaliser l’induction.
Induction intramusculaire
Principalement utilisé lorsqu’aucune intraveineuse n’est en place. Aussi très utilisé pour calmer les patients qui sont soit très très anxieux, ayant une certaine déficience ou les enfants. Le médicament le plus commun utilisé pour ce genre d’induction est la kétamine.
Maintenant parlons de la progression de l’anesthésie générale. Lorsqu’on induit un patient, il est possible de différencier les stades de l’anesthésie.
Stade 1: Analgésie et perte de conscience: Le patient démontre une respiration plus lente, généralement hémodynamiquement stable. Il est capable de répondre aux stimulus verbaux. C’est dans ce stade que de petites interventions sont possibles. (ex.: Cardioversion, sédation consciente, manipulation de membres, etc.)
Stade 2: Agitation et excitation: Parfois difficile à percevoir lors d’une anesthésie générale intraveineuse, car tout se passe vite. Se caractérise par une exagération des réflexes et par des réactions potentiellement dangereuses tels que les vomissements, le laryngospasme, l’hypertension, la tachycardie et les mouvements désordonnés. Les pupilles sont souvent dilatées, le regard est divergent et la respiration irrégulière.
Stade 3: Anesthésie chirurgicale: C’est le stade recherché lors de toutes les anesthésies générales. C’est à ce moment que l’intubation est indiqué. Les réflexes superficiels sont abolis, les réflexes profonds sont actifs et les mouvements volontaires sont totalement absents. Pendant ce stage, les signes vitaux redeviennent normaux; la respiration est régulière, les pupilles reviennent graduellement en myosis et le regard est de plus en plus central. C’est à ce moment que l’anesthésie est considérée assez profonde pour procéder à l’intubation. En effet, il n’y aura pas de réponse somatique ou sympathique (phase 3).
B: La médication en anesthésie
Les anxiolytiques: Ils font parti de la classe des tranquillisants et sont utilisés pour diminuer l’anxiété des patients qui doivent subir une chirurgie ou une intervention. Ils sont aussi appelés les benzodiazépines. Ils sont d’excellent agents pour la sédation et ont un effet de synergie survient lorsqu’utilisé avec d’autres médicaments. Leur mécanisme d’action repose sur une potentialisation des récepteurs GABA.
Les médicaments les plus communs dans le milieu hospitalier sont le midazolam et le lorazépam. Le midazolam est principalement utilisé comme adjuvent en anesthésie, principalement pour son effet amnésique. Le lorazépam lui, est surtout utilisé afin de calmer l’anxiété et aussi pour ses propriétés anticonvulsivants.
Il est possible de renverser l’effet des benzodiazépines. Afin de réaliser ceci, on doit utiliser le flumazénil. Ils viennent bloquer les effets de ces médicaments en provocant une inhibition compétitive au niveau des récepteurs. Il est important de comprendre que la demi-vie de ce médicament est d’une heure. Ainsi, un patient qui reçoit ce médicament doit être sous surveillance, car les benzodiazépines ont une demi-vie plus grande ce celle de leur renverse.
Les opioïdes sont des analgésiques narcotiques. Leur principale application clinique pour l’anesthésie est de soulager la douleur pendant la chirurgie, empêchant du même coup une variation de la pression artérielle ou de la fréquence cardiaque.
Les narcotiques sont aussi utilisés pour traiter la douleur pré et post opératoire. En d’autres mots, ils diminuent la réponse au stress et aux stimuli chirurgicaux. La morphine et le fentanyl sont aussi utilisés pour induire et maintenir l’anesthésie pour les patients en chirurgie cardiaque. Les récepteurs des opioïdes sont localisés surtout dans le tronc cérébral, la moelle épinière, le tractus intestinal et le conduit gastro-intestinal. Il y a trois récepteurs opioïdes qui participent à la médiation de l’analgésie et de l’anesthésie. Ces récepteurs sont : Mu, Kappa et Sigma
La fentanyl est grandement utilisé dans le milieu clinique. Il est important de noter que cet opioïde est très puissant. On note qu’il est 100x plus puissant que la morphine.
Il est possible de renverser l’effet des opioïdes. Afin de réaliser ceci, on doit utiliser le naloxone. Ce médicament vient bloquer les effets de ces médicaments en provocant une inhibition compétitive au niveau des récepteurs. Il est important de comprendre que la demi-vie de ce médicament est de 45 à 90 minutes. Ainsi, un patient qui reçoit ce médicament doit être sous surveillance, car les benzodiazépines ont une demi-vie plus grande ce celle de leur renverse. Considérant “l’épidémie” d’utilisation de narcotiques en communauté, de plus en plus de personnes ont accès gratuitement à la naloxone afin d’être capable d’agir en situation d’urgence. Ce qui est un point positif de ce médicament est sa variabilité d’administration. Il peut être administré via IV, IM, intranasal, et bien plus!
Un agent d’induction, aussi appelé agent anesthésique, est utilisé au début de l’anesthésie afin d’induire la perte de conscience. Depuis les dernières années, les centres hospitaliers font tout en leur pouvoir pour réduire le temps d’hospitalisation et favoriser la chirurgie d’un jour. C’est pour cette raison que le Propofol est maintenant l’agent de choix pour l’induction.
Le propofol est une substance laiteuse qui est très utilisé en milieu clinique. La plus grande particularité de ce médicament est son début et durée d’action. On parle d’une action entre 30-40 secondes. Ce médicament est liposoluble, ce qui veux dire qu’il est capable de se dissoudre et faire action rapidement, en plus d’être capable d’aller se “cacher” dans les tissus adipeux. Les 2 grandes complications de ce médicament est l’hypotension qui est causé ainsi que la douleur au site d’injection. Il est aussi important de considérer le fait que la lécithine d’œuf est utilisée dans le médicament, et ainsi pourrait causer une réaction allergique si le patient est connu pour une allergie aux œufs.
La kétamine est un agent de dissociation qui provoque une anesthésie et du même coup une analgésie très puissante. Il amène une dépression respiratoire minime et conserve les réflexes laryngés. À la suite de l’injection de cet agent, le patient entre dans un état cataleptique. L’absorption est rapide et peut traverser le placenta. Il est surtout métabolisé par le foie. Ce médicament est apprécié car; il maintien la respiration et cause une bronchodilatation directe, maintien la stabilité hémodynamique et on peut l’administrer IV et IM. On ne doit pas négliger les effets secondaires qui sont; l’augmentation de la pression intracrânienne, l’augmentation de la fréquence cardiaque (stimulation sympathique), les hallucinations et cauchemars.
Les relaxants musculaires, aussi appelés curares, bloquent la transmission des impulsions nerveuses entre les terminaisons des nerfs moteurs et les fibres musculaires. Les relaxants musculaires procurent un degré de relaxation des muscles sans produire une dépression du système nerveux central.
Généralement, il faut une anesthésie plus profonde pour rendre un patient inconscient et incapable de bouger. Il est donc, évident qu’il est préférable d’avoir recours à un agent curarisant, que d’utiliser des doses gigantesques d’autres médicaments anesthésiques pour empêcher les mouvements des patients.
La succinylcholine est un relaxant musculaire dépolarisant. Étant le seul de sa catégorie, il se lie aux protéines alpha des sites post-jonctionnels cholinergiques nicotiniques et ouvre les canaux des ions de sodium. Cette ouverture dépolarise les plaques finales motrices et dépolarise les fibres musculaires. Cette liaison aux sites récepteurs empêche la repolarisation des plaques et le fonctionnement normal de l’acétylcholine. La transmission neuromusculaire est interrompue et les muscles demeurent flaccides. La dépolarisation soutenue avec l’administration initiale de la succinylcholine se manifeste par une contraction des muscles squelettiques transitoire appelée « fasciculations». Le début d’action est très rapide (entre 30-60 secondes) et sont temps d’action assez court (5 à 10 minutes). C’est principalement pour cette raison qu’il est indiqué pour les intubations, particulièrement lorsqu’on parle de l’induction par séquence rapide.
Les agents non dépolarisants sont des agents antagonistes compétitifs de l’acétylcholine aux récepteurs alpha et empêchent les changements de la perméabilité des membranes post-jonctionnelles cholinergiques nicotiniques en gardant fermée l’ouverture des récepteurs. La dépolarisation ne peut se produire et une paralysie des muscles squelettiques se développe. Les curares non dépolarisants sont classés selon leur durée d’action.
| Médicament | Durée | % d’excrétion dépendant des reins | Temps avant d’agir assez pour permettre l’intubation |
| Rocuronium (Zemuron) | 30-45 minutes | 25 | 90 secondes |
| Cisatracurium (Nimbex) | 20-60 minutes | 0 | 3.3 minutes |
| Pancuronium (Pavulon) | 60-75 minutes | 60-80 | 3-8 minutes |
Il est possible d’utiliser des renverses afin d’annuler l’effet des paralysant musculaire. Il est important de noter que les renverses sont seulement utilisés pour les paralysant du type non-dépolarisant. Le sugammadex est assez récent sur le marché et très utilisé. Son mécanisme d’action consiste à encapsuler les molécules des paralysants musculaires afin de les rendent inactivent, et par le fait même renverser la paralysie. On utilise aussi la néostigmine et l’édrophonium afin d’obtenir le même effet. Il est cependant important de mélanger ces renverses avec des anticholinergiques (respectivement glycopyrrolate et atropine) afin de contrer la baisse de fréquence cardiaque.
Les médicaments d’urgence sont grandement utilisés en anesthésie lorsque le patient est induit. Plusieurs changements hémodynamiques peuvent se produire durant le maintien et il est important de connaître ces médicaments afin d’agir adéquatement selon les changements notés.
Lorsqu’on parle de médicament « d’urgence » on identifie une urgence comme : une bradycardie, une hypotension et une tachycardie.
La phényléphrine est un vasopresseur agoniste des récepteurs alpha. Il est utilisé pour traiter une hypotension lorsque la fréquence cardiaque est supérieure à 70/min. On doit noter qu’il cause une bradycardie réflexe (généralement, baisse de 10/min). Il peut être utilisé en perfusion ou en bolus. Les effets secondaires principaux sont: arythmies, angine, n/v et faiblesse. Afin de l’administrer, on doit faire une dilution du médicament : Le médicament vient dans une concentration de 10mg/ml et on doit administrer la phényléphrine sous une dose de 0.1mg/ml
L‘éphédrine est un vasopresseur agoniste alpha et bêta. Il est utilisé pour traiter une hypotension associée avec une baisse de la fréquence cardiaque (sous 70/min). Ses effets secondaires principaux : arythmies, douleur thoracique, palpitations et maux de tête. Il faut faire attention, car près 2-4 doses, les récepteurs deviennent saturés et le médicament ne fait plus son effet. Afin de l’administrer, on doit faire une dilution du médicament : Le médicament vient dans une concentration de 50mg/ml et on doit administrer l’éphédrine sous une dose de 5mg/ml
L’atropine est un anticholinergique utilisé pour traiter des bradycardies sévère et soudaine ou des asystolies (dans un contexte plus de ACLS). En anesthésie, on considère une bradycardie sévère lorsque la fréquence cardiaque est sous 35 battements/minute. Ses principaux effets secondaires : arythmies, tachycardie et des symptômes anticholinergiques. La dose à administrer : 2mg. Aucune dilution nécessaire
La glycopyrolate est aussi un anticholinergique utilisé pour traiter des bradycardie. On l’utilise pour traiter des bradycardies supérieures à 35 battements / minute. Ses principaux effets secondaires : arythmies, tachycardie et des symptômes anticholinergiques. La dose à administrer : 0.2mg. Aucune dilution nécessaire
Les gaz anesthésiques:
La façon de faire de l’anesthésie a grandement changé au cours des 10 dernières années, étant donnée l’apparition de nouveaux médicaments intraveineux. En effet, le rôle des agents volatils est passé pratiquement des agents d’induction à des agents de maintien. Aujourd’hui, nous les employons plutôt pour diminuer le dosage des médicaments intraveineux ainsi que pour leurs effets secondaires, tout en potentialisant leurs effets bénéfiques.
Les agents volatils ont tous une solubilité basse dans l’eau et élevée dans les graisses. Voici la séquence dans laquelle un agent volatil réussit à atteindre le cerveau :
- L’agent traverse la machine d’anesthésie et atteint le circuit du patient.
- Il atteint ensuite le poumon (les alvéoles) où il est dilué. Ensuite, il diffuse à travers la membrane alvéolo-capillaire.
- Une fois traversé, l’agent se dissout dans le sang et est ensuite transporté vers le cerveau où il pourra exercer ses effets.
La pression partielle qui s’établit au cerveau détermine la profondeur de l’anesthésie et reflète du même coup, la pression partielle du gaz dans l’alvéole. Lors de la lecture des valeurs expirées par le patient, nous pouvons lire sur l’analyseur de gaz et ainsi nous avoir une bonne idée de ce qui se passe au niveau du cerveau.
Pour différentier les agents entre eux, nous faisons référence à leur puissance qui est exprimée en MAC. Cette valeur est la concentration alvéolaire minimale qui prévient le mouvement chez 50 % des patients soumis à un stimulus chirurgical standard, comme par exemple, une incision au bistouri. En clinique, on ajoute un supplément de 20 à 30 % à la valeur du MAC pour accroître l’effet sur un plus grand nombre de patients soit : 95 %.
Voici la valeur du MAC pour les différents agents volatils ainsi que pour le protoxyde d’azote (gaz anesthésique) :
| Agents volatils ou gaz anesthésique | MAC |
| Halothane | 0.75 % |
| Isoflurane (Forane) | 1.16 % |
| Enflurane | 1.68 % |
| Sévoflurane | 2.2 % |
| Desflurane | 6 % |
| Protoxyde d’azote | 105 % |
Plusieurs facteurs influencent la vitesse pour atteindre la concentration de gaz alvéolaire. Ces facteurs sont:
- La concentration de l’agent inspiré
- La ventilation minute
- Le débit inspiratoire réglé sur la machine d’anesthésie
- La solubilité du gaz utilisé
- Le débit cardiaque
- La différence alvéolo-veineuse
Le protoxyde d’azote est un gaz incolore, inodore et hilarant. Souvent utilisé en combinaison avec d’autres agents volatils pour réduire la valeur de leur MAC et par conséquent leurs effets secondaires. Il est utilisé dans les cabinets de dentiste et en urgence pédiatrique. Certaines particularités doivent être pris en considération avec le N2O. Son MAC est de 105% et son coefficient de solubilité dans le sang est de 0.47.
- La diffusion rapide de protoxyde d’azote vers le sang diminue sa quantité au niveau des alvéoles ce qui provoque l’augmentation rapide de la concentration des autres agents (agents volatils ou oxygène) dans le mélange gazeux alvéolaire. C’est ce qu’on appelle l’effet du second gaz.
-
Lorsque l’on arrête l’administration du protoxyde d’azote, une grande quantité de celui-ci diffuse du sang vers les alvéoles. Étant donné son coefficient de solubilité très bas, cette diffusion se fait tellement rapidement que le protoxyde d’azote va occuper une grande portion du mélange gazeux alvéolaire et va diminuer à la fois le % d’oxygène contenu dans le poumon. C’est ce qu’on appelle l’hypoxie de diffusion. Pour empêcher un tel phénomène, il est recommandé d’administrer de l’oxygène à 100 % lorsque l’on veut couper l’apport du protoxyde d’azote. Plus le % d’oxygène est bas, plus le risque d’hypoxie est grand.
-
Une certaine quantité de protoxyde d’azote se diffuse vers les espaces clos (ballonnet, les pneumothorax, intestins) qui contiennent de l’air. Il est donc déconseillé de l’employer lorsque certaines pathologies sont présentes, comme par exemple : les obstructions intestinales, les pneumothorax, la présence d’embolies gazeuses et au cours de la tympanoplastie. Lorsque le protoxyde d’azote est utilisé à une concentration de 66 %, le volume de ces espaces clos double. Il est donc important de vérifier le ballonnet du tube endotrachéal lorsque la chirurgie dure plusieurs heures pour ne pas causer de la nécrose au niveau du larynx.
L’halothane est l’agent le plus puissant, mais très peu utilisé de nos jours dû aux effets dépresseurs cardiaques (chronotrope -, inotrope -). Très peu dispendieux. Son MAC est de 0.75%
L’isoflurane est un agent puissant qui a un début d’action assez rapide. Un des agents les plus utilisés en anesthésie. Son MAC est de 1.15% et son coefficient de solubilité dans le sang est de 1.4, donc son début d’action est assez rapide. Une particularité est que ce gaz permet d’augmenter le débit sanguin cérébral et aussi la pression intracrânienne. Ce gaz est irritant pour les voies aériennes.
Le desflurane est un agent moins puissant avec son MAC de 6%, mais a un début d’action ultra rapide étant donné son coefficient de solubilité dans le sang qui est de 0.42. Il doit être chauffé afin être utilisé et son point d’ébullition = 23.5 oC. Il est irritant pour les voies aériennes. On note aussi la tachycardie et l’hypertension avec ce gaz.
Le sévoflurane est possiblement l’agent le plus utilisé en anesthésie. Il est excellent pour l’induction au masque, car il n’irrite pas les voies respiratoires et son odeur est plus agréable que les autres. Il provoque une vasodilatation périphérique est ainsi une hypotension peut être noté. Le MAC de ce gaz est de 2.2% et son coefficient de solubilité dans le sang est 0.65.
Partie C: Anesthésie locorégionale
Lorsqu’on parle d’anesthésie, on ne veut pas nécessairement dire que le patient est intubé et ventilé à chaque fois. Il existe d’autres méthodes afin d’offrir des anesthésies aux patients. On parle d’anesthésie locorégionale (ALR) lorsqu’on permet de bloquer une partie du corps du patient.
Voici des indications pour choisir une ALR
- Assure une anesthésie sélective
- Permets un traitement de la douleur péri et postopératoire
- Diminue le besoin des narcotiques durant la chirurgie
- Suspecte une intubation difficile qu’on veut éviter
- Lorsqu’on s’inquiète de l’impact de l’anesthésie générale chez le patient
Voici des inconvénients possibles avec l’ALR
- Pas possible pour tous les types de chirurgie (ex. : thorax = non)
- Technique qui ne fonctionne pas à 100%
- Possibilité de complications nerveuses
- Le patient peut tout entendre durant la chirurgie et causer du stress
L’anesthésie locorégionale est possible via différentes méthodes dont les bloc des terminaison nerveuse. On parle de l’anesthésie locale ou topique, l’anesthésie par infiltration ainsi que l’anesthésie par bloc intraveineux. Les autres types d’anesthésie sont le bloc d’un nerf ou un bloc central (épidurale, rachidienne ou combiné).
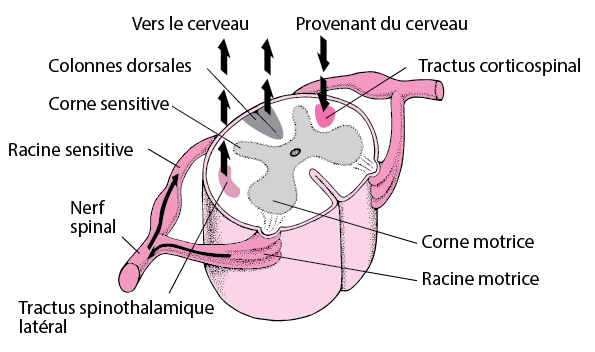
Nous allons discuter ici de les blocs centraux. Avant toute chose, on doit revoir la structure de la moelle épinière. Il s’agit d’une longue tige qui parcourt le canal vertébral à partir du trou occipital (foramen magnum) jusqu’à la première ou la deuxième vertèbre lombaire. On y observe deux renflements importants :le renflement cervical : d’où partent plusieurs nerfs des bras, le renflement lombaire : d’où partent plusieurs nerfs qui se rendent vers les membres inférieurs.
La partie inférieure de la moelle a la forme d’un cône. Un prolongement fibreux de la pie-mère rattache au coccyx la portion inférieure de la moelle. Sur une coupe transversale de la moelle, on peut observer la substance blanche à l’extérieur entourant la substance grise. La substance grise a la forme d’un « H ». Elle est constituée de corps cellulaires de neurones. Les zones de substance grise de la moelle épinière portent le nom de « cornes ». La substance blanche est constituée de plusieurs faisceaux de fibres myélinisées. Les zones de substance blanche de la moelle épinière portent le nom de « cordons ».
Si on débute avec l’épidurale, ceci consiste à placer un cathéter dans l’espace épidural qui demeurera en place et qui nous permettra d’offrir des anesthésiques locaux en perfusion. Le médicament est offert dans l’espace péridural qui est considéré comme « un espace vide ». Le médicament se retrouve donc à entourer les nerfs et ainsi on note beaucoup moins d’effets secondaires perçus par les patients. Les indications sont : accouchement, opération abdominale et opération des membres inférieurs.
Il ne faut pas oublier que l’épidurale permet une excellente gestion de la douleur, surtout en postopératoire étant donné que le cathéter peut rester en place et ainsi offrir une analgésie.
Lorsqu’on fait une épidurale, l’anesthésiste doit d’abord confirmer le placement du cathéter avant de le sécuriser et d’administrer des médicaments. On injecte normalement un test dose avec une microdose d’épinéphrine. Étant donné que le cathéter est placé dans une espace péridurale (vide), l’épinéphrine n’a pas d’impact. Cependant, si on note une augmentation de la FC, on peut confirmer que le cathéter n’est pas en place et on doit rebuter la technique.
Voici quelques complications possibles avec une épidurale :
- Hypotension
- Anesthésie inadéquate
- Céphalée
- Douleur au site d’injection
- Hématomes
- Nausées
- Rétention urinaire
- Infection des méninges
- Injection intravasculaire
Une rachidienne consiste à une injection d’anesthésique local dans le liquide céphalorachidien (LCR). Ce liquide entour les nerfs et ainsi permet un contact direct avec ceux-ci.
Le LCR est un liquide clair, ayant une consistance visqueuse. Ce liquide se forme à un rythme de 900 à 1200 ml/jour. Il est considéré comme faisant parmi des méninges, car il entoure la moelle épinière et les nerfs de la colonne vertébrale.
Lors d’une rachidienne, il est indiqué de faire le prélèvement vers le bas du dos, soit entre L2 et L5. La raison; la moelle épinière est terminée et on se retrouve avec seulement du LCR dans cet espace, ainsi, la technique est beaucoup plus sécuritaire. Étant donné le contact direct entre le médicament injecté et les nerfs, les effets secondaires sont beaucoup plus importants avec la rachidienne qu’avec l’épidurale. On peut noter très rapidement de grands changements hémodynamiques telle l’hypotension artérielle.
Partie D: Le positionnement
Le positionnement est important autant pour le chirurgien que l’anesthésiste. Le chirurgien et l’anesthésiste doivent s’entendre pour obtenir une position qui optimisera l’exposition chirurgicale en ayant le moins de complications et de répercussions physiologiques/hémodynamiques possible. Les patients les plus vulnérables aux complications reliées à des neuropathies causées par le positionnement sont :
- Atteint de pathologie du système nerveux périphérique
- Diabétique
- Maladies vasculaires périphériques
- Arthrite
- Alcoolique
Le patient sous anesthésie générale est incapable de vous mentionner qu’il a le bras engourdi ou qu’il a terriblement mal au dos. Par conséquent, le patient vulnérable peut être positionné avant l’induction de l’anesthésie générale pour s’assurer de leur confort. On doit manipuler avec soin les membres du patient pour éviter de le blesser. On devrait porter une attention particulière aux points de pressions, lors de contact avec des supports métalliques ainsi qu’à la position et au fonctionnement de l’intraveineuse.
Durant la chirurgie, on doit vérifier le bon positionnement du patient à quelques reprises. Croyez-le ou non, on doit aussi vérifier que le chirurgien ou les infirmières ne font pas pression sur le patient en s’appuyant sur celui-ci ou en déposant des instruments sur son visage!
Le décubitus dorsal consiste à avoir le patient en position couché. Il est possible de voir une diminution de la capacité résiduelle fonctionnelle d’environ 10%. Cette position ne cause pas beaucoup de répercussions hémodynamiques. Il faut faire attention avec les femmes enceinte, car cette position peut comprimé la veine cave inférieure et ainsi avoir un impact négatif sur le débit cardiaque. Pour cette raison, on place un rouleau afin d’élevé la hanche droite et libérer la veine cave.
Le trendelenburg consiste à avoir le patient en position couché, avec la table inclinée entre 10 à 20 degrés de façon à ce que la tête du patient soit vers le bas. Il est aussi possible de mettre le patient en trendelenburg inversé, qui consiste à avoir la tête vers le haut et les pieds vers le bas.
La position latérale est utilisée surtout pour des chirurgies orthopédiques. Peut importe le côté sur lequel le patient est placé, il est important de s’assurer de bien supporter la tête, les jambes ainsi que les bras. Le but est de s’assurer que la colonne vertébrale soit bien droite ainsi que les membres soient supportés afin de minimiser les compressions.
La position ventrale est aussi appelé la position prône. Cette position est grandement utilisé en contexte de soins intensifs car elle inverse les zones de ventilation et de perfusion qui peut être grandement utile lors de trouble oxygénatoire. Il est important de s’assurer de bien fixer le tube endotrachéal. Typiquement du diachylon est utilisé en anesthésie, mais lorsqu’on positionne le patient ainsi, il est impératif d’utiliser un dispositif plus sécuritaire afin de tenir le tube en place. On doit aussi faire attention à ne pas comprimer les parties génitales lorsque le patient est dans cette position.
La position assise peut être utilisée pour des chirurgies orthopédiques et neurologique. Lorsque le patient est sous sédation, il est pertinent de soutenir la tête du patient afin d’éviter que celle-ci bascule vers l’avant et comprime les voies aériennes supérieures. Une attention particulière doit aussi être apporté à la tension artérielle cérébrale puisque la tête état surélevé par rapport au cœur, il serait possible d’erroné la perfusion cérébrale.
Finalement, la position de lithotomie consiste à avoir le patient couché sur le dos avec ses jambes écartées et supportées par des étriers. Il faut mettre les jambes fléchies à un maximum de 90 degré.
UA 3: Le maintien et les complications anesthésiques
Partie A: Les principes du maintien anesthésique
Le maintien débute après l’intubation et prend fin lorsque la chirurgie se termine. Il s’agit de la période où le patient demeure endormi. C’est à l’anesthésiste ou au thérapeute respiratoire que revient la responsabilité de surveiller le patient.
Buts du maintien :
- Assurer une profondeur d’anesthésie adéquate
- Surveiller les signes vitaux, assurer la stabilité hémodynamique
- Poser les gestes appropriés lorsqu’un changement, un problème ou une réaction indésirable survient
C’est principalement dans le maintien que nous allons utiliser les médicaments d’urgence afin de maintenir l’équilibre hémodynamique.
Il est aussi important de reconnaître la profondeur de l’anesthésie, du moins, de s’assurer que la profondeur est adéquate. Lors d’une anesthésie bien équilibrée, le patient a une pression artérielle normale à légèrement diminuer et une peau chaude, rose et sèche. Cependant, lorsque l’anesthésie n’est pas assez profonde, il est possible de noter différentes réponses.
Somatique: grimaces du visage, mouvements musculaires involontaires et ouvertures des yeux
Sympathique: hypertension, tachycardie, transpiration et respiration irrégulière
Parasympathique: lacrymation et salivation
L’émergence est le passage du sommeil à l’état de veille. Cette étape débute lorsque l’anesthésiste se prépare à sortir le patient de son état d’inconscience et peut s’étendre jusqu’à 12 heures après la chirurgie. L’état de veille est caractérisé par un patient qui est bien orienté dans le temps, l’espace et le lieu. La durée de l’émergence est très différente d’un patient à l’autre et dépend de plusieurs facteurs relatifs à la condition du patient.
Voici les principaux facteurs déterminant la durée d’action des médicaments et par conséquent de la durée de l’émergence :
- Le type, la dose et la concentration des médicaments utilisés
- La fonction hépatique et rénale du patient
- Le taux plasmatique de pseudocholinestérase
- L’âge du patient
- L’interaction médicamenteuse (synergie ou autre)
- Certaines pathologies
- La durée de l’intervention
L’induction et l’émergence sont les étapes les plus critiques lors d’une anesthésie générale car le patient passe par le stade 2 de l’anesthésie générale, soit la phase d’excitation
Partie B: L’anesthésie obstétricale
Les changements notés chez la femme enceinte sont très importants et se doivent d’être pris en considération afin d’assurer une bonne gestion anesthésie. Voici les principaux effets qui sont considérables pour notre travail
| Système respiratoire | Diminution de la FRC et ainsi la réserve d’oxygène lors de l’intubation
Augmentation de la ventilation minute de 50% lors du premier trimestre (la PaCO2 chute naturellement sous 30mmHg lors de cette période) Augmentation de la consommation d’oxygène (dois ainsi augmenter la FiO2 offerte) Augmentation du volume des seins qui gêne l’intubation |
| Système cardiovasculaire | Augmentation du débit cardiaque (jusqu’à 60%)
Augmentation de la FC et augmentation du volume Augmentation des facteurs de coagulation Nécessite une hémoglobine d’au moins 12g/L Dois considérer la compression de la veine cave lors du positionnement, car peuvent causer des changements hémodynamiques +++ |
| Système gastro-intestinal | Augmentation de la grosseur de l’utérus
Retard de la vidange de l’estomac Augmentation de la pression intragastrique Augmentation de l’acidité gastrique Diminution de la mobilité intestinale |
| Système rénal | Augmentation de l’aldostérone = augmentation de la rétention d’eau
Augmentation de la filtration glomérulaire = augmentation de la vitesse d’élimination de certains médicaments |
Les femmes enceintes peuvent développer certaines conditions médicales qui doivent être prise en considération dans la gestion anesthésique.
Prééclampsie: Condition caractérisé par une augmentation de la tension artérielle systémique. Pour être considéré “prééclampsie”, on doit aussi noter une protéinurie (présence de protéine dans l’urine). On suspecte une telle condition, évidemment lorsque la tension artérielle est en haut des normes, mais aussi si la patiente se plaint de vertige, maux de tête, trouble de la vue et lorsque le fœtus semble plus petit que son âge gestationnel. En anesthésie, on doit faire particulièrement attention à leur tension artérielle. On notera des changements hémodynamique important et un risque de saignement augmenté.
HELLP: Syndrome considéré comme une complication grave de la prééclampsie. L’acronyme = Hemolysis elevated liver enzymes low platelet count. Le fœtus ne s’est pas bien “agrippé” dans les structures de l’utérus et ainsi cause un débalancement de l’utérus, celle-ci causera le relâchement d’enzyme qui vont faire en sorte qu’on va noter une hypertension ainsi qu’une diminution du nombre de plaquettes. En anesthésie, on s’inquiète particulièrement du # de plaquette, les risques de saignement sont augmenté en flèche. On doit tout préparer pour une possible transfusion.
Diabète gestationnel: La présence d’hormones provenant du placenta entrave la fonction de l’insuline au niveau du foie. Condition assez fréquente (7-9% au QC en sont atteint durant la grossesse). Les risques sont plus au bébé qu’à la maman. On note des bébés beaucoup plus gros avec une chance plus haute d’avoir des débalancement dans leur niveau de bilirubine. En anesthésie, on doit vérifier leur taux de sucre et faire attention car elles sont plus prône à faire de l’hypertension artérielle
La gestion de l’anesthésie générale est compliquée par la pharmacologie qui est possible d’utiliser chez les femmes enceintes. Il n’est pas recommandé d’administrer plusieurs médicaments car ils peuvent causer des effets néfastes pour le bébé : les opioïdes, le rocuronium, le propofol, la kétamine et le midazolam. Il n’y a donc peu d’option pour la femme enceinte lorsqu’on parle d’une chirurgie, quelle soit urgente ou planifiée! Il faut être au courant des risques et être prêt à agir.
Partie C: Les transfusions et les complications
Malgré que l’anesthésie soit un environnement qui est très contrôlé, nous ne sommes pas immunisés contre des complications qui peuvent arriver! Et oui, plusieurs complications sont possibles, et certaines avec de grandes conséquences chez le patient. Évidemment que la préparation anesthésique, un bon plan anesthésique et une bonne gestion du maintien préviennent le plus possible ces complications.
Une composante importante qu’on note dans un contexte anesthésique est la perte de sang. Imaginez qu’on vous ouvre l’abdomen pour enlever une partie de votre intestin; il va certainement y avoir une perte de sang. L’important, c’est d’être en mesure de dire : est-ce que cette perte de sang est attendue (normale pour ce type de chirurgie), ou la perte de sang est plus importante qu’anticipée. En répondant à cette question et en évaluant le patient, nous serons en mesure de valider le besoin pour une transfusion sanguine.
Tout d’abord, on doit être en mesure de calculer la perte de sang afin de bien évaluer la perte totale. Voici comment on peut mesurer le sang perdu
- Sang récupéré dans les compresses.
- Sang dans les succions
- Estimation de sang qui se retrouve sur le site opératoire et le plancher
- Estimation du sang perdu dans le patient
- Sang perdu en préopératoire
Il existe 2 méthodes afin de savoir si la perte de sang qui est notée doit être remplacée chez le patient. La première méthode consiste à comparer la perte de sang au volume circulant total (VCT). Ainsi, si le patient perd 20% et + de son volume sanguin, il doit être remplacé.
Calculer le volume circulant (VCT) :
Volume circulant chez l’homme = 75 ml sang / kg
Volume circulant chez la femme = 65 ml sang / kg
Ex : Une femme de 60KG à un volume circulant de 3900ml (65ml X 60kg). On soustrait 20% = 780ml. La patiente a donc une perte acceptable de 780ml, plus que ça, il est suggéré de remplacer le volume.
Les colloïdes sont des fluides qui sont particulièrement utilisés pour le remplacement des pertes de sang, car ils ne traversent pas la membrane semi-perméable. Ainsi, ces fluides vont rester le plus possible dans le compartiment vasculaire et aider à maintenir l’hémostasie. Contrairement aux cristalloïdes, les colloïdes doivent être administrés en ratio 1 : 1 lors de pertes sanguines.
Il existe 2 différents types de colloïdes : les produits synthétiques et les dérivés du sang.
| Produits synthétiques | Dérivés du sang |
| Hestastarch | Albumine |
| Dextran | Culot globulaire (globules rouges) |
| Pentaspen | Plaquettes |
| Voluven / Volulyte | Plasma |
| Cryoprécipités | |
| Sang entier |
| Produits synthétiques | |
| Hestastarch / Dextran | – Osmolarité de 310 mOsm/L
– À la capacité de se maintenir dans le compartiment vasculaire entre 3-24h – Complications : Risques de surcharge, anémie d’hémodilution, rx allergique |
| Pentaspen | – À la capacité de se maintenir dans le compartiment vasculaire entre 18-24h
– Complications : Risques de surcharge, anémie d’hémodilution, rx allergique – Indications spécifiques : Brûlures, choc hypovolémique |
| Voluven / Volulyte | – Plus de complications associées à des défaillances rénales
– Dose maximale de 33ml/kg/jour |
| Dérivés du sang | |
| Albumine | – Disponible en 2 concentrations qui est déterminé selon les besoins par les Md
– Plus associés à des maladies de transmission |
| Culot globulaire (globules rouges) | – Très utilisé dans le milieu hospitalier
– Culot entre 240-340ml – 1 unité augmente l’Hb d’environ 10mg/dL – Doit être administré en perfusion avec du normal salin seulement |
| Plaquettes | – Typiquement administré seulement après multiple transfusion
– Diminution des troubles de coagulopathie (diminution des saignements) – Ne pas administrer chauffer, car la chaleur détruit les plaquettes |
| Plasma | – Recommandé lorsque le patient perd la totalité de son volume en 24h |
| Cryoprécipités | – Considéré comme un « boost » de facteurs de coagulation
– Indiqué lors de troubles de coagulation sévère tels que DIC – Administré chez les gens hémophiles |
| Sang | – Toutes les composantes du sang avec un anticoagulation
– Doit être administré en perfusion avec du normal salin seulement |
Les transfusions sanguines sont des techniques très minutieuses qui se doivent d’être faites avec là plus de précautions possibles afin d’assurer la sécurité du patient. Faire l’administration du mauvais sang au patient pourrait engendrer de graves complications.
Lorsqu’on reçoit un produit sanguin, il est identifié avec une étiquette spécifique avec l’information du patient et la description du produit à administrer. On doit faire une double vérification afin d’être sécuritaire dans l’administration du sang. Ce type de validation permet à 2 personnes de valider l’information du patient ainsi que le produit à administrer de façon indépendante.
Une double vérification permet de valider :
- L’information du patient (DDN, Nom, Prénom, # dossier)
- Groupe sanguin du patient
- Produit de sang à administrer (date de péremption, volume du produit et groupe sanguin du produit)
Par la suite, on est prêt à administrer le produit au patient. N’oublions pas que les produits dérivés de sang doivent être administrés en conjonction avec un fluide. Seulement le normal salin 0.9% peut être utilisé avec des transfusions sanguines, puisqu’il est le seul n’ayant pas d’impact sur l’intégrité du produit sanguin. Les transfusions se doivent d’être prises au sérieux et administrées par des personnes compétentes, car les complications qui peuvent se produire sont nombreuses et peuvent être très graves pour le patient.
| Quelques complications liées aux transfusions sanguines | |
| Réaction fébrile | Réaction dangereuse causée par une lyse des cellules du patient. Causé par une incompatibilité des cellules. C’est comme si le corps rejette le sang administré et on note une grosse réaction infectieuse qui peut être mortelle. |
| Réaction allergique | Légère : Démangeaisons, rougeur
Sévère : Anaphylaxies |
| Réaction hémolytique aiguë | Un peu le même principe que la réaction fébrile, mais c’est causé par un rejet complet du sang par l’administration du mauvais culot. La réaction est plus face à la lyse des cellules du sang. Risque de mortalité très élevé |
| Réaction tardive d’hémolyse | Augmentation du montant d’anticorps 2 à 21 jours après une transfusion. Une réaction tardive qui s’accueille comme un rejet de la transfusion. |
| Coagulopathie de dilution | Lorsqu’on administre beaucoup de culot globulaire et qu’on n’administre pas de produit entier ou de facteurs de coagulation, on peut voir des baisses importantes dans les facteurs de coagulation, qu’on appelle ici coagulopathie de dilution. IL est ainsi important d’administrer des facteurs de coagulation lors de transfusion dite massive. |
| Hépatite / HIV / Maladies infectieuses | Parfois des patients donnent du sang et ont certaines pathologies qui peuvent être transmises par le sang. Le sang est analysé, mais il est parfois possible de noter ce genre de contamination, quoique de moins en moins vu de nos jours. |
| Intoxication au potassium ou citrate | On note une augmentation du K+ lorsque le sang est entreposé durant de longues périodes (35 jours +).
On peut aussi noter une augmentation du citrate qui cause une hypocalcémie |
| Anormalité acido-basique | Lorsque les produits sont entreposés pour plusieurs jours (plus que 35), on peut noter une acidité des produits.
Administrer beaucoup de produits sanguins de façon rapide peut avoir un impact sur le pH et le HCO3 |
| Hypothermie | Particulièrement si les produits sont administrés sans être chauffés |
Il existe différentes méthodes afin d’offrir une transfusion sanguine.
Homologue : Mode de transfusion le + répandu au Canada. Le donneur se présente afin de faire un don de sang dans un endroit à cet effet. Le sang est ensuite analysé et redistribué dans les différents hôpitaux. Le donneur et le receveur ne sont pas du tout liés.
Massive : Mode de transfusion homologue, mais effectuée à très grande échelle. On parle ici d’une transfusion d’au moins 10 unités de sang (n’importe quel dérivé) en moins de 24h. On considère aussi une transfusion massive lorsqu’on remplace l’équivalent de la totalité du volume sanguin du patient. Souvent offerte avec une pompe à perfusion offrant une livraison rapide de culot sanguin appelé le « level one ».
Autologue : Mode de transfusion qui permet au patient de faire un don de son propre sang afin qu’il le récupère lors de sa chirurgie ou autre. Le patient doit ainsi faire don de sang au moins 72hrs avant sa chirurgie, prendre des suppléments de faire et avoir un taux d’hémoglobine supérieur à 11g/L afin d’être éligible. Souvent dans des situations ou le patient à des croyances religieuses qui l’empêchent de recevoir du sang qui n’est pas le sien. Il faut aussi évidemment anticiper des pertes de sang afin de préparer le patient adéquatement. Il faut aussi que l’hôpital ou le centre de don soit équipé afin de répondre à ce genre de demande.
Hémodilution normovolémique : Technique très spécifique de mode de transfusion qui nécessite des installations hautement spécialisées en gestion vasculaire, car il s’agit de retirer une partie du sang du patient (environ 30% de son volume sanguin), avec des fluides (cristalloïdes VS colloïdes). Le sang est récupéré pour être administré au patient durant sa chirurgie. Il faut quand même être assez rapide, car le sang prélevé doit être réadministré dans les 6 h suivant le prélèvement. Évidemment que si le patient démontre des signes d’instabilité, une anémie ou des troubles cardiaques sévères, il ne sera pas en mesure de qualifier pour ce genre de transfusion.
Récupération de sang : Encore une fois, il s’agit d’une technique très spécifique de mode de transfusion qui nécessite des installations hautement spécialisées en gestion vasculaire. Il consiste à prélever le sang du patient durant même la chirurgie avec des succions spéciales qui accueille le sang du patient dans des contenants stériles et qui peut, par la suite, être récupérée pour le redonner au patient. On doit s’assurer que le système soit très stérile afin d’éviter au maximum les risques d’infections. Attention, si le patient démontre des signes d’infections, il ne sera pas candidat pour ce genre de transfusion.
Il peut y avoir plusieurs complications après une chirurgie qui rend l’expérience du patient plus ardu. Il est important d’être conscient de ces complications, de savoir les reconnaitre et d’être en mesure de les traiter adéquatement. Nous allons voir certaines complications qui sont communes, mais cette liste aurait plus être encore plus exhaustive! Concentrons-nous sur l’essentiel.
Avant de parler de réaction allergique, il est important de définir ce qu’est une réaction allergique. On parle d’une réaction allergique lorsque la complication associée affecte les différents systèmes du corps, généralement plus que 1. Une réaction peut être plus localisée et affecte généralement la peau. Les gens ont souvent tendance à dire qu’ils sont allergiques à tel ou tel médicament. Mais quelles ont été les complications? Est-ce vraiment une rx allergique ou une simple complication?
Il existe 2 types de réactions importantes. : anaphylactique et anaphylactoïde.
On parle d’une réaction anaphylactique lorsque le processus antigène – anticorps est présent. Ainsi, le patient a obligatoirement été soumis à l’agent ayant causé une réaction allergique dans le passé. Lors de la première exposition, le corps a réagi en produisant des anticorps qui ont pour but de défendre le corps lors d’une deuxième exposition.
Les réactions anaphylactoïdes quant à elles se produisent lorsque l’agent responsable cause la réaction lors du premier contact avec le patient. On note une réaction allergique grave dès le premier contact, ainsi, la relation anticorps – antigène n’est pas présente.
Peu importe le type de réaction qui est fait, les traitements demeurent les mêmes :
- Cesser l’administration de l’agent responsable de la réaction
- Informer l’équipe afin de ne pas débuter ou continuer la chirurgie, si la rx est grave
- Administrer les traitements selon les normes d’un choc anaphylactique :
- Épinéphrine
- Antihistaminique
- Oxygène
- Anti-inflammatoire
- Soins réanimation si nécessaire
Une aspiration du contenu gastrique peut arriver dans un contexte d’anesthésie. Malgré le fait que les patients sont (le plus possible) à jeun, donc avec l’estomac le plus vide possible, les risques sont quand même présents. Surtout chez les gens qui ont une vidange gastrique retardée (obèse, femme enceinte, certains médicaments, GERD, etc) ces complications sont plus plausibles.
Mais pourquoi est-ce que les patients postopératoires sont plus à risque d’aspiration? Et bien, les conditions dans lesquels les extubations sont réalisées ne sont pas du tout les mêmes que dans un contexte de soins intensifs, par exemple. Souvent, les patients sont extubés à des niveaux de sédations un peu plus élevés que dans d’autres contextes. On voit parfois des extubations se réaliser avec un niveau de sédation élevé et on appel cette technique : deep extubation. On doit s’assurer que le patient respire spontanément, mais le MAC utilisé peut encore être élevé (MAC +0.4, moins que 1). Le patient a ainsi moins de risque de faire de bronchospasmes et de laryngospasmes lors de tels extubations. Cependant, les risques d’aspiration sont bels et bien présents.
N’oublions pas que le contenu gastrique est très acide (pH environ 2.5), ce qui est très dommageable pour les structures pulmonaires du patient. Les risques de développer des pneumonies et du dommage tel ARDS sont très grands lors de tels évènements.
On peut toujours prévenir ce genre de complications par :
- Administrer de la prémédication chez les gens les plus à risques
- Minimiser les « deep extubation » chez les gens plus à risques
- Utiliser des TET avec les gens plus à risques
- Utiliser des sondes naso-gastrique chez les gens plus à risque afin de vider l’estomac
- Traiter si aspiration il y a : oxygène, antibiotiques, intubation si nécessaire, anti-inflammatoires, etc.
L’atélectasie est une condition qui est très commune lorsqu’on parle de complications postopératoires. Plusieurs facteurs contribuent à de l’atélectasie dans un contexte anesthésique :
- Le positionnement
- L’induction anesthésique
- L’utilisation de médicaments tels les narcotiques, les anesthésiques et les gaz anesthésiques
- L’atteinte au système nerveux central
- La sous-utilisation du paramètre de la PEEP lors de l’utilisation de la ventilation mécanique
Tous ces facteurs ont un rôle dans la diminution de la FRC noté au bloc opératoire. On peut noter une diminution jusqu’à 20% de celle-ci chez certains patients. Il est ainsi important de ne pas négliger ceci, de maximiser le recrutement lorsque possible et surtout de traiter en phase postopératoire. Voici quelques traitements qui sont utilisés : spirométrie incitative, le breath-stacking et l’oxygénothérapie
L’embolie gazeuse se définit par l’entrée de bulle d’air dans la circulation sanguine. Étant donné que durant une chirurgie, les vaisseaux sanguins sont exposés à l’air, il est plus à risque de noter ce genre de complications. Ce genre de complication est particulièrement à risque lorsqu’on est en position assise comme pour certaines chirurgies orthopédiques.
Au niveau pulmonaire, on note souvent une diminution du CO2 expiré, de l’hypoxémie et une augmentation de la pression artérielle pulmonaire. Le meilleur traitement et d’empêcher l’entrée de bulles d’air dans la circulation et d’administrer 100% d’O2 afin de minimiser la bulle d’air.
La douleur est une composante importante de la gestion des patients en postopératoire. Peu importe la chirurgie, il est normal de noter de la douleur, cependant, il faut maximiser la gestion de celle-ci, car avoir de la douleur peut apporter plusieurs atteintes à différents systèmes
| Respiratoire | Hypoventilation
Respiration superficielle Diminution de l’efficacité de la toux |
| Cardiovasculaire | Relâchement de l’ADH = rétention d’eau
Hypertension Tachycardie |
| Endocrinien | Relâchement du cortisol
Retardement de la guérison |
| Coagulation | Augmentation de l’adhésion des plaquettes
Diminution de l’activité de la fibrinolyse |
Une des méthodes qui est vue sur une base quotidienne est l’analgésie contrôlée par le patient; la pompe ACP. Ce traitement consiste en une gestion de la douleur par le patient lui-même. La pompe contient l’analgésique prescrit avec une dose par heure maximal. Ainsi, le patient peut s’administrer une dose, jusqu’à un maximum par heure.
En anesthésie, on considère une hypothermie lorsque la température corporelle chute sous 36 degrés Celsius. Plusieurs facteurs peuvent contribuer à cette condition dans un contexte d’anesthésie.
- Le bloc opératoire est gardé avec une température très basse (environ 19 degrés) (pour éviter la propagation des bactéries)
- Les fluides utilisés ne sont pas systématiquement chauffés
- L’utilisation de vasodilatateurs
- L’anesthésie qui prive le patient de ses réflexes
Comme mentionné plutôt, nous mettons pleins de techniques en place afin de minimiser les pertes de chaleur chez le patient. Comme nous ne sommes pas des superhéros, il arrive que certains patients souffrent d’hypothermie en postopératoire. Particulièrement les patients qui sont soumis à de très longues chirurgies (3h+) et ceux qui ont besoin de beaucoup de remplacement fluidique.
Que peuvent être les conséquences de l’hypothermie chez les patients?
- Diminution de l’affinité de l’hémoglobine avec l’oxygène (courbe shiftée vers la gauche)
- Peut apporter des acidoses métaboliques
- Diminution de la production d’urine
- Diminution de l’efficacité des facteurs de coagulation
- Diminution du MAC nécessaire pour l’effet désiré
- Diminution du métabolisme de certains médicaments
En anesthésie, les patients sont beaucoup à risque de faire des laryngospasmes, car on passe par les étapes d’excitation de l’anesthésie générale. Un laryngospasme est caractérisé par un spasme soudain des cordes vocales qui bloque le larynx et ainsi le mouvement d’air vers les poumons. On parle d’un mouvement involontaire des muscles laryngés.
Une telle condition est très stressante à gérer, car on doit travailler rapidement pour rétablir une ventilation. Voici les traitements : ventilation continue à pression positive (CPAP) ou de la succinylcholine afin de provoquer la relaxation des muscles laryngés.
En phase postopératoire, on peut voir 2 types d’œdème pulmonaire. Le premier peut être causé par une surcharge volémique qui pourrait être en lien avec sur administration exagérée de fluides. Lors de ce type d’œdème, on parle d’une augmentation de la pression hydrostatique qui est en cause.
Le deuxième type d’œdème qu’il est possible de noter est par une génération trop importante de pression négative. Ceci se passe généralement lorsqu’on est en train de réveiller le patient et qu’il mord sur sa voie aérienne. On parle ici d’un œdème pulmonaire causé par des pressions négatives. Peu importe le type d’œdème, le traitement demeure le même! Diurétique et / ou BIPAP.
L’hyperthermie maligne est une condition très sérieuse qui peut être très grave pour les patients. On considère l’hyperthermie maligne comme un syndrome important et il se doit d’être souligné et considéré comme une allergie. Il s’agit d’une réaction du corps face à certains médicaments utilisés en anesthésie tels que : les gaz anesthésiques et la succinylcholine.
L’hyperthermie maligne est une maladie considérée comme étant un trouble pharmacogénétique. Ceci signifie que les médicaments administrés ont un impact avec un gène particulier (CACNA1) et une réaction importante s’en suit. L’atteinte principale est aux muscles squelettiques. On note principalement une rigidité musculaire, une augmentation de la température corporelle (augmentation de 1degré Celsius aux 5min) et bien plus!
Voici un tableau plus exhaustif des différents signes. On note des signes précoces (développement rapide) et des signes tardifs.
| Signes précoces | Signes tardifs |
| Hypercapnée | Hyperkaliémie |
| Tachycardie | Douleur musculaire intense (si le patient n’est pas sous anesthésie) |
| Arythmies | Augmentation des CPK sériques |
| Spasmes / Rigidité musculaires | Myoglobinurie / Myoglobinémie (signe de rhabdomyolyse) |
| Hyperthermie (augmentation de 1 degré Celsius / 5 minutes) | Changement de la couleur de l’urine (typiquement foncée) |
| Acidose respiratoire | Trouble de coagulation (typiquement CIVD) |
| Augmentation de la consommation d’O2 | Arrêt cardiaque |
| Diaphorèse | |
| Marbrure (changement de la couleur de la peau) | |
| Instabilité de la tension artérielle | |
| Désaturation |
Il est important d’être en mesure de reconnaitre les signes de l’hyperthermie rapidement afin de traiter la condition le plus rapidement possible. On augmente les chances de survie par beaucoup lorsque la prise en charge de cette condition se fait dans de brefs délais.
Le premier traitement consiste à arrêter la cause! Simple à dire, autre chose à faire. Il est donc important de cesser l’administration des gaz anesthésique et de les retirer de la chambre afin de minimiser les futurs risques d’erreurs. On fait la même chose avec la succinylcholine. Pourquoi ces 2 médicaments? Car ils sont les déclencheurs de crises d’HM.
On peut, par la suite, se fier au tableau qui est dans votre manuel de cours à la page 99.
Le joueur le plus important dans la gestion de l’hyperthermie maligne est le Dantrolène qui est un médicament qui peut venir minimiser les effets pharmacodynamiques de cette réaction. Ce médicament doit être administré pour une dose initiale de 20mg très rapidement. Par la suite, on peut continuer une administration continue jusqu’à un total de 10mg/kg.

