3 Médicaments pour le traitement de l’hyperlipidémie
3.1 Pathologie
La section précédente a abordé l’importance des facteurs de coagulation pour maintenir l’intégrité indispensable du système circulatoire et assurer la fluidité du sang. Cependant, certains déséquilibres peuvent survenir au niveau d’autres composants, tels que les macronutriments. On distingue trois macromolécules principales : les protéines, les glucides et les lipides. Cette section se penche principalement sur l’altération des concentrations de lipides dans le sang.
Les lipides ont de multiples fonctions essentielles dans l’organisme :
- compartimentalisation : Chaque cellule du corps humain est séparée de l’environnement extérieur par une structure de bicouche phospholipidique. En outre, les lipides sont également utilisés dans la compartimentation intracellulaire.
- stockage de l’énergie : Les lipides renferment la plus grande quantité d’énergie par gramme parmi les autres macronutriments et servent efficacement de molécules de stockage d’énergie. En général, plus un atome de carbone est réduit dans une molécule biologique, plus la quantité d’énergie stockée est importante.
- signalisation cellulaire : Différentes voies biochimiques dépendent de la présence ou de l’absence de lipides déterminés, comme la réponse inflammatoire ou la signalisation hormonale.
- absorption alimentaire : L’organisme utilise différents lipides, souvent stockés sous forme de bile, pour faciliter la digestion et l’absorption des substances hydrophobes ou grasses.
Bien que les lipides soient essentiels au fonctionnement physiologique normal, un excès de cholestérol ou d’acides gras dans le sang peut entraîner une affection appelée hyperlipidémie.
3.1.1 Différents types de lipides biologiques
Il est recommandé de consommer environ 20 à 35 % de l’apport calorique quotidien total sous forme de lipides. Il existe trois principaux types de lipides, tels qu’illustrés dans la Figure 3.1 :
- triglycérides : Ces lipides sont formés d’une structure de base de glycérol invariable, composé d’une chaîne de trois atomes de carbone, chacun portant trois groupes hydroxyle. Chacun de ces groupes est lié à un acide gras par une liaison ester. Le type d’acide gras attaché au glycérol peut varier. Ces molécules sont non polaires et représentent environ 95 % de l’absorption des lipides alimentaires (graisses et huiles).
- phospholipides : Ces phospholipides présentent des similitudes avec les triglycérides, car ils se composent aussi d’une structure de base de glycérol. Cependant, contrairement aux triglycérides, les phospholipides ne possèdent que deux groupes d’acides gras, le troisième groupe étant une tête de groupement phosphate. Ce groupement modifie radicalement les propriétés du lipide : il comporte désormais une partie hautement hydrophile à une extrémité de la molécule et deux queues lipophiles à l’autre extrémité. Les phospholipides représentent environ 2 % des lipides dans le régime alimentaire.
- stérols : Ces lipides sont constitués d’un noyau cyclopentaphénathrène, composé de trois cycles hexagonaux et d’un cycle pentagonal. Ils représentent environ 3 % des lipides présents dans le régime alimentaire. Chez les mammifères, le cholestérol est le stérol lipidique le plus connu. De plus, toutes les hormones stéroïdiennes et les acides biliaires sont synthétisés à partir du cholestérol.
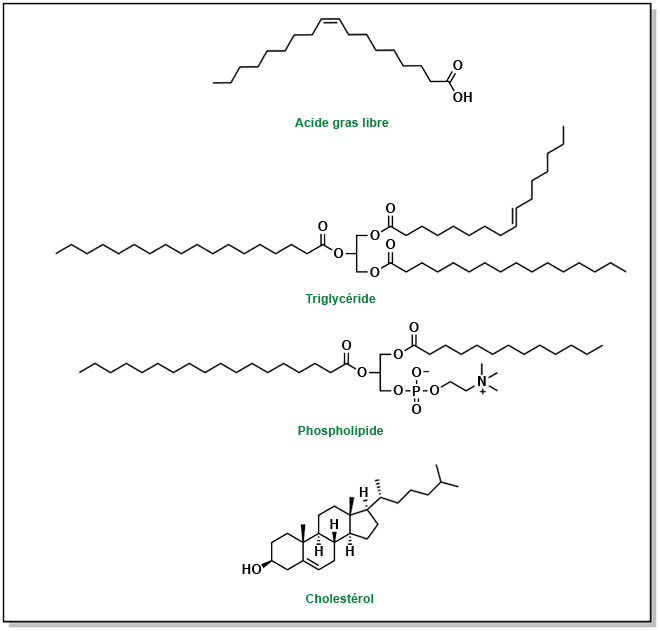 FIGURE 3.1 Structures représentant un acide gras générique et les trois principaux types de macromolécules lipidiques.
FIGURE 3.1 Structures représentant un acide gras générique et les trois principaux types de macromolécules lipidiques.
Les lipides se distinguent nettement des autres macromolécules par leur forte hydrophobicité et leur incapacité à se mélanger avec l’eau. Étant donné que le corps humain est constitué d’environ 70 % d’eau et que les lipides sont essentiels pour chaque cellule du corps, leur transport à travers le système sanguin dans un environnement aqueux représente un défi en raison de leur hydrophobicité. Par conséquent, les lipides sont transportés dans une particule complexe composée à la fois de protéines et de lipides, que l’on appelle lipoprotéine. La structure d’une lipoprotéine est présentée à la Figure 3.2. Les lipoprotéines possèdent une enveloppe externe constituée de phospholipides, au sein de laquelle se trouvent diverses protéines (apolipoprotéines) et dont l’intérieur est composé de triglycérides et de cholestérol. Ces lipoprotéines se déplacent dans la circulation sanguine pour faciliter le transport des lipides.
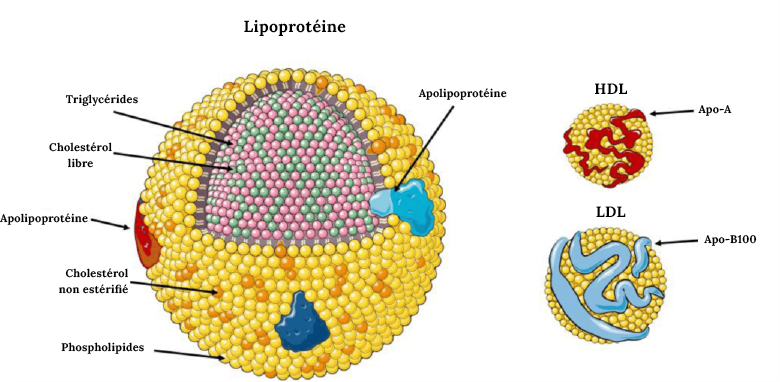
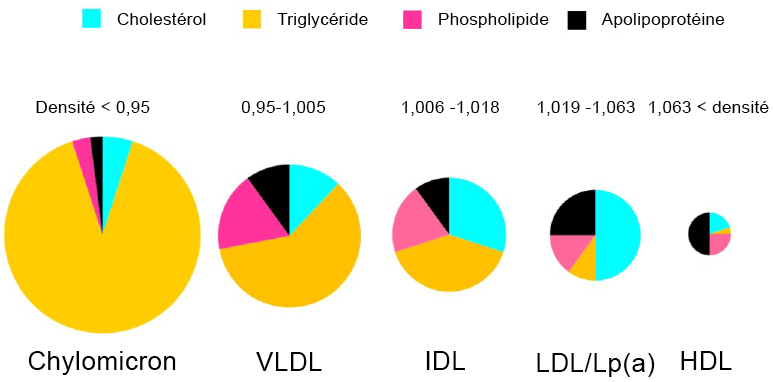
Les lipoprotéines portent des noms différents en fonction de leur composition et de leur densité (Figure 3.3). Les lipides riches en protéines sont désignés sous le nom de lipoprotéines de haute densité (HDL), tandis que les lipoprotéines de densité intermédiaire, faible ou très faible sont dénommées IDL, LDL et VLDL. Les HDL ont un diamètre relativement petit (5 à 10 nm), tandis que les LDL et VLDL ont un diamètre compris entre 20 et 50 nm. Il existe également des classes de lipoprotéines plus vastes dites chylomicrons qui sont essentielles à la digestion et à l’absorption des graisses. Dans le langage courant, les HDL sont souvent considérés comme le « bon cholestérol » et les LDL et VLDL comme les « mauvais gras ». D’une manière générale, les plus grosses particules ont une teneur en lipides plus élevée et une plus faible stabilité.
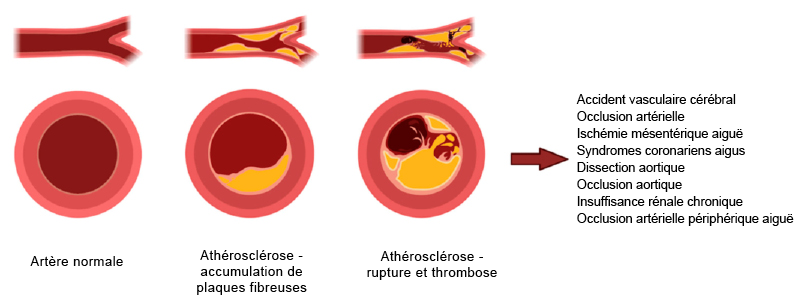
L’hyperlipidémie survient lorsqu’il y a un excès de lipides provoquant une concentration élevée de LDL et de VLDL. Ces graisses peuvent se déposer dans la circulation sanguine pour former des dépôts sur les parois artérielles et bloquer éventuellement le flux sanguin (Figure 3.4). Ces occlusions, dénommées plaques, réduisent la lumière artérielle, entraînant une diminution de l’élasticité des vaisseaux sanguins et crée un foyer de formation pour d’autres thrombus. L’objectif principal du traitement de l’hyperlipidémie est de réduire les concentrations de LDL et de VLDL.
3.2 Traitements
L’une des approches pour traiter l’hyperlipidémie consiste d’abord à réduire la consommation de graisses et de cholestérol, tout en augmentant l’activité physique. Bien que ces efforts soient importants, près de 80 % du cholestérol est synthétisé par le foie, tandis que seulement environ 20 % proviennent de sources alimentaires. Par conséquent, modifier le régime alimentaire et augmenter l’activité physique peut ne pas suffire, et la réduction du cholestérol peut nécessiter un traitement pharmacologique. Il existe trois stratégies principales pour réduire les concentrations de lipides dans le sang : inhiber la synthèse des lipides, inhiber l’absorption ou la capture de lipides et accélérer la dégradation ou la clairance des lipides. Chacune des approches thérapeutiques ci-dessous s’inscrit dans l’un de ces trois axes.
3.2.1 Inhibition de la synthèse des lipides : les statines
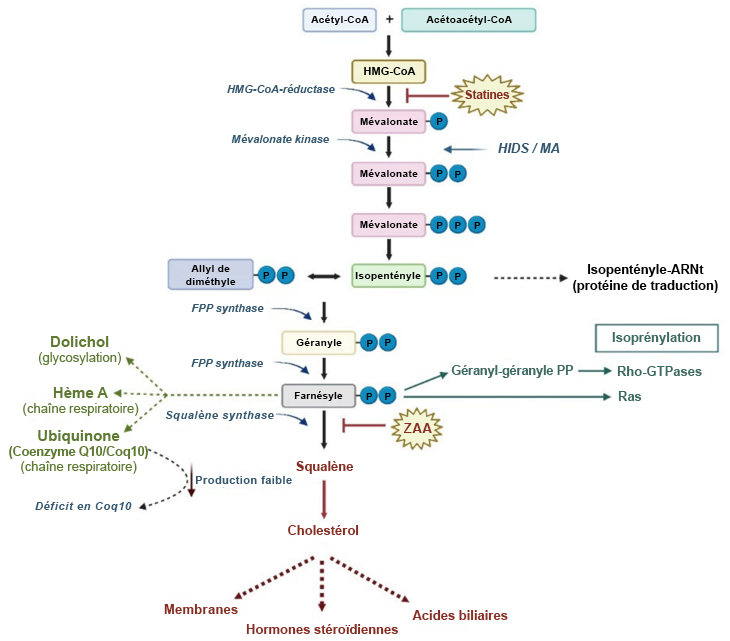
Les statines, une classe d’agents réducteurs de cholestérol, constitue les médicaments les plus couramment utilisés; il est donc important de bien comprendre leur mécanisme d’action. Elles sont conçues pour bloquer la synthèse du cholestérol. Cette synthèse se produit dans le foie par la voie du mévalonate, une voie biochimique d’environ 25 étapes débutant par l’acétyl-CoA. L’une des principales caractéristiques de cette voie est l’étape limitante de la cinétique, c’est-à-dire la réaction qui convertit l’HMG-CoA en mévalonate. Cette réaction est catalysée par l’enzyme HMG-CoA réductase. En neutralisant cette enzyme à l’aide de méthodes pharmaceutiques, il est possible d’interrompre efficacement la voie du mévalonate et la synthèse du cholestérol.
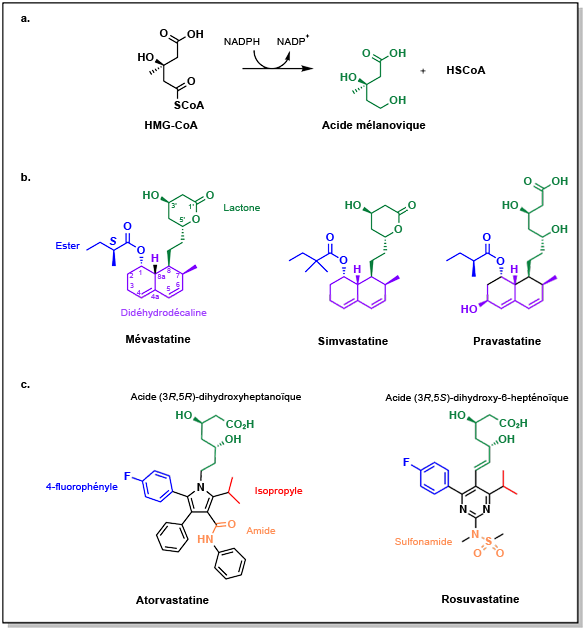
La HMG-CoA réductase catalyse la réduction de la HMG-CoA en utilisant deux équivalents de NADPH, ce qui génère de l’acide mévalonique. Dans les années 1970, les premières tentatives pour identifier les molécules qui interagissent avec cette enzyme ont été réalisées à travers de vastes criblages de produits naturels. La compactine, produite par le champignon Penicillium, a été la première molécule identifiée pour inhiber cette enzyme (Figure 3.6). La compactine présente plusieurs caractéristiques chimiques importantes :
- Anneau de lactone : Cet anneau agit comme un précurseur qui s’ouvre pour former un carboxylate, dont la charge anionique est essentielle pour interagir avec une Lys735 de l’HMG-CoA réductase. La lactone hydrolysée imite alors l’acide 3,5-dihydroxylheptanoïque du substrat enzymatique naturel. Les configurations stéréochimiques des positions 3 et 5 jouent un rôle important dans l’interaction avec l’enzyme.
- Anneau didehydrodécaline : Cet anneau hydrophobe s’engage dans une poche qui se forme lors de la liaison de l’acide à l’enzyme.
La compactine n’a finalement pas été approuvée comme médicament en raison de problèmes de sécurité. Cependant, des composés similaires ont été développés, tels que la lovastatine et la simvastatine. Ces médicaments conservent la même structure chimique de base comportant une lactone séparée par un bras écarteur d’une didehydrodécaline. La pravastatine est un composé intéressant qui, bien qu’elle ne contienne pas de lactone, présente une forte similitude avec la partie acide 3R,5R-dihydroxyheptaonique du substrat, c’est-à-dire l’acide mévalonique Soulignons que toutes ces molécules ont des demi-vies relativement courtes. Le cholestérol étant surtout synthétisé la nuit, il est recommandé de prendre ces médicaments le soir afin d’optimiser leur efficacité dans le blocage de la synthèse.
Malgré que le blocage de la HMG-CoA réductase inhibe la synthèse du cholestérol dans le foie, ce dernier a néanmoins besoin de cholestérol pour fonctionner correctement. Les faibles concentrations de cholestérol dans le foie stimulent l’absorption du cholestérol contenu dans les LDL et VLDL présents dans le sang. Par conséquent, l’extraction des LDL et VLDL du sang contribuera à réduire le taux de cholestérol total.
Les statines de deuxième génération préservent certaines des propriétés structurelles clés mentionnées précédemment. Cela inclut l’acide dihydroxyhépatonique, essentiel pour la liaison de l’enzyme au résidu Lys735, ainsi que la configuration stéréochimique des groupes d’alcool. Cependant, la partie de la molécule qui interagit avec la poche hydrophobe a été modifiée pour inclure des hétéroatomes, ce qui a conduit à la création de l’atorvastatine (Lipitor) et de la rosuvastatine (Crestor). Les deux molécules contiennent des substituts p-fluorophényle et isopropyle qui contribuent à l’affinité du récepteur. La différence principale entre ces molécules réside dans leur composition : l’atorvastatine contient un amide, tandis que la rosuvastatine contient un sulfamide. Cette variation structurelle se traduit par des propriétés différentes. L’atorvastatine est la statine la plus lipophile et peut traverser plusieurs membranes cellulaires, notamment celles des différents muscles et tissus. À l’inverse, la rosuvastatine est la statine la plus hydrophile et la plus puissante. Les deux médicaments ont des profils métaboliques CYP différents, l’atorvastatine étant principalement métabolisée par le CYP3A4 et la rosuvastatine par le CYP2C9.
Il existe également une controverse concernant les types d’effets secondaires observés avec ces statines, les plus courants (de 1 à 25 %) étant la faiblesse musculaire et la rhabdomyolyse (où le muscle se décompose et libère des substances dans le sang pouvant entraîner des troubles rénaux ou cardiaques). Même si le mécanisme n’est pas entièrement compris, le blocage de la HMG-CoA réductase et la réduction de la formation d’acide mévalonique ont pour effet de diminuer les substrats nécessaires à d’autres voies biochimiques. Parmi ces voies, on compte notamment la synthèse de la coenzyme Q10, une molécule essentielle pour les muscles et l’utilisation de l’énergie (voir Figure 3.5). Bien que certains patients prennent des suppléments, les données disponibles ne sont pas concluantes. De plus, les statines les plus lipophiles ont la capacité de traverser la barrière hématoencéphalique, ce qui peut entraîner des effets sur le cerveau, notamment des pertes de mémoire.
3.2.2 Inhibition de la synthèse des lipides : la niacine
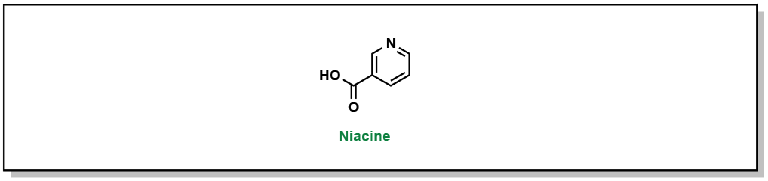
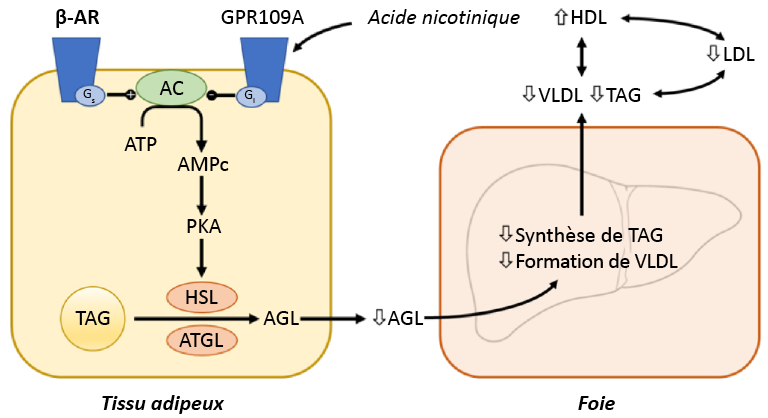
La niacine (ou vitamine B3) est une petite molécule utilisée pour bloquer la synthèse des triglycérides dans le tissu adipeux (Figure 3.7). Bien que cette molécule soit utilisée en clinique depuis plus de 50 ans, son mécanisme d’action n’a pas été encore totalement élucidé.
La liaison de la niacine se produit au niveau du récepteur GPR109A (un récepteur couplé aux protéines G), qui inhibe ensuite l’activité de l’adénylcyclase. Cette inhibition réduit la conversion de l’ATP en messager secondaire AMPc. Cela bloque l’activation de la PKA et l’activité subséquente de la lipase hormono-sensible (LHS). Cette lipase est responsable de la dégradation des triglycérides en acides gras libres, libérés ensuite dans la circulation sanguine. La réduction des concentrations d’acides gras libres dans le sang entraîne une diminution de la formation des VLDL et de la synthèse des triglycérides dans le foie (Figure 3.8).
3.2.3 Inhibition de l’absorption des lipides : l’ézétimibe
Un autre mécanisme de réduction du taux de cholestérol consiste à empêcher son absorption lors de la consommation d’aliments. Le cholestérol provenant de l’alimentation est absorbé dans l’intestin grêle par les récepteurs NPC1L1 (Figure 3.9). Le cholestérol se lie à ces récepteurs, et le complexe cholestérol-récepteur est ensuite internalisé grâce à un processus médié par AP2-clathrine.
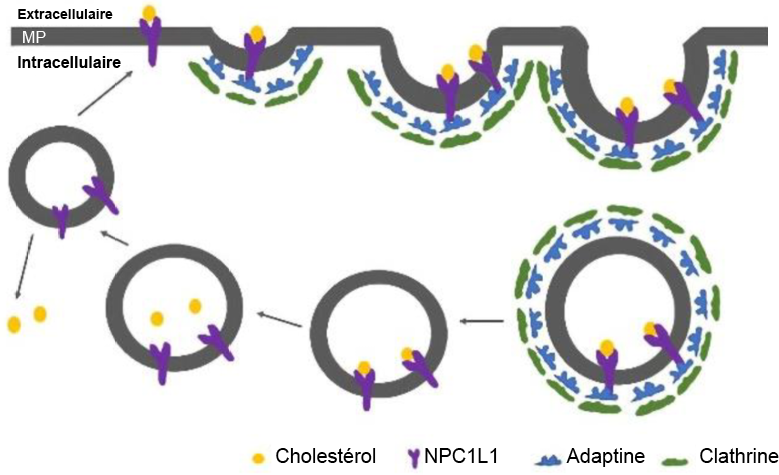
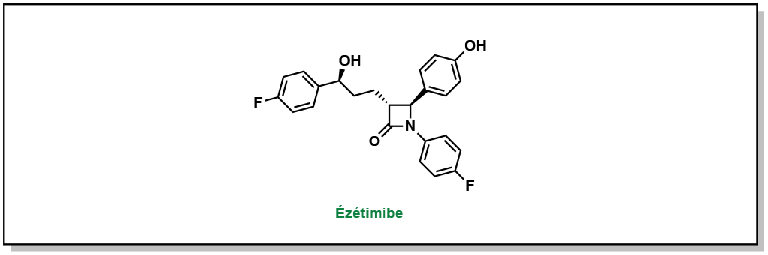
L’ézétimibe est un médicament qui inhibe l’interaction entre le récepteur NPC1L1 et les molécules de clathrine, empêchant ainsi la cellule d’absorber le cholestérol. Sa structure 1,4-diaryl-β-lactame est essentielle pour son activité. Ces médicaments peuvent être administrés en complément des statines pour réduire efficacement la quantité de cholestérol absorbée, mais également synthétisée (Figure 3.10).
3.2.4 Accélération de la dégradation ou de la clairance des lipides : les fibrates
Les fibrates sont une classe de composés qui peuvent réduire les effets de l’hypertriglycéridémie. Les fibrates agissent en activant le récepteur activé par les proliférateurs de péroxysomes de type α (PPARα). Ce récepteur forme un hétérodimère avec une autre protéine appelée récepteur X des rétinoïdes (RXR). Ensemble, ils se fixent ensuite à la séquence des éléments de réponse PPARα, régulant l’expression d’un groupe de gènes impliqués dans le métabolisme des lipides, permettant ainsi d’augmenter les HDL et de réduire la synthèse des TG (Figure 3.11).
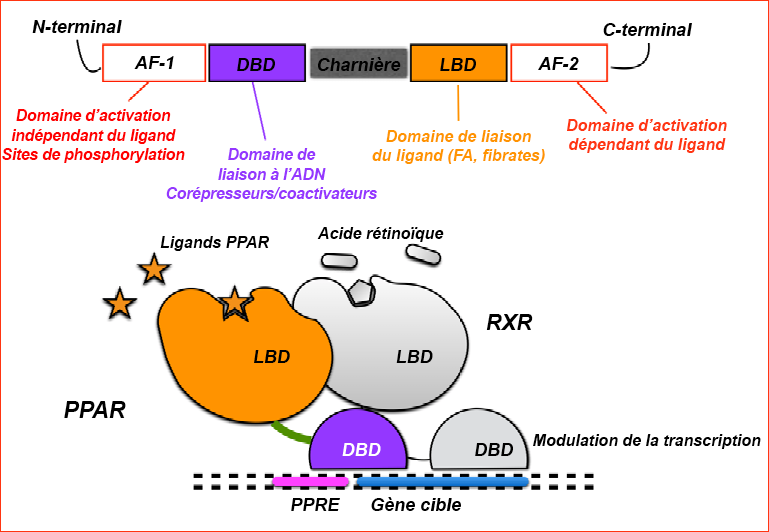
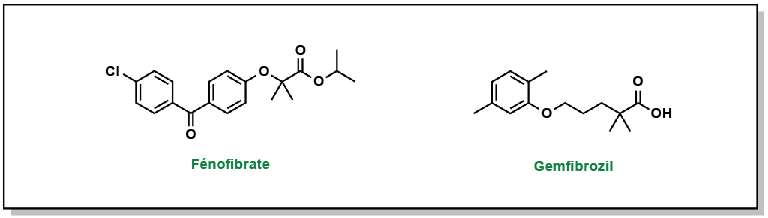
Le principal pharmacophore qui permet aux fibrates de se lier et d’activer PPARα comprend un acide phénoxybutyrique, qui établit une interaction ionique-dipôle avec un résidu tyrosine spécifique (Tyr464) de PPARα. Les deux principaux fibrates sont le fénofibrate et le gemfibrozil (Figure 3.12).
3.2.5 Accélération de la dégradation ou de la clairance des lipides : les chélateurs des acides biliaires
Comme mentionné précédemment, la nature hydrophobe des lipides peut poser problème lors de leur digestion et de leur absorption, en raison du milieu aqueux de l’estomac et de l’intestin grêle. Les lipides de source alimentaire sont digérés grâce à la bile, un liquide complexe composé en grande partie d’acides biliaires et de dérivés du cholestérol. La bile est produite par le foie et stockée dans la vésicule biliaire. À la suite de la digestion, environ 97 % de la bile est réabsorbée dans l’iléon et stockée dans la vésicule biliaire. Cependant, les chélateurs des acides biliaires ajoutés se lient à la bile, l’empêchant d’être réabsorbée et la contraignant à être excrétée. En réaction à cette perte de bile, le foie synthétise des acides biliaires supplémentaires, ce processus impliquant l’absorption du cholestérol et des LDL présents dans le sang, réduisant ainsi la concentration de lipides.
Les chélateurs des acides biliaires sont des cations chargés positivement qui se lient aux acides biliaires, ceux-ci étant chargés négativement. Cette interaction forme un complexe qui ne peut alors pas être absorbé. Ces chélateurs sont normalement des poudres qui se prennent par voie orale. Ils ne sont pas absorbés par l’intestin grêle, ce qui limite les effets indésirables systémiques. Cependant, leur consommation peut être difficile et entraîner divers troubles gastro-intestinaux.
3.3 Résumé
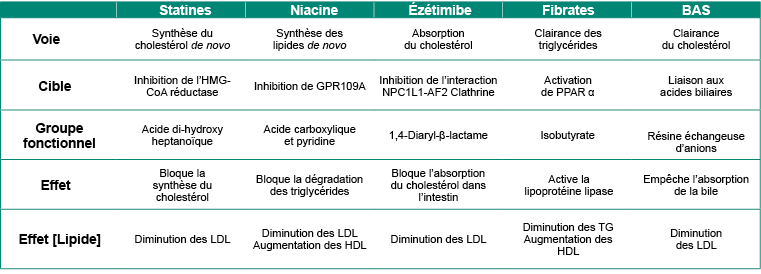
Le Tableau 3.1 présente un résumé des différentes propriétés pharmacologiques des agents hypolipidémiants.
Tableau 3.1 : Résumé des agents hypolipidémiants.