2 Médicaments pour le traitement de la thromboembolie veineuse
2.1 Pathologie
Le système circulatoire distribue le sang dans l’ensemble du corps, acheminant l’oxygène, les nutriments et les hormones vers les différents organes, tout en éliminant le dioxyde de carbone et les autres déchets. Le sang contient plusieurs composants, dont des cellules sanguines et un ensemble de protéines, lipides et glucides divers. Le maintien d’un flux sanguin constant est essentiel à la viabilité de tous les organes et tissus. La thromboembolie veineuse (TEV) fait référence à un blocage causé par un caillot sanguin dans les veines et qui entrave la circulation sanguine. Il existe deux types de TEV qui se distinguent par la localisation de l’obstruction : la thrombose veineuse profonde (TVP) et la thrombose veineuse superficielle (TVS). Les veines superficielles se trouvent plus près de la surface de la peau et sont souvent bien visibles. En général, les caillots sanguins qui se forment dans ces régions ont tendance à se résorber naturellement (en quelques heures ou quelques jours) et sont moins préoccupants sur le plan médical, à moins qu’ils ne migrent vers les veines profondes, comme celles des jambes. Inversement, la TVP peut entraîner des complications potentiellement mortelles, notamment des embolies pulmonaires, et doit être traitée le plus rapidement possible.
2.1.1 Blocages dans la circulation sanguine
Les blocages qui se produisent dans la circulation sanguine ont différentes appellations. Lorsque les cellules sanguines s’agglutinent et forment une masse semi-solide attachée à un vaisseau sanguin, on parle de thrombus. Si cette masse se détache du vaisseau sanguin, il s’agit alors d’un caillot sanguin. Cette distinction, bien que mineure, est importante. Prenons l’exemple où du sang est laissé dans un tube à essai et coagule pour former une masse semi-solide. Dans ce cas, on parle de caillot sanguin (et non de thrombus), car il n’est pas attaché à un vaisseau sanguin. Un caillot sanguin est également un exemple précis d’embole, c’est-à-dire une substance qui se déplace dans la circulation sanguine et peut provoquer un blocage. Les caillots sanguins, les bulles de gaz, les agrégats de cholestérol ou les corps étrangers sont tous susceptibles de constituer des emboles dans le flux sanguin.
Dans certaines situations, il est nécessaire de bloquer la circulation sanguine, surtout lorsque le système circulatoire est endommagé et qu’une hémorragie survient. Dans ce cas, l’organisme dispose d’un mécanisme de réponse pour limiter les saignements et réparer les dommages. Ce processus se déroule en deux étapes : l’hémostase primaire, au cours de laquelle les plaquettes se rassemblent dans la région endommagée et commencent à adhérer les unes aux autres, et l’hémostase secondaire (ou coagulation), au cours de laquelle un réseau de protéines, principalement une protéine appelée fibrine, se forme pour maintenir les plaquettes ensemble. Au cours de la coagulation, des brins de fibrine s’enroulent autour du clou plaquettaire qui se forme lors de l’hémostase primaire et deviennent insolubles (sous l’action du facteur FXIIIa), permettant l’arrêt du saignement.
2.1.2 Cascade de coagulation
La coagulation du sang est contrôlée par des « facteurs de coagulation » de la voie biochimique connue sous le nom de cascade de coagulation. Au total, il existe 12 facteurs de coagulation désignés par des chiffres romains (I, II, III, IV, V, VII, VIII, IX, X, XI, XII et XIII). À noter qu’il n’y a pas de facteur de coagulation VI. En effet, ces protéines sont numérotées dans l’ordre de leur découverte, et la protéine initialement identifiée comme facteur de coagulation VI a ensuite été reconnue comme une variante du facteur de coagulation V. Fait important, les facteurs de coagulation existent sous deux formes : une forme active et une forme inactive. La forme active est identifiée par la lettre « a » minuscule suivant le chiffre romain. En plus de cette convention de dénomination, les formes active et inactive de chacun des facteurs portent des noms communs qui sont répertoriés dans la Figure 2.1.
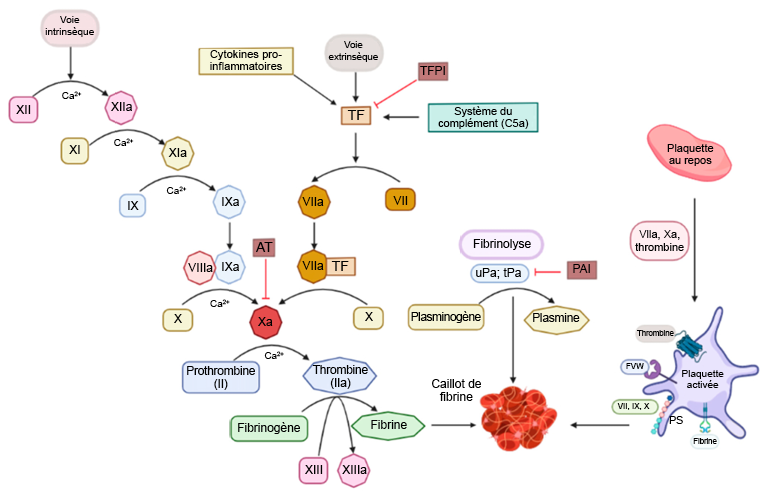
Ces facteurs interviennent tous dans la cascade de coagulation, dont l’objectif final est de générer une protéine de fibrine (facteur Ia) pour la formation d’un réseau insoluble. Plusieurs de ces facteurs sont des enzymes à activité sérine-protéase qui clivent et activent le facteur en aval. Le processus biochimique de la cascade complète est complexe et peut être déclenché par une lésion interne de l’endothélium vasculaire (voie intrinsèque) ou un traumatisme externe (voie extrinsèque). Néanmoins, les deux voies convergent vers l’activation du facteur X en Xa, ce qui entraîne ensuite l’activation de la thrombine (IIa) et de la fibrine (Ia). Cette voie est également naturellement régulée par la protéine antithrombine. Cette protéine peut se lier à la thrombine (IIa) et bloquer aussi le facteur Xa.
L’objectif des traitements anticoagulants est d’interférer dans l’un des processus de la cascade de coagulation afin d’empêcher la formation de fibrine. Ce mécanisme est commun à tous les anticoagulants actuellement offerts sur le marché.
2.2 Traitements anticoagulants
2.2.1 Warfarine
La warfarine, un anticoagulant approuvé en 1954, bénéficie d’une abondante documentation clinique concernant son utilisation chez de nombreux patients. La warfarine est donc l’anticoagulant le plus simple à prescrire d’un point de vue clinique. Elle cible les facteurs X et II (prothrombine), mais bloque également les facteurs IX et VII, ce qui lui confère des effets anticoagulants très puissants. Ces effets d’inhibition multiples résultent de la nécessité pour ces enzymes de se lier au Ca2+. La warfarine perturbe la synthèse normale de ces facteurs, les empêchant ainsi de se lier au Ca2+ dans une voie complexe.
2.2.1.1 La warfarine inhibe le VKORC, entraînant des effets en cascade sur les facteurs de coagulation
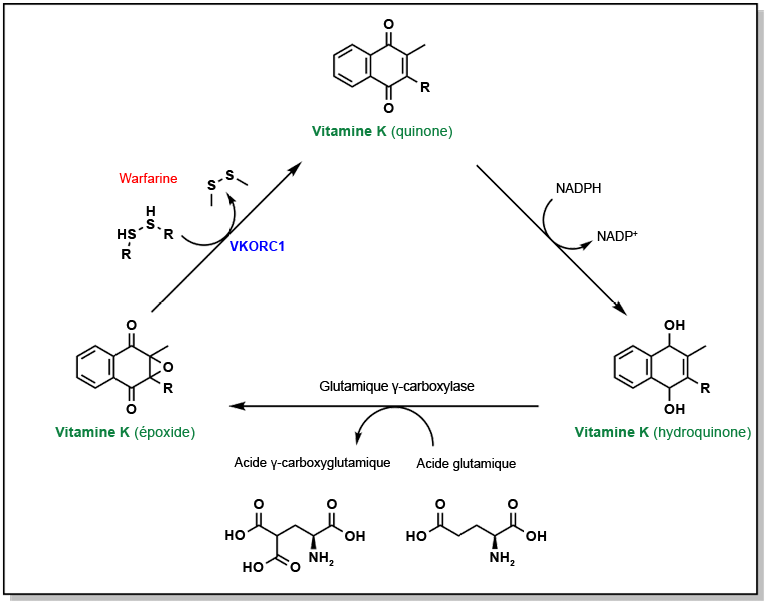
La liaison de l’ion calcium aux facteurs de coagulation se produit selon un mode de liaison unique. Les facteurs de coagulation X, II, IX et VII possèdent tous un acide glutamique donné dont la chaîne latérale est convertie en acide dicarboxylique. Contrairement aux chaînes latérales normales de l’acide glutamique qui ne comportent qu’une seule fonction acide, cet acide aminé modifié possède deux groupes carboxyliques qui lui permettent de chélater l’ion Ca2+. La décarboxylation est un processus dépendant de la vitamine K catalysé par l’enzyme gamma-glutamyl carboxylase. Au cours de ce processus, la vitamine K, sous forme d’hydroquinone, est convertie en époxyde, créant ainsi un dérivé inactif de vitamine K. Pour décarboxyler un nouvel acide glutamique, la vitamine K doit se régénérer. Cette régénération est assurée par une enzyme appelée sous-unité 1 du complexe vitamine K époxyde réductase (VKORC1). La warfarine peut se lier de manière compétitive au site actif du VKORC1 et bloquer cette réaction, empêchant ainsi la régénération de la vitamine K (Figure 2.2).
2.2.1.2 Propriétés de la warfarine
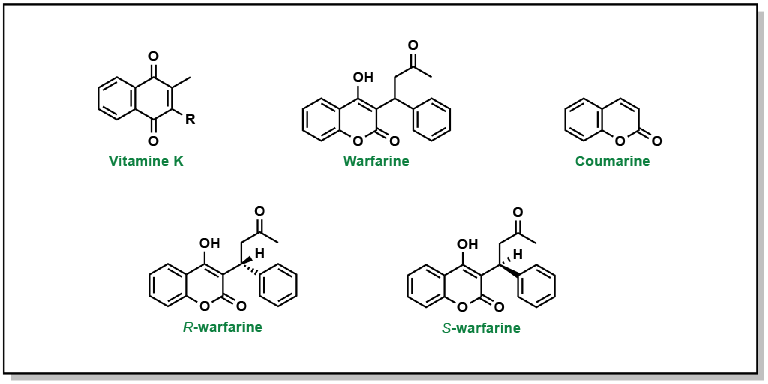
La vitamine K est une quinone (cycle à 6 chaînons insaturés conjugué à deux groupes carbonyles). Il existe deux variantes de la vitamine K chez l’homme, selon le niveau de saturation de la queue hydrophobe. La warfarine délogera de manière compétitive la vitamine K du site actif de VKORC1. Contrairement à la vitamine K, la warfarine a une structure coumarine (Figure 2.3) et surtout, elle possède un centre stéréogène générant deux molécules chirales différentes (R-warfarine et S-warfarine). L’énantiomère S est environ cinq fois plus actif, bien que le médicament pharmaceutique soit délivré sous la forme d’un mélange racémique (concentrations égales des deux énantiomères).
La warfarine peut être administrée par voie orale et présente une biodisponibilité supérieure à 99 %. Cela signifie que presque la totalité du médicament ingéré sera absorbée et circulera dans le sang sans être dégradée ou métabolisée (ce qui est inhabituel pour un médicament administré par voie orale). De plus, la warfarine possède une demi-vie relativement longue dans l’organisme (supérieure à 40 heures). Cependant, il s’agit également d’un médicament à action lente, c’est-à-dire qu’il faut environ trois à quatre jours pour observer ses effets. En effet, le mécanisme d’action de la warfarine consiste à bloquer la synthèse de nouveaux facteurs de coagulation, de sorte qu’elle n’aura pas d’effet sur les protéines actuelles. Par conséquent, les facteurs de coagulation préexistants doivent compléter leur cycle de vie normal dans l’organisme avant que les effets de la warfarine ne deviennent apparents. Généralement, le renouvellement des facteurs se produit à l’intérieur de trois à quatre jours. La warfarine est également tératogène et traverse le placenta; elle ne doit donc pas être utilisée en cas de grossesses.
La posologie de ce médicament peut être un processus complexe, car il peut y avoir une grande variabilité entre différents individus, allant jusqu’à 20 fois dans les cas extrêmes. D’un point de vue nutritionnel, la warfarine, en tant qu’inhibiteur compétitif de la vitamine K, peut voir ses effets réduits par la consommation d’aliments riches en vitamine K, tels que les légumes verts à feuilles. Pour cette raison, il est fréquemment conseillé aux patients de maintenir une consommation régulière de légumes verts dans leur alimentation. On évite ainsi les fluctuations constantes dans la posologie de la warfarine. La métabolisation de la warfarine par l’enzyme CYP2CP est un autre élément de variabilité dont les isoformes génétiques présentes chez certaines populations diffèrent. Ces isoformes métabolisent la warfarine à des vitesses différentes. Par exemple, CYP2C9*2 (variant R144C) et CYP2C9*3 (variant I359L) entraînent une réduction significative de l’activité métabolique. En tenant compte de tous ces éléments, il est essentiel de surveiller attentivement le dosage de la warfarine et de l’ajuster au besoin. On procède par un test RIN (rapport international normalisé), qui fournit une mesure quantitative de la vitesse à laquelle le sang coagule chez un patient.
2.2.2 Héparines
Après la warfarine, les héparines sont devenues le deuxième anticoagulant le plus fréquemment utilisé. Contrairement à la warfarine, qui est un inhibiteur à petite molécule et qui n’existe pas à l’état naturel dans l’organisme, l’héparine est un dérivé du sucre présent naturellement. La structure de l’héparine se compose d’une séquence spécifique de cinq monomères d’hydrates de carbone (séquence pentasaccharidique) suivie de monomères d’hydrates de carbone supplémentaires de longueur variable. L’héparine naturelle est composée par l’ensemble de ces sucres comportant des queues glucidiques de différentes tailles et longueurs.
La principale cible de l’héparine est la protéine antithrombine. Rappelons que l’antithrombine régule l’activité de la thrombine (facteur IIa) et du facteur Xa (Figure 2.1). Cette fonction est assurée par la séquence pentasaccharidique conservée que l’on trouve sur toutes les molécules d’héparine et qui se lie à l’antithrombine. Cette liaison déclenche un changement de conformation du site actif de l’antithrombine qui lui permet de se lier soit au facteur Xa, soit au facteur IIa (les sites de liaison étant similaires sur les deux protéines) (Figure 2.4). Lorsque l’antithrombine se lie à la thrombine (facteur IIa), l’héparine peut envelopper l’antithrombine dans un processus de « formation de ponts » et interagir la protéine thrombine liée. Cette fonction de formation de ponts bloque plus efficacement la protéine, à condition que l’héparine soit suffisamment longue (c’est-à-dire, qu’elle possède au moins 13 molécules de sucre). Cette deuxième interaction de formation de ponts est généralement nécessaire pour que l’héparine inhibe totalement l’activité de la thrombine. Cependant, ce site d’interaction n’existe pas entre l’héparine et le facteur Xa, quelle que soit la longueur de la molécule d’héparine. Comme l’héparine existe sous forme de polymère de taille variable (molécules de sucre), différentes variantes sont utilisées en clinique, chacune ayant des effets thérapeutiques donnés.
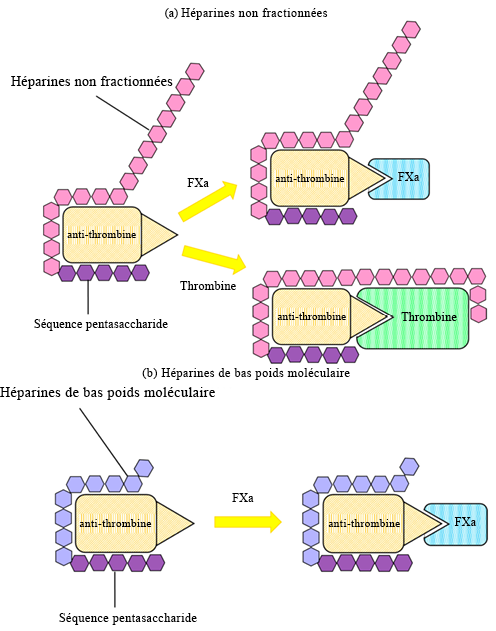
2.2.2.1 Héparines non fractionnées
L’héparine non fractionnée (HNF) est extraite du sang de porc et contient un mélange complet de molécules de sucres. Le poids moléculaire de chaque molécule d’héparine se situe entre 5 000 et 15 000 Da. Cette héparine est plus facile à produire, car il y a moins d’étapes de purification. De plus, comme ce mélange contient à la fois des molécules d’héparine courtes et longues, il inhibe efficacement la thrombine et le facteur Xa. Cependant, la diversité des tailles moléculaires entraîne une variabilité des profils pharmacocinétiques à la suite de l’administration de ce mélange.
2.2.2.2 Héparines de bas poids moléculaire
Pour compenser la variabilité des profils pharmacocinétiques, l’héparine peut être purifiée davantage pour obtenir un mélange plus homogène. L’héparine de bas poids moléculaire (HBPM) ne contient que des molécules de poids moléculaire inférieur à 8 000 Da, ce qui améliore considérablement la reproductibilité et la prévisibilité du profil pharmacocinétique. Cependant, cette proportion plus importante de molécules d’héparine plus courtes entraîne également une diminution de la liaison, et donc de l’inhibition du facteur thrombine. En effet, un plus petit sous-ensemble de molécules d’héparine peut assurer la formation de ponts. Ainsi, les HBPM sont généralement moins efficaces que les HNF.
2.2.2.3 Fondaparinux
Toujours dans le but de rendre les profils pharmacocinétiques plus prévisibles, l’héparine peut être tronquée au niveau de la séquence pentasaccharide. Cette variante n’existe pas à l’état naturel et n’est produite que de manière synthétique; elle est commercialisée sous le nom de Fondaparinux. Bien qu’elle ne puisse bloquer que l’activité du facteur Xa (et non celle de la thrombine), elle demeure un inhibiteur extrêmement puissant.
2.2.2.4 Thrombocytopénie induite par l’héparine
Le rôle de l’héparine consiste à fluidifier le sang et à agir comme anticoagulant. Cependant, dans certains cas (environ 5 % des patients), l’administration d’héparine entraîne un effet contraire. Cette affection est appelée thrombocytopénie induite par l’héparine (TIH), et elle se décline en deux sous-types. La TIH de type I est généralement moins grave et survient lorsque l’héparine s’associe à une protéine chargée positivement appelée facteur plaquettaire 4 (FP4), formant ainsi un complexe antigénique IgG. Quant à elle, la TIH de type II est plus souvent une réponse à médiation immunitaire résultant de la production d’anticorps par le patient en raison d’un composant présent dans le mélange d’injection d’héparine (plus particulièrement lorsque l’HNF ou l’HBPM proviennent d’une autre espèce). Cette réaction peut mettre en jeu la vie du patient, ce dernier pouvant entrer dans un état d’hypercoagulabilité. Dans ce cas, le patient est habituellement traité avec une substance capable de neutraliser les effets de l’héparine (molécule chargée négativement). Le sulfate de protamine (un peptide cationique) est administré à cet effet. Il est important de noter qu’aucun cas de TIH n’a été observé lors de l’administration de Fondaparinux, mais qu’il n’existe pas non plus de contre-agents en cas de surdosage.
Les problèmes posés par les anticoagulants courants tels que la warfarine (qui exige un processus de personnalisation et une surveillance constante, et dont l’action est lente) et l’héparine (qui nécessite des injections et présente un risque de TIH) ont motivé la recherche de nouveaux inhibiteurs capables d’interagir avec la thrombine ou le facteur Xa. L’objectif de ces médicaments était de trouver un équilibre entre l’efficacité, la facilité d’administration et le délai d’action. Ces médicaments ont été développés sous le nom de nouveaux anticoagulants oraux (NOAC), bien que ce terme soit tombé en désuétude au profit des AOD (anticoagulants oraux directs).
2.2.3 AOD : inhibiteurs directs de la thrombine
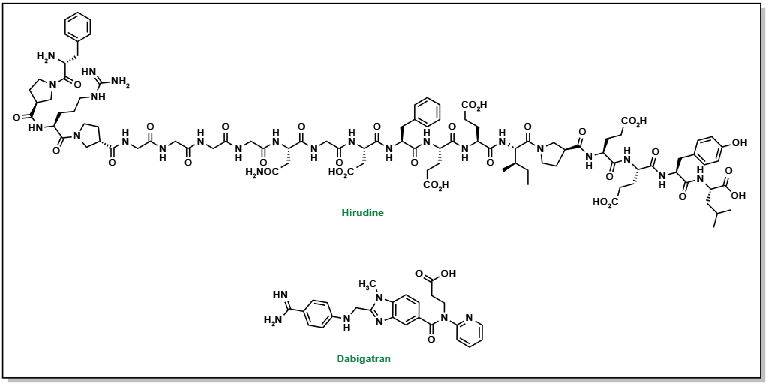
La thrombine, qui se trouve en amont de la cascade de la coagulation, possède une structure protéique connue pour comporter d’importants sites distincts dont l’exosite 1, un site actif qui se lie à la fibrine, et l’exosite 2, qui se lie à l’héparine. Les premiers inhibiteurs ont été identifiés comme des dérivés d’analogues de l’hirudine (composés isolés des glandes salivaires de la sangsue Hirudo medicinalis) qui correspondent à des peptides synthétiques d’environ 20 résidus. Ces molécules se lient directement à la thrombine en formant une structure en L, de sorte qu’elles bloquent à la fois le site actif et l’exosite 1. Bien que ces inhibiteurs soient puissants, les peptides étant de grande taille, ces molécules doivent être administrées par voie sous-cutanée. Les générations plus récentes de molécules sont actives en tant qu’agents oraux, comme le dabigatran, qui ne se lie qu’au site actif de la thrombine et contient un groupe benzamidine essentiel.
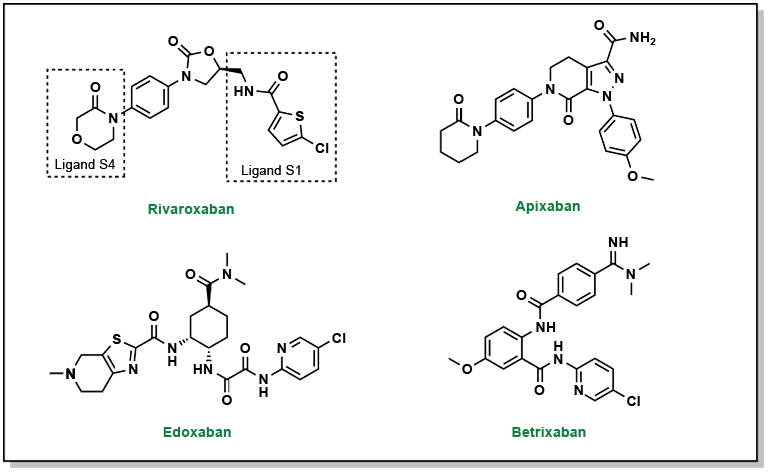
2.2.4 AOD : inhibiteurs directs du facteur Xa
Il existe également des AOD qui ciblent le facteur Xa et peuvent servir de substituts à la warfarine. Ils nécessitent moins d’essais de coagulation, ont des profils pharmacocinétiques plus prévisibles et agissent plus rapidement. Tout comme les inhibiteurs directs de la thrombine, ces molécules se lient aussi en formant une structure en L à travers quatre sous-poches du facteur Xa (appelées S1, S2, S3 et S4). Du point de vue de la nomenclature, ces médicaments sont généralement facilement reconnaissables puisqu’ils contiennent tous les lettres « Xa » dans leur nom, comme le rivaroxaban, l’aprixaban, l’edoxaban et le betrixaban (Figure 2.6). Le pharmacophore de ces inhibiteurs est moins facilement identifiable et repose sur des interactions d’empilement pi-pi entre le noyau phényle des inhibiteurs et l’indole de Trp214 sur le facteur Xa. De plus, des interactions de liaison hydrogène supplémentaires sont présentes dans l’ensemble de la molécule.
2.3 Résumé
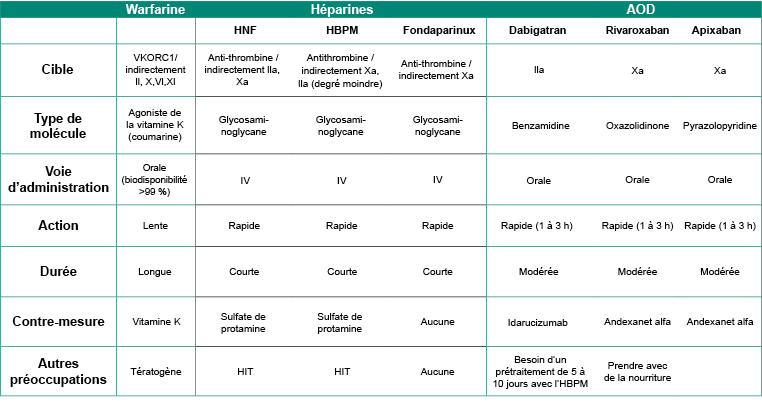
Le tableau suivant résume les propriétés importantes des médicaments anticoagulants.
Tableau 2.1 : Résumé des agents anticoagulants.