9
9
Méthodes pour l’électrophorèse SDS-PAGE
Pour préparer les échantillons d’extrait brut pour l’électrophorèse sur gel, prenez d’abord les culots cellulaires de 250 µl qui ont été conservés à -20 °C. Resuspendez les culots dans 50 µl de H2O distillée – pipetez de haut en bas et passez au vortex pour remettre en suspension la totalité du culot cellulaire. Ajoutez ensuite 50 µl de colorant SDS 2x. Assurez-vous que le colorant SDS est complètement dissous avant de l’ajouter aux échantillons, car le SDS précipite hors de la solution à basse température. Chauffer les échantillons à 100 °C pendant environ 5 à 10 minutes, en les passant au vortex au besoin pour assurer une dissolution complète. Centrifuger les échantillons à >10 000 rcf pendant 5 minutes. Une fois le gel préparé comme indiqué dans le protocole d’instructions, 20 µl du surnageant peuvent être placés dans chaque cavité du gel de polyacrylamide. N’oubliez pas d’ajouter 5 µl de marqueurs de poids moléculaire dans une cavité.
Pour effectuer l’expérience, suivez le protocole d’instructions Bio-Rad Protean II. Une fois que le front de colorant a atteint le fond du gel, coupez la tension et retirez le gel des plaques de verre. Placez le gel dans la solution de coloration bleu de Coomassie brillant G-250 dans un récipient en plastique et agitez pendant plusieurs heures (ou suivez le conseil ci-dessous). La solution de coloration peut ensuite être versée et le décolorant versé sur le gel, en agitant encore par la suite. Le décolorant peut être versé dans le conteneur à déchets prévu à cet effet sous la hotte et remplacé plusieurs fois jusqu’à ce que les bandes soient clairement visibles sur le fond du gel.
- CONSEIL : Pour accélérer le processus de coloration, puisque les étapes de coloration fonctionnent par attraction et diffusion électrostatiques, le gel (coloré ou décoloré) peut être chauffé au micro-ondes sous la hotte jusqu’à ébullition (environ 20 à 30 secondes) avant d’être placé sur l’agitateur pendant 10 minutes. Assurez-vous de porter des lunettes et des gants de protection! Ne pas laisser décolorer plus d’une nuit.
Matériel nécessaire pour la purification de la protéine de résine TALON
Préparation du tampon de purification et composants
- Tampons d’étalonnage de pH
- 5 N HCl et 8 N NaOH
- Imidazole
- NaCl
- NaH2PO4, Na2HPO4, H3PO4, sels de Na3PO4
Ressources et protocoles suggérés
- Utilisation des gels de polyacrylamide : Les ressources suivantes contiennent des renseignements utiles sur la théorie et la pratique de l’électrophorèse sur gel de protéines. Voir la page 15 pour connaître l’emplacement de ces ressources :
Le manuel Bio-Rad Mini Protean Tetra Cell (en particulier la section 4.2) contient des protocoles pour la fabrication de solutions mères pour les gels et tampons pour la SDS-PAGE en Laemmli discontinu).
Voet et Voet
Sambroo’s Molecular Cloning: A Laboratory Manual
- Préparation du tampon de purification de protéines : Le manuel des « Résines à affinité métalliques TALON » est publié sur le site du cours Canvas.
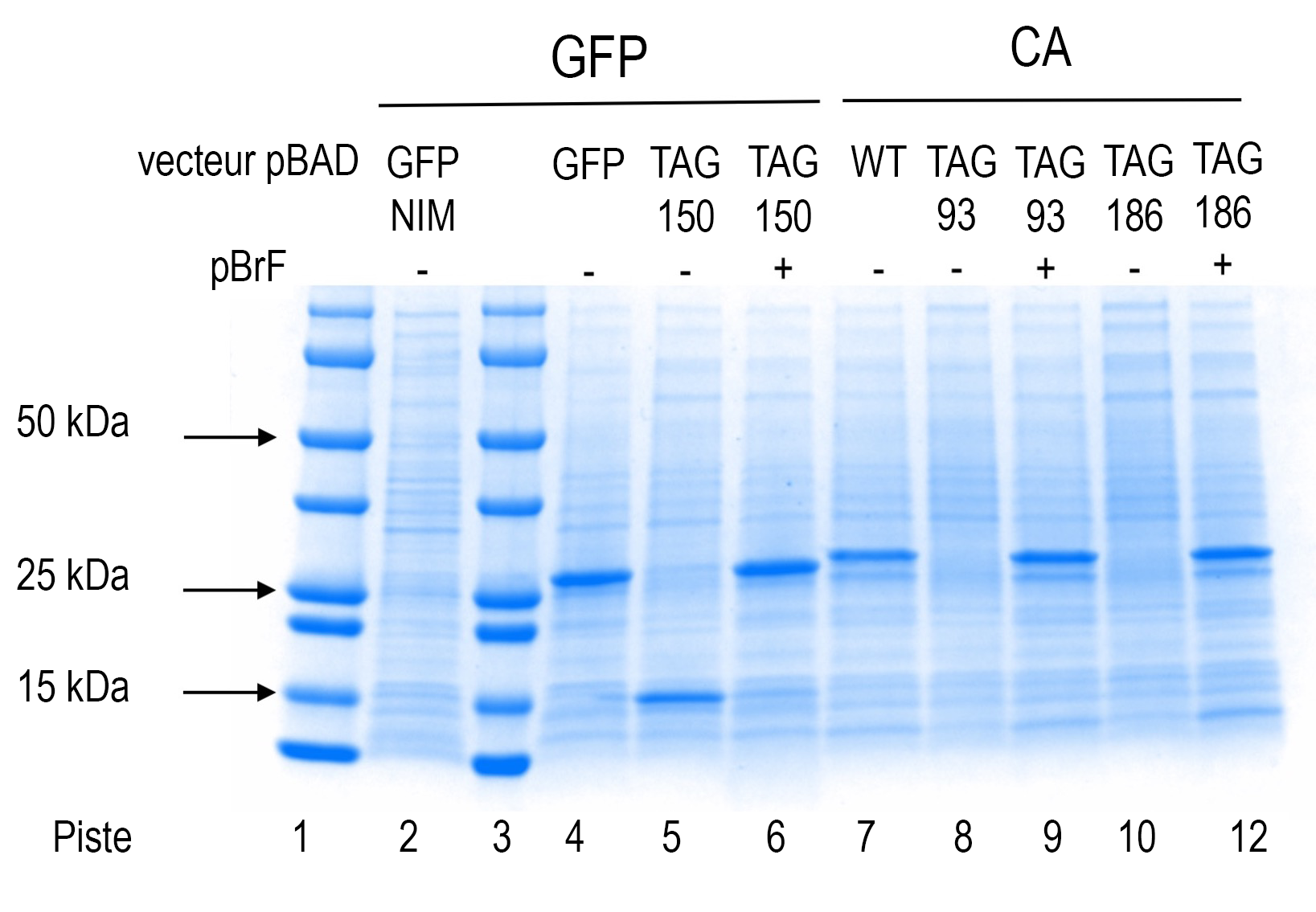
Le poids moléculaire des protéines GFP et CA est respectivement de 27 et 30 kDa.
Des contrôles positifs et négatifs de la production de protéines séparées par SDS-PAGE et colorées par colorant Coomassie sont présentés. Les pistes 1 et 3 contiennent des marqueurs de précision et des marqueurs précolorés (Bio-Rad). La piste 2 montre l’expression de la protéine à partir du plasmide indiqué pour les cellules cultivées dans un milieu non inductif (NIM). Les pistes 4 à 12 montrent les résultats de l’expression des protéines à partir des plasmides indiqués en absence ou en présence de para-bromophénylalanine (pBrF). Le produit de troncation GFP150 est visible dans la piste 5 à un poids moléculaire estimé à 15 kDa.


