Chapitre 3 : Récepteurs couplés aux protéines G (RCPG) dans les voies de signalisation
3.1 Introduction
Les RCPG sont un groupe de récepteurs qui jouent un rôle physiologique important dans les processus biologiques, répondant à des signaux comme les composés aromatiques, les neurotransmetteurs, les hormones et même la lumière. Ces stimuli sont relayés en réponse à l’intérieur de la cellule. Contrairement aux RTK, les RCPG activent les protéines G (protéines de liaison aux nucléotides de guanine), qui forment également la base de leur nom. Ce module portera sur les aspects structurels et fonctionnels des RCPG.
3.2 Résultats d’apprentissage du chapitre
À la fin de ce chapitre, vous pourrez :
- décrire la structure des RCPG;
- expliquer comment les propriétés structurelles dictent l’isolement des RCPG;
- faire la distinction entre deux catégories de protéines G;
- décrire la composition de la sous-unité des protéines G hétérotrimériques;
- démontrer comment la sous-unité alpha (α) des protéines G fonctionne à la manière d’une séquence activatrice;
- décrire les étapes générales de la voie de signalisation des RCPG;
- faire la différence entre le premier et le second messager, en donnant un exemple pour chacun d’eux;
- illustrer les effets en aval dans la voie du RCPG;
- dresser la liste de réactions catalysées par l’adénylcyclase;
- décrire comment l’enzyme adénylcyclase peut réguler l’expression génique;
- interpréter les voies de signalisation.
3.3 Propriétés structurelles et fonctionnelles des RCPG
3.3.1 Décrire la structure canonique des RCPG.
Les RCPG sont des protéines intégrales (semblables aux récepteurs couplés à des enzymes ou aux RTK) qui sont intégrées à la membrane cellulaire. La structure classique des RCPG se compose de sept hélices α transmembranaires (numérotées de H1 à H7) (figure 3.1). Les parties hélicoïdes sont reliées par des boucles extracellulaires ou intracellulaires. Les ligands peuvent coopérer avec un RCPG en se liant à la partie extracellulaire (située près de l’extrémité N-terminale). L’extrémité C-terminale (partie carboxyle), qui est située dans le cytosol, contient également une hélice α (H8) supplémentaire. Il importe de noter que les RCPG sont également associés à un domaine de liaison des protéines G dans la région cytosolique.
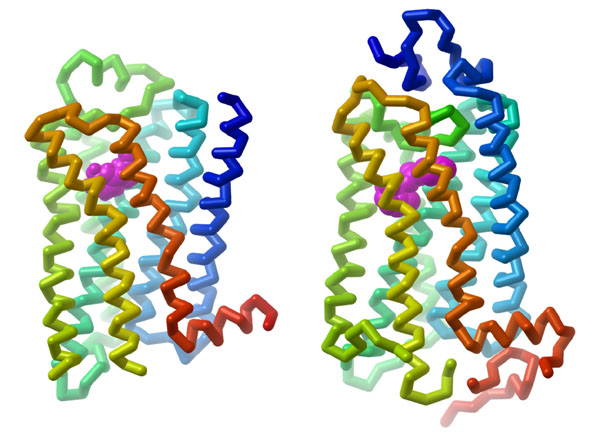
3.3.2 Selon leurs propriétés structurelles, lequel des réactifs suivants serait le plus efficace pour isoler les RCPG de la membrane cellulaire?
a. Des traitements à l’aide de lipides et de détergents (p. ex., dodécylsulfate de sodium [DSS]).
b. Une incubation avec une solution à faible concentration en sel (p. ex., chlorure de sodium).
c. Une augmentation du pH du tampon alcalin.
Étant donné que les RCPG contiennent plusieurs hélices transmembranaires, ils ont besoin d’un environnement hydrophobe pour préserver leur intégrité structurelle. En raison de la nature des protéines (étroitement associées à la membrane), le traitement à l’aide de détergents ou de bicelles lipidiques peut permettre d’isoler les RCPG (Weis et Kobilka, 2018). Les détergents contenant des régions hydrophobiques peuvent interagir avec la membrane et les hélices transmembranaires. Cette interaction permet d’éliminer le RCPG de la membrane tout en en maintenant la structure globale en la capturant dans une particule contenant des lipides.
3.3.3 Laquelle des techniques suivantes est préférable pour déterminer la structure de l’adrénorécepteur?
a. Radiocristallographie
b. Microscopie par fluorescence
c. Analyse calorimétrique différentielle
La radiocristallographie est une technique biophysique courante qui révèle la structure protéique avec une résolution de niveau atomique. Cette technique utilise un faisceau concentré de rayons X dirigé vers un « cristal » de protéine. Les rayons X sont diffractés lorsqu’ils traversent le cristal et produisent un diagramme de diffraction précis (ou une ombre). Ce diagramme de diffraction peut être déconvolué mathématiquement dans le but de déterminer la position des différents atomes dans le cristal, qui fournit la structure tridimensionnelle de la protéine.
Une protéine se « cristallise » lorsque l’eau est retirée de l’échantillon de protéine d’une manière bien précise. Expérimentalement, ce procédé peut s’avérer extrêmement difficile, mais il s’agit d’une technique puissante qui fournit des images haute résolution des atomes de la protéine. Chaque protéine produit un cristal unique qui dépend de sa structure tridimensionnelle.
3.3.4 Dresser la liste des ligands courants qui activent les RCPG.
Il existe un nombre diversifié de ligands qui peuvent activer les RCPG, notamment des peptides, des nucléotides et des photons bien précis. Toutefois, les RCPG possèdent également une activité endogène, bien qu’elle se produise à un niveau inférieur à celui d’un ligand. Les ligands qui favorisent l’activité des RCPG au-dessus de l’état basal sont appelés agonistes (Weis et Kobilka, 2018). Certains ligands peuvent se lier à un RCPG et bloquer la réponse; c’est alors qu’on les appelle antagonistes.
Le protéome humain contient plus de 900 RCPG et chacun d’eux a un ligand différent (Gaitonde et González-Maeso, 2017). De plus, les RCPG constituent des cibles pour environ 30 % de tous les médicaments offerts sur le marché (Hauser et coll., 2017). Entre autres exemples précis de ligands endogènes du RCPG, on compte l’adrénaline, la noradrénaline, l’histamine, le glucagon, la calcitonine, l’oxytocine et la neurokinine.
3.3.5 Où se trouve le site de liaison des ligands sur les RCPG?
Les ligands tels que les peptides se lient à proximité de l’extrémité amino-terminale ou des boucles extracellulaires. Inversement, les petits ligands se lient dans la région transmembranaire des heptahélices (Calebiro et coll., 2021).
3.4 Voies de signalisation entraînées par les RCPG
3.4.1 Décrire les caractéristiques d’une protéine G et son lien avec un RCPG.
Les protéines G sont des protéines de liaison aux nucléotides de guanine qui agissent comme protéines de signalisation intermédiaires entre les RCPG et les seconds messagers. Ces protéines peuvent se lier à la fois à la GTP et au GDP, ce qui détermine si elles sont actives (liées à la GTP) ou inactives (liées au GDP).
Les protéines G peuvent se diviser en deux catégories : i) petites protéines G monomériques et ii) grosses protéines G hétérotrimériques. Les grosses protéines G hétérotrimériques se composent de trois sous-unités protéiques différentes : α (Gα), β (Gβ) et γ (Gγ). Les sous-unités α et γ sont reliées à la membrane par des ancres lipidiques (qui sont de longues queues hydrophobes qui interagissent avec la membrane). Les trois sous-unités existent dans un complexe trimère, y compris une molécule GDP liée à la sous-unité Gα. Lors de l’activation du RCPG (liaison du ligand), le GDP est remplacé par une GTP. Cet échange entraîne la dissociation de la sous-unité Gα des sous-unités Gβ et Gγ. Les sous-unités α et βγ peuvent s’associer à des protéines supplémentaires pour faciliter la transduction de signal.
Les RCPG peuvent également s’associer aux petites protéines G. Ces protéines ressemblent davantage aux sous-unités Gα des protéines G hétérotrimériques et ont également la capacité de se lier à la GTP et au GDP. Les petites protéines G sont généralement reconnues comme des GTPases RAS.
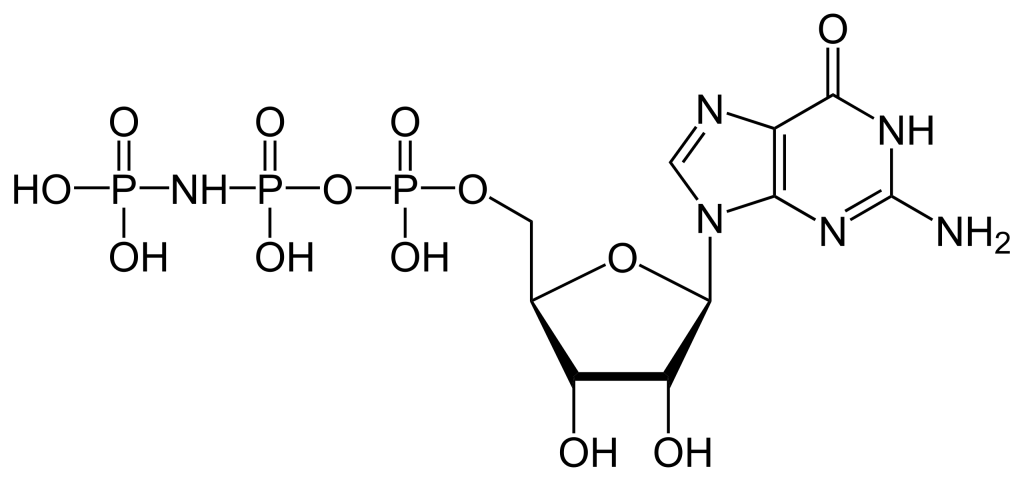
3.4.2 Prédire une conséquence potentielle pour le RCPG advenant qu’un analogue non hydrolysable (comme le GMP·PNP) soit présent en fortes concentrations à l’intérieur de la cellule comparativement à la GTP.
a. La sous-unité Gα pourrait se lier au GMP·PNP, mais elle ne produirait pas d’hydrolyse. Par conséquent, la sous-unité Gα demeurerait à l’état actif.
b. La sous-unité Gα serait en mesure de se lier au GMP·PNP et finalement de se convertir en GMP. Par conséquent, la sous-unité Gα passerait à l’état inactif.
La sous-unité α de la protéine G hétérotrimérique possède un site de liaison du nucléotide guanine. Par conséquent, la sous-unité α peut se lier au GMP·PNP surtout si la concentration est plus élevée que celle de la GTP (Maegley et coll., 1996) (figure 3.2).
Normalement, lorsque le complexe αβγ est lié au GDP, il en résulte un état inactif. Ensemble, les sous-unités βγ stabilisent la sous-unité α à l’état inactif. Lorsque le complexe αβγ est lié à la GTP, il en résulte un état actif, menant finalement à la dissociation de la sous-unité Gα.
3.4.3 Quelle sous-unité de la protéine G agit comme séquence activatrice?
a. Gα
b. Gβ
c. Gγ
La sous-unité Gα fonctionne comme une séquence activatrice possédant un domaine GTPase.
3.4.4 À quel composant faisons-nous référence lorsque nous parlons du GEF?
a. RCPG
b. Gα
c. Gβ
d. Gγ
Un GEF représente un facteur d’échange des nucléotides guanyliques qui permet le remplacement du GDP par la GTP pour favoriser l’activation du RCPG. Pendant que le RCPG signale la voie, un ligand se lie au récepteur à la surface extracellulaire. Cette action déclenche un changement conformationnel qui se propage à travers les hélices transmembranaires et entraîne l’activité du GEF du côté intracellulaire du RCPG. Par conséquent, le RCPG activé permet de remplacer le GDP par la GTP à la sous-unité Gα, ce qui entraîne l’activation de cette dernière.
3.4.5 Décrire le mécanisme de signalisation pour le RCPG représentant.
En période de stress, le corps peut réagir en libérant des hormones telles que l’adrénaline (aussi appelée épinéphrine), ce qui permet de venir à bout d’une réponse appropriée aux signaux externes comme la réaction d’attaque-fuite.
Le signal hormonal (adrénaline) se lie à l’adrénorécepteur, ce qui entraîne un changement conformationnel (figure 3.3). Le récepteur s’associe et se lie à la protéine G située dans l’espace cytoplasmique. La sous-unité Gα (illustrée en orange) est associée au GDP, la liaison au RCPG actif déclenche l’activité du GEF et le GDP est remplacé par la GTP. La liaison à la GTP entraîne la dissociation des sous-unités Gα et Gβγ (illustrées en jaune et en vert). La sous-unité Gα dissociée (liée à la GTP) interagit avec un effecteur, comme une kinase, pour stimuler un effet en aval. Dans cette voie, l’effecteur est l’enzyme, l’adénylcyclase (AC), une protéine transmembranaire illustrée en bleu.
L’adénylcyclase catalyse la conversion de l’ATP en AMPc, qui est une puissante molécule de signalisation, appelée second messager (figure 3.3). À mesure qu’augmentent les niveaux du second messager dans le cytoplasme, l’AMPc interagit avec un certain nombre de protéines, dont la protéine kinase A (PKA). Le nucléotide AMPc active la PKA, qui phosphoryle par la suite un certain nombre de protéines cibles, entraînant l’activation de plusieurs protéines participant au métabolisme du glucose et des lipides et fournissant ainsi plus d’énergie au corps.
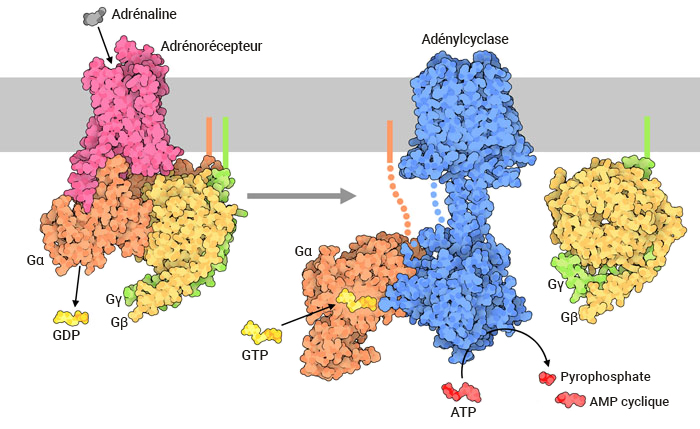
3.4.6 Quelle réaction l’enzyme adénylcyclase catalyse-t-il?
L’enzyme adénylcyclase, ou adénylate cyclase, est analogue à la guanylyl cyclase. Il catalyse la conversion de l’ATP en version cyclisée (AMP cyclique – AMPc). Une molécule de pyrophosphate est également libérée (figure 3.3).
3.4.7 Faire la différence entre un premier messager et un second messager.
Le signal extracellulaire est un exemple de premier messager, tandis que les seconds messagers font généralement partie des événements de signalisation en aval. Par exemple, le ligand qui se lie à un RCPG (comme l’adrénaline) est classé comme premier messager. Le premier messager ne traverse généralement pas la membrane cellulaire. Une fois que le premier messager se lie à une cible (comme un RCPG), le signal est transmis à une autre molécule. Dans le cas de l’adrénaline et de l’adrénorécepteur, l’AMPc qui est produite constitue un exemple de second messager. Outre les petites molécules diffusibles, les ions sont un autre exemple courant de seconds messagers. Le processus de conversion d’un signal à un autre est appelé transduction de signal. Ce processus facilite les réponses à différents stimuli. Il importe de noter que le premier messager peut déclencher la production ou la libération de plusieurs molécules de second messager, ce qui amplifie considérablement le signal.
3.4.8 Pourquoi la PKA est-elle également appelée protéine kinase AMPc-dépendante?
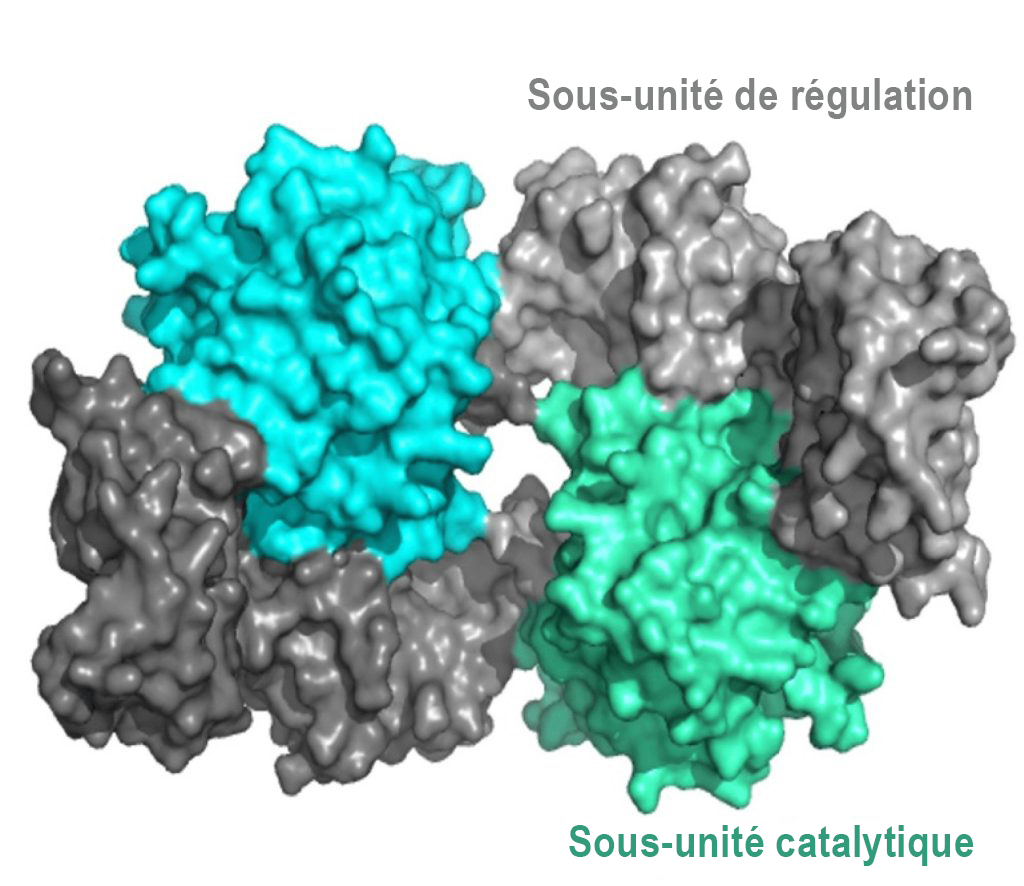
Le mécanisme de régulation servant à l’activation de la PKA fait appel aux molécules AMPc. Structurellement parlant, la PKA est un hétérotétramère composé de deux sous-unités catalytiques et de deux sous-unités de régulation (figure 3.4). Les sous-unités catalytiques hébergent le site actif de la phosphorylation des protéines (et se lient à l’ATP et au substrat), ainsi qu’un domaine de liaison de la sous-unité de régulation. Les sous-unités de régulation possèdent un domaine auto-inhibiteur (qui agit comme un substrat analogique pour se lier à l’activité kinase de la sous-unité catalytique, et inhiber celle-ci), ainsi qu’un domaine de liaison de l’AMPc et un domaine de dimérisation. Les sous-unités de régulation existent sous différents isoformes, et la dimérisation peut être covalente par l’entremise de ponts disulfures ou non covalente.
En l’absence (ou en raison d’une faible concentration) d’AMPc, le dimère de la sous-unité de régulation est associé aux sous-unités catalytiques de la PKA, qui maintiennent les protéines dans une conformation inactive. En présence d’AMPc (ou de concentrations croissantes), l’AMPc se lie aux sous-unités de régulation du domaine de liaison de l’AMPc, entraînant une modulation allostérique et la dissociation des sous-unités catalytiques. Les sous-unités catalytiques de la PKA qui sont libres peuvent maintenant se lier et phosphoryler les cibles de la cellule en aval.
3.4.9 Quels acides aminés sont phosphorylés par la PKA sur les protéines cibles correspondantes?
a. Sérine
b. Thréonine
c. Tyrosine
d. a et b
La PKA est une sérine/thréonine kinase. Cependant, la PKA se situe souvent dans la membrane cellulaire en raison de son association à une protéine d’échafaudage, la protéine kinase A d’ancrage (AKAP) (figure 3.5) (Welsh et coll., 2023). Dans certains cas, cela introduit une couche de ciblage spatial pour la kinase et un autre mécanisme de régulation.
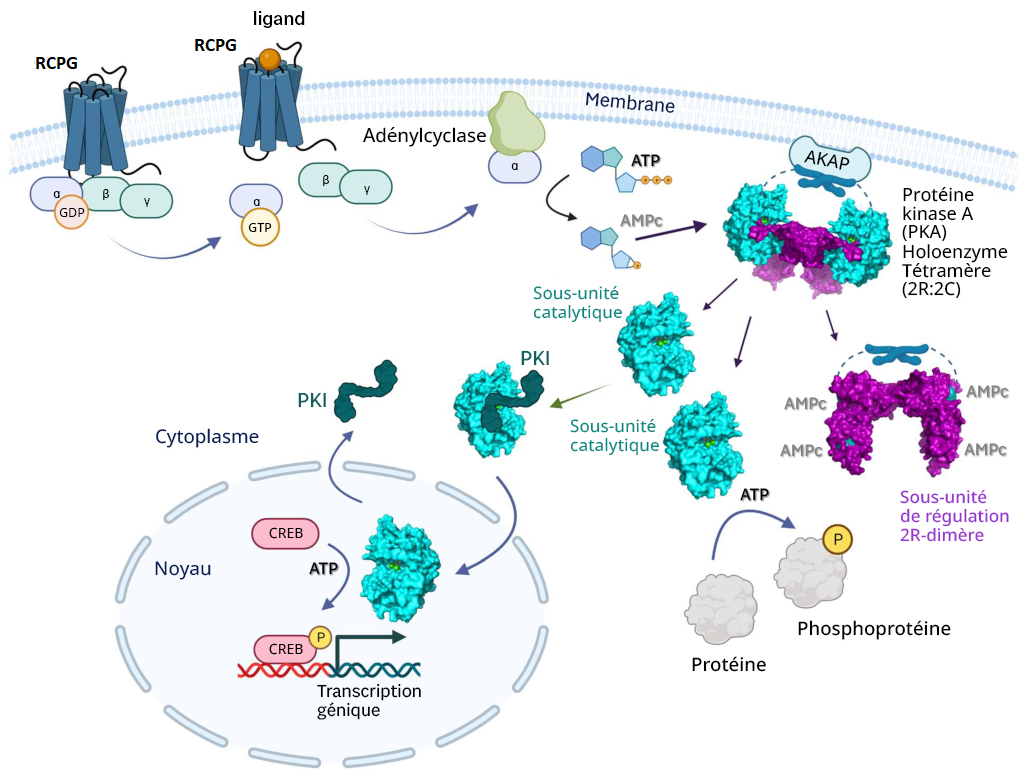
3.4.10 Comment l’AC est-elle liée à la régulation de l’expression génique?
L’adénylcyclase entraîne une augmentation de la production d’AMPc, qui (comme nous l’avons décrit ci-dessus) active la PKA. Il se peut que les sous-unités catalytiques de la PKA ne soient plus ancrées à la membrane (si elles ne sont pas associées aux protéines d’ancrage lipidiques) et qu’elles puissent se diffuser dans d’autres régions de la cellule. Cela comprend la capacité d’entrer dans le noyau et de réguler l’expression génique. À l’intérieur du noyau, la PKA phosphoryle une sérine sur différents facteurs de transcription tels que la protéine se liant au CRE (CREB) (figure 3.5). La CREB peut se lier à une autre protéine CBP (protéine se liant au CREB) et le complexe CREB/CBP se lie au CRE (élément de réponse à l’AMPc), une séquence d’ADN qui flanque les gènes sous son contrôle, y compris les neuropeptides (p. ex., somatostatine, enképhaline), la tyrosine-hydroxylase et les autres protéines impliquées dans les rythmes circadiens (Montminy et coll., 1990).
3.4.11 Qu’est-ce qu’une protéine effectrice?
Il s’agit de protéines en aval de la voie modifiée par le signal. Par exemple, un RCPG n’est généralement pas une protéine effectrice, mais l’adénylcyclase en est une. L’adénylcyclase exécute l’activité en aval et réalise l’« effet » du signal original (événement de liaison au ligand).
3.4.12 Comment la sous-unité α peut-elle influer sur l’activité de l’effecteur en aval, l’adénylcyclase?
Il existe une variété de sous-unités α responsables de différentes réactions physiologiques. Par exemple, les protéines αs (aussi appelées Gαs) stimulent l’enzyme adénylcyclase. Inversement, la sous-unité α de la protéine G inhibitrice (αi ou Gαi) se lie à l’enzyme adénylcyclase, et inhibe celle-ci.
3.4.13 Comment les RCPG sont-ils liés à une réponse cellulaire différente, comme l’ouverture de canaux Ca2+?
À l’instar de l’adrénorécepteur β (où l’adrénaline active le RCPG), différents ligands (comme l’hormone angiotensine II) se lient et activent différents types de RCPG (comme l’AT1 ou l’AT2). Comme nous l’avons déjà décrit, au moment de la liaison, de l’activation et de l’échange de la GTP par le RCPG, la sous-unité α de la protéine G liée à la GTP se dissocie du complexe βγ. La sous-unité Gα se lie et active l’enzyme PLC ou phospholipase C (la protéine effectrice). La PLC divise la phosphatidylinositol 4,5-bisphosphate (PIP2 ou PI[4,5] P2) en principaux produits, le diacylglycérol (DAG) et l’inositol 1,4,5-trisphosphate (IP3) (Kadamur et Ross, 2013).
Le destin de ces deux produits a des effets importants sur la cellule. L’IP3 se lie aux canaux calciques de libération Ca2+ sensible à l’IP3 sur la membrane du réticulum endoplasmique (RE), ce qui en entraîne l’ouverture Le Ca2+ emmagasiné dans le RE est libéré dans le cytosol et peut se lier à un certain nombre de protéines cibles, dont la protéine kinase C (PKC).
Le DAG est un autre produit découlant de l’action enzymatique de la PLC. Le DAG est intégré dans le feuillet valvulaire interne de la membrane cellulaire. Le DAG active la PKC, qui phosphoryle diverses cibles sur les résidus de la sérine et de la thréonine. La PKC liée au Ca2+ est capable de fonctionner avec le DAG par l’intermédiaire de son domaine de liaison au DAG (figure 3.6).
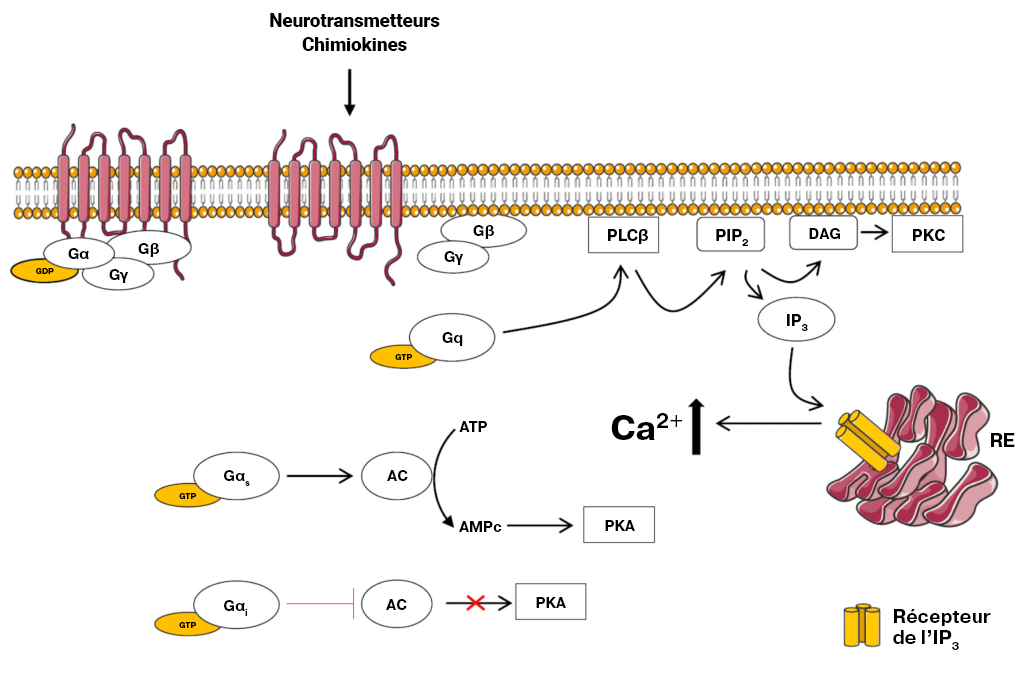
3.4.14 Où se trouve le substrat PIP2?
Souvenez-vous que la structure de la membrane cellulaire est une bicouche lipidique composée d’une membrane ou d’un feuillet valvulaire intérieur et extérieur. Le PIP2 se trouve sur le feuillet valvulaire de la membrane intérieure.
3.4.15 La PLC a été classée comme étant l’effecteur dans cette voie. Quel est le second messager?
a. L’IP3
b. Le DAG
c. a et b
L’IP3 et le DAG sont des exemples de seconds messagers, dont la concentration cellulaire augmente en réaction à l’activation de la voie de signalisation du RCPG.
3.5 Les voies de signalisation biochimique sont interconnectées.
Cela signifie simplement que les voies de signalisation sont souvent introduites sous forme de voies linéaires qui fonctionnent à la fois de façon séquentielle et isolée. Toutefois, c’est rarement le cas et les voies de signalisation sont souvent interconnectées et entraînent une régulation à la hausse et une régulation à la baisse complexes de nombreuses protéines différentes (p. ex., figure 3.7). L’activité d’une seule cible est souvent régie par l’action consensuelle de nombreuses protéines effectrices différentes. Il existe des activateurs, des inhibiteurs, des chaperons et d’autres protéines qui agissent à titre de régulateurs à différents moments à chacune des étapes biochimiques. Cela procure un degré élevé de régulation afin de contrôler précisément le résultat physiologique provenant de la voie.
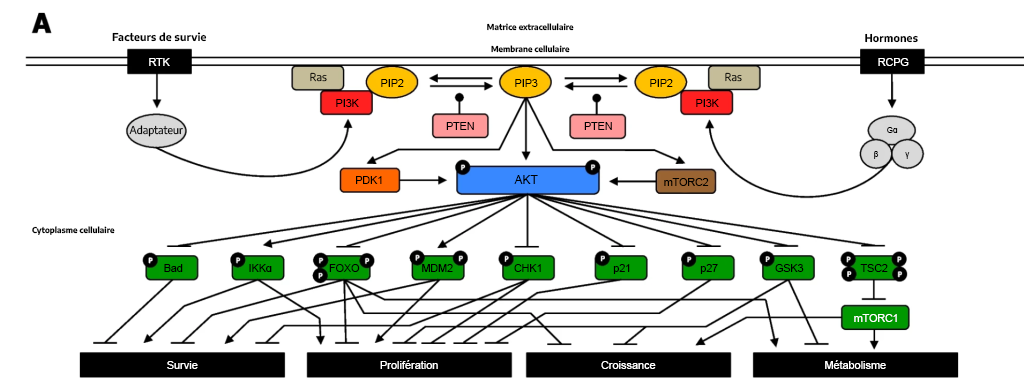
3.5.1 Examinez la figure 3.7. Que représente le P majuscule?
Le symbole P majuscule indique que la protéine est phosphorylée.
3.5.2 Lors de l’examen de la voie PI3K/Akt de la figure 3.7, notez la flèche émoussée de l’Akt (à l’état phosphorylé) à l’agoniste associé à la Bcl-2 de la protéine de mort cellulaire (Bad). Quel énoncé convient le mieux à la voie?
a. L’Akt phosphoryle la protéine Bad qui en entraîne l’inhibition.
b. L’Akt inhibe le gène Bad.
c. L’Akt phosphoryle la protéine Bad, ce qui entraîne l’activation de la Bad.
d. L’Akt active le gène Bad.
Une tête de flèche émoussée indique que l’Akt phosphorylé inhibe la protéine Bad, alors qu’une tête de flèche normale indique que la réaction se déroule normalement. L’Akt phosphoryle la protéine Bad, ce qui en entraîne l’inhibition.
3.5.3 Que représente la flèche de la figure 3.7 allant de l’Akt phosphorylé à l’IKKα?
a. L’Akt phosphoryle la protéine IKKα, l’inhibant par le fait même.
b. L’Akt inhibe le gène IKKα (gène CHUK).
c. L’Akt phosphoryle la protéine IKKα, l’activant par le fait même.
d. L’Akt active le gène IKKα (gène CHUK).
La flèche indique que l’Akt phosphoryle la protéine IKKα, activant ainsi cette dernière.
3.5.4 Décrivez la voie PI3K/Akt et son lien avec les récepteurs.
Les RTK et les RCPG participent à la régulation de la voie PI3K/Akt. Pour les deux récepteurs, le ligand apparenté peut se lier et induire un changement conformationnel qui aura des répercussions et qui convergera sur les kinases en aval, notamment la PI3K. Dans le cas des RCPG, il activera la PI3K, tandis qu’une cascade de kinases finira par entraîner l’activation de la PI3K dans les RTK.
La phosphorylation de la PI3K entraîne la formation de PIP3. Le PIP3 se lie aux protéines, y compris l’Akt (PKB) et la PDK1. L’Akt des kinases sérine et thréonine phosphoryle un certain nombre de cibles en aval, ce qui en entraîne l’activation ou l’inhibition. Cette action a une incidence sur une pléthore de processus cellulaires. L’Akt phosphoryle un éventail de protéines, comme le promoteur mort associé à Bcl-2 (Bad), les facteurs de transcription FOXO (ou tout simplement FOXO), la protéine Checkpoint kinase 1 (CHK1), le p21, le p27 et le glycogène synthase kinase 3 (GSK3), les inhibant par le fait même (figure 3.7). L’Akt phosphoryle également la protéine, la sclérose tubéreuse de Bourneville du gène TSC2 (ou tout simplement TSC2), ce qui en entraîne l’inhibition, permettant ainsi l’activation du mTORC1. Inversement, la phosphorylation de l’Akt active la IκBα kinase α (IKKα) et la murine double minute-2 (MDM2).
3.5.5 À l’aide de la figure 3.7, comment peut-on inverser l’effet des kinases?
Le phosphatase PTEN élimine les groupes de phosphate du PIP3 pour former le PIP2.
3.5.6 À la suite d’un traitement par l’inhibiteur bisperoxovanadium, quel serait l’effet sur les niveaux de phosphorylation présentés à la figure 3.7 :
a. Augmentation
b. Diminution
c. Aucune incidence sur les niveaux de phosphorylation
Le bisperoxovanadium est un inhibiteur du PTEN (Schmid et coll., 2004) qui bloquerait l’activité du phosphatase de la protéine. On prévoit que les niveaux de phosphorylation augmenteraient.
Bibliographie
Boczek, T., Mackiewicz, J., Sobolczyk, M., Wawrzyniak, J., Lisek, M., Ferenc, B., Guo, F. et Zylinska, L. « The Role of G Protein-Coupled Receptors (GPCRs) and Calcium Signaling in Schizophrenia. Focus on GPCRs Activated by Neurotransmitters and Chemokines », Cells, 10(5). https://doi.org/10.3390/cells10051228
Calebiro, D., Koszegi, Z., Lanoiselée, Y., Miljus, T., et O’Brien, S. (2021). G protein-coupled receptor-G protein interactions: a single-molecule perspective. Physiological Reviews, 101(3), 857-906. https://doi.org/10.1152/physrev.00021.2020
Gaitonde, S. A., et González-Maeso, J. (2017). Contribution of heteromerization to G protein-coupled receptor function. Current Opinion in Pharmacology, 32, 23-31. https://doi.org/10.1016/j.coph.2016.10.006
Glaviano, A., Foo, A. S. C., Lam, H. Y., Yap, K. C. H., Jacot, W., Jones, R. H., Eng, H., Nair, M. G., Makvandi, P., Geoerger, B., Kulke, M. H., Baird, R. D., Prabhu, J. S., Carbone, D., Pecoraro, C., Teh, D. B. L., Sethi, G., Cavalieri, V., Lin, K. H., … Kumar, A. P. (2023). PI3K/AKT/mTOR signaling transduction pathway and targeted therapies in cancer. Molecular Cancer, 22(1), 1-138. https://doi.org/10.1186/s12943-023-01827-6
Hauser, A. S., Attwood, M. M., Rask-Andersen, M., Schiöth, H. B., et Gloriam, D. E. (2017). Trends in GPCR drug discovery: new agents, targets and indications. Nature Reviews. Drug Discovery, 16(12), 829-842. https://doi.org/10.1038/nrd.2017.178
Kadamur, G., et Ross, E. M. (2013). Mammalian phospholipase C. Annual Review of Physiology, 75(1), 127-154. https://doi.org/10.1146/annurev-physiol-030212-183750
Maegley, K. A., Admiraal, S. J., et Herschlag, D. (1996). Ras-Catalyzed Hydrolysis of GTP: A New Perspective from Model Studies. Proceedings of the National Academy of Sciences – PNAS, 93(16), 8160-8166. https://doi.org/10.1073/pnas.93.16.8160
Montminy, M. R., Gonzalez, G. A., et Yamamoto, K. K. (1990). Regulation of camp-inducible genes by creb. Trends in Neurosciences, 13(5), 184-188. https://doi.org/10.1016/0166-2236(90)90045-C
Schmid, A. C., Byrne, R. D., Vilar, R., et Woscholski, R. (2004). Bisperoxovanadium compounds are potent PTEN inhibitors. FEBS Letters, 566(1–3), 35-38. https://doi.org/10.1016/j.febslet.2004.03.102
Seok, S.-H. (2021). Structural Insights into Protein Regulation by Phosphorylation and Substrate Recognition of Protein Kinases/Phosphatases. Life, 11(9). https://doi.org/10.3390/life11090957
Weis, W. I., et Kobilka, B. K. (2018). The Molecular Basis of G Protein–Coupled Receptor Activation. Annual Review of Biochemistry, 87(1), 897-919. https://doi.org/10.1146/annurev-biochem-060614-033910
Welsh, C. L., Conklin, A. E., et Madan, L. K. (2023). Interaction Networks Explain Holoenzyme Allostery in Protein Kinase A. Kinases and Phosphatases, 1(4), 265-287. https://doi.org/10.3390/kinasesphosphatases1040016

