Chapitre 1 : Phosphorylation des protéines et son rôle dans la signalisation cellulaire
1 Phosphorylation des protéines et son rôle dans la signalisation cellulaire
1.1 Introduction
Les protéines subissent plusieurs modifications post-traductionnelles qui en augmentent les fonctions et en modifient l’interactome. La phosphorylation est l’un des mécanismes de régulation les plus courants et les plus critiques pour les protéines. Cette unité vise à donner un aperçu des principaux groupes d’enzymes intervenant dans la phosphorylation et la déphosphorylation des protéines.
1.2 Résultats d’apprentissage du chapitre
À la fin de ce chapitre, vous pourrez :
- définir les propriétés clés des kinases en vous référant à des exemples précis;
- définir les propriétés clés des phosphatases réciproques en vous référant à des exemples précis;
- décrire les cycles de phosphorylation et de déphosphorylation;
- définir les kinomes et le rôle des kinases dans le contexte de la signalisation.
1.3 Enzymes intervenant dans la phosphorylation
1.3.1 Que sont les protéines kinases?
Les kinases sont un terme générique désignant les enzymes qui interviennent dans le transfert d’un groupement phosphate d’une molécule (substrat) à une autre. Dans les eucaryotes, les protéines kinases conventionnelles introduisent des groupements phosphate sur trois principaux acides aminés : la sérine (S), la thréonine (Thr) ou la tyrosine (Tyr).
1.3.2 Énumérez les kinases générales courantes participant à la signalisation cellulaire.
i. Tyrosine kinases
ii. Sérine/thréonine kinases
Le nom de la kinase correspond aux acides aminés spécifiques qui sont phosphorylés. Il existe également des kinases à double spécificité qui phosphorylent les résidus de S, Thr et Tyr. En principe, la phosphorylation des protéines sérine et thréonine est associée à d’importants changements dans la conformation des protéines, tandis que la phosphorylation des protéines tyrosine est associée à la modification de la localisation cellulaire d’une protéine. Le génome humain compte environ 518 protéines identifiées comme kinases (Manning et coll., 2002).
1.3.3 Quel groupe fonctionnel est ciblé par la phosphorylation sur différents acides aminés?
a. Hydroxyle (OH)
b. Thiol (SH)
c. Oxyde de diéthyle (-O-)
d. Alcène (C=C)
Lorsque l’on compare les structures de S, Thr et Tyr, on remarque que tous ces acides aminés possèdent un groupe hydroxyle dans leur groupe de chaîne latérale (figure 1.1). Un groupement phosphate chargé négativement peut être conjugué à ces acides aminés, produisant respectivement la phosphosérine, la phosphothréonine ou la phosphotyrosine.
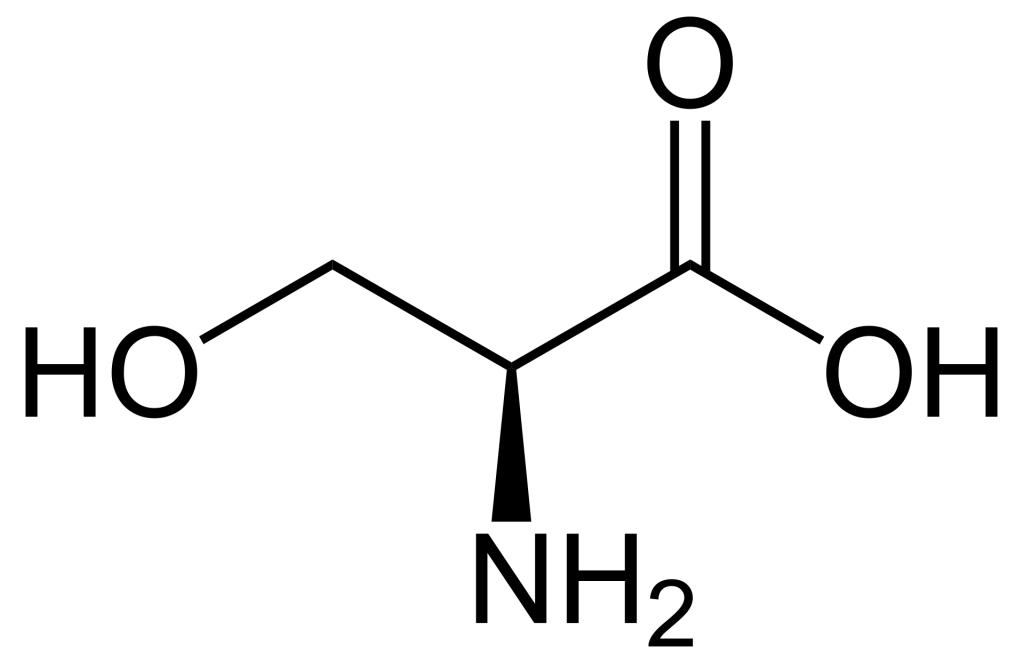
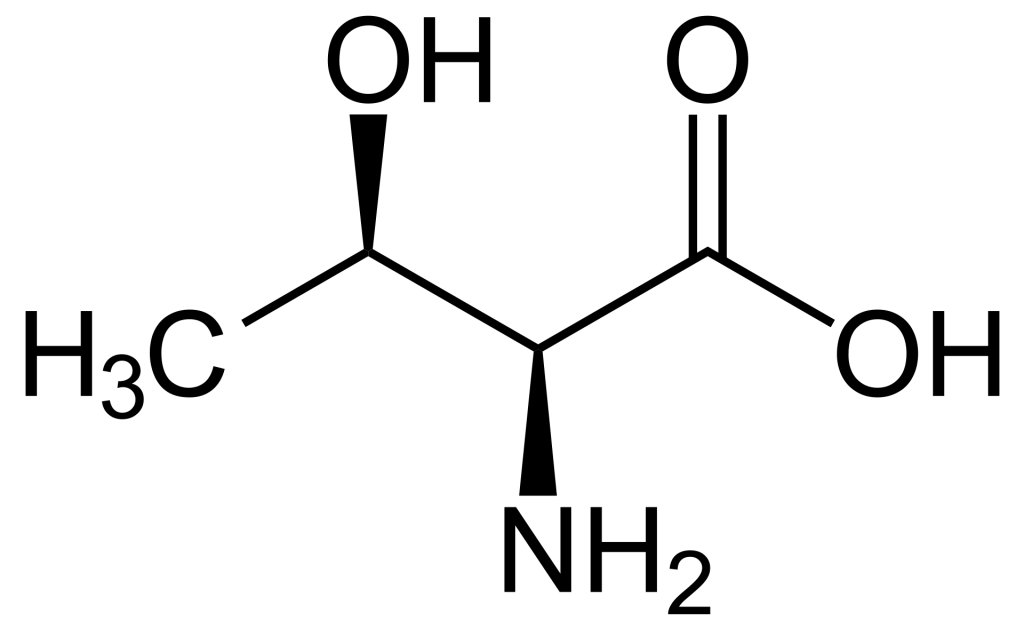
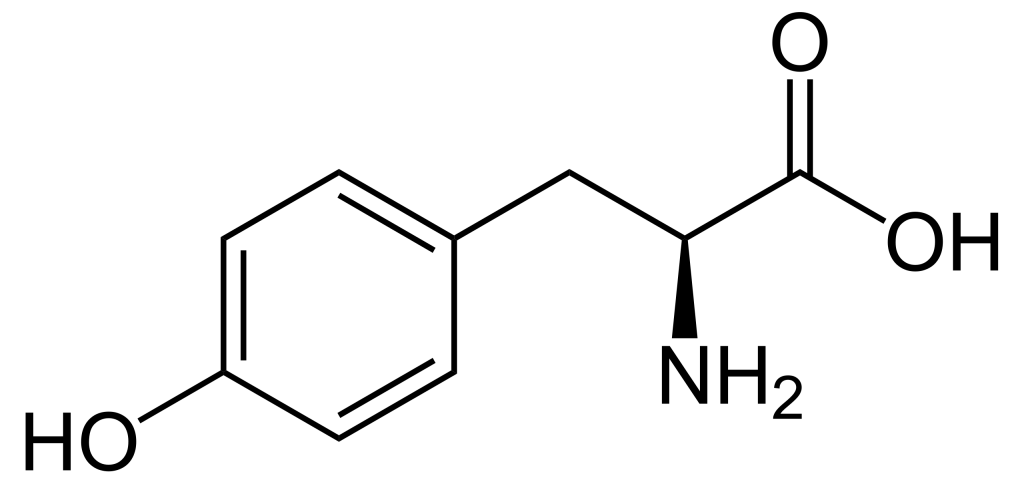
1.3.4 Quelle est l’incidence de la phosphorylation sur l’activité d’une protéine?
a. Elle augmente l’activité catalytique de la protéine.
b. Elle diminue l’activité catalytique de la protéine.
c. Cela dépend du scénario.
La phosphorylation d’une protéine (ajout d’un groupement phosphate) peut augmenter ou diminuer l’activité catalytique d’une protéine selon les changements structurels qui en résultent et qui ont une incidence sur la conformation de la protéine (figure 1.2). Le groupement phosphate introduit une charge négative divalente sur le site de la protéine (distincte de tout acide aminé naturellement présent) qui peut modifier radicalement les propriétés physico-chimiques de la protéine.
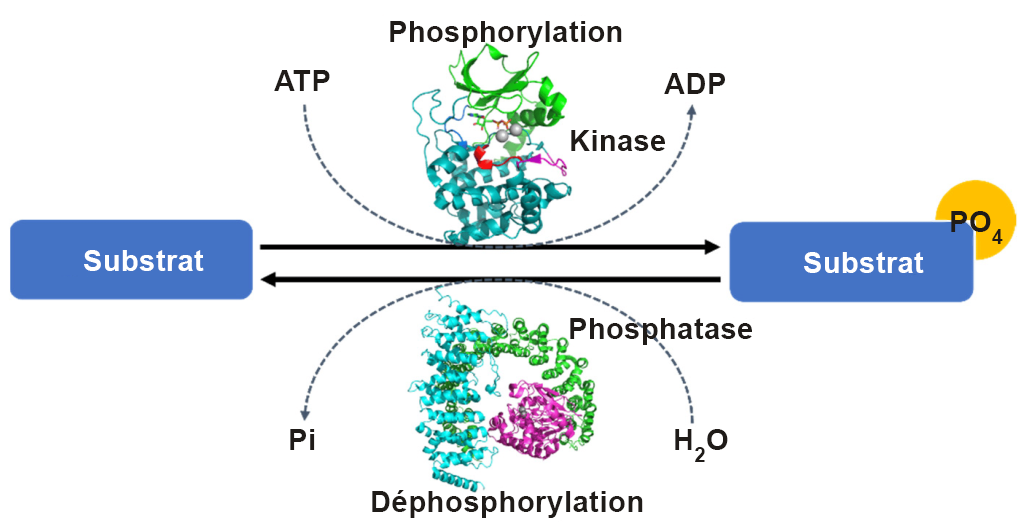
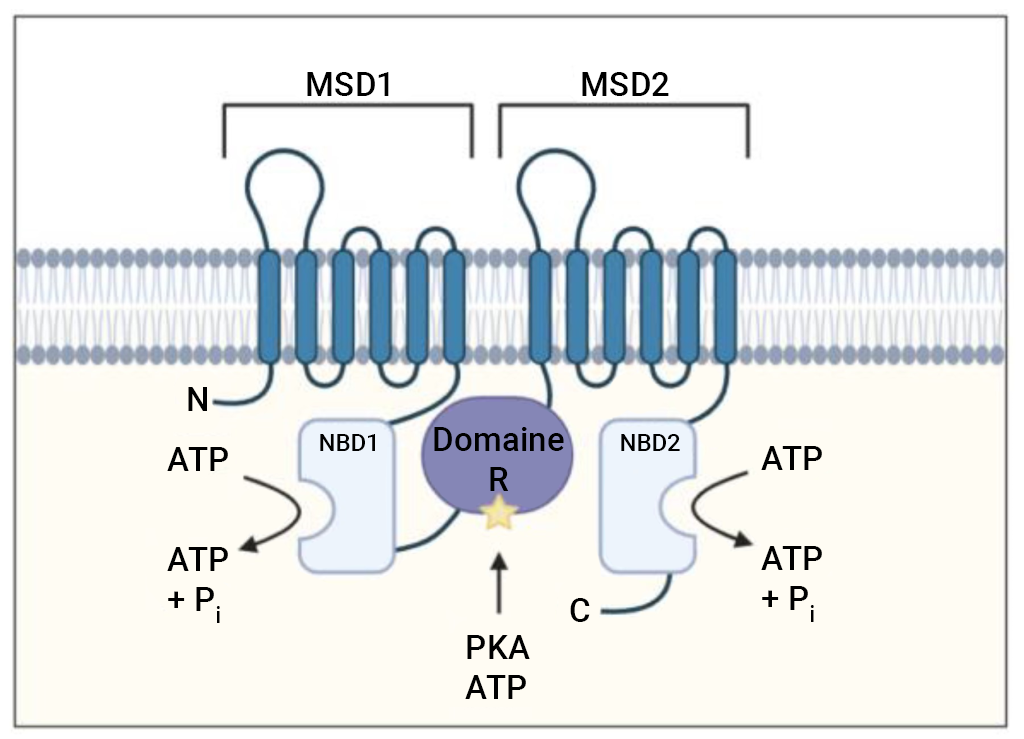
Par exemple, la phosphorylation d’une protéine de type canal ionique chlorure appelée CFTR (régulateur de la perméabilité transmembranaire de la fibrose kystique) se produit sur une boucle spécifique (appelée région R) de la protéine, qui bloque normalement le flux d’ions chlorure à travers le canal (figure 1.3). La perturbation électrostatique résultant de la phosphorylation de la boucle lui permet d’interagir avec d’autres régions de la protéine, ce qui l’empêche de bloquer stériquement l’accès aux pores.
De plus, un sous-ensemble de protéines est également sujet à la phosphorylation sur plusieurs sites, où il existe des grappes de S ou de Thr pouvant être phosphorylées. L’augmentation des niveaux de phosphorylation peut entraîner un effet plus prononcé. Par exemple, la région R du CFTR contient au moins dix sites de phosphorylation, et une phosphorylation progressive augmente l’activité de régulation.
1.3.5 Décrivez brièvement la relation entre les kinases et les kinomes.
En biologie, il existe plusieurs catégories se terminant par « ome ». Le suffixe « ome » désigne généralement un sous-ensemble de biomolécules provenant d’une cellule ou d’un organisme. Il peut s’agir de sous-ensembles définis de façon plus large, comme le génome (sous-ensemble de gènes au sein d’une cellule) ou le protéome (sous-ensemble de protéines au sein d’une cellule). Il existe également des termes plus spécialisés, comme le « kinome », qui englobe toutes les kinases d’un organisme. Le kinome humain est souvent représenté sous la forme d’un « arbre du kinome », qui est une représentation visuelle phylogénétique des relations évolutives entre les 518 kinases différentes (Manning et coll., 2002).
1.3.6 Comment une kinase sait-elle où phosphoryler sur une protéine?
La sérine, la thréonine et la tyrosine sont des résidus couramment présents dans les protéines. Toutefois, ces résidus ne sont pas tous marqués par un groupement phosphate sous l’action d’une kinase. Les kinases reconnaissent une séquence spécifique contenant la S, Thr et Tyr, appelée « séquence consensus ». Cette séquence peptidique fournit un motif de reconnaissance permettant la liaison de la kinase, ce qui permet des interactions spécifiques avec le site actif de la kinase afin d’insérer les résidus de S, Thr et Tyr appropriés dans la pochette. Par exemple, la séquence de reconnaissance de la protéine kinase dépendante (PKA) de l’AMPc est R-R/K-x-S-ϕ (où X est un acide aminé quelconque et ϕ un résidu hydrophobe) (Kemp et coll., 1977).
1.4 Enzymes intervenant dans la déphosphorylation
1.4.1 Quelle réaction générale est catalysée par les protéines phosphatases?
a. Les enzymes qui catalysent l’hydrolyse des groupes phosphoryles sur les substrats de protéine.
b. Les enzymes qui catalysent l’ajout de groupes phosphoryles sur les substrats de protéine.
c. Les enzymes qui catalysent la formation de liaisons disulfures.
L’un des avantages de la phosphorylation en tant qu’événement post-traductionnel d’une protéine est que le groupement phosphate peut être éliminé de manière réversible par des étapes de déphosphorylation (figure 1.2). Cela crée un mécanisme de régulation transitoire, en agissant efficacement comme une séquence activatrice pour activer ou désactiver une protéine. Les protéines phosphatases sont des enzymes qui éliminent les groupements phosphate présents sur les acides aminés S, Thr ou Tyr, ce qui entraîne un retour à la chaîne latérale d’origine de la protéine avec un groupe hydroxyle (-OH). Un groupe d’orthophosphate (Pi) est ensuite libéré.
1.4.2 Énumérez les phosphatases généraux courants participant à la signalisation cellulaire.
Comme pour les kinases, il existe deux classes communes de phosphatases qui participent aux voies de signalisation cellulaires :
i. Protéines S/Thr phosphatases
ii. Protéines Tyr phosphatases
1.4.3 Définissez les protéines tyrosine phosphatases.
Les protéines tyrosine phosphatases sont des enzymes qui catalysent l’élimination des groupements phosphate des résidus Tyr présents dans les substrats de protéine. Les protéines tyrosine phosphatases peuvent être classées en deux catégories : les protéines de type récepteur et les protéines non transmembranaires. Les protéines tyrosine phosphatases de type récepteur seront abordées dans le module sur les récepteurs couplés aux enzymes. Il existe environ 226 protéines phosphatases (Liu et Chance, 2014).
Le domaine d’homologie avec Src-2 (SH2) contenant la protéine tyrosine phosphatase 2 ou SHP2 est un exemple de membre d’une protéine phosphatase non transmembranaire, exprimée dans plusieurs tissus. La SHP2 est un exemple particulier de phosphatase cytosolique, composée de différents domaines de protéines, dont deux domaines SH2 en tandem et un domaine de phosphatase catalytique (Qu, 2000). La SHP2 agit en déphosphorylant plusieurs protéines, ce qui a généralement un rôle négatif dans le blocage des voies de signalisation.
1.4.4 Explorez le mécanisme d’action de la SHP2 dans les réseaux de signalisation.
En l’absence d’une protéine cible, le domaine de phosphatase interagit avec la région N-terminale du domaine SH2 de la SHP2. Cette interaction maintient la protéine dans une conformation fermée et empêche l’accès des substrats au site de la phosphatase. Par conséquent, la SHP2 est incapable d’effectuer des réactions d’hydrolyse du phosphate.
En présence d’une cible (p. ex., une protéine contenant de la tyrosine phosphorylée), la cible phosphorylée liera le domaine SH2 de la SHP2. Cet événement de liaison déclenche un changement conformationnel, modifiant les interactions entre le domaine SH2 et le domaine catalytique. Le site actif devient plus accessible, ce qui permet la liaison de la protéine au domaine catalytique de la phosphatase et l’élimination ultime du groupement phosphate de la protéine cible. Les produits sont libérés pour réinitialiser le cycle catalytique.
1.4.5 Définissez les phosphatases à double spécificité.
Au sein du groupe des protéines tyrosine phosphatases, il existe une autre sous-famille, appelée « phosphatases à double spécificité », qui sont des phosphatases hydrolysant les groupements phosphate, principalement à partir des résidus de Tyr. Cependant, ils possèdent également une activité phosphatase des protéines S et Thr.
Bibliographie
Harwood, K. H., McQuade, R. M., Jarnicki, A., et Schneider-Futschik, E. K. (2021). Anti-Inflammatory Influences of Cystic Fibrosis Transmembrane Conductance Regulator Drugs on Lung Inflammation in Cystic Fibrosis. International Journal of Molecular Sciences, 22(14). https://doi.org/10.3390/ijms22147606
Kemp, B. E., Graves, D. J., Benjamini, E., et Krebs, E. G. (1977). Role of multiple basic residues in determining the substrate specificity of cyclic AMP-dependent protein kinase. The Journal of Biological Chemistry, 252(14), 4888-4894. https://www.jbc.org/article/S0021-9258(17)40137-2/pdf
Liu, Y., et Chance, M. R. (2014). Integrating phosphoproteomics in systems biology. Computational and Structural Biotechnology Journal, 10(17), 90-97. https://doi.org/10.1016%2Fj.csbj.2014.07.003
Manning, G., Whyte, D. B., Martinez, R., Hunter, T., et Sudarsanam, S. (2002). The Protein Kinase Complement of the Human Genome. Science, 298(5600), 1912-1934. https://doi.org/10.1126/science.1075762
Qu, C. K. (2000). The SHP—2 tyrosine phosphatase:Signaling mechanisms and biological functions. Cell Research, 10(4), 279-288. https://doi.org/10.1038/sj.cr.7290055
Seok, S.-H. (2021). Structural Insights into Protein Regulation by Phosphorylation and Substrate Recognition of Protein Kinases/Phosphatases. Life, 11(9). https://doi.org/10.3390/life11090957

